外源硅对PEG胁迫下小麦幼苗生长及抗氧化酶活性的影响
郑世英,郑建峰,徐 建,郑 芳,李士平,张乃芹,于凌春,耿建芬
(1.德州学院生态与园林建筑学院, 山东 德州 253023; 2.德州学院经济与管理学院, 山东 德州 253023;3.德州学院物理与电子学院, 山东 德州 253023)
外源硅对PEG胁迫下小麦幼苗生长及抗氧化酶活性的影响
郑世英1,郑建峰2,徐 建3,郑 芳1,李士平1,张乃芹1,于凌春1,耿建芬1
(1.德州学院生态与园林建筑学院, 山东 德州 253023; 2.德州学院经济与管理学院, 山东 德州 253023;3.德州学院物理与电子学院, 山东 德州 253023)
以德抗961(DK961)和泰山9818(TS9818)为试验材料,研究不同浓度外源硅对PEG胁迫下小麦幼苗的生长及抗氧化酶活性的影响。结果表明:与单纯PEG胁迫相比,外源硅浓度为1.0 mmol·L-1时,DK961和TS9818的鲜重、干重及根系活力均最大,细胞膜透性最小,鲜重分别增加了32.85%和49.43%,干重分别增加了24.14%和50.00%,根系活力分别增加了18.97%和15.60%,细胞膜透性分别降低了12.53%和10.48%;外源硅浓度为0.5 mmol·L-1时,DK961和TS9818的SOD、CAT活性均最大,分别增加了18.11%、19.71%和47.41%、44.51%;外源硅浓度分别为0.5 mmol·L-1和0.1 mmol·L-1时,DK961和TS9818的POD活性最大,MDA含量最低,POD活性分别增加了18.41%和13.02%,MDA含量分别降低了11.80%和12.31%。较低浓度的外源硅能有效促进PEG胁迫下小麦幼苗的生长,增加抗氧化酶活性,降低丙二醛含量。外源硅能够缓解干旱胁迫对小麦幼苗的危害,提高小麦抗旱能力。
外源硅;PEG胁迫;小麦;抗氧化酶
硅是地球表面的第二大元素,对大多数高等植物的生长是有益的。许多研究表明,硅能促进植物(尤其是单子叶植物)生物学产量的增长及生长发育,提高作物对逆境胁迫的抗性[1]。大量研究表明,植物吸收硅后能够促进其生长发育并且对环境适应性加强[2]。硅处理大麦幼苗能提高其根系CAT、SOD、APX、POD、GSH活性,降低丙二醛含量,由此降低盐胁迫下大麦体内由盐诱导产生的过氧化伤害[3]。研究证实,硅在提高植物对非生物胁迫如离子毒害[4-6]、盐害[7-8]、干旱胁迫[9-10]等及生物胁迫稻温病、甘蔗茎螟的抗性方面有重要作用[11-12]。硅可显著提高干旱胁迫下黄瓜、高粱、水稻的抗旱性,但其抗旱机理并不完全清楚[13]。干旱胁迫是自然界中最主要的非生物胁迫之一,地球上约1/3的土地属于缺水的干旱和半干旱区域,我国的干旱半干旱区域约占全国土地面积的1/2,即使半湿润、甚至湿润地区也常会有周期性和季节性或阶段性的干旱[14]。
小麦在遭受干旱胁迫时会产生大量的活性氧,引起膜脂过氧化作用,产生过氧化产物丙二醛(MDA)。植物体内的保护酶能降低或消除活性氧对膜脂的伤害[15]。超氧化物歧化酶(SOD)可以消除超氧化物阴离子自由基产生H2O2,而H2O2可被过氧化氢酶(CAT)和过氧化物酶(POD)分解成H2O。POD可清除线粒体中或胞浆中产生的低浓度H2O2。CAT主要分布在细胞的过氧化物体中,可清除高浓度的H2O2[16]。保护酶的活性以及MDA含量,可以作为植物受干旱胁迫程度和植物对干旱胁迫抵御能力的衡量指标。因此,研究外源硅对干旱胁迫下不同小麦幼苗生长及抗氧化酶活性的影响,对发展节水农业与旱作农业具有重要指导意义。
有关硅缓解干旱胁迫对植物伤害的作用已引起学者们的关注[17]。但关于硅提高小麦耐干旱胁迫能力的研究却较少,为此,本试验采用水培方法,用聚乙二醇(PEG6000)模拟干旱胁迫条件,研究干旱胁迫下硅对小麦幼苗生物量、根系活力、细胞膜透性(CMP)、抗氧化酶活性等生理指标的影响,旨在通过研究硅对PEG胁迫条件下小麦幼苗的生长影响,探明硅对PEG胁迫下小麦适应性的调节机制,并为实际生产提供理论依据。
1 材料与方法
1.1 试验材料
材料为德抗961(DK961,抗旱性强)和泰山9818(TS9818,抗旱性中等),种子购自德州市农业科学院。
1.2 材料的培养
采用溶液培养的方法,精选均匀一致的小麦种子,0.1% HgCl2消毒5 min,先用自来水冲洗数次,再用蒸馏水反复冲洗,在25℃的培养箱里催芽24 h后,将种子置于培养床(孔径0.25 cm,架于面积34 cm×23 cm,深8 cm的聚乙烯盒内,有支架的尼龙丝网),网下是水培液,与网面平,根可从网孔扎入下面的液体中。所有处理均在光照培养箱中进行,白天为16 h、25℃,夜晚为8 h、18℃。每天增补蒸发与吸收掉的水溶液,待麦苗生长至二片真叶时,选择健壮且长势一致的幼苗,移栽到不透光的盛有400 ml 1/2 Hoagland营养液的塑料杯中,进行通气培养。营养液每3天更换一次,用PEG6000(聚乙二醇6000)模拟干旱胁迫条件(渗透势约为-0.50 MP)。
1.3 试验处理
① 对照(CK);② 单纯PEG处理;③ (Si1):PEG+0.1 mmol·L-1Si;④ (Si2):PEG+0.5 mmol·L-1Si;⑤ (Si3):PEG+1.0 mmol·L-1Si。所用的硅为硅酸钾。处理期间每2天换一次营养液,营养液pH值为6.5,全天通气培养。处理8 天后采样测定指标,每个处理设3个重复。
1.4 相关指标的测定
生物量的测定:每个处理取6株麦苗,用蒸馏水洗净,用吸水纸吸干表面水分,称取鲜重。然后在110℃杀青10 min,于75℃烘干至恒重,称取干重。
根系活力测定采用氯化三苯基四氮唑(TTC)法[18];细胞膜透性(CMP)测定采用相对电导率法[18];超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑法[18];过氧化氢酶(CAT)活性的测定采用紫外分光光度法[19];过氧化物酶(POD)活性测定采用愈创木酚显色法[19];丙二醛(MDA)含量的测定采用硫代巴比妥酸法[19]。
1.5 数据分析
用SPSS 11.5 for Windows软件进行方差分析和显著性检验,Microsoft Excel 2003作图。
2 结果与分析
2.1 外源硅对干旱胁迫下小麦幼苗生物量、根系活力及细胞膜透性的影响
试验结果(表1)表明,单一PEG胁迫条件下,两个小麦品种幼苗的鲜、干重均显著下降。外源硅处理下,随着外源硅处理浓度的不断提高,两小麦品种鲜重及干重均有一定程度增加。当外源硅浓度为 0.1、0.5、1.0 mmol·L-1时,与PEG处理相比,DJ961鲜重分别增加了14.98%、27.05%及32.86%,干重分别增加了6.90%、9.68%及24.14%;TS9818鲜重分别增加了20.42%、33.97%及49.32%,干重分别增加了21.74%、34.78%及50.00%。
根活力水平直接影响植物地上部的生长、营养状况及产量,而根部又是植物直接与土壤接触的部位,很容易受到外界因素的影响。单一PEG处理胁迫下,两个小麦品种幼苗的根系活力均降低,随着外源硅处理浓度的提高,DJ961和TS9818的根系活力分别增加了18.97%和15.60%。
注:表中数据为六次重复的平均值;同列不同字母表示处理间在P<0.05水平有显著差异。下同。
Note: The data are averages of six replicates; letters within the same column with different letter mean significant differences atP<0.05. The same below.
单一PEG处理胁迫下,两个小麦品种幼苗的细胞膜透性均升高,随着外源硅处理浓度增大,细胞膜透性逐渐降低,硅浓度为0.1、0.5、1.0 mmol·L-1时,DJ961细胞膜透性分别为PEG处理的95.95%、91.90%、87.47%,TS9818细胞腊透性分别为PEG处理的95.69%、93.91%及89.52%。细胞质膜是一种选择透性膜,它能控制和调节细胞内外物质的运输与交换,其透性是评定植物对逆境反应的指标之一[20]。
2.2 外源硅对PEG胁迫下小麦SOD活性的影响
由图1可以看出,外源硅对PEG胁迫下DK961及TS9818 SOD活性均有影响。单纯PEG处理降低DK961及TS9818 SOD活性,其活性分别降低2.07%和2.59%,随着硅浓度的逐渐增大,两个小麦品种SOD活性均表现出先升后降趋势。当硅浓度为0.5 mmol·L-1时,两个小麦品种SOD活性均达到最大,与单纯PEG胁迫相比,分别增加了18.11%和19.45%。
2.3 外源硅对PEG胁迫下小麦CAT活性的影响
由图2可以看出,外源硅对干旱胁迫下DK961及TS9818 CAT活性均有影响。单纯PEG处理DK961及TS9818 CAT活性分别降低3.13%和4.84%。随着外源硅处理浓度的逐渐增大,两个小麦品种CAT活性均表现出先升后降趋势。当硅浓度为0.5 mmol·L-1时,两个小麦品种CAT活性均达到最大,与单纯PEG胁迫相比,分别增加了47.41%和44.51%。
图1 外源硅对PEG胁迫下两个小麦品种超氧化物歧化酶活性的影响
Fig.1 Effect of Si on SOD of DK961 andTS9818 under drought stress
2.4 外源硅对PEG胁迫下小麦POD活性的影响
由图3可以看出,外源硅对PEG胁迫下DK961及TS9818 POD活性均有影响。单纯PEG处理DK961及TS9818 POD活性分别降低2.54%和3.23%。随着外源硅浓度增大,两个小麦品种POD活性均表现出先上升后下降的趋势。当硅浓度为0.5 mmol·L-1时,DK961 POD活性达到最大,当硅浓度为0.1 mmol·L-1时,TS9818 POD活性达到最大,与单纯PEG胁迫相比,分别提高了18.41%和13.02%。
2.5 外源硅对PEG胁迫下小麦MDA含量的影响
由图4可知,外源硅对PEG胁迫下DK961及TS9818 MDA含量均有影响。单纯PEG胁迫下DK961及TS9818的MDA含量分别增加4.94%和6.63%。外源硅浓度为0.1~0.5 mmol·L-1,随着外源硅浓度的升高MDA含量逐渐降低;当外源硅浓度为0.5~1.0 mmol·L-1时,随着外源硅浓度的升高MDA含量增大,并且TS9818 MDA含量高于DK961。

图2 外源硅对PEG胁迫下两个小麦品种 过氧化氢酶活性的影响
Fig.2 Effect of Si on CAT of DK961 and TS9818 under drought stress
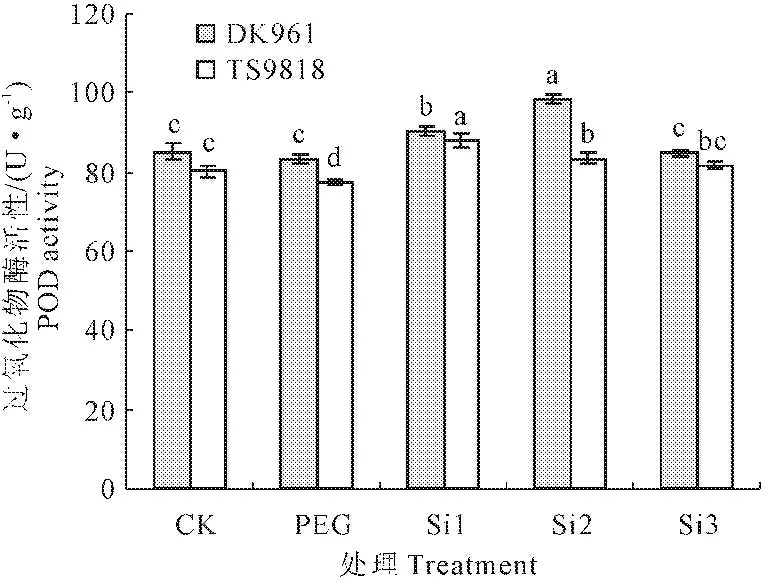
图3 外源硅对PEG胁迫下两个小麦品种 过氧化物酶活性的影响
Fig.3 Effect of Si on POD of DK961 and TS9818 under drought stress

图4 外源硅对PEG胁迫下两个小麦品种丙二醛含量的影响
Fig.4 Effect of Si on MDA of DK961 and TS9818 under drought stress
3 讨 论
外源硅对PEG胁迫下小麦幼苗根系活力、细胞膜透性及抗氧化酶活性均有影响。随着外源硅处理浓度的不断增加,PEG胁迫下的两个小麦品种的鲜重、干重、根系活力均上升,细胞膜透性均呈现下降趋势。说明干旱抑制小麦根系对水和无机养料的吸收,使其鲜重和干重均下降。同时对细胞膜有一定的破坏作用,导致小麦根系活力下降及细胞膜透性增加。硅处理改善了植物体内的水分状况,减缓了胁迫所造成的负面影响,促进了小麦根系对水和无机养料的吸收,使其鲜重、干重及根系活力升高,并且降低了细胞膜透性。Kaya 等[21]也有类似结果,即干旱胁迫下硅处理能增加玉米叶片Ca、K、Si的含量。
大量研究表明,逆境条件下植物体存在膜保护系统,它们能够清除植物体内多余的自由基,这一保护系统是一个抗氧化系统,它由许多保护酶和还原型物质组成,其中SOD,POD,CAT是植物体内主要的抗氧化酶,可清除对植物有害的体内活性氧,从而保护植物的膜系统[22]。SOD为超氧自由基清除剂,POD为过氧化物清除剂,CAT是含Fe的蛋白酶,在植物体内能将SOD的歧化产物H2O2分解成H2O,从而达到清除体内多余H2O2的目的,避免了H2O2对植物组织的伤害[23]。本研究表明,与单纯PEG处理相比,在外源硅浓度较低时(0.1~0.5 mmol·L-1),DK961 SOD、CAT、POD及TS9818 SOD、CAT活性提高,在外源硅浓度为0~0.1 mmol·L-1时,TS9818 POD活性提高,增强适应能力,但当外源硅浓度为0.5~1.0 mmol·L-1,DK961 SOD、CAT、POD及TS9818 SOD、CAT活性降低,在外源硅浓度为0.1~1.0 mmol·L-1时,TS9818 POD活性降低,植物体代谢受到影响。此结果与硅对野生大豆抗盐性影响[24]及硅对干旱胁迫下玉米的影响[25]的研究结果基本一致。这可能是由于较高浓度的硅产生了渗透胁迫。
丙二醛(MDA)含量增加是膜系统受到伤害的重要标志之一,对膜和细胞中的蛋白质、核酸和酶等许多功能分子均有较强的破坏作用,并且破坏生物膜的结构与功能[26]。本研究表明,当外源硅浓度较低,植物MDA含量降低,增强适应能力,随着外源硅浓度升高,MDA含量上升。说明PEG胁迫下较低浓度的外源硅能够降低电解质外渗率,抑制丙二醛积累,抑制膜脂过氧化作用,从而减轻膜脂过氧化对细胞的伤害,促进脯氨酸的合成。较高浓度硅处理会增强膜脂质过氧化作用,导致植物体内的活性氧增加,打破活性氧的代谢平衡,破坏膜的结构,影响膜的功能。外源硅浓度越高,脂质过氧化产物MDA积累越多。
外源硅使得PEG胁迫下的两个小麦品种生物量及根系活力均升高,并且DK961高于TS9818;而细胞膜透性均降低,并且DK961低于TS9818,说明与TS9818相比,DK961有较强的光合效率、根系活力及细胞膜控制物质进出细胞的能力。外源硅条件下,两个小麦品种在PEG胁迫下的三种抗氧化酶SOD、CAT及POD活性均先上升后下降,而且DK961抗氧化酶活性均高于TS9818,说明干旱环境下DK961清除活性氧的能力高于TS9818。外源硅使得两个小麦品种在PEG胁迫下的MDA均先下降后上升,并且DK961的MDA含量低于TS9818,说明PEG胁迫下外源硅处理时,DK961膜系统受到伤害程度小于TS9818。陈明灿等[27]对洛麦21和同舟麦916的研究表明,外源硅处理对不同小麦品种的影响不同,硅处理可以促进同舟麦916的生长和生物量的积累,而对于洛麦21,低浓度硅处理促进洛麦21的生物量积累,高浓度硅处理对洛麦21的生长表现为抑制作用。本研究结果表明,在PEG处理条件下,两个抗旱性不同的小麦品种对硅的响应相同,因此施加外源硅可以有效地提高不同品种小麦的耐旱性,本试验结果对旱地小麦施加硅肥具有一定的指导意义。
[1] 陈 伟,蔡昆争,陈基宁.硅和干旱胁迫对水稻叶片光合特性和矿质养分吸收的影响[J].生态学报,2012,32(8):2620-2628.
[2] 朱 佳,梁永超,丁燕芳,等.硅对低温胁迫下冬小麦幼苗光合作用及相关生理特性的影响[J].中国农业科学,2006,39(9):1780-1788.
[3] 梁永超,丁瑞兴.硅对大麦根系中离子的微域分布的影响及其与大麦耐盐性的关系[J].中国科学,2002,32(2):113-121.
[4] 朱军涛,李向义, 张希明,等.塔克拉玛干沙漠南缘3种荒漠植物光合特性的比较[J].干旱区地理,2012,35(1):171-176.
[5] Neumann D, Zur Nieden U. Silicon and heavy metal tolerance of higher plants[J]. Phytochemistry, 2001,56(7):685-692.
[6] Yongchao Liang. Effects of silicon on enzyme activity and sodium, potassium and calcium concentration in barley under salt stress[J]. Plant and Soil, 1999,209(2):217-224.
[7] Zhu Z J, Wei G Q, Li J, et al. Silicon alleviates salt stress and increases antioxidant enzymes activity in leaves of salt-stressed cucumber(CucumissaticusL.)[J]. Plant Science, 2004,167(3):527-533.
[8] Gong H J, Chen K M, Chen G C, et al. Effects of silicon on growth of wheat under drought[J]. Journal of Plant Nutrition, 2003,26(5):1055-1063.
[9] Taiichiro Hattori, Shinobu Inanaga, Hideki Araki, et al. Application of silicon enhanced drought tolerance in Sorghum bicolor[J]. Physiologia plantarum, 2005,123(4):459-466.
[10] Kvedaras O L, Keeping M G. Silicon impedes stalk penetration by the borer Eldana saccharcane[J]. Entomologia Experimentalis et Applicata, 2007,125(1):103-110.
[11] Cai Kunzheng, Gao Dan, Luo Shiming, et al. Physiological and cytological mechanisms of silicon-induced resistance in rice against blast disease[J]. Physiologia Plantarum, 2008,134(2):324-333.
[12] Cai Kunzheng. Distribution and absorption of silicon in plant and its role in plant disease resistance under environmental stress[J]. Acta Ecologica Sinica, 2010,30(10):2745-2755.
[13] Raven J A. Cycling silicon-the role of accumulation in plants[J]. Now Phytologist, 2003,158(3):419-421.
[14] 李 明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,2002,22(4):503-507.
[16] 李 慧,王妙媛,彭立新,等.NaCl胁迫对胡卢巴幼苗抗氧化酶活性和丙二醛含量的影响[J].华北农学报,2012,27(2):185-188.
[17] 丁燕芳,梁永超,朱 佳,等.硅对干旱胁迫下小麦幼苗生长及光合参数的影响[J].植物营养与肥料学报,2007,13(3):471-478.
[18] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2002:57-60.
[19] 高俊风.植物生理学实验技术[M].西安:世界图书出版公司,2000:76-78.
[20] 常燕虹,武 威,刘建朝,等.干旱胁迫对文冠果树苗某些生理特征的影响[J].干旱地区农业研究,2012,30(1):170-174.
[21] Kaya C, Tuna L, H. Effect of silicon on plant growth and mineral nutrition of maize grown under water-stress condition[J]. Journal of Plant Nutrition, 2006,29(8):1469-1480.
[22] 吕 庆,郑荣梁.干旱及活性氧引起小麦膜脂过氧化与脱脂化[J].中国科学,1996,26(1)26-30.
[23] 郑爱珍,刘传平,沈振国.镉处理下青菜和白菜MDA含量、POD和SOD活性的变化[J].湖北农业科学,2005,(1):67-69.
[24] 王丽燕.硅对野生大豆幼苗耐盐性的影响及其机制研究[J].大豆科学,2013,32(5):659-663.
[25] 李清芳,马成仓,季必金.硅对干旱胁迫下玉米水分代谢的影响[J].生态学报,2009,29(8):4163-4168.
[26] 尤 佳,王文瑞,卢 金,等.盐胁迫对盐生植物黄花补血草种子萌发和幼苗生长的影响[J].生态学报,2012,32(12):3825-3833.
[27] 陈明灿,王贺正,姚孚荣,等.硅对小麦幼苗生长及部分生理指标的影响[J].广东农业科学,2014,(21):7-1.
Effects of exogenous silicon on plant growth and activity of anti-oxidative enzymes in wheat seedlings under drought stress
ZHENG Shi-ying1, ZHENG Jian-feng2, XU Jian3, ZHENG Fang1, LI Shi-ping1,ZHANG Nai-qin1, YU Ling-chun1, GENG Jian-fen1
(1.CollegeofEcologyandLandscapeArchitecture,DezhouUniversity, 253023,China;2.ColleegeofEconomicsandManagement,DezhouUniversity, 253023,China;3.CollegeofPhysicsandElectronicInfromation,DezhouUniversity, 253023,China)
Using DK961 and TS9818 as experimental materials, the effects of different concentration of exogenous silicon on the growth of wheat seedlings and antioxidant enzyme activity under PEG stress were studied. Results indicated that: compared with only PEG stress, when the exogenous silicon concentration was 1.0 mmol·L-1, the fresh weight, the dry weight and the root activity of DK961 and TS9818 were the highest, increased by 32.85%, 49.43%, 24.14%, 50.00%, and 18.97%, 15.60%, respectively, and the cell membrane permeability was the lowest, reduced by 12.53% and 10.48%, respectively. When exogenous silicon concentrations was 0.5 mmol·L-1, the SOD and CAT activities of DK961 and TS9818 were the largest, increased by 18.11%,19.71%, and 47.41%, 19.71%, respectively; when exogenous silicon concentrations were 0.5 and 0.1 mmol·L-1, the POD activity of DK961 and TS9818 were the largest, increased by 18.41% and 13.02%, respectively, and the MDA content was the lowest, reduced by 11.80% and 12.31%, respectively. Lower concentration of exogenous silicon can promote the growth of wheat seedlings effectively under PEG stress, increasing the activity of antioxidant enzymes while reducing the content of MDA. Exogenous silicon can avoid the hazard of drought stress on wheat seedling.
exogenous silicon; PEG stress; wheat; anti-oxidative enzymes
1000-7601(2017)02-0074-05
10.7606/j.issn.1000-7601.2017.02.13
2016-03-14基金项目:国家自然科学基金(31271667)
郑世英(1962—),女,山东德州人,教授,硕士生导师,主要从事植物生态研究。 E-mail:zsy0015@163.com。
S512.1
A

