拟南芥HGO基因启动子与GUS融合表达载体的构建及转化鉴定
蔡 薇,支添添,任春梅,2*
(1湖南农业大学生物科学技术学院,长沙410128;2作物基因工程湖南省重点实验室,长沙410128)
拟南芥HGO基因启动子与GUS融合表达载体的构建及转化鉴定
蔡 薇1,支添添1,任春梅1,2*
(1湖南农业大学生物科学技术学院,长沙410128;2作物基因工程湖南省重点实验室,长沙410128)
HGO基因编码的尿黑酸1,2双加氧酶催化酪氨酸降解途径中的倒数第三步。本研究构建了拟南芥HGO基因启动子与GUS的融合表达载体,采用农杆菌介导法转化拟南芥获得转基因株系。经GUS组织化学染色鉴定,证明拟南芥HGO基因启动子与GUS的融合表达载体成功构建且能正常启动GUS基因的表达,为深入研究拟南芥HGO基因的表达特征创建了有价值的材料。
拟南芥;HGO;启动子;同源重组;基因克隆
酪氨酸降解途径在动物体内是必不可少的一条代谢途径[1],尿黑酸1,2双加氧酶(homogentisate dioxygenase,HGO)是酪氨酸降解途径中倒数第三步,可将尿黑酸氧化分解成马来酰乙酰乙酸,再经马来酰乙酰乙酸异构酶作用形成延胡索酰乙酰乙酸,最后在延胡索酰乙酰乙酸酶(fumarylacetoacetate hydrolase,FAH)的作用下形成乙酰乙酸和延胡索酸进入三羧酸循环彻底分解[2]。在动物中,HGO基因是不可缺少的,HGO的缺失会导致尿黑酸血症[3]。在植物中,除发现HGO基因突变可以促进拟南芥幼苗的生长[4]外,无其他研究成果。
本试验以模式植物拟南芥为材料,构建了HGO基因启动子与GUS的融合表达载体,将其转入拟南芥中,抗性筛选获得了稳定遗传的转基因株系,利用GUS染色检测到拟南芥HGO基因启动子成功转入植株内且能正常启动GUS基因的表达。
1 材料与方法
1.1 实验材料
拟南芥(Arabidopsis thaliana)野生型Col-0和载体pCAMBIA1301由作物基因工程湖南省重点实验室植物信号传导课题组保存,ClonExpressⅡ重组试剂盒从Vazyme公司购买。
1.2 植物的培养和生长条件
将拟南芥种子用消毒液(20%bleach+0.1% Triton100)浸泡10 min后,在超净台上用无菌水清洗4~5次,直接播种在含1%蔗糖的MS固体培养基上。4℃黑暗处理3 d后,转入培养室生长,培养温度(22±2)℃,光周期为16 h光照/8 h黑暗[5]。待其生长7 d后,移栽到营养土(东北黑土与蛭石的体积比为1∶1)中并盖上透明塑料盖培养1~2 d,生长条件同上。
1.3 表达载体的构建
1.3.1 设计引物及目的片段的扩增
在TAIR网站上找到已公布的拟南芥HGO基因启动子序列,经plantcare在线分析软件分析后选取ATG前2000 bp序列,运用引物设计软件Primer Premier5设计特异性引物PstⅠ-F/NcoⅠ-R。因所选表达载体需含有GUS报告基因,而所有含GUS报告基因的载体在35S启动子下游都只含NcoⅠ和BglⅡ这两个可选限制性酶切位点,BglⅡ酶切位点包含在GUS基因内,而NcoⅠ与目的基因中存在同源序列。针对这一问题采用同源重组法构建载体,先将载体线性化,选取两个限制性内切酶PstⅠ和NcoⅠ对载体进行双酶切。因此需要在引物5′端引入线性化载体末端同源序列,使得插入片段扩增产物5′和3′最末端分别带有和线性化载体两末端对应的完全一致的序列[6],引物为:

下划线部分为酶切位点,5′端前端为入线性化载体末端同源序列。根据引物合成时预测的退火温度,选用67℃为PstⅠ-F/NcoⅠ-R退火温度。用SDS法[7]提取拟南芥Col-0野生型叶片基因组DNA,以此为模板用高保真酶进行PCR扩增。扩增后的PCR产物经1.0%琼脂糖凝胶电泳检测后切胶回收并纯化。
1.3.2 拟南芥HGO基因与GUS融合载体的重组及鉴定
选用PstⅠ和NcoⅠ限制性内切酶将pCAMBIA1301载体线性化(载体线性化方式可以为限制性内切酶酶切消化,也可以为反向PCR扩增)。利用ClonExpressⅡ试剂盒进行重组反应。体系为5 ×CEⅡBuffer 4μL,线性化载体8μL,插入片段扩增产物1μL,ExnaseⅡ2μL,ddH2O 5μL。将配置好的体系置于37℃反应30 min,反应完后将反应管立即置于冰上冷却5 min。将20μL冷却反应液,加入到200μL的感受态中,轻弹管壁混匀,在冰上放置30 min。42℃热激60~90 s,冰水浴孵育2 min。加入900μL LB液体培养基,37℃孵育10 min充分复苏。37℃150 rmp摇菌45 min。6000 g离心2 min,去部分上清液,将其充分混匀,取100μL混匀后的菌液涂布在含有50 mg/L kan的LB培养基上。37℃倒置过夜培养[8~11]。取阳性克隆送华大基因公司测序。采用电击法将测序验证正确的重组载体质粒转化到根癌农杆菌GV3101中,挑取阳性克隆进行菌落PCR鉴定。
1.3.3 拟南芥的遗传转化及筛选
挑选菌落PCR验证正确的农杆菌单菌落于含有卡那霉素(50 mg/L)、庆大霉素(50 mg/L)和利福平(25 mg/L)的YEB液体培养基里进行活化处理,28℃、220 rpm振荡培养18~24 h。6000 g离心大量活化菌液2 min,弃上清,用农杆菌悬浮液(5%蔗糖+1/2 MS+0.02%Silwet-L77+0.01%6-BA)将菌体重悬至OD600在0.6~1.0之间。利用浸花法[12]转化拟南芥,收取T0代种子,在含有潮霉素(25 mg/L)的MS培养基上筛选成功转入pHGO::GUS表达载体的转基因植株,进一步采用PCR进行植株鉴定,用GUS组织化学法检测启动子活性。
2 结果与分析
2.1 拟南芥HGO基因启动子的克隆
根据已知的序列信息,设计带特异酶切位点的引物,扩增引物分别含PstⅠ和NcoI的酶切位点,以拟南芥Col-0野生型基因组DNA为模板,采用高保真酶进行PCR扩增,PCR产物预期大小为2002 bp。将扩增产物用1%琼脂糖凝胶电泳检测,电泳结果表明扩增产物符合预期大小(图1)。这表明PstⅠ-F和NcoⅠ-R能成功扩增出目的片段。

图1 HGO基因启动子PCR扩增结果Fig.1 PCR result of HGO promoter
2.2 pHGO∶∶GUS融合表达载体的构建
将PCR产物和线性化载体用ClonExpressⅡ试剂盒重组,构建重组后产物采用热激法转入大肠杆菌E.coli DH5α,随机挑选单菌落进行PCR检测(图2)。菌落PCR扩增产物大小在2000 bp左右,与预期结果一致。2号泳道加入的模板为水,此泳道没有出现条带,说明PCR体系没有DNA污染;3~6号泳道条带大小均在2000 bp左右,与预期大小相似。选取条带最亮的6号大肠杆菌扩大培养后提取质粒送至上海博尚生物技术有限公司进行测序鉴定。测序结果显示:6号菌种插入片段大小为2002 bp,经过DNAMAN软件序列比对分析,发现目的基因与GUS之间的结合位点与预期一致,且没有移码乱码现象,这表明pHGO∶∶GUS融合表达载体(图3)成功构建。
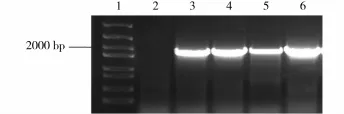
图2 融合表达载体转化E.coli DH5α后的菌落PCR检测Fig.2 PCR result of fusion expression vector was transformed into E.coli DH5α
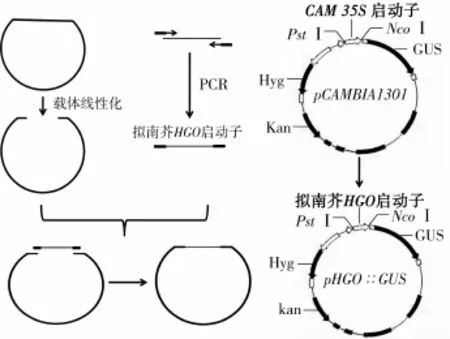
图3 pHGO∶∶GUS融合表达载体示意图Fig.3 Schematic diagram of pHGO∶∶GUS vector
2.3 pHGO∶∶GUS融合表达载体的遗传转化及鉴定
将pHGO∶∶GUS重组表达载体通过电击法转入根癌农杆菌GV3101中,并通过农杆菌介导的浸花法转化模式植物拟南芥,进行融合基因的稳定表达实验。融合表达载体具有潮霉素抗性,将浸染后当代成熟的种子铺种在MS培养基上春化后在长日照下生长,具有潮霉素抗性的植株正常生长。将抗性苗移栽至人工土壤中,简易SDS法提取潮霉素抗性植株基因组DNA,以引物对pC1301-F/pC1301-R进行特异性扩增,引物为:

结果表明,大部分潮霉素抗性植株能产生特异扩增带(图4),说明融合表达载体已成功整合到拟南芥基因组中。
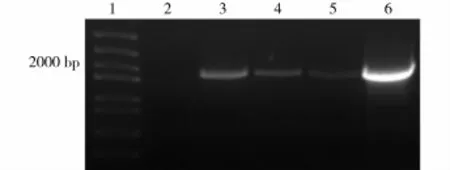
图4 转基因拟南芥植株的PCR检测Fig.4 Result of genetic transformation
2.4 转基因植株GUS检测
为了检测转基因植株中的HGO启动子是否具有活性,随机挑选具潮霉素抗性和PCR阳性的T2代转基因拟南芥进行报告基因的检测。将检测植株的种子铺种在含有潮霉素(25 mg/L)的MS培养基上,置于长日照(16 h光照/8 h黑暗)下培养7~9 d,取无菌苗进行GUS组织化学法检测,通过实体显微镜观察染色结果。结果表明:转入pCAMBIA1301质粒(含35S启动子)的阳性对照(图5A)幼苗中,GUS基因在根、下胚轴、叶中都高度表达;转入拟南芥HGO基因启动子与GUS融合表达载体的转基因植株幼苗(图5B),GUS基因在根、下胚轴及子叶中表达较强,在真叶中的表达较弱;而GUS基因未在阴性对照幼苗中表达(图5C)。
3 结论与讨论
在构建表达载体时,需要精心选择酶切位点及标记基因。当目的基因中含有较多的常用酶切位点时,不得不选择酶切效率低、价格昂贵的非常用限制性内切酶或构建中间载体,这样会大幅度降低实验成功率。本研究中因目的基因内含较多常用酶切位点,所以选用了Vazyme公司ClonExpressⅡ重组试剂盒,此试剂盒采用同源重组的原理,不受酶切位点的限制,降低了载体的局限性。
本研究成功构建了拟南芥HGO基因启动子与GUS载体的融合表达载体,经过电泳及测序检测,证实目的片段与pCAMBIA1301在预测位点重组且插入片段无错配现象,大小正确。对拟南芥遗传转化后代进行筛选,在含有潮霉素(25 mg/L)的MS培养基上获得抗性苗,GUS染色结果表明,拟南芥HGO基因启动子成功转入植株中且能正常启动GUS基因的表达,为深入研究拟南芥HGO基因的表达特征创建了有价值的材料。
GUS染色结果显示,拟南芥HGO基因启动子转入拟南芥,在根、下胚轴和子叶中表达较强,在真叶中表达较弱,表明在根、下胚轴和子叶中酪氨酸的积累较多,酪氨酸降解途径较活跃;而真叶中酪氨酸的积累较少,酪氨酸降解途径较缓慢。这也说明为什么HGO基因的突变使得拟南芥只在幼苗期长势较野生型更为健硕。因生命活动或功能的不同需求,同种物质在拟南芥的不同组织部位有着其特异性的表达,但这特异性的表达还有待进一步研究。
[1] Colditz PB,Yu JS,Billson FA.Tyrosinaemia II[J].Med JAust,1984,141:244-245.
[2] Dixon DP,Edwards R.Enzymes of tyrosine catabolism in Arabidopsis thaliana[J].Plant Science,2006,171:360-366.
[3] Scriver CR,Clow CL.Phenylketonuria and other phenylalanine hydroxylasemutants inman[J].Annu Rev Genet,1980,14:179-202.
[4] 陈彦成,钱伟超,彭志红,等.酪氨酸及酪氨酸降解途径中HGO基因突变体对拟南芥幼苗生长的影响[J].作物研究,2014,28(3):251-253.
[5] 袁利兵,张 琨,彭志红,等.拟南芥psc1突变体降低蔗糖诱导的花青素积累[J].湖南农业大学学报(自然科学版),2011,37(2):139-142.
[6] 李 敏,杨 谦.一种高效构建同源重组DNA片段的方法——融合PCR[J].中国生物工程杂志,2007,27(8):53-58.
[7] Dellaporta SL,Wood J,Hicks JB.A plant DNAminipreparation:VersionⅡ[J].Plant Molecular Biology Reporter,1983,1(4):19-21.
[8] Chan RY,Palfree RG,Congote LF,etal.Developmentof a novel type of cloning vector for suicide selection of recombinants[J].DNA Cell Biol,1994,13(3):311-319.
[9] Yang YS,Watson WJ,Tucker PW,et al.Constraction of recombinant DNA by exonuclease recession[J].Nucleic Acids Res,1993,21:1889-1892.
[10]Yang YS,Yang MC,Watson WJ,et al.Directional cloning of an oligonucleotid fragment into a single restriction site[J].Journal of ImmunologicalMethods,1995,181:137-140.
[11]毛春生,金宁一,顾万钧.一种高效率通用的平端亚克隆方法[J].生命的化学,1995,15(5):42-43.
[12]Clough S,Bent A.Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J].Plant J,1998,16:735-743.
Cloning and Transformation of the HGO Promoter from Arabidopsis thaliana
CAIWei1,ZHITiantian1,REN Chunmei1,2*
(1 College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha,Hunan 410128,China;2 Crop Gene Engineering Key Laboratory of Hunan Province,Changsha,Hunan 410128,China)
The HGO gene encodes the1,2-homogentisate dioxygenase,which catalyzes the last third step in the Tyr degradation pathway.In this study,a fusion expression vector of Arabidopsis thaliana HGO gene promoter and GUSgene was constructed and transformed into Arabidopsis thaliana by Agrobacterium-mediated transformation.Results from histochemical GUS assay suggested that fusion expression vector of HGO gene promoter and GUSgene was successfully constructed and it drives the expression of GUSgene successfully.Our results create valuablematerials for studying the expression characteristics of HGO gene in Arabidopsis thaliana.
Arabidopsis thaliana;HGO;promoter;homologous recombination;gene cloning
Q784
A
1001-5280(2017)03-0256-04 DO I:10.16848/j.cnki.issn.1001-5280.2017.03.09
2016- 11- 30
蔡 薇(1992-),女,硕士研究生,Email:416382074@qq.com。*通信作者:任春梅,教授,博士,主要从事植物分子遗传学研究,Email:rencm66@163.com。
国家973计划前期研究专项(2014CB160308)。

