胸腰椎骨折术后伤椎上终板骨缺损的生物力学有限元分析
王鹏,王静成,冯新民,杨建东,陶玉平,张志强
(扬州大学临床医学院苏北人民医院 脊柱外科,江苏 扬州 225001)
胸腰椎骨折术后伤椎上终板骨缺损的生物力学有限元分析
王鹏,王静成,冯新民,杨建东,陶玉平,张志强
(扬州大学临床医学院苏北人民医院 脊柱外科,江苏 扬州 225001)
目的 利用有限元法对胸腰椎骨折术后合并伤椎上终板塌陷骨缺损患者是否适合取出内固定进行生物力学分析。方法选取健康男性志愿者1名,通过影像学检查,排除脊柱骨骼畸形、损伤等病变,利用64排螺旋CT提取胸11~腰2(T11~L3)水平薄层扫描图像。数据导入M im ics 15.0医学图像处理软件建立只包含三维表面单元,不含实体的T11~L2三维有限元骨骼模型。利用SolidW orks进一步建立实体模型。该逆向工程软件可以无损失保留各椎体空间结构,并直接组建装配体,划分网格并补充建立椎间盘、韧带等相关结构。对模型进行赋值并进行验证。在此模型基础上加入椎弓根钉棒系统,同时衍生出具有5种不同缺损大小的包含钉棒系统的模型,以及模拟取出钉棒系统后的5种模型:(缺损体积分别为椎体前柱的1/5、2/5、3/5、4/5、5/5),在该基础上进行生物力学分析。结果内固定取出后随着缺损体积的增加,E组(4/5缺损组→5/5缺损组应力差)的7种工况的综合应力改变幅度最大,当塌陷缺损体积达到椎体前柱4/5时,应力集中明显增加,意味着此时取出内固定后出现伤椎继续压缩甚至再次骨折的风险增加。结论当伤椎上终板缺损体积达到前柱4/5时,应慎重考虑内固定的取出,避免伤椎前柱再次骨折。
胸腰椎骨折;终板塌陷;骨缺损;有限元分析
椎体骨折是骨科的常见损伤,胸腰段为活动的腰椎与固定的胸椎之间的转换点,也是应力容易集中的部位,约占所有脊柱损伤部位的28%~60%。在各类内固定方式中,后路短节段椎弓根螺钉内固定技术(short segment pedicle instrumentation SSPI)[1-2]是胸腰段椎体骨折中最为常见的手术方式。但复位后形成的椎体“蛋壳样”改变、骨缺损、上终板塌陷等并发症也不断见诸报道[3-7]。对胸腰段椎体骨折内固定患者术后随访中发现,部分患者在影像学上出现伤椎上终板的“火山口样”塌陷,塌陷面积及深度不尽相同,甚至累及椎体前缘。
本文研究的内容及创新点在于首次引入有限元法,对此类塌陷的转归进行生物力学研究,对影像学上具有此类塌陷的患者,是否适合取出内固定,得出可供临床医师参考的实际结果。
1 资料与方法
1.1 研究对象
选取健康男性志愿者1名,年龄27岁,身高173 cm,体重68 kg,受试者对该实验知情同意,并签署同意书。通过X线的影像学检查,排除受试者脊柱骨骼畸形、损伤等病变。
1.2 仪器和软件
1.2.1 计算机硬件 有限元分析计算机工作站:联想ThinkStation P500;CPU:Xeon E5-1620v3;显卡:Quadro K2200 4GB;硬盘:1 TB;内存:DDR4 RDIMM 128GB;显示器:优派VX2370S-LED。
1.2.2 有限元软件 三维建模及有限元分析软件:医学图像处理软件Mimics15.0(Materialise Company,比利时);大型CAD软件SolidWorks2014(Solid-Works Company,美国);CAE应用软件HyperMesh 12.0(Altair Company,美国);大型有限元分析软件Abaqus6.13(DassaultCompany,法国)。
1.3 方法
1.3.1 CT数据采集 利用64排螺旋CT,志愿者取平卧位,自T11~L2行水平薄层扫描,获得392张相应节段水平截图。扫描的数据资料以DICOM格式导出,并刻录光盘储存,以便于Mimics 15.0医学图像处理软件处理图像数据。
1.3.2 建立T11~L2三维有限元模型 将392张DICOM格式的胸腰椎水平截图导入到Mimics 15.0医学图像处理软件中,软件可自动定位的图像,并按照3种截面(冠状位、水平位和矢状位)分别显示。见图1。
1.3.3 阈值分割 CT图像利用阈值分割方法可以很容易将CT值差别明显的骨骼和软组织分开,并形成1个蒙版。如果相邻像素的灰度值接近,人眼很难分割边界,利用Mimics 15.0医学图像处理软件中Draw Profile Line及Thresholding功能,将图像阈值调节为462~2 676Hu,使胸腰椎椎体,椎间盘,骶骨以及关节突关节各部分的界限更清楚。见图2。1.3.4 区域增长及edit masks 利用区域增长可将上述蒙版上彼此不相连的分割区域形成1个新的蒙版。利用Region Growing功能可粗略提取感兴趣的腰椎各个节段。在每一层扫描图像上对每个骨的边界轮廓进行修改或擦除操作,将去除多余髋骨,骨与骨之间的边界轮廓区分准确,特别是上下关节突关节。见图3、4。

图1 截面
1.3.5 建立脊柱三维骨骼模型 断层图像处理结束后,重建脊柱骨盆三维表面模型,生成脊柱各部分椎体独立骨骼模型,清楚直接地再现三维立体骨结构形态。三维重建后的图象,可进行全方位的旋转、平移等演示。见图5。
上述骨骼模型不含实体,只包含三维表面单元。各骨骼模型数据自动包含了椎体整体坐标系中的位置坐标,将数据信息导入SolidWorks软件并进一步建立实体模型。
1.3.6 使用SolidW orks软件构建T11~L2的三维实体模型及钉棒系统 具体情况见图6、7。
1.3.7 划分网格并补充建立椎间盘和韧带 将SolidWorks软件中建立的T11~L2与钉棒系统的三维实体模型导入HyperMesh软件,利用HyperMesh软件强大的网格制作及剖分功能,将装配体划分四面体网格,同时构建1mm厚的皮质骨,网格尺寸分别为:T11~L2为2mm,钉棒系统为1mm。然后按照解剖部位和形态补充建立终板、纤维环、髓核,前后纵韧带、横突间韧带、棘上、棘间韧带、黄韧带、关节囊韧带,以及上下关节突软骨等结构,获得T11~L2的三维有限元模型,该模型具有191 386个单元和55 741个节点组成。见图8。
并获得T11~L2与钉棒系统的三维有限元模型,该模型具有310 970个单元和73 469个节点组成。见图9。同时衍生出具有5种不同缺损大小的打入钉棒系统的模型,以及取出钉棒系统后的5种模型:(缺损体积分别为椎体前柱的 1/5、2/5、3/5、4/5、5/5)。见图10。
1.3.8 对模型进行赋值 利用ABAQUS有限元分析软件进行处理分析,本实验还是采用有限元软件中的另一种赋值方法,直接参考以往的文献。根据既往文献参数进行材料赋值。所有组织的材料特性被认为是均匀和各向同性。见表1。
这些韧带根据其功能均用Truss单元模拟,定义Truss压缩无弹力,拉伸有弹力的属性,即韧带单元只有拉伸载荷。Truss单元数目根据韧带的横截面积,同时为了避免局部应力集中,对其进行了如下设置:前纵韧带20个,后纵韧带20个,棘间韧带16个,棘上韧带12个,横突间韧带共32个,黄韧带20个,关节囊韧带48个,故全部韧带共包含168个Truss单元。腰椎小关节突间活动中有位置的相对变化和摩擦,因此本研究设定为接触(interaction),摩擦系数定义为0.2。

图2 阈值增长后

图3 区域增长获得T11~L2阶段的骨骼

图4 使用edit masks逐层修改或擦除获得各骨骼的准确轮廓
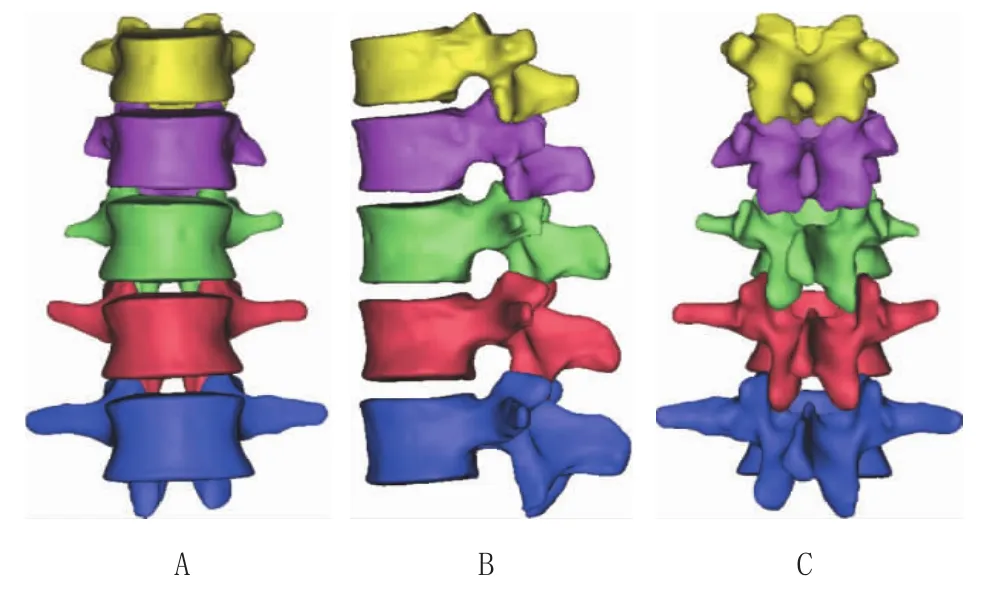
图5 三维模型

图6 构建T11~L2的三维实体模型

图7 T11~L2与钉棒系统的三维实体模型

图8 T11~L2的有限元网格模型

图9 T11~L2的钉棒系统有限元网格模型

图10 椎体前柱缺损体积(1/5-5/5)模型

表1 材料赋值参数表
1.3.9 对模型进行验证 有限元模型的验证方法较多,主要包括自身检验、与以往相同模型的比较及体外生物力学实验结果比较等。本实验采用与以往模型的比较的方法来验证其有效性。①对完整模型施加1 200N的垂直载荷,计算轴向压缩刚度;②对模型施加15N.M的扭矩,计算模型的在前屈、后伸、侧屈、旋转4种工况下的刚度。并与文献比较模型的压缩及压缩刚度,两者结果相仿。见表2。

表2 模型的弯曲及扭转刚度
2 结果
正常椎体垂直、前屈、后屈及侧屈的受力云图,见图11。从图11中可以发现,垂直状态下椎体前2/3及椎体终板的后部及近椎弓根处是正常椎体的应力集中区,并向后外侧呈放射状分布;很明显皮质骨尤其是椎体前缘所受应力高于松质骨;当椎体前后及侧向屈伸运动时,屈侧及伸侧以及椎弓根附近均出现应力集中现象。
在打入钉棒系统的模型中,模拟5种上终板塌陷(缺损体积分别为椎体前缘2/3的1/5、2/5、3/5、4/5、5/5)分别在垂直、前后屈、侧屈、左右旋转下的受力情况,应力分布见表3。从表3中数据可以看出,植入内固定后,随着伤椎缺损体积不断增大,应力也相应增大。
模拟取出内固定后,5种上终板塌陷(缺损体积分别为椎体前缘2/3的1/5、2/5、3/5、4/5、5/5)分别在垂直、前后屈、侧屈、左右旋转下的受力转归情况,应力分布见表4。
本研究将工况受力情况类似的垂直载荷、左旋转、右旋转以及前屈、后伸、右侧屈、左侧屈分别做点线图。见图12、13。
从表4中可以看出,随着内固定的取出,失去了内固定的支持后,随着缺损体积的增加,应力逐渐变大。从点线图12、13中可以看出,在应力逐渐增加的趋势下,E组(4/5缺损组→5/5缺损组应力差)的7种工况的综合应力改变幅度最大,提示内固定取出后,伴有上终板塌陷骨缺损的伤椎,当其塌陷缺损面积达到椎体前柱4/5时,应力集中明显增加,意味着此时取出内固定后出现伤椎继续压缩甚至再次骨折的风险增加。

表3 钉棒系统下5种缺损体积的总体及内固定最大应力分布 MPa

表4 5种缺损体积取出内固定后的总体最大应力分布 MPa

图11 正常椎体垂直、前屈、后屈及侧屈的受力云图

图12 取出内固定后,左旋、右旋及垂直载荷下伤椎受力趋势曲线图

图13 取出内固定后,左、右侧屈及后伸、前屈载荷下伤椎受力趋势曲线图
3 讨论
有限元法已在脊柱研究中得到广泛应用且具有其独特无法替代的优势。通过有限元分析与实验研究的比较,国内外很多学者都证实有限元模型分析的结果是可靠的。GEOL等[8]最早利用CT扫描的几何形状重建复杂腰椎节段的三维有限元模型,BREAU等[9]则报道了应用CT腰椎扫描数据建立模型的详细方法,AYTURK等[10]则研究了人类脊柱有限元模型的参数趋同的敏感性及有效性。除此之外已有很多文献报道证实了三维有限元方法对脊柱进行生物力学分析的可靠性[11-13]。近年来BISWAS等[14]利用有限元方法研究了低位腰椎最优化的内固定螺钉方式,并认为有限元分析法(finite element analysis,简称FEA)是公认的计算机辅助下模拟脊柱病理条件的最有效的工具。KULDUK等[15]则研究了有限元模型下脊柱活动范围和负载特性内固定动态稳定生物力学的比较。由此可以看出,有限元法在脊柱疾病及内固定生物力学方面的研究确实有着无可比拟的优越性。
国内外许多学者对术后伤椎椎体真空征,终板塌陷等形成机制做了广泛的研究。早在1895年,KÜMMELL在对术后椎体后凸畸形研究中首先描述了椎体内真空征,后来该特征以其名字命名为“KÜMMELL Disease”[16-19]。结合之前学者的研究成果,关于伤椎椎体术后的塌陷机制,主要有以下几种理论:①椎体缺血性坏死理论:MALDAGUE等在1978年首次将椎体内真空征与椎体缺血性坏死联系起来。而这种理论也得到了解剖学上研究的支持:胸腰椎的脉管系统由成对的节段性的动脉组成,椎体后部的后段中央支供应临近的两个椎体,同时椎体腹侧的前部中央支供应一个椎体。因此椎体腹侧部份理论上就有血供不足的风险,这一较弱的血液供应也被WU[20]所证实;②骨不连和假关节的形成:内固定虽然将伤椎撑开复位,但其内部的骨小梁支架等骨性结构并未同时恢复,形成所谓的“蛋壳椎”,如果活动一直存在且骨折不愈合,则继而造成骨不连及假关节形成[21];③当患者仰卧时,椎间盘及韧带的牵拉作用可以使得椎体高度得到部分的恢复,因椎体内的压力要低于外界大气压,MATZAROGLOU等[22]认为破裂的终板、椎间盘以及缝隙较大的椎体骨折裂隙,使得气体可以很容易的进入,椎体出现真空的同时,往往也伴有椎间盘的真空现象;④骨质疏松以及类固醇药物的应用被认为是导致椎体内真空现象的两个最重要的危险因素[23]。患者年龄越高、骨密度越低,其发生椎体内空腔现象的几率就越高。
后路椎弓根内固定术的自身缺陷也是导致椎体空壳样变及终板塌陷的重要原因:①后路手术远期植骨融合率较前路手术低,且内固定术后伤椎内部骨小梁等骨性结构并未同时恢复,远期导致椎体蛋壳样改变[24];②脊柱损伤往往使得前中柱丧失了结构上的完整性,这直接导致了其承受纵向压缩负荷能力的下降。而后路内固定系统缺乏对前柱的有效支撑,导致内固定载荷异常,即使牢固的内固定系统也会因疲劳而失败,发生断钉、断棒[25],从而导致复位的椎体在未愈合前受压再次塌陷;③前后纵韧带的夹板作用可以使椎体前后壁及压缩椎体的高度得到复位,但无法使压缩下陷的终板中心区域复位,椎间盘可再次陷人椎体内[26]。椎体内较大裂隙也会导致损伤的椎间盘组织陷入椎体,阻碍椎体内的骨性愈合,最终出现椎体真空征导致椎体终板塌陷。
因此,正是基于以上的理论及后路椎弓根内固定术本身的这些缺陷性从而导致了术后椎体上终板的塌陷。
通过有限元法模拟伤椎上终板塌陷,模拟随缺损体积变化的应力改变,本研究认为当伤椎上终板缺损体积达到前柱4/5时,应慎重考虑内固定的取出,避免伤椎前柱再次骨折。同时为了防止术后出现此类情况,应严格掌握后路手术适应症,前后路联合手术,亦有学者尝试后路联合伤椎内植骨,远期随访伤椎上终板塌陷骨缺损现象明显减少,但对于此现象仍需进一步的临床研究。
FEA能够将各种复杂问题简单化,通过建模、应力分布等从生物力学角度探讨脊柱骨折好发部位及发生机制,从而有效地预防脊柱损伤的发生,还能更加科学地对骨折进行分型,为脊柱骨折的治疗提供新的科学依据并减少并发症的发生。但现今因各种因素的影响,FEA在胸腰段脊柱骨折中的应用尚有欠缺。有限元的求解结果仅为一近似值,只有单元数目接近无限大时,才为真正的实解,因而提高有限元的精确性至关重要。特别是在脊柱模型的建立中,由于脊柱解剖结构、组织材料力学性能及负荷分布等方面的复杂性,目前研究建立的模型形态和结构域实际还有差距,建立模型时所用生物材料的性质与实际也并不完全一致。目前尚不能建立十分精确的有限元模型。
相信随着技术的进步,有限元模型将会更加精确,能更好地为各种脊柱骨折内固定、脊柱矫形的治疗及人工椎间盘、人工椎体的置换提供合理正确的解释。
[1]LINDSEY R W,DICK W.The fixateur interne in the reduction and stabilization of thoracolumbar spine fractures in patients with neurologic deficit[J].Spine,1991,16(3):S140-S5.
[2]DICK W,KLUGER P,MAGERL F,et al.A new device for internal fixation of thoracolumbar and lumbar spine fractures:the‘fixateur interne[J].Spinal Cord,1985,23(4):225-232.
[3]PROIETTI L,SCARAMUZZO L,SCHIRO G R,et al.Complications in lumbar spine surgery:A retrospective analysis[J].Indian Journal of Orthopaedics.2013,47(4):340.
[4]GURWITZ G S,DAWSON J M,MCNAMARA M J,et al. Biomechanical analysis of three surgical approaches for lumbar burst fractures using short-segment instrumentation[J].Spine, 1993,18(8):977-982.
[5]MC CORMACK T,KARAIKOVIC E,GAINES R W.The load sharing classification of spine fractures[J].Spine,1994,19(15): 1741-1744.
[6]MC LAIN R F,SPARLING E,BENSON D R.Early failure of short-segment pedicle instrumentation for thoracolumbar fractures. A preliminary report[J].The Journal of Bone& Joint Surgery, 1993,75(2):162-167.
[7]SASSO R C,COTLER H B.Posterior instrumentation and fusion for unstable fractures and fracture-dislocations of the thoracic and lumbar spine:a comparative study of three fixation devices in 70 patients[J].Spine,1993,18(4):450-460.
[8]GOEL V K,KIM Y E,LIM T,et al.An analytical investigation of the mechanics of spinal instrumentation[J].Spine,1988,13(9): 1003-1011.
[9]BREAU C,SHIRAZI-ADL A,DE GUISE J.Reconstruction of a human ligamentous lumbar spine using CT images-a three-dimensional finite element mesh generation[J].Annals of Biomedical Engineering.1991,19(3):291-302.
[10]AYTURK U M,PUTTLITZ C M.Parametric convergence sensitivity and validation of a finite elementmodel of the human lumbar spine[J].Computer Methods in Biomechanics and Biomedical Engineering,2011,14(8):695-705.
[11]QIU T X,TAN K W,LEE V S,et al.Investigation of thoracolumbar T12-L1 burst fracture mechanism using finite element method[J].Medical Engineering&Physics.2006,28(7):656-664.
[12]IMAI K,OHNISHI I,BESSHO M,et al.Nonlinear finite element model predicts vertebral bone strength and fracture site[J]. Spine,2006,31(16):1789-1794.
[13]PARK W M,PARK Y S,KIM K,et al.Biomechanical comparison of instrumentation techniques in treatment of thoracolumbar burst fractures:a finite element analysis[J].Journal ofOrthopaedic Science,2009,14(4):443-449.
[14]BISWAS J,KARMAKAR S,MAJUMDER S,et al.Optimization of spinal implant screw for lower vertebra through finite element studies[J].Journal of Long-term Effects of Medical Implants, 2014,24(2/3):99-108.
[15]KULDUK A,ALTUN N S,SENKOYLU A.Biomechanical comparison of effects of the dynesys and coflex dynamic stabilization systems on range of motion and loading characteristics in the lumbar spine:a finite element study[J].the International Journal of Medical Robotics and Computer Assisted Surgery,2015,11 (4):400-405.
[16]LIBICHER M,APPELT A,BERGER I,et al.The intravertebral vacuum phenomen as specific sign of osteonecrosis in vertebral compression fractures:results from a radiological and histological study[J].European Radiology,2007,17(9):2248-2252.
[17]RESNICK D,NIWAYAMA G,GUERRA JR J,et al.Spinal vacuum phenomena:anatomical study and review[J].Radiology, 1981,139(2):341-348.
[18]MALDAGUE B E,NOEL H M,MALGHEM J J.The intravertebral vacuum cleft:a sign of ischemic vertebral collapse 1[J]. Radiology,1978,129(1):23-29.
[19]YANG H,PAN J,WANG G.A Review of osteoporotic vertebral fracture nonunion management[J].Spine,2014,39(26B):B4-6.
[20]WU A M,CHI Y L,NI W F.Vertebral compression fracture with intravertebral vacuum cleft sign:pathogenesis,image,and surgicalintervention[J].Asian Spine Journal,2013,7(2):148-155.
[21]PAPPOU I P,PAPADOPOULOS E C,SWANSON A N,et al. Osteoporotic vertebral fractures and collapse with intravertebral vacuum sign(Kummel's disease)[J].Orthopedics,2008,31(1): 61-66.
[22]MATZAROGLOUC,GEORGIOUCS,PANAGOPOULOS A.Kummell's disease:clarifying the mechanisms and patients'inclusion Criteria[J].the Open Orthopaedics Journal.2014,8:288-297.
[23]STÄBLER A,SCHNEIDER P,LINK T M,et al.Intravertebral vacuum phenomenon following fractures:CT study on frequency and etiology[J].Journal of Computer Assisted Tomography,1999, 23(6):976-980.
[24]沈军,邹天明,缪烨,等.决定胸腰椎骨折椎体内植骨组织爬行替代的因素[J].中国组织工程研究,2013(53):9113-9118.
[25]刘钢.钉棒系统置入内固定治疗腰椎骨折的力学分析[J].中国组织工程研究与临床康复,2011(43):8147-8150.
[26]AMBATI D V,WRIGHT EK J R,LEHMAN RA J R,et al. Bilateral pedicle screw fixation provides superior biomechanical stability in transforaminal lumbar interbody fusion:a finite element study[J].The Spine Journal:Official Journal of The North American Spine Society,2014,15(8):1812-1822.
(张西倩 编辑)
Biomechanical stability finite element analysis of injured vertebrae w ith superior endp late bone defect after thoracolumbar fracture surgery
PengWang,Jing-chengWang,Xin-min Feng,Jian-dong Yang, Yu-ping Tao,Zhi-qiang Zhang
(Departmentof Spine Surgery,Subei People's Hospital,Clinical Medical College of Yangzhou University,Yangzhou,Jiangsu 225001,China)
ObjectiveTo evaluate whether the condition of the patients is suitable for removal of the internal fixation using biomechanical finite elementanalysis in the patients complicated with superior endplate bone defect of injured vertebrae after thoracolumbar fracture surgery.MethodsA healthymale volunteer was chosen after exclusion of spinal bone deformities,injury or other lesions by imaging examination.The thin slice images of T11-L2 were extracted using 64 row spiral CT.The data were put into Mimics 15.0 software to establish a 3-dimensional finite elementmodel of T11-L2 vertebrae which contained 3-dimensional surface element but excluded entity.Further entity model was set up using SolidWorks software,which could retain the original spatial relations and build the model directly,generate mesh and establish intervertebral disc,ligament and other structures.The value was assigned to the model and tested.The pedicle screw-rod system was inserted in the model and the modelscontaining 5 different volume(1/5,2/5,3/5,4/5 and 5/5 of anterior vertebral column)of bone defectwere derived out and a biomechanical analysis was made on this basis.ResultsWith the increase of bone defect after removal of implants,the group E(4/5 to 5/5 volume of anterior vertebral column)had the biggestamplification of the total stress about the 7 kinds of operatingmodes.When the bone defect volume reached 4/5 of anterior vertebral column,stress concentration increased significantly,indicating the risks of vertebral compress and even fracture were greatly increased after removing the internal fixation at thismoment.ConclusionsWe hold the opinion that if the superior endplate bone defect of the injured vertebrae reaches 4/5 of anterior vertebral column,careful consideration should be given to the removal of internal fixator in order to avoid vertebral refracture.
thoracolumbar fracture;collapse of the endplate;bone defect;finite elementanalysis
R 683
A
10.3969/j.issn.1005-8982.2017.07.017
1005-8982(2017)07-0072-08
2016-11-27
杨建东,E-mail:yangjiandong69@sohu.com;Tel:18051060409

