瞬时受体电位离子通道3在糖尿病肾病小鼠的表达及意义
于海霞 郭 佳 刘东伟 秦 丽 余 琦 刘章锁
瞬时受体电位离子通道3在糖尿病肾病小鼠的表达及意义
于海霞1,2,3郭 佳1,2刘东伟1,2秦 丽1,2,3余 琦1,2,3刘章锁1,2
目的:研究瞬时受体电位离子通道3(TRPM3)在2型糖尿病肾病模型db/db小鼠肾组织的表达,以及高糖对人肾小管上皮细胞(HK2)和小鼠足细胞(MPC)TRPM3表达的影响。 方法:(1)将20只雄性5周龄db/db小鼠随机分为两组,各10只。同窝出生的db/m小鼠作为正常对照组(n=20)。待db/db小鼠生长至10周龄和18周龄后取血、尿标本测定相关生化指标,留取肾组织。利用Western blot、实时荧光定量PCR(qRT-PCR)和免疫组织化学方法,检测正常对照组(db/m小鼠)及不同周龄(10周、18周)db/db小鼠肾组织中TRPM3的表达水平及分布情况。 (2)体外培养HK2和条件永生化MPC,分别按以下处理分组:对照组(D-葡萄糖5.6 mmol/L);甘露醇组(D-葡萄糖5.6 mmol/L+甘露醇24.4 mmol/L);高糖组(D-葡萄糖30 mmol/L),培养24h、48h、72h收获细胞,用Western blot和qRT-PCR检测细胞中TRPM3的表达。 结果:(1)与db/m小鼠相比,db/db小鼠肾组织肾小管和肾小球中TRPM3的表达增多,差异有统计学意义(P<0.05);(2)与正常对照组相比,高糖组HK2和MPC中TRPM3的表达均增多,差异有统计学意义(P<0.05); 结论:TRPM3可表达于糖尿病肾病小鼠肾脏组织的肾小管和肾小球中,且高血糖可诱导TRPM3在HK2细胞和MPC细胞的高表达;TRPM3可能参与了糖尿病肾病的发生发展。
糖尿病肾病 瞬时受体电位离子通道3 人肾小管上皮细胞 条件永生化的小鼠足细胞
糖尿病肾病(DN)是糖尿病最常见的微血管并发症,是导致终末期肾病(ESRD)的主要病因之一。肾小球滤过屏障受损(足细胞损伤起关键作用)、肾小球硬化及肾间质纤维化在DN的进展中发挥重要作用[1]。瞬时受体电位通道(即TRP通道)是位于细胞膜上一类重要的阳离子通道,它可广泛表达多种哺乳动物的组织和细胞[2]。TRP家族分为7个亚家族,不同亚型在肾脏发挥的作用不同。近年来,亚家族中TRPC6与瞬时受体电位离子通道3(TRPM3)备受关注。最早有研究指出,TRPC6基因突变能够导致局灶节段性肾小球硬化(FSGS),由此揭示了TRPC6与肾脏疾病的密切关系[3]。最新研究发现,在DN的发病进程中,TRPC6能够诱导细胞Ca2+内流改变,进而引起足细胞滤过功能的损伤,最终导致蛋白尿[4]。作为另一个钙通透性离子通道TRPM家族中的一员,TRPM3主要表达于脑和肾脏。相关报道指出,TRPM3在背根神经节神经元中可参与调控机体的避害行为[5]。同时它能够调控寡突胶质细胞的分化和中枢神经系统髓鞘的形成[6]。此外,还在维持肾脏的钙离子稳态中发挥重要作用,但是目前有关TRPM3在DN小鼠肾组织及细胞中的表达及作用研究较少。考虑到TRPC6在DN中的相关研究较多,因此本课题选取TRPC6为参照,同时比较TRPM3、TRPC6在DN小鼠肾组织中的表达分布情况及高糖环境下两者在人肾小管上皮细胞、小鼠足细胞中的表达情况。
材料与方法
材料与试剂 兔抗小鼠(或兔抗人)多克隆抗体TRPM3 (SantaCruz,CA);兔抗小鼠(或兔抗人)多克隆抗体TRPC6(英国Abcam);小鼠抗小鼠(或小鼠抗人)GAPDH单克隆抗体(中杉金桥生物工程公司);辣根过氧化物酶标记的山羊抗兔二抗及山羊抗小鼠二抗(北京鼎国昌盛生物技术公司);RPIM 1640 培养基、胎牛血清、0.25%胰蛋白酶(均购自美国Gibco);DMEM培养基(美国Hyclone);小鼠γ-干扰素(美国R&D systems);cDNA合成试剂盒及实时荧光定量PCR试剂盒(日本东洋纺公司);PV-9001免疫组化检测试剂(中杉金桥生物工程公司)。
仪器与设备 安稳血糖仪(三诺生物传感股份有限公司)、液氮容器(北京恒奥生物科技有限公司)、CO2细胞培养箱、高速低温离心机(德国Eppendorf)、高压灭菌器(日本SANYO公司)、数显恒压恒流电泳仪(Tanon公司)、转移电泳槽(天能Tanon公司)。
方法
实验动物及分组 (1)C57BLKS/J的清洁级雄性db/db小鼠和db/m小鼠由南京模式动物中心提供,于河南省实验动物中心动物房分笼饲养,同窝出生的5周龄小鼠经检疫及适应性饲养1周。每笼5只,室温18~24℃, 实验期间自由进食饮水,喂养普通饲料,不使用胰岛素和其他降糖药物。(2)分组:将20只雄性5周龄db/db小鼠随机分为两组,各10只。同窝出生的db/m小鼠(20只)作为正常对照组。从6周龄起定期测定各组小鼠的体重,收集24h尿,禁食8 h后测尾尖血糖。饲养10周、18周后用5%水合氯醛按照0.1 ml/10g体重腹腔注射麻醉小鼠,收集心脏血,分离两侧肾脏,观察一般情况,剥离肾包膜并留取肾脏,将肾脏皮质切成绿豆样大小后置于光镜液中固定,剩余肾组织置于液氮中保存备用。
细胞培养及分组 (1)人近端肾小管上皮细胞系(HK2)(购自于中国典型培养物保藏中心)培养于含10%胎牛血清(FBS)的低糖(D-葡萄糖 5.6 mmol/L)DMEM培养基中,细胞置于37℃、5%C02细胞培养箱贴壁培养。0.25%胰酶消化,按需传代,待细胞生长至 70%~80%融合时,用无血清培养基饥饿同步12h后随机分为以下5组:①正常对照组(NG 5.6 mmol/L葡萄糖);②甘露醇组(NG+M即5.6 mmol/L葡萄糖+24.4 mmol/L甘露醇);③高糖组(HG 30 mmol/L葡萄糖),分别于24h、48h、72h各时间点收获细胞。(2)条件性永生化小鼠足细胞株(MPC)由南方医科大学聂静教授(Southern Medical University,China)惠赠。参照Peter Mundle教授的方法[7],增殖状态下,未分化足细胞在33℃、5% CO2培养箱贴壁培养,使用含10%胎牛血清、5.6 mmol/L葡萄糖、10 U/ml小鼠干扰素γ的RPMI1640培养基,待细胞生长至70%~80%融合后进行传代或放入37℃、5% CO2的培养箱使其分化,此时改用含10%胎牛血清、5.6 mmol/L葡萄糖、不含重组小鼠干扰素γ的RPMI 1 640培养基,培养足细胞12~14天,待其分化成熟后,余处理及分组同上。
生化指标检测 空腹血糖采用快速血糖仪检测,血生化在郑州大学第一附属医院生化室检测。
实时荧光定量PCR(qRT-PCR)法检测相关mRNA表达 Trizol法提取动物肾组织和各实验细胞中的总RNA,采用紫外线分光光度计测定各样本RNA浓度,按反转录试剂盒说明书反转录获得cDNA。用荧光定量PCR仪分别扩增内参照基因和各目的基因,用Ct值表示样品中内参照基因和目的基因的相对含量。qRT-PCR扩增体系如下:PCR Master Mix 10 μl,上、下游引物(10 nmol/L)各1 μl,模板cDNA 2 μl,加RNase-free水补足至20 μl。循环条件:95℃ 30s、95℃ 5s和60℃ 32s,循环45次,重复实验至少3次。各引物序列见表1。

表1 目的基因引物序列
Western印迹法检测蛋白表达 (1)组织蛋白的提取:取液氮冻存的肾组织,加适量裂解液后充分研磨,4℃ 裂解组织,12 000×rpm低温离心10 min,取上清液,BCA法测蛋白浓度,不煮蛋白,直接将各组蛋白上样进行SDS-PAGE电泳,然后湿转将胶上蛋白转移至PVDF膜上,5% BSA室温封闭2h,4℃一抗孵育过夜,各抗体工作浓度分别为:TRPM3抗体(1∶ 1 500)、TRPC6抗体(1∶ 1 500)、GAPDH抗体(1∶ 2 000)。次日1×TSBT洗膜三次、10 min/次,用辣根过氧化物酶标记的山羊抗兔二抗(1∶ 2 500)或山羊抗小鼠二抗(1∶ 2 500)室温孵育2h,1×TSBT洗膜三次、10 min/次。用Tanon全自动化学发光成像分析系统进行曝光成像,以GAPDH为内参,Image J软件分析条带并计算TRPM3、TRPC6蛋白表达水平。(2)细胞蛋白的提取:收集各组细胞,按照全细胞裂解液说明书冰上提取总蛋白,12 000×rpm低温离心10 min,取上清液,BCA法测定蛋白浓度,余方法同上。按相同实验条件、用不同批次细胞重复实验至少3次。
免疫组织化学 用石蜡包埋小鼠肾组织,切成3 μm厚度薄组织,贴于防脱片上,60℃恒温箱烤片2h,后于4℃冰箱内保存。用前烤片30 min,经二甲苯、梯度酒精进行脱蜡、水化,PBS洗涤5 min/次×3次,微波修复抗原,待恢复室温后PBS洗涤5 min/次×3次,3%H2O2室温孵育30 min以阻断内源性过氧化物酶,PBS洗涤5 min/次×3次,山羊血清封闭20 min,分别滴加一抗TRPM3(1∶ 150)、TRPC6(1∶ 150),4℃孵育过夜;次日PBS洗涤5 min/次×3次后滴加相应HRP标记的二抗及反应增强液,显微镜下控制DAB显色时间,苏木素染核,梯度酒精脱水、二甲苯透明后封片。阴性对照组使用PBS 替代一抗。

结 果
糖尿病肾病小鼠肾组织TRPM3、TRPC6的表达分布
一般状态和生化指标 db/db小鼠的体重和空腹血糖、24h尿蛋白和肌酐水平均高于同周龄db/m小鼠(P<0.05)(表2)。
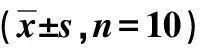
表2 各组小鼠生化指标情况
db/db:糖尿病肾病模型小鼠;db/m:正常对照组;*:与同周龄db/m小鼠相比,P<0.05
肾组织TRPM3、TRPC6表达 Western 印迹法示,10周db/db小鼠和18周db/db小鼠肾组织中TRPM3、TRPC6蛋白表达量明显高于db/m小鼠(P<0.05);qRT-PCR结果与Western印迹结果趋势一致(图1)。
肾组织TRPM3、TRPC6免疫组织化学结果 TRPM3、TRPC6主要表达于细胞质,呈棕色。与同周龄db/m小鼠相比,db/db小鼠肾组织肾小管和肾小球中的TRPM3、TRPC6表达明显增多(图2、3)。
高糖环境下HK2和MPC细胞TRPM3、TRPC6的表达情况
HK2细胞 (1) Western 印迹结果显示,与NG组相比,HG组中TRPM3、TRPC6蛋白表达随高糖培养时间延长逐渐增多(均P<0.05)。qRT-PCR结果与Western印迹结果趋势一致(图4);(2) 对各组中TRPM3、TRPC6蛋白表达水平进行相关性分析显示,两者呈线性正相关(r=0.609,P=0.016)。
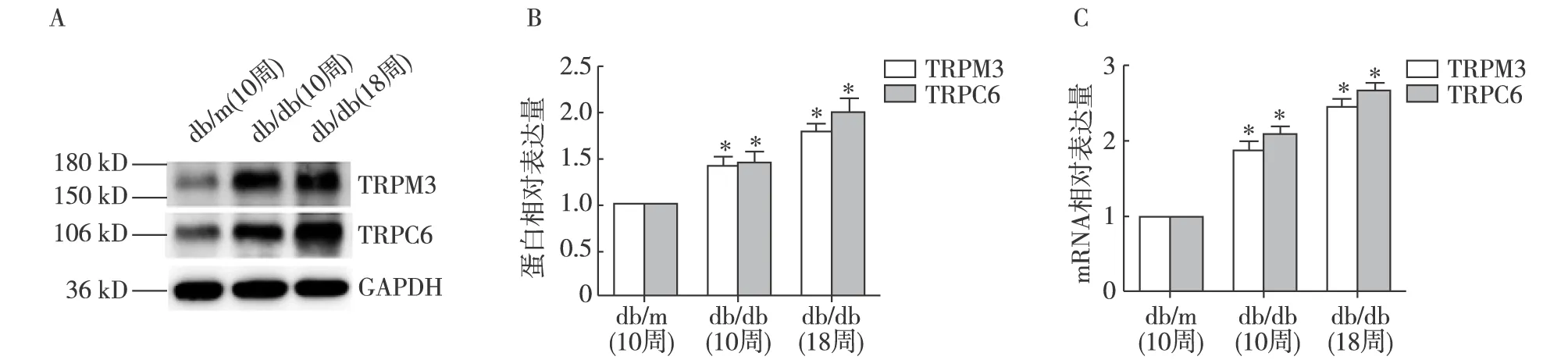
图1 各组小鼠肾组织中TRPM3、TRPC6蛋白和mRNA表达情况db/db:糖尿病肾病模型小鼠;db/m:正常对照组;TRPM3:瞬时受体电位离子通道3;TRPC6:瞬时受体电位通道6;A、B:Western Blot检测TRPM3、TRPC6蛋白结果;C:qRT-PCR检测TRPM3、TRPC6 mRNA结果;*:与db/m(10周)相比,P<0.01

图2 各组小鼠肾组织中TRPM-3、TRPC-6免疫组化结果(IH,×200)db/db:糖尿病肾病模型小鼠;db/m:正常对照组;TRPM3:瞬时受体电位离子通道3;TRPC6:瞬时受体电位通道6

图3 小鼠肾组织中TRPM3、TRPC6表达的半定量分析TRPM3:瞬时受体电位离子通道3;TRPC6:瞬时受体电位通道6;*:与db/m(10周)相比,P<0.05;△:与db/m(18周)相比,P<0.05
MPC细胞 (1)Western印迹结果显示,与NG组相比,HG组中TRPM3、TRPC6蛋白表达随高糖培养时间延长逐渐增多(均P<0.01)。qRT-PCR结果与Western印迹结果趋势一致(图5);(2) 对各组中TRPM3、TRPC6蛋白表达水平进行相关性分析显示,两者呈线性正相关(r=0.939,P<0.01)。
讨 论
db/db小鼠是早期DN的模型,有研究证实,db/db小鼠自第8~10周开始出现蛋白尿及肾功能损害[8]。本研究显示,自第6周开始,db/db小鼠的血糖较db/m小鼠升高,出现多饮、多尿、体重增加。自第10周开始,db/db小鼠的尿蛋白较db/m小鼠明显增高,这都与既往研究结果一致,这说明DN小鼠模型建立成功。
TRPM3是一种瞬时受体电位通道,可介导Ca2+、Mn2+、Zn2+等进入细胞[9](以通透Ca2+为主),参与机体的各种病理生理过程。有研究表明,TRPM3能够介导胰岛素的分泌[10],还可以下调增殖的血管平滑肌中炎症因子IL-6的表达[11]。它主要表达于人体肾脏中,在钙离子稳态中发挥重要作用,但具体机制仍然处于待研究阶段。新近研究指出,肾透明细胞癌中TRPM3的表达上调,这可能与TRPM3诱导细胞钙离子内流增多进而引起细胞的自噬有关,由此可利用TRPM3通道为切入点对肾脏肿瘤进行靶向治疗[12],这表明TRPM3通道在肾脏中发挥的作用不可小觑。而截止目前,TRPM3与DN的关系鲜有报道,且其在小鼠肾脏组织中的表达及分布情况并不十分清楚。因此,本研究通过DN模型小鼠,我们发现db/db小鼠肾脏组织TRPM3 mRNA及其蛋白表达水平较正常对照组小鼠(db/m)升高,且随着周龄的增加TRPM3的表达也随之升高;免疫组化结果提示db/db小鼠肾小管和肾小球中TRPM3表达上调;此外我们的研究以人肾小管上皮细胞和小鼠足细胞为实验对象,从细胞水平验证了高糖能够诱导HK2和MPC中TRPM3的高表达。这表明TRPM3可能在DN的发生发展中产生了作用。

图4 高糖对HK-2中TRPM3、TRPC6蛋白和mRNA表达情况TRPM3:瞬时受体电位离子通道3;TRPC6:瞬时受体电位通道6;NG:正常对照组;NG+M:甘露醇组;HG:分别为D-葡萄糖30 mmol/L 24h/48h/72h组;A/B:Western blot检测TRPM3、TRPC6蛋白结果;C:qRT-PCR检测TRPM3、TRPC6 mRNA结果;*:与NG组相比,P<0.05

图5 高糖对MPC中TRPM3、TRPC6蛋白和mRNA表达情况TRPM3:瞬时受体电位离子通道3;TRPC6:瞬时受体电位通道6;NG:正常对照组;NG+M:甘露醇组;HG:分别为D-葡萄糖30 mmol/L 24h/48h/72h组;*:与NG组相比,P<0.01;A、B:Western Blot检测TRPM3、TRPC6蛋白结果;C:qRT-PCR检测TRPM3、TRPC6 mRNA结果
作为瞬时受体电位通道家族的另一成员,TRPC6是足细胞裂孔膜蛋白的一员,能够介导钙离子内流进而调节足细胞的功能,维系肾小球的正常滤过,成为近年来研究的热点。有学者发现,高糖能够诱导体外培养的足细胞中TRPC6的表达增多,最终引起足细胞骨架蛋白的损伤[13]。也有研究提出,高血糖可诱导TRPC6在DN大鼠肾小球中的高表达,这可能参与了DN大鼠足细胞的损害和蛋白尿的形成[14]。DN中氧化应激的出现及活性氧簇(ROS)的增加可上调TRPC6的表达[15-16],同时,TRPC6还可参与血管紧张素Ⅱ诱导足细胞损伤的病理生理过程[17]。本次研究从组织水平和细胞水平证实了TRPC6在DN小鼠肾组织和高糖环境处理后各细胞系中的表达均是增多的,这与既往研究的部分结果一致。
综上所述,高血糖能诱导TRPC6和TRPM3在糖尿病肾病小鼠肾组织、人肾脏肾小管上皮细胞及小鼠肾小球足细胞的高表达。据此,我们推测TRPM3可能如TRPC6一样也在DN发病进程中发挥着重要的作用,而其是否受氧化应激因子的调控及其能否通过调控钙离子的浓度进而影响DN的进展,这些具体的机制尚待进一步深入探究。
1 Mclennan SV,Fisher E,Martell SY,et al.Effects of glucose on matrix metalloproteinase and plasmin activities in mesangial cells:Possible role in diabetic nephropathy.Kidney Int Suppl,2000,77:S81-S87.
2 Nilius B,Owsianik G.The transient receptor potential family of ion channels.Genome Biol,2011,12(3):218.
3 Winn MP,Conlon PJ,Lynn KL,et al.A mutation in the TRPC6 cation channel causes familial focal segmental glomerulosclerosis.Science,2005,308(5729):1801-1804.
4 Moller CC,Wei C,Altintas MM,et al.Induction of TRPC6 channel in acquired forms of proteinuric kidney disease.J Am Soc Nephrol,2007,18(1):29-36.
5 Vriens J,Owsianik G,Hofmann T,et al.TRPM3 is a nociceptor channel involved in the detection of noxious heat.Neuron,2011,70(3):482-494.
6 Hoffmann A,Grimm C,Kraft R,et al.TRPM3 is expressed in sphingosine-responsive myelinating oligodendrocytes.J Neurochem,2010,114(3):654-665.
7 Mundel P,Reiser J,Zuniga MBA,et al.Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocyte cell lines.Exp Cell Res,1997,236(1):248-258.
8 Wang LH,Liu JS,Ning WB,et al.Fluorofenidone attenuates diabetic nephropathy and kidney fibrosis in db/db mice.Pharmacology,2011,88(1-2):88-99.
9 Wagner TF,Drews A,Loch S,et al.TRPM3 channels provide a regulated influx pathway for zinc in pancreatic beta cells.Pflugers Arch,2010,460(4):755-765.
10 Thiel G,Muller I,Rossler OG.Signal transduction via TRPM3 channels in pancreatic beta-cells.J Mol Endocrinol,2013,50(3):R75-R83.
11 Naylor J,Li J,Milligan CJ,et al.Pregnenolone sulphate- and cholesterol-regulated TRPM3 channels coupled to vascular smooth muscle secretion and contraction.Circ Res,2010,106(9):1507-1515.
12 Hall DP,Cost NG,Hegde S,et al.TRPM3 and miR-204 establish a regulatory circuit that controls oncogenic autophagy in clear cell renal cell carcinoma.Cancer Cell,2014,26(5):738-753.
13 杨贺,赵波,孟可欣,等.TRPC6在高糖所致足细胞骨架F-actin损伤中的作用.哈尔滨医科大学学报,2013,47(4):297-300.
14 Zhang X,Song Z,Guo Y,et al.The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats.Mol Cell Biochem,2015,399(1-2):155-165.
15 Sudhir VShah,Radhakrishna Baliga,Mohan Rajapurkar,et al.Oxidants in chronic kidney disease.J Am Soc Nephrol,2007,18(1):16-28.
16 Wang Z,Wei X,Zhang Y,et al.NADPH oxidase-derived ROS contributes to upregulation of TRPC6 expression in puromycin aminonucleoside-induced podocyte injury.Cell Physiol Biochem,2009,24(5-6):619-626.
17 蔡佳盈,沈世忠,万建新.瞬时受体电位通道蛋白6参与血管紧张素Ⅱ诱导足细胞损伤的信号传导机制.肾脏病与透析肾移植杂志,2014(5):458-461.
(本文编辑 青 松)
Expression of transient receptor potential melastatin 3 in diabetic nephropathy mice
YUHaixia1,2,3,GUOJia1,2,LIUDongwei1,2,QINLi1,2,3,YUQi1,2,3,LIUZhangsuo1,2
1DepartmentofNephrology,TheFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China2NephrologyResearchInstituteofZhengzhouUniversity,Zhengzhou450052,China3InstituteofClinicalMedicine,TheFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China
LIUZhangsuo(E-mail:zhangsuoliu@sina.com)
Objective:To study the expression of transient receptor potential melastatin 3 (TRPM3) in the internationally recognized db/db mouse model of type 2 diabetic nephropathy, in human tubular epithelial cells (HK2) and conditionally immortalized mouse podocytes (MPC) under high glucose. Methodology:Twenty male five-week db/db mice were randomly divided into two groups (eachn=10), and we used db/m mice of littermate as the normal control group (n=20). At the age of 10 weeks and 18 weeks, the samples of blood, urine and renal tissues were collected. The biochemical indexes were measured. The expression of TRPM3 in renal tissues was assessed by Western blot、qRT-PCR and immunohistochemistry respectively. HK2 and MPC were cultured in vitro and divided into the following groups: (1) Normal control group (D-glucose 5.6 mmol/L); (2) Mannitol group (D-glucose 5.6 mmol/L+D-mannitol 24.4 mmol/L); (3) High glucose group (D-glucose 30 mmol/L).The corresponding indexes were measured at 24th,48th and 72th hour. Western blot and qRT-PCR were used to examine the expression of TRPM3 in protein and mRNA. Results:Compared with the 10w db/m mice, the expression of TRPM3 in the 10w db/db and 18w db/db mice was increased significantly (P<0.05). In cultured HK2 and MPC, the protein and mRNA expression of TRPM3 was increased in High glucose group, compared with the normal control group (P<0.05). Conclusion:TRPM3 can be expressed in the renal tubules and glomerulus of mouse, and high glucose can induce the higher expression of TRPM3 in HK2 and MPC. TRPM3 may be involved in the development of diabetic nephropathy.
diabetic nephropathy transient receptor potential melastatin 3 human tubular epithelial cells (HK2) conditionally immortalized mouse podocytes (MPC)
10.3969/cndt.j.issn.1006-298X.2017.02.008
1郑州大学第一附属医院肾脏内科(郑州,450052);2郑州大学肾脏病研究所;3河南省高等学校临床医学重点学科开放实验室
刘章锁(E-mail:zhangsuoliu@sina.com)
2016-11-02
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有

