特发性膜性肾病凝血功能障碍与血小板功能亢进的关联
刘 蕾 乐伟波 徐孝东 刘正钊 秦华章 周敏林 施劲松 李丽娟 谌达程 任 强 刘志红
特发性膜性肾病凝血功能障碍与血小板功能亢进的关联
刘 蕾 乐伟波 徐孝东 刘正钊 秦华章 周敏林 施劲松 李丽娟 谌达程 任 强 刘志红
目的:探讨特发性膜性肾病患者凝血功能障碍的具体表现及影响因素。 方法:回顾性分析2012年1月至2016年9月在南京总医院国家肾脏病临床研究中心经肾活检确诊的242例肾病综合征状态的特发性膜性肾病患者血栓弹力图R时间、K时间、α 角、MA值和CI,并将81例蛋白尿定量≤1 g/24h的特发性膜性肾病患者作为对照组。 结果:组间比较提示肾病综合征状态的特发性膜性肾病患者MA值显著高于对照组(69.6 mmvs65.1 mm,P<0.01),而两组之间R时间无明显差异(6.0 minvs6.1 min,P=0.72)。单因素线性相关分析发现,肾病综合征状态的特发性膜性肾病患者血清白蛋白水平与血栓弹力图的MA值(r=-0.19,P<0.01)、α 角(r=-0.16,P=0.01)和CI(r=-0.13,P=0.05)呈负相关,与K时间(r=0.12,P=0.06)呈正相关,与R时间(r=0.01,P=0.87)无明显关联。多元线性回归分析提示血白蛋白是特发性膜性肾病患者MA值的独立相关因素。在肾病综合征状态的特发性膜性肾病患者中,抗磷脂酶A2受体(PLA2R)抗体阳性组和PLA2R抗体阴性组之间各项临床指标和血栓弹力图指标均无明显差异。 结论:特发性膜性肾病患者凝血功能障碍与血小板功能亢进关系密切,而血小板功能亢进与肾病综合征状态有关,与抗PLA2R抗体无明显关系。提示抗凝治疗联合抗血小板治疗可能会减少特发性膜性肾病患者血栓事件的发生率。
特发性膜性肾病 肾病综合征 血小板功能亢进 血栓弹力图
血栓栓塞是肾病综合征(NS)患者最常见且最严重的并发症之一[1-2]。高凝状态是血栓发生的基础,主流观点认为血浆抗凝与促凝因子失衡是NS患者血栓发生的重要病理生理基础[3-5]。在NS的各种病理类型中,膜性肾病(MN)的血栓发生率最高[1,3,6-7]。2012年KDIGO指南提出对MN患者进行预防性抗凝治疗,推荐口服华法林,但证据等级较低(2C),加上华法林治疗窗窄、个体剂量差异大、易与其他食物药物相互作用及需监测国际标准化比值(INR)等因素,使得MN患者血栓的预防和治疗成为困扰临床医生的一大难题。
血栓弹力图(TEG) 是一种能够动态监测整个凝血过程的分析仪,可以对凝血全过程及血小板聚集功能进行全面检测,近年来用于预测心脏手术术后血栓风险[8-9]。本文将通过TEG来评估不同疾病状态下的特发性膜性肾病(IMN)患者的凝血功能,进一步探索IMN患者高凝状态的特征和影响因素。
对象和方法
研究对象 回顾性纳入2012年1月至2016年9月在南京总医院国家肾脏病临床研究中心肾活检前行TEG检测的NS状态的IMN患者242例(NS-IMN组),此外,在此期间选择81例肾活检前行TEG检测时尿蛋白定量≤1 g/24h的IMN患者作为对照组。两组入选标准均满足:(1)根据光镜、免疫荧光和电镜结果确诊为MN,临床上排除了继发因素如狼疮、乙肝和肿瘤等;(2)TEG检测前48h内未使用过肝素、低分子肝素等抗凝药物,一周内未使用过抗血小板药物。
临床指标 年龄、性别、血红蛋白(Hb)、血细胞比容(Hct)、血小板计数(PLT)、总胆固醇、三酰甘油、尿酸、血清白蛋白(Alb)、尿蛋白定量、凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、凝血酶时间(TT)、纤维蛋白原(Fib)及血清抗磷脂酶A2受体(PLA2R)抗体等,并应用EPI公式计算估算的肾小球滤过率(eGFR)[10]。NS状态定义为蛋白尿定量>3.5 g/24h同时Alb<30 g/L。
TEG指标含义 (1)R时间(min):指血样放入分析仪开始到第一块纤维蛋白凝块形成的时间,反映参加凝血启动阶段的凝血因子的作用,正常值5~10 min;(2)K时间(min):指从R时间终点至描记幅度达20 mm所需的时间,反映血凝块形成速率,K时间受纤维蛋白和血小板的共同作用,其中以纤维蛋白功能为主,正常值1~3 min;(3)α 角:指从R时间终点至描记图最大曲线弧度做切线与水平线的夹角,与K时间意义相同,正常值53°~72°;(4)最大振幅(MA)值(mm):是描记图上的最大振幅,主要反映血小板的聚集功能,受Fib和血小板影响,血小板的作用要比Fib大,正常值50~70 mm;(5)凝血综合指数(CI):反应凝血综合状态,<-3为低凝,-3~3为正常,>3为高凝。
统计学方法 采用SPSS 20.0软件进行数据处理。正态分布数据以均数±标准差表示,组间比较应用t检验。非正态分布数据以中位数(四分位数)表示,组间比较应用Mann-Whitney检验。分类变量采用频数和频率表示,组间比较采用卡方检验。Pearson’s和Spearman’s相关分析研究TEG指标和临床其他指标的关系。多元逐步回归分析影响MA值的因素。所有统计学检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
两组基线资料和凝血参数 NS-IMN组患者242例,对照组81例,各项临床指标见表1。TEG指标中,NS-IMN组和对照组除了K时间(1.4 minvs1.4 min,P=0.03)、α 角(70.4°vs69.0°,P<0.01)和CI值(1.7vs0.8,P<0.01)有差异显著之外, MA值(69.6 mmvs65.1 mm,P<0.01)的差异也有统计学意义,而两组之间R时间(6.0 minvs6.1 min,P=0.72)无明显差异(图1)。

表1 NS-IMN组和对照组患者的基本临床指标
NS:肾病综合征;IMN:特发性膜性肾病;eGFR :肾小球滤过率估算值;PLA2R抗体:磷脂酶A2受体抗体;PT:凝血酶原时 间;APTT:活化部分凝血酶原时间;TT:凝血酶时间;Fib:纤维蛋白原;*:306例患者拥有完整的常规凝血指标数据(NS组229例,对照组77例)

图1 两组患者TEG指标的比较NS:肾病综合征;IMN:特发性膜性肾病;TEG:血栓弹力图

图2 NS-IMN患者的Alb与TEG指标的相关性NS-IMN:肾病综合征状态的特发性膜性肾病患者;Alb:血清白蛋白;TEG:血栓弹力图
凝血与临床指标相关性分析 对242例NS-IMN患者的TEG指标与临床指标进行了单因素线性相关分析,发现Alb与MA值、α 角和CI呈负相关,与K时间呈正相关,而与R时间无明显相关性(图2)。在229例有普通凝血检测结果的NS-IMN患者中,单因素线性相关分析提示Alb与APTT(r=-0.05,P=0.50)无明显相关性,与PT(r=-0.13,P=0.05)、TT(r=-0.16,P=0.02)、Fib(r=-0.24,P<0.01)呈负相关。Hct与R时间无明显相关关系,与MA值、α 角及CI呈负相关,与K时间呈正相关。PLT与R时间无明显相关关系,与K时间呈负相关,与MA值、α 角及CI呈正相关。
NS-IMN患者的MA值与各临床指标的多元线性回归分析 为探索NS-IMN患者MA值的影响因素,多元线性回归分析提示校正性别、eGFR、抗PLA2R后,Alb与MA值(β=-0.25,P=0.03)独立相关,但其与R时间、K时间、α 角和CI值无明显相关(表2),提示Alb是NS-IMN患者血小板功能亢进的独立相关因素。
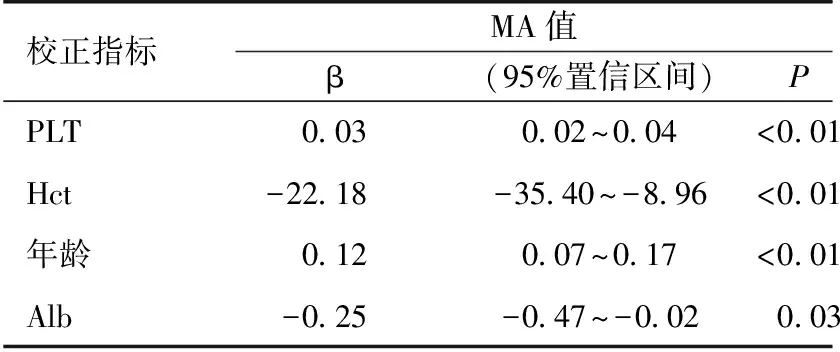
表2 NS-IMN患者MA值与临床指标的多元线性回归分析
NS-IMN:肾病综合征状态的特发性膜性肾病患者;PLT:血小板计数;Hct:红细胞比容;Alb:血清白蛋白;β:多元回归分析的非标准化系数
PLA2R抗体阳性组和阴性组的NS-IMN患者临床指标和TEG指标之间的比较 将242例NS-IMN患者根据PLA2R抗体分为抗PLA2R阳性组(170例)与抗PLA2R阴性组(70例),发现两组之间临床指标和TEG指标均无明显差异,提示PLA2R抗体对NS-IMN患者血小板功能亢进明显无影响,进一步提示MA值差异可能与NS状态有关。
MA≤70 mm组和MA>70 mm组的NS-IMN患者临床指标和TEG指标的比较 将242例NS-IMN患者根据MA值分为MA≤70 mm组(129例)和 MA>70 mm组(113例)。和MA≤70 mm组相比较,MA>70 mm组患者的肾功能更差,Hb和Hct更低,而PLT和三酰甘油更高,两组之间Alb和尿蛋白水平差异无统计学意义(表3)。
讨 论
IMN患者血栓的预防和治疗是困扰临床医生的一大难题。Loscalzo[11]认为NS患者血栓形成机制主要是大量蛋白尿导致抑制血栓形成的蛋白从尿中丢失,如抗凝血酶Ⅲ[12]、蛋白C和蛋白S[13];以及低蛋白血症导致促血栓因子代偿性增加如V因子和vWF等[6]。此外,血小板功能亢进也涉及其中,表现为血小板聚集性增高,活性物质释放增多,血小板表面激活相关标志物表达增加[5,14]。

表3 MA≤70 mm组和MA>70 mm组NS-IMN患者临床指标的比较
NS-IMN:肾病综合征状态的特发性膜性肾病患者; eGFR :估算的肾小球滤过率
在MN患者的血栓机制研究中,Huang等[15-16]发现相对于微小病变肾病患者和正常人,MN患者的高凝状态更为明显,低白蛋白血症是MN患者高凝状态的主要原因。Li等[17]的研究提示对于NS状态的MN患者,D-二聚体、蛋白尿及蛋白尿/血白蛋白比值是其静脉血栓发展的危险因素。然而Mahmoodi等[7]发现对于NS状态的MN患者而言,Alb和尿蛋白与MN患者静脉血栓的发生有一定相关性,但并未达到统计学意义。由此可见,关于MN患者静脉血栓机制的研究还存在诸多争议。
本研究结果表明,Alb是NS-IMN患者血小板功能亢进的独立相关因素。IMN患者凝血功能障碍与血小板功能亢进的关系密切,而其血小板功能亢进与其当时是否处于NS状态有关,与PLA2R抗体无关,其机制可能是低白蛋白血症增加花生四烯酸(arachidonic acid,AA)的生物利用度。AA来源于膜磷脂,在血小板激活剂的作用下生成血栓烷A2(TXA2),TXA2进一步促进血小板的激活和聚集,当Alb水平降低时,游离AA增加,AA的生物利用度增加,因此血小板的聚集性增高[18-19]。在凝血指标方面,APTT是内源性凝血系统的筛查试验,TEG检测是通过加入高岭土来激活凝血途经,理论上只激活内源性凝血途经。本研究中NS-IMN组患者和对照组之间APTT无明显差异,与两组之间R时间也无明显差异相符。NS-IMN和对照组之间PLA2R抗体阳性率差异较大,考虑与特发性膜性肾病的病程有关。Qin等[20]的研究提示PLA2R抗体水平和IMN病程有关,对照组患者尿蛋白≤1 g/24h,在整个IMN病程中处于缓解状态,整体PLA2R抗体水平较NS-IMN患者低,对照组中部分患者出现抗体转阴,因此两组PLA2R抗体阳性率差异较大。
对于静脉血栓的治疗,INSPIRE研究表明校正治疗依从性后,抗血小板药物阿司匹林可减少42%的原发性静脉血栓的复发率[21]。因此有研究者建议对于Alb<25 g/L的NS-IMN患者,若出血风险低则使用华法林抗凝,风险高则使用阿司匹林治疗。而对于Alb 25~32 g/L的IMN患者,若动脉血栓风险较高,也可使用阿司匹林[22]。目前IMN患者预防性抗凝药物是低分子肝素、华法林及利伐沙班,三种均针对凝血因子。低分子肝素需皮下注射,患者依从性偏低,华法林出血风险较大,而利伐沙班性价略低。抗血小板药物为口服制剂,性价比高,出血风险较华法林低,因此对于需要长期院外抗凝的患者,抗血小板药物可作为选择之一。
对于常规抗凝联合抗血小板治疗的出血风险,Mega等[23]的临床试验提示在急性冠脉综合征患者病情稳定后的长期抗凝治疗中,接受利伐沙班+抗血小板药治疗的患者,出血风险相对于利伐沙班+安慰剂的患者较高,风险呈剂量依赖性增大。但通过对利伐沙班进行剂量调整,可在保证抗凝效果的基础上降低出血风险,同时也降低治疗成本。
本研究的局限性在于其回顾性分析的属性,部分研究对象时间较久远,未行肾组织PLA2R抗原检测。此外,部分患者没有规律随访其血栓事件的发生,这也是本研究最大的缺陷。本研究入组时剔除了TEG检测前48h内使用过抗凝药物,一周内使用过抗血小板药物的患者,虽然避免药物对TEG结果的影响,但也意味着可能排除了部分已发生静脉血栓或者明显高凝状态的患者,低估了IMN患者高凝状态的程度和血栓发生率。
小结:血小板功能亢进在NS-IMN患者凝血功能障碍中起重要作用,尤其是高MA值患者,抗凝联合抗血小板治疗可能会为其带来临床获益,但仍需进一步临床试验证实。
1 Kerlin BA,Ayoob R,Smoyer WE.Epidemiology and pathophysiology of nephrotic syndrome-associated thromboembolic disease.Clin J Am Soc Nephrol,2012,7(3):513-520.
2 Llach F.Hypercoagulability,renal vein thrombosis,and other thrombotic complications of nephrotic syndrome.Kidney Int,1985,28(3):429-439.
3 Orth SR,Ritz E.The nephrotic syndrome.N Engl J Med,1998,338(17):1202-1211.
4 Schafer AI.The hypercoagulable states.Ann Intern Med,1985,102(6):814-828.
5 Robert A,Olmer M,Sampol J,et al.Clinical correlation between hypercoagulability and thrombo-embolic phenomena.Kidney Int,1987,31(3):830-835.
6 Singhal R,Brimble KS.Thromboembolic complications in the nephrotic syndrome: pathophysiology and clinical management.Thromb Res,2006,118(3):397-407.
7 Mahmoodi BK,ten Kate MK,Waanders F,et al.High absolute risks and predictors of venous and arterial thromboembolic events in patients with nephrotic syndrome: results from a large retrospective cohort study.Circulation,2008,117(2):224-230.
8 Hobson AR,Agarwala RA,Swallow RA,et al.Thrombelastography: current clinical applications and its potential role in interventional cardiology.Platelets,2006,17(8):509-518.
9 Gurbel PA,Bliden KP,Guyer K,et al.Platelet reactivity in patients and recurrent events post-stenting: results of the PREPARE POST-STENTING Study.J Am Coll Cardiol,2005,46(10):1820-1826.
10 Levey AS,Stevens LA,Schmid CH,et al.A new equation to estimate glomerular filtration rate.Ann Intern Med,2009,150(9):604-612.
11 Loscalzo J.Venous thrombosis in the nephrotic syndrome.N Engl J Med,2013,368(10):956-958.
12 Vaziri ND,Paule P,Toohey J,et al.Acquired deficiency and urinary excretion of antithrombin III in nephrotic syndrome.Arch Intern Med,1984,144(9):1802-1803.
13 Cosio FG,Harker C,Batard MA,et al.Plasma concentrations of the natural anticoagulants protein C and protein S in patients with proteinuria.J Lab Clin Med,1985,106(2):218-222.
14 Sirolli V,Ballone E,Garofalo D,et al.Platelet activation markers in patients with nephrotic syndrome.A comparative study of different platelet function tests.Nephron,2002,91(3):424-430.
15 Huang MJ,Wei RB,Wang ZC,et al.Mechanisms of hypercoagulability in nephrotic syndrome associated with membranous nephropathy as assessed by thromboelastography.Thromb Res,2015,136(3):663-668.
16 Huang MJ,Wei RB,Li QP,et al.Hypercoagulable state evaluated by thromboelastography in patients with idiopathic membranous nephropathy.J Thromb Thrombolys,2016,41(2):321-327.
17 Li SJ,Guo JZ,Zuo K,et al.Thromboembolic complications in membranous nephropathy patients with nephrotic syndrome-a prospective study.Thromb Res,2012,130(3):501-505.
18 Undas A,Brummel-Ziedins K,Mann KG.Why does aspirin decrease the risk of venous thromboembolism? On old and novel antithrombotic effects of acetyl salicylic acid.J Thromb Haemost,2014,12(11):1776-1787.
19 Schieppati A,Dodesini P,Benigni A,et al.The metabolism of arachidonic acid by platelets in nephrotic syndrome.Kidney Int,1984,25(4):671-676.
20 Qin HZ,Zhang MC,Le WB,et al.Combined Assessment of Phospholipase A2 Receptor Autoantibodies and Glomerular Deposits in Membranous Nephropathy.J Am Soc Nephrol,2016,27(10):3195-3203.
21 Simes J,Becattini C,Agnelli G,et al.Aspirin for the prevention of recurrent venous thromboembolism: the INSPIRE collaboration.Circulation,2014,130(13):1062-1071.
22 Hofstra JM,Wetzels JF.Should aspirin be used for primary prevention of thrombotic events in patients with membranous nephropathy? Kidney Int,2016,89(5):981-983.
23 Mega JL,Braunwald E,Mohanavelu S,et al.Rivaroxaban versus placebo in patients with acute coronary syndromes (ATLAS ACS-TIMI 46): a randomised,double-blind,phase II trial.Lancet,2009,374(9683):29-38.
(本文编辑 凡 心)
Coagulation disorders and platelet hyperactivity in idiopathic membranous nephropathy
LIULei,LEWeibo,XUXiaodong,LIUZhengzhao,QINHuazhang,ZHOUMinlin,SHIJinsong,LILijuan,CHENDacheng,RENQiang,LIUZhihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
LIUZhihong(E-mail:liuzhihong@nju.edu.cn)
Objective:To investigate the specific manifestation and influencing factors of the coagulation disorders in patients with idiopathic membranous nephropathy (IMN). Methodology:Two hundred forty two patients with nephrotic syndrome, who were diagnosed as IMN by renal biopsy from January 2012 to September 2016 in our clinical research center, were enrolled into this respective study. Their R time, K time, α angle, MA value, and coagulation index (CI) in thrombrone-lastogram (TEG) were analyzed. Besides, 81 IMN patients with 24h urinary protein less than 1g were regarded as control group. Results:Significant difference was noticed in MA value between IMN with nephrotic syndrome group and control group (69.6vs65.1 mm,P<0.01), but not in R time(6.0vs6.1 min,P=0.72). With regard to IMN patients with nephrotic syndrome, correlation analysis showed that serum albumin was negatively related to MA value(r=-0.19,P<0.01), α angle(r=-0.16,P=0.01)and CI(r=-0.13,P=0.05), positively related to K time(r=0.12,P=0.06), but not related to R time(r=0.01,P=0.87). Multiple linear regression analysis indicated that serum albumin was an independent relevant factor of platelet hyperactivity in IMN. And there were no differences in all the clinical characteristics and TEG parameters between anti-PLA2R(+)and anti-PLA2R(-) IMN patients with nephrotic syndrome. Conclusion:Platelet hyperactivity is correlated closely to the coagulation disorders of IMN. Platelet hyperactivity is related to nephrotic syndrome state, but not PLA2R antibody. These results indicate that combination of anticoagulant and anti-platelet therapy may decrease the incidence of thromboembolic events in IMN.
idiopathic membranous nephropathy nephrotic syndrome platelet hyperactivity thromboelastogram
10.3969/cndt.j.issn.1006-298X.2017.02.002
国家自然科学基金(81500547);国家科技支撑计划课题(2015BAI12B02,2015BAI12B05);江苏省科技计划项目(BE2016747)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 硕士研究生(刘 蕾),国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
刘志红(E-mail:liuzhihong@nju.edu.cn)
2017-01-23
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有

