微型多血管炎伴肺部损害患者的疗效反应及远期预后
邵 芳 陈樱花 张丽华 涂远茂 胡伟新 刘志红 谢红浪
微型多血管炎伴肺部损害患者的疗效反应及远期预后
邵 芳 陈樱花 张丽华 涂远茂 胡伟新 刘志红 谢红浪
目的:分析伴或不伴肺损害的微型多血管炎(MPA)患者的临床特征及远期预后差异。 方法:1995年12月至2014年12月间南京军区南京总医院确诊为MPA的患者196例(男80例,女116例,平均年龄52岁),中位病程2.0个月(1.0~6.0个月),基线中位血清肌酐344.8 μmol/L(176.8~556.9 μmol/L),其中70例(35.7%)起病需肾脏替代治疗。回顾性分析肺损害对MPA疗效、人肾存活率及远期预后的影响。利用Kaplan-Meier法计算患者的人肾存活率,并利用COX回归模型分析临床及病理指标与远期人存活相关性。 结果:196例患者平均随访38.9±42.0个月,期间20例(10.2%)死亡,81例(41.3%)进入终末期肾病(ESRD)。111例(56.6%)患者伴有肺损害,最常见临床症状为咯血、咳嗽咳痰,胸部CT或X线检查以斑片影、条索影及胸膜增厚多见。肺损害组年龄、男性和吸烟比例、伯明翰血管炎活动性评分、血清肌酐及MPO-ANCA滴度均显著高于无肺损害组(P<0.05)。1年内肺损害组和无肺损害组完全缓解率分别为13.5%、21.2%(P=0.155);治疗无效比例分别为42.3%、35.3%(P=0.317)。肺损害组的人存活率更低(P=0.013);两组肾存活率无统计学差异。多因素COX回归分析显示肺损害及起病时肾脏替代治疗为影响患者存活的独立危险因素。 结论:伴有肺损害的MPA患者年龄更大、血管炎更活动,肺损害是影响MPA患者存活的独立危险因素。
肺损害 微型多血管炎 人存活率 危险因素
微型多血管炎(MPA)是我国临床最常见的一种坏死性小血管炎[1]。肺脏毛细血管丰富,是最易累及的器官之一。肺部受累可表现为咳嗽、痰中带血、胸痛、呼吸困难等,X线或CT检查可发现肺部多种影像学改变。目前尚不明确肺部受累与肾脏病变之间有无关联,以及肺损害对患者的远期预后的影响。本文回顾性分析肺损害对MPA患者近期疗效及远期人、肾存活率的影响。
对象和方法
病例资料 1995年12月~2014年12月南京军区南京总医院肾脏科住院患者,均符合以下条件:(1)符合Chapel Hill的MPA诊断标准[2],血清抗中性粒细胞胞质抗体阳性;(2)有肾脏受累;(3)随访时间≥6个月,或达到随访终点;(4)肾活检组织标本光镜下肾小球数≥10个/片;(5)排除局限于肾脏的血管炎、肉芽肿性血管炎、变态反应性肉芽肿性血管炎、过敏性紫癜、药物过敏、狼疮性血管炎、类风湿性血管炎、肿瘤、冷球蛋白血症和感染等继发性血管炎,以及合并其他肾脏疾病如IgA肾病、糖尿病肾病、膜性肾病和抗肾小球基膜肾炎等。
按起病时是否伴有肺损害将患者分为肺损害组和无肺损害组。肺损害组患者伴有咳嗽、痰中带血、胸痛、呼吸困难等肺部受累的临床表现,影像学检查肺部病变为弥漫浸润或间质性改变,伴或不伴空洞形成,并排除单纯性肺部感染、尿毒症性肺炎、ARDS、急性肺水肿、霉菌性肺炎、肺结核、结节病等病变;非肺损害组无上述改变。观察两组患者的临床特征,疗效和远期预后。
临床及实验室指标 患者一般情况,血管炎病程,全身脏器受累情况;肺部受累指标包括临床表现、呼吸功能及影像学改变;肾损害指标包括尿沉渣红细胞计数、24h尿蛋白定量、血清肌酐(SCr)、估算的肾小球滤过率(CKD-EPI公式)和血清白蛋白。MPA活动性采用伯明翰血管炎活动性评分(BVAS)评估[3]。采用间接免疫荧光(IF)和ELISA法(Euroimmune 试剂盒)检测ANCA。IF法测定ANCA分为核周型(P-ANCA)和胞浆型(C-ANCA)。ELISA法测定针对髓过氧化物酶(MPO)和蛋白酶3的ANCA分别称为MPO-ANCA和PR3-ANCA[4]。
肾组织病理 所有患者均行肾活检,肾组织按照标准流程进行常规光镜、免疫荧光和电镜检查。正常肾小球定义为无血管炎病变或球性硬化,可伴缺血导致的轻微病变或少量炎症细胞浸润,不伴广泛的缺血病变[5](包囊壁皱缩或断裂);细胞性新月体定义为节段或环状新月体的细胞成分>10%,可伴纤维性素性坏死或包囊壁断裂;球性硬化定义为单个肾小球面积>80%为硬化性病变。肾小管间质急性病变(ATI)和慢性病变(CTI)采用半定量评分,根据肾小管间质累及范围分为轻度(<25%,记1分)、中度(25%~50%,记2分)、重度(>50%,记3分)。
治疗方案 活动期MPA均先接受强化免疫抑制治疗,即甲泼尼松龙0.5g×3d静脉注射,后续口服泼尼松(起始剂量为0.6 mg/kg.d),4周后逐渐减量至10 mg/d维持。诱导期联合吗替麦考酚酯(MMF)1~1.5 g/d或间断环磷酰胺(CTX)静脉冲击(NIH方案)诱导治疗。缓解期采用小剂量激素联合MMF(0.5~0.75 g/d)、硫唑嘌呤[1~2 mg/(kg·d)]或雷公藤多苷片(60 mg/d)治疗。ANCA滴度高或伴有肺出血者进行体外循环抗体清除治疗(包括免疫吸附[6]、血浆置换或双重滤过血浆置换等[7]),严重肾功能受损者予连续性肾脏替代治疗。
疗效评价 治疗1年时进行疗效评价,完全缓解(CR)定义为无肾脏及肾外血管炎活动,无咳嗽咳痰、咳血、呼吸困难等肺血管炎活动表现;胸部影像学提示肺部病变缩小或吸收。BVAS=0,SCr正常,尿蛋白定量<1.0 g/24h,尿沉渣红细胞计数≤10万/ml。部分缓解(PR)定义为尿蛋白及尿沉渣红细胞计数较基础值减少>50%,SCr稳定或下降,无肺血管炎活动。无效(NR)定义为SCr无下降或伴活动性尿沉渣,或需维持肾脏持续替代治疗,或持续存在或新出现肾外血管炎活动。
随访终点 截止2015-11-28或患者死亡或ESRD。ESRD是指eGFR<15 ml/(min·1.73m2)或需要维持性肾脏替代治疗持续>3个月[8]。
统计学方法 采用SPSS 21.0软件进行统计分析。以单样本Kolmogorov-Smirnov Z检验对数据进行正态检验。正态分布计量资料以均数±标准差表示,组间比较采用方差分析;非正态分布计量资料均以中位数(四分位间距)表示,组间比较采用Mann-Whitney非参数检验;计数资料以百分比表示,组间比较采用卡方检验。人肾存活率采用Kaplan-Meier法估算,Log-rank 检验比较组间生存曲线差异,并利用COX回归模型分析治疗反应和远期预后的影响因素。以P<0.05为差异具有统计学意义。
结 果
一般情况 196例MPA患者入选,男80例,平均年龄52岁,血管炎中位病程为2个月。195(99.5%)例MPO-ANCA阳性,182(92.9%)例P-ANCA阳性,182(92.9%)例P/MPO-ANCA双阳性。基线中位SCr 344.8 μmol/L(176.8~556.9 μmol/L),其中70例(35.7%)起病需肾脏替代治疗。BVAS评分14(12~16)分。111(56.6%)例伴有肺损害,肺损害组年龄、男性和吸烟比例、BVAS评分、血清肌酐和血清MPO-ANCA滴度均明显高于无肺损害组;其余基线指标两组无明显差异(表1)。
肺部受累的临床症状为咯血(45.9%)、咳嗽咳痰(45.0%)、发热(19.8%)、低氧血症(2.7%)[不吸氧时PaO2<60 mmHg(1 mmHg=0.133 kPa)]、呼吸困难(1.8%)及鼻塞(1.8%)等。胸部CT或X线检查主要以斑片影(30.6%)、条索影(27.9%)、胸膜增厚(25.2%)、肺部结节(13.5%)及网格影(9.0%)等(表2)。
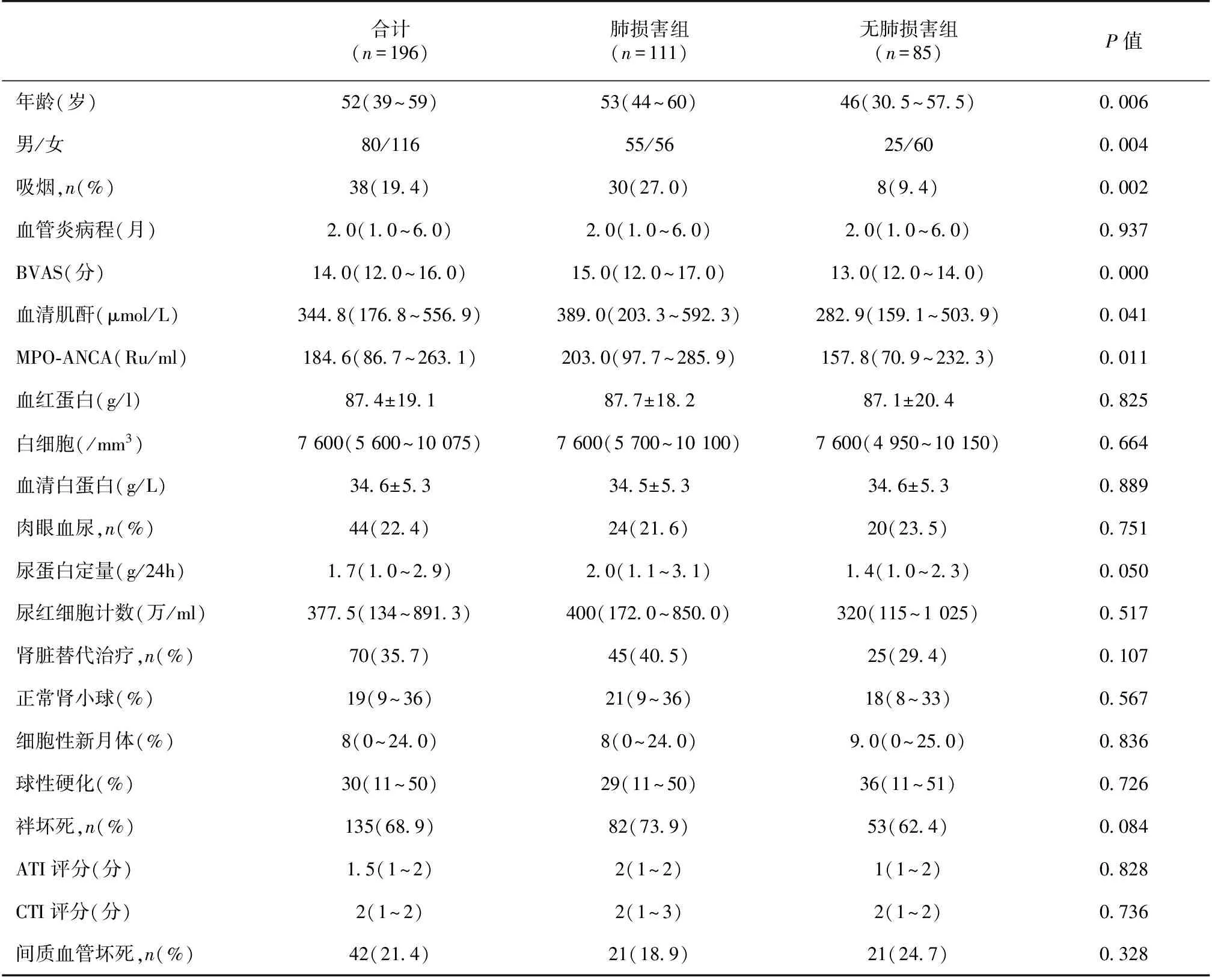
表1 196例微型多血管炎患者基线临床病理资料
BVAS:伯明翰血管炎活动性评分;MPO-ANCA:髓过氧化物酶型抗中性粒细胞胞质抗体;ATI:急性肾小管间质病变;CTI:慢性肾小管间质病变
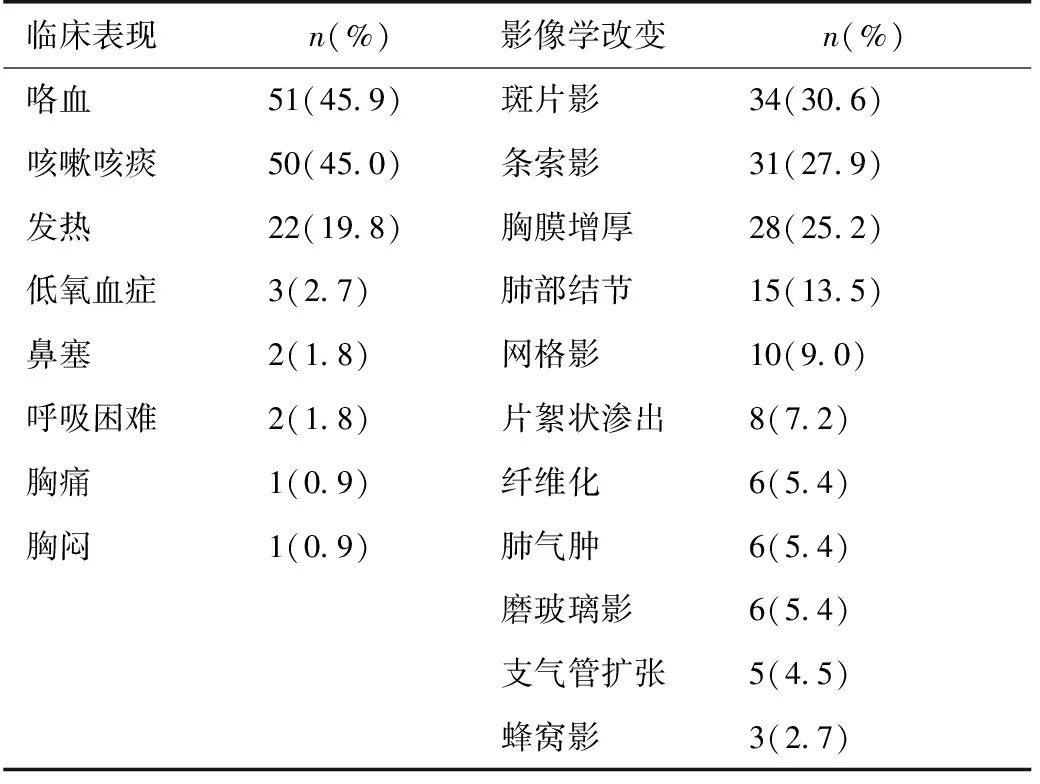
表2 肺损害的临床及影像学改变
治疗反应和疗效评估 144例(73.5%)接受强化免疫抑制剂治疗,48(24.5%)例接受体外循环抗体清除治疗,其中双重血浆置换(DFPP)26例(13.3%)、免疫吸附(IA)20例(10.2%)、血浆置换(PE)2例(1.0%)。入院时需即时透析的70例中43例(61.4%)接受强化免疫抑制治疗,24例(34.3%)摆脱透析治疗,35例(50%)需维持性透析治疗,11例(15.7%)死亡。入院时无需透析的126例中101例(80.2%)接受强化免疫抑制治疗,92例(73.0%)肾功能恢复正常,25例(19.8%)进入ESRD,9例(7.1%)死亡。1年内肺损害组和无肺损害组完全缓解率分别为13.5%、21.2%(P=0.155);治疗无效比例分别为42.3%、35.3%(P=0.317)(表3)。
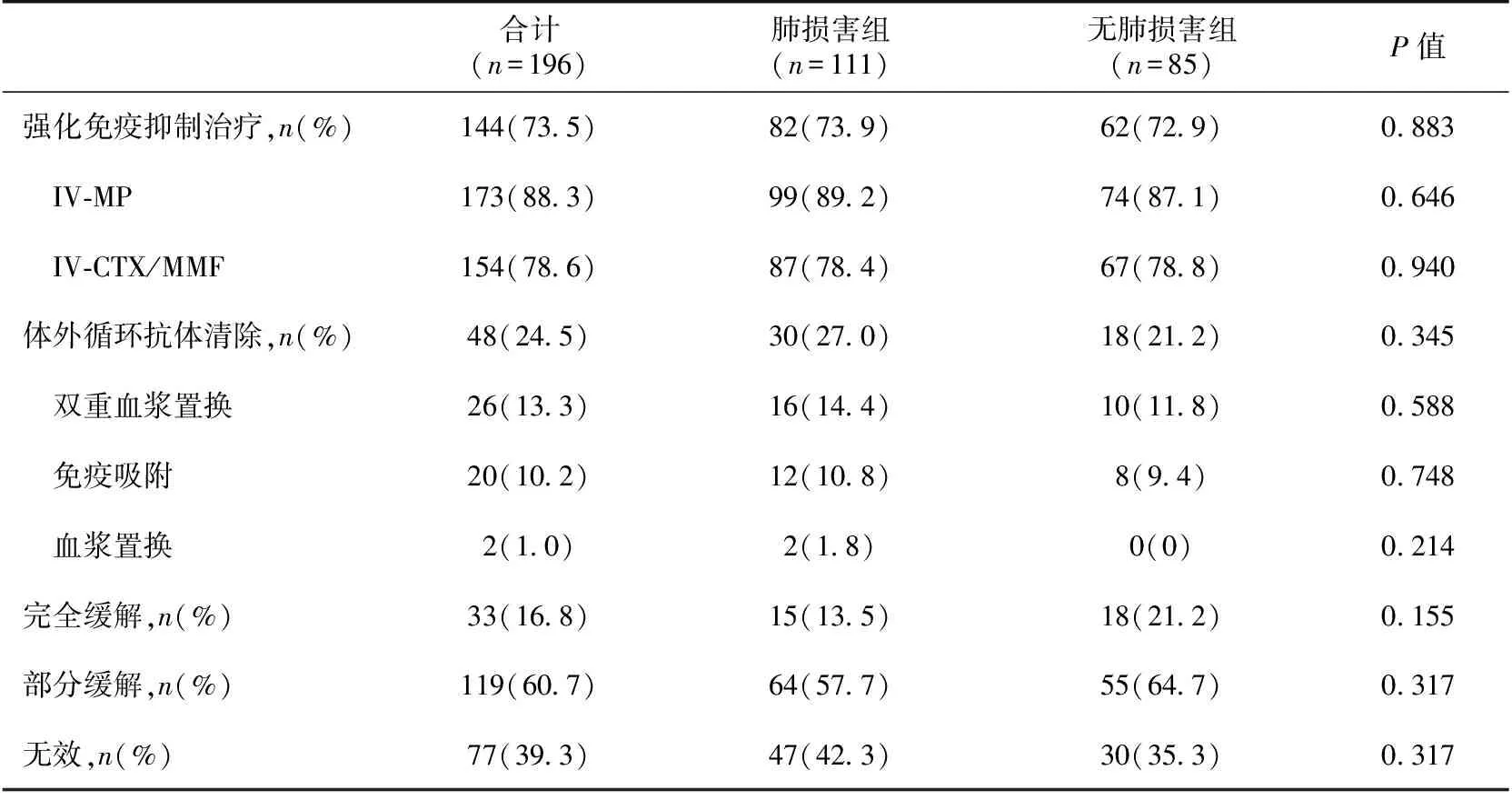
表3 肺损害对微型多血管炎患者近期疗效的影响
IV-MP:甲泼尼龙静脉冲击;IV-CTX/MMF:静脉环磷酰胺/吗替麦考酚酯
远期预后及影响因素
肾存活率 196例患者平均随访38.9±42.0个月,随访≥5年41例(20.9%)。随访期间共81例(41.3%)进入ESRD,肺损害组和无肺损害组分别为45例(40.5%)和36例(42.4%)。肾存活率无显著差异(P=0.518)(1年:69.9%vs72.9%;3年:54.7%vs63.7%;5年:51.4%vs56.5%)(图1)。
人存活率 随访期间共20例(10.2%)死亡,肺损害组和无肺损害组分别有16例(14.4%)、4例(4.7%);其中死于肺部感染分别为8例、1例;肺出血4例、0例;尿毒症合并症4例、2例;中耳炎术后感染0例、1例。肺损害组中11例在确诊后1年内(平均4.8±3.3个月)死亡;无肺损害组中4例在确诊后1年内(平均5.5±4.4个月)死亡。随访末肺损害组人存活率低于无肺损害组,两组间人存活率有显著差异(P=0.013)(1年:88.7%vs94.9%;3年:78.6%vs94.9%;5年:78.6%vs94.9%)(图2)。
对基线资料进行单因素COX回归分析显示,肺损害、起病需RRT及血肌酐与人存活相关。将上述单因素COX回归分析具有统计意义的参数纳入多因素COX回归分析显示肺损害(HR 1.9,P<0.01)、起病时肾脏替代治疗(HR 2.2,P<0.01)为影响人存活的独立危险因素(表4)。
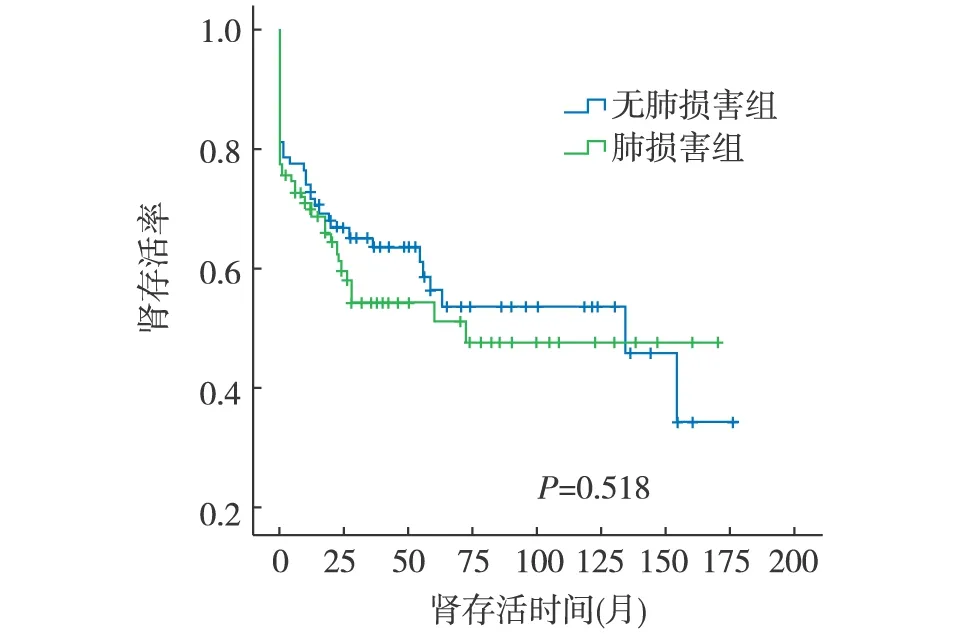
图1 肺损害对微型多血管炎患者肾存活的影响
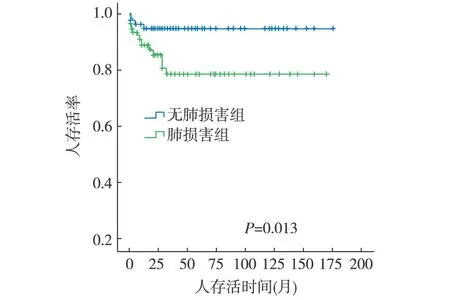
图2 肺损害对微型多血管炎患者人存活的影响
讨 论
MPA为非肉芽肿性坏死性小血管炎,伴寡或无免疫复合物沉积[9],可侵犯全身多个系统器官,肺和肾脏是最易受累的器官。国外文献报道,25%~55%的MPA患者存在肺部受累,可表现为肺泡出血、胸腔积液、肺水肿、肺间质病变等[10]。Jenette 等[11]报道ANCA相关性血管炎中50%MPA患者伴肺部受累。
与其他疾病相比,系统性小血管炎的肾存活率较低,胡伟新等[14]2004年曾报道了60例MPA肾损害的预后,1年和3年肾存活率分别为66.8%、58.5%;本研究196例MPA患者1年和3年肾生存率分别为71.2%和59.3%。略高于上述研究,可能的原因为与本组患者就诊较早、血管炎病程较短有关:2004年研究中患者就诊时肾功能损害重(SCr477.4 μmol/Lvs344.8 μmol/L)、肾小管间质急性病变和慢性病变均重于本研究,起始需透析患者中摆脱透析的比例低于本组(25.9%vs34.3%)。
本研究发现发现肺损害不影响MPA的肾存活率,但显著降低患者的长期生存率,可能原因如下:(1)肺损害患者年龄大、起病肾功能损害严重、ANCA滴度及BVAS评分高,远期预后差;(2)肺部疾病本身或治疗带来的感染并发症发生率高,死亡风险大;(3)该型病变活动,需要强化免疫抑制治疗,易继发肺部感染,与MPA肺部受累叠加协同损害呼吸功能。本组研究中肺损害组接受强化免疫抑制及体外循环抗体清除治疗的病例明显多于无肺损害组;与无肺损害组相比,肺损害组完全缓解率较低,而治疗无效比例更高;表明肺损害组诱导强化治疗反应差,必须寻找其接受强化免疫治疗的指标,避免不必要的感染,提高患者远期生存率。
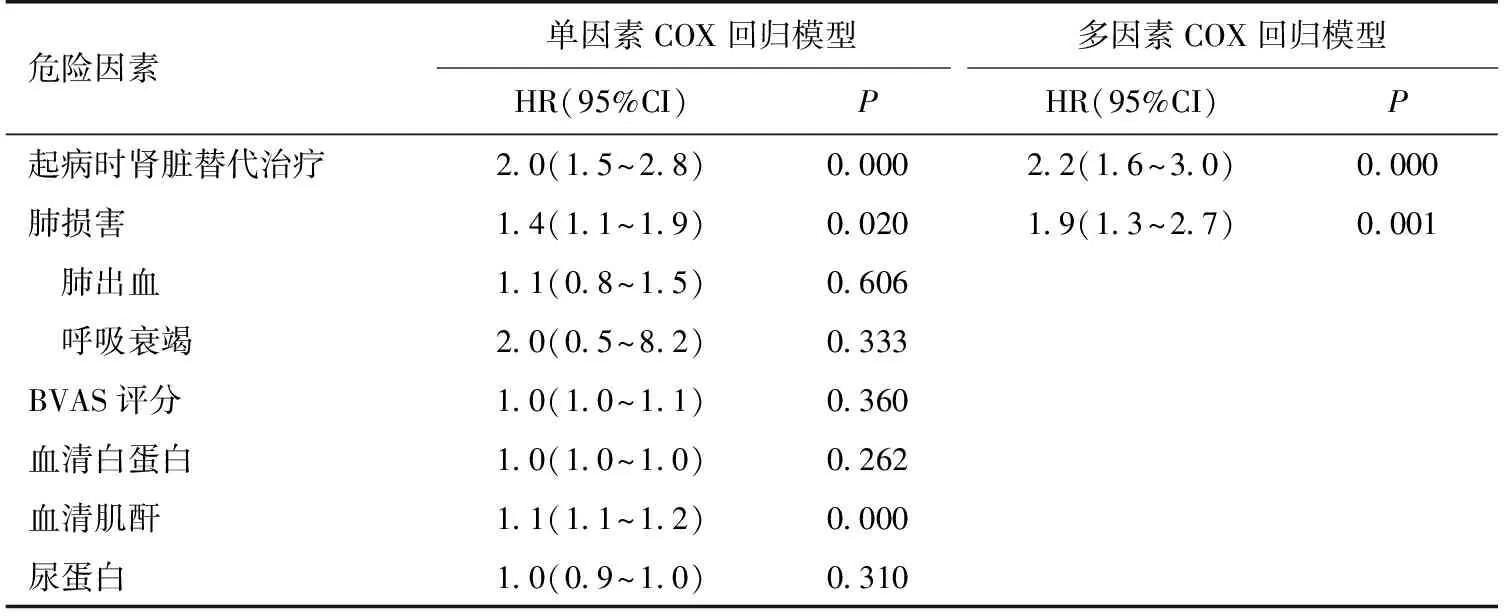
表4 影响微型多血管炎患者人存活率的因素
BVAS:伯明翰血管炎活动性评分
本研究为单中心回顾性研究,患者均来自肾脏科,未包括无肾脏受累就诊于呼吸科的肺部损害患者;临床类型以MPO-ANCA为主,对抗体阴性者未行进一步分析;因此还需要更大样本多中心、多科室的临床对照实验进一步验证本研究结果。
小结:本研究是目前国内样本量最大的关于肺损害对MPA患者疗效及远期预后的影响。与既往研究类似,肺损害是影响MPA生存率的主要因素。本研究中MPA肺损害的患者年龄更大,血管炎更活动,但临床和影像学改变无特异性,需要强化免疫抑制治疗的比例更高,治疗的缓解率较低。肺部损害不影响MPA患者的远期肾脏预后,但显著影响患者的长期生存率,肺部感染是MPA肺损害的主要死亡原因。
1 Charles Jennette J,Xiao H,Hu P.Complement in ANCA-associated vasculitis.Semin Nephrol,2013,33(6):557-564.
2 Jennette JC,Falk FC.Andrassy Ket al.Nomenclature of systemic vasculitides.Proposal of an international consensus conference.Arthritis Rheum,1994,37(2):187-192.
3 Luqmani RA,Bacon PA,Moots RJ,et al.Birmingham Vasculitis Activity Score (BVAS) in systemic necrotizing vasculitis.QJM,1994,87(11):671-678.
4 Hu W,Liu C,Xie H,et al.Mycophenolate mofetil versus cyclophosphamide for inducing remission of ANCA vasculitis with moderate renal involvement.Nephrol Dial Transplant,2008,23(4):1307-1312.
5 Berden AE,Ferrario F,Hagen EC,et al.Histopathologic classification of ANCA-associated glomerulonephritis.J Am Soc Nephrol,2010,21(10):1628-1636.
6 梅洁卉.胡伟新.季大玺.等.免疫吸附治疗ANCA相关血管炎的初步观察.肾脏病与透析肾移植杂志,2007,16(4):316-321.
7 Gong D,Ji D,Xu B,et al.More selective removal of myeloperoxidase-anti-neutrophil cytoplasmic antibody from the circulation of patients with vasculitides using a novel double-filtration plasmapheresis therapy.Ther Apher Dial,2013,17(1):93-98.
8 Hu WX,Liu ZH,Liu CB,et al.Prognosis of microscopic polyangiitis with renal involvement:report of 60 Chinese patients.Chin Med J (Engl),2005,118(24):2089-2092.
9 Hauer HA,Bajema IM,Van Houwelingen HC,et al.Determinants of outcome in ANCA-associated glomerulonephritis:a prospective clinico-histopathological analysis of 96 patients.Kidney Int,2002,62(5):1732-1742.
10 Chung SA,Seo P.Microscopic polyangiitis.Rheum Dis Clin North Am,2010,36(3):545-558.
11 Jennette JC,Falk RJ.Small-vessel vasculitis.N Engl J Med,1997,337(21):1512-1523.
12 Savage CO,Haper L,Adu D,et al.Primary systemic vasculitis.Lancet,1997,349(9051):553-558.
13 Bakoush O,Segelmark M,Torffvit O,et al.Urine IgM excretion predicts outcome in ANCA-associated renal vasculitis.Nephrol Dial Transplant,2006,21(5):1263-1269.
14 胡伟新.刘春蓓.唐 政.等.微型多血管炎肾损害的预后.肾脏病与透析肾移植杂志,2004,13(5):419-430.
15 Pavone L,Grasselli C,Chierici E,et al.Outcome and prognostic factors during the course of primary small-vessel vasculitides.J Rheumatol,2006,33(7):1299-1306.
16 Schönermarck U,Gross WL,de Groot K.Treatment of ANCA-associated vasculitis.Nat Rev Nephrol,2014,10(1):25-36.
(本文编辑 凡 心)
Manifestation and long-term prognosis in microscopic polyangiitis patients with pulmonary involvement
SHAOFang,CHENYinghua,ZHANGLihuang,TUYuanmao,HUWeixin,LIUZhihong,XIEHonglang
NationalClincalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
XIEHonglang(E-mail:xiehl_doctor@163.com)
Objective:To analyze the clinical characteristics and long-term prognosis of patients with microscopic polyangiitis(MPA) with and without pulmonary involvement. Methodology:196 MPA patients with renal involvement were enrolled in the study. The median serum creatinine (SCr) was 344.8 (176.8~556.9) μmol/L, 70(35.7%) of them needed renal replacement therapy at diagnosis. The prognosis and risk factor of MPA with pulmonary involvement were retrospectively studied. Survival Curve was estimated by Kaplan-Meier methods, and multivariate Cox regression analysis is applied to probe into the correlation between clinical features as well as pathological parameters and long-term human survival outcome. Results:With a mean follow-up time of 38.9±42.0 months, 20 patients died, 81(41.3%) developed end stage renal disease(ESRD). The pulmonary involvements were observed in 111 MPA patients, their main clinical symptoms included hemoptysis and cough; CT or X-ray manifestations included patchy, funicular shadow and pleural thickening. The age, proportion of male patients and smokers, BVAS score, serum creatinine and MPO-ANCA level in pulmonary involvement group were apparently higher than those of non-pulmonary involvement group (P<0.05). The 1-year complete remission rate was 13.5% and 21.2% (P=0.155) in patients with and without pulmonary involvement; while their ineffective treatment proportion was respectively 42.3% and 35.3% (P=0.317). Patient survival rate in pulmonary involvement group was significantly lower (P=0.013); renal survival was not differed between two groups. Cox multivariate analysis indicated that lung involvement and dialysis dependent on admission were significant negative prognostic factors for patients survival. Conclusion:The vasculitis of older MPA patients with lung damage was more active. Lung involvement was an independent risk factor for human survival.
Lung damage MPA Patient survival Risk factor
10.3969/cndt.j.issn.1006-298X.2017.02.004
国家重点研发计划课题(2016YFC0904103,2016YFC0901202);国家支撑计划课题(2015BAI12B02,2015BAI12B05)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 硕士研究生(邵 芳) 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
谢红浪(E-mail:xiehl_doctor@163.com)
2016-09-28
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有

