重质碳酸钙螯合吸附剂的制备及其吸附性能研究*
汤 泉,谢 微,唐小闲,高友君
(1.贺州学院化学与生物工程学院,广西贺州542899;2.食品科学与工程技术研究院)
重质碳酸钙螯合吸附剂的制备及其吸附性能研究*
汤 泉1,谢 微2,唐小闲2,高友君1
(1.贺州学院化学与生物工程学院,广西贺州542899;2.食品科学与工程技术研究院)
以重质碳酸钙为原料,采用阳离子淀粉改性制备重质碳酸钙螯合吸附剂。通过单因素实验,并用正交实验优化探究影响因素对Cd2+吸附效果的影响,用原子吸收分光光度计测定溶液中重金属Cd2+的浓度。结果表明,重质碳酸钙螯合吸附剂对Cd2+的最优吸附条件为pH=5.0、重质碳酸钙螯合吸附剂用量为25 g/L、吸附时间为3 h、温度为25℃,吸附率可达到99.94%。红外光谱表征表明,重质碳酸钙与阳离子淀粉存在化学吸附,改变了重质碳酸钙的表面性质,并且重质碳酸钙表面已被阳离子淀粉包覆。
重质碳酸钙螯合吸附剂;阳离子淀粉;吸附
污水处理技术有许多种,如化学沉淀法、吸附法、离子交换法、生化处理法等,吸附法简单、有效,是中国应用较广泛的一种吸附污水中重金属离子的方法。吸附材料多种多样,主要的有生物炭[1]、膨润土[2]、高岭土[3]、海泡石[4]、蒙脱石[5-6]、硅藻土[7-8]、沸石[9-12]、铁矿[13]等。重质碳酸钙是一种重要的化工无机粉体材料[14-15],贺州拥有丰富的重质碳酸钙粉体资源,其价格低、原料广、无毒无害,目前主要被应用于塑料、橡胶、造纸、涂料、油墨、化妆品等行业[16-17],起到增加体积、降低成本的作用,具有极佳的经济效益。在重质碳酸钙加工过程中,表面因水解作用而分布有一定数量羟基[18],具有较强亲水性[19],表面呈现较强的碱性,易与酸反应,由于粒子表面静电作用,表面能较高,正因为这种特殊的表面结构特征,可以通过表面接枝、螯合、包覆等方式,改变重质碳酸钙表面官能团[20],丰富表面官能团种类,从而改变微粒的表面性质,赋于其大量吸附金属离子的特征。因此利用廉价天然矿物材料重质碳酸钙作基底制备重金属污染的修复材料,用阳离子淀粉改性重质碳酸钙螯合吸附Cd2+,实现重金属的无害化转换,做到环境友好处理,并致力在环境保护领域中推广应用,具有一定的科学和社会意义。
1 实验过程
1.1 药品与仪器
阳离子淀粉(AR),四水硝酸镉(AR),硝酸(AR),22.5 μm重质碳酸钙(工业品)。
AR224CN电子分析天平;SHA-B恒温振荡器;PHS-3C便携式pH计;Frontier FTIR傅里叶红外光谱仪;AA1700原子吸收分光光度计,分析参数:波长324.8 nm、光谱带宽0.4 nm、灯电流2 mA、负高压约285V、火焰为空气-乙炔火焰、乙炔流量1.4L/min、燃烧头高度约8 mm、线性范围0~10 mg/L。
1.2 重质碳酸钙螯合吸附剂的制备
按照固液质量体积比为1 g/mL将阳离子淀粉加水分散均匀,加热并搅拌,在95℃下糊化2 min,按照糊化阳离子淀粉与重质碳酸钙质量比为40%将二者加入烧杯中,在干法条件下,改性温度为50℃进行搅拌处理30 min,产品为重质碳酸钙螯合吸附剂。
1.3 重金属Cd2+溶液的配制
用电子天平称取1.371 9 g分析纯的四水硝酸镉,用蒸馏水溶解,定容至500 mL,此时Cd2+溶液的质量浓度为1 g/L。再从中取10 mL稀释到100 mL的容量瓶中,即得100 mg/L的标准Cd2+溶液。
1.4 重质碳酸钙螯合吸附剂吸附重金属离子
称取一定量的重质碳酸钙螯合吸附剂,加入到100 mL 100 mg/L Cd2+溶液中,在一定的温度、一定的pH下,搅拌吸附一定时间,利用原子吸收分光光度计测定吸附前后Cd2+溶液浓度,确定吸附的最优条件。
1.5 吸附率的计算
将重质碳酸钙螯合吸附剂装入锥形瓶中,然后在各个容器中加入一定体积的溶液,浓度为ρ0,盖上瓶塞,将容器置于恒温震荡器中,以相同搅拌速度搅拌。达到吸附平衡后,抽滤分离重质碳酸钙螯合吸附剂,用原子吸收分光光度计测量滤液中的重金属离子浓度。这个浓度就是吸附平衡浓度ρe。溶液中重金属离子的吸附率计算公式为:

式中:Re为溶液中重金属离子的吸附率(%);ρ0为吸附前溶液中重金属离子的质量浓度(mg/L);ρe为吸附平衡后溶液中重金属离子的质量浓度(mg/L)。
2 结果与分析
2.1 Cd2+标准曲线
分别配制质量浓度为2、4、6、8、10 mg/L的Cd2+溶液,利用原子吸收分光光度计做出标准曲线,标准曲线测定结果见图1。图1为Cd2+溶液的标准曲线,其方程表达式为y=0.056 8x+0.089 1,相关系数R2=0.999 6。说明浓度和吸光度成线性关系,相关性良好。

图1 Cd2+溶液标准曲线
2.2 pH对Cd2+吸附率的影响
在25℃、重质碳酸钙螯合吸附剂用量为1.0 g、吸附时间为4 h条件下,不同的吸附pH(4.5、5.0、5.5、6.0、6.5)对重金属Cd2+的吸附率影响见图2。从图2可以看出,pH对重质碳酸钙螯合吸附剂吸附Cd2+的影响显著,也是影响吸附率的主要因素之一。溶液pH从4.5增至5.0时,吸附率不断增大;pH从5.0增加至原溶液的pH时,吸附率呈现下降趋势,主要是因为随着溶液pH的升高,酸性不断减弱,碱性增强,未吸附的Cd2+由离子形态转变成Cd(OH)2沉淀,此时溶液中主要以氢氧根和镉离子反应为主。综合上述分析最佳pH应为5.0。

图2 pH对Cd2+吸附率的影响
2.3 重质碳酸钙螯合吸附剂用量及吸附时间对Cd2+吸附率的影响
在25℃、pH为5.0、吸附时间为4 h的条件下,重质碳酸钙螯合吸附剂用量(1.0、1.5、2.0、2.5、3.0 g)对重金属Cd2+的吸附率影响见图3a。重质碳酸钙螯合吸附剂用量是一个重要参数,因为它决定了吸附过程中的有效结合位点的数量,从图3a可以看出,随着重质碳酸钙螯合吸附剂用量逐渐增加,Cd2+的吸附率不断增加,在用量为2.0 g的时候达到最高值。当用量超过2.0 g后,吸附率曲线趋于平缓。可以认为,随着重质碳酸钙螯合吸附剂增加,表面的活性位点数量也不断增多,Cd2+进一步被吸附利用,使吸附率不断上升;当重质碳酸钙螯合吸附剂用量达到某一数值后,尽管用量持续增加,但吸附率没什么变化,此时对Cd2+的吸附达到完全。结果表明,对于重质碳酸钙螯合吸附剂吸附初始质量浓度为100 mg/L的Cd2+溶液的最佳吸附剂用量为2.0g,即为20 g/L。
在25℃、pH为5.0的吸附条件下,重质碳酸钙螯合吸附剂用量为2.0 g时,不同的吸附时间(1.0、1.5、2.0、2.5、3.0、3.5、4.0 h)对重金属Cd2+的吸附率影响见图3b。从图3b可以看出,吸附时间也是影响Cd2+吸附率的主要因素之一。吸附时间在1.0~3.0 h时,Cd2+的吸附率不断增加;当吸附时间超过3.0 h后,Cd2+的吸附率曲线变平缓,认为重质碳酸钙螯合吸附剂对重金属Cd2+的吸附已经达到平衡状态。结果表明,最佳吸附时间为3.0 h。

图3 吸附剂用量及吸附时间对Cd2+吸附率的影响
2.4 温度对Cd2+吸附率的影响
在pH为5.0的吸附条件下,重质碳酸钙螯合吸附剂用量为2.0 g、吸附时间为3.0 h时,不同的吸附温度(15、25、35、45、55、65℃)对重金属Cd2+的吸附率影响见图4。由图4可以看出,在不同的温度下,吸附率变化不大并且吸附效果良好,都在98%以上。故吸附温度对重质碳酸钙螯合吸附剂吸附重金属Cd2+没什么影响,为了操作方便,在常温下进行即可。

图4 温度对Cd2+吸附率的影响
2.5 正交实验
正交实验设计见表1,正交实验结果分析见表2。
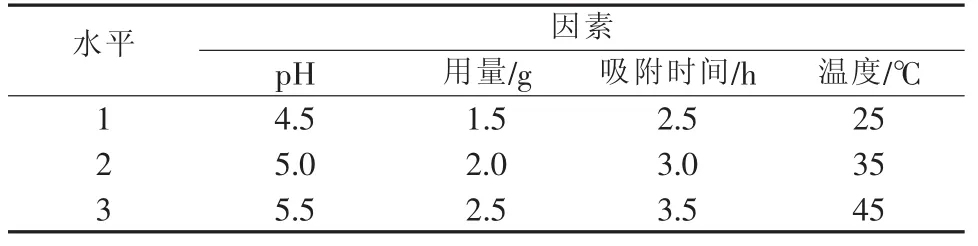
表1 正交实验设计

表2 正交实验结果
由表2中的R值可以看出,各因素作用主次顺序依次为pH、吸附时间、用量、吸附温度,说明在考察范围内,pH对阳离子改性碳酸钙吸附重金属镉离子的影响最大,其次是吸附时间、用量,而温度的影响最小。从k值可以看出吸附的最佳方案为A2B3C2D1,即pH=5.0、重质碳酸钙螯合吸附剂用量为2.5 g、吸附时间为3 h、温度为25℃。
2.6 验证性实验
在pH=5.0、重质碳酸钙螯合吸附剂用量为2.5 g、吸附时间为3 h、温度为25℃条件下做3次验证性实验,吸附率分别为99.93%、99.95%和99.95%,平均值为99.94%。
2.7 红外光谱表征
图5a为重质碳酸钙红外光谱图,图5b为重质碳酸钙螯合吸附剂红外光谱图。从图5a可以看出,重质碳酸钙红外光谱图中在3 400 cm-1处是—OH基的对称吸收伸缩振动,在1 420 cm-1处的宽强峰、870 cm-1处的中强峰和713 cm-1处的中峰是碳酸盐矿物CO32-的主要特征吸收峰。从图5b可知,重质碳酸钙螯合吸附剂红外光谱图中除了上述峰外,在1 040~1 100 cm-1处出现了阳离子淀粉中醚基的特征吸收峰,在750、600 cm-1处出现了淀粉中的葡萄环基基团的特征吸收峰,表明重质碳酸钙与阳离子淀粉存在化学吸附,改变了重质碳酸钙的表面性质,并且重质碳酸钙表面已被阳离子淀粉包覆。
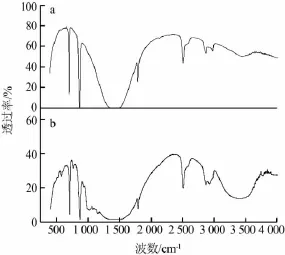
图5 重质碳酸钙及重质碳酸钙螯合吸附剂红外光谱图
3 结论
1)经单因素实验和正交实验的计算结果表明,重质碳酸钙螯合吸附剂吸附重金属Cd2+的最优条件为:pH=5.0、重质碳酸钙螯合吸附剂用量为25 g/L、吸附时间为3h、温度为25℃,吸附率可达到99.94%。2)红外光谱分析表明,重质碳酸钙与阳离子淀粉存在化学吸附,改变了重质碳酸钙的表面性质,并且重质碳酸钙表面已被阳离子淀粉包覆。
[1] 蒋艳艳.生物炭吸附固定镉、铜效果的研究[D].荆州:长江大学,2014.
[2] 丁述理,孙晨光.膨润土吸附水中Cr(Ⅵ)的影响因素研究[J].非金属矿,2006,29(3):45-48.
[3] Arias M,Barral M T,Mejuto J C.Enhancement of copper and cadmium adsorption on kaolin by the presence of humic acids[J]. Chemosphere,2002,48(10):1081-1088.
[4] Lazarevic S,Jankovic-Castvan I,Jovanovic D,et al.Adsorption of Pb2+,Cd2+and Sr2+ions onto natural and acid-activated sepiolites[J]. Applied Clay Science,2007,37(1/2):47-57.
[5] 田犀卓,金兰淑,应博,等.钢渣-蒙脱石复合吸附剂对水中Cd2+的吸附去除[J].环境科学学报,2015(1):207-214.
[6] 代亚平,吴平霄.3-氨丙基三乙氧基硅烷改性蒙脱石的表征及其对Sr(Ⅱ)的吸附研究[J].环境科学学报,2012(10):2402-2407.
[7] 矫娜,王东升,段晋明,等.改性硅藻土对三种有机染料的吸附作用研究[J].环境科学学报,2012,32(6):1364-1369.
[8] 郑权男.硅藻土的炭化与吸附性能研究[D].吉林:吉林大学,2014.
[9] 李曼尼,刘晓飞,江雅新,等.改性斜发沸石在水处理中的应用[J].环境化学,2007,26(1):21-26.
[10] 林建伟,詹艳慧,陆霞.锆改性沸石对水中磷酸盐和铵的吸附特性[J].中国环境科学,2012,32(11):2023-2031.
[11] 谢杰,王哲,吴德意,等.表面活性剂改性沸石对水中酚类化合物吸附性能研究[J].环境科学,2012,33(12):4361-4366.
[12] 何敏祯,胡勇有,雷超,等.HDTMA改性沸石对三氯生的吸附特性研究[J].环境科学学报,2013,33(1):20-29.
[13] Li W,Zhang S,Shan X.Surface modification of goethite by phosphate for enhancement of Cu and Cd adsorption[J].Colloids Surf. A,2007,293:13-19.
[14] 郑水林.重质碳酸钙生产技术现状与趋势[J].无机盐工业,2015,47(5):1-3.
[15] 王友,曾一文,覃康玉,等.硬脂酸-钛酸酯偶联剂改性重质碳酸钙粉体研究[J].无机盐工业,2016,48(6):38-40.
[16] 汤泉,周国永,曾一文,等.甲基丙烯酸甲酯聚合改性重质碳酸钙的研究[J].贺州学院学报,2013,29(3):136-140.
[17] 王友.Span60表面改性重质碳酸钙粉体研究[J].无机盐工业,2016,48(7):25-28.
[18] 汤泉,陈瑞琼,卢玉昌,等.松香酸烷醇酰胺表面改性重质碳酸钙的研究[J].化学工程师,2012(3):11-13.
[19] 周国永,曾一文,黄志强,等.P(BA-FA)原位聚合法改性重质碳酸钙微粒的研究[J].无机盐工业,2013,45(4):18-20.
[20] 汤泉,周国永,张志.油酸正丁酯硫酸酯钠盐活化重质碳酸钙及其性能研究[J].中国非金属矿工业导刊,2012(3):24-26.
Research on preparation and adsorption properties of heavy calcium carbonate chelate adsorbent
Tang Quan1,Xie Wei2,Tang Xiaoxian2,Gao Youjun1
(1.College of Chemical and Biological Engineering,Hezhou University,Hezhou 542899,China;2.Research Institute of Food Science&Engineering Technology)
With heavy calcium carbonate as raw material,heavy calcium carbonate chelate adsorbent was prepared by cationic starch modification.The adsorption effect of Cd2+was explored through single factor and orthogonal optimization experiments. The concentration of heavy metal Cd2+was measured by atomic absorption spectrophotometer.Results showed that the optimal adsorption conditions of heavy calcium carbonate chelate adsorbent to Cd2+:pH=5.0,heavy calcium chelate adsorbent dosage was 25 g/L,adsorption time was 3 h,and temperature was 25℃.Under the optimal conditions,the adsorption rate reached 99.94%.IR showed that chemical adsorption was between the heavy calcium carbonate and cationic starch,changed the surface properties of heavy calcium carbonate,and heavy calcium carbonate surface has been doped by cationic starch.
heavy calcium carbonate chelate adsorbent;cationic starch;absorption
TQ132.32
A
1006-4990(2017)04-0033-04
2016-10-21
汤泉(1973— ),男,硕士,讲师,实验室主任,研究方向为无机功能材料和污水处理,已发表论文10多篇。
谢微
广西自然科学基金项目(2013GXNSFAA19321);广西高校科学技术研究项目(YB2014380);贺州学院科研项目(2015ZZZK10)。
联系方式:249201676@qq.com

