β-胡萝卜素合成的代谢工程研究进展
王岩岩,邢建民,陈红歌
β-胡萝卜素合成的代谢工程研究进展
王岩岩1,邢建民2,陈红歌1
1 河南农业大学生命科学学院,河南郑州 450002 2 中国科学院过程工程研究所生化工程国家重点实验室,北京 100190
β-胡萝卜素是自然界中最重要的商业化生产的植物色素之一,具有多种生理功能和生物活性。自上世纪60年代开始,随着系统生物学概念的提出以及对类胡萝卜素合成途径研究的不断深入,系统代谢工程在提高类胡萝卜素产量方面发挥了重要作用。文中在介绍β-胡萝卜素传统生产方法的基础上,重点介绍了如何运用系统代谢工程手段构建β-胡萝卜素高产菌株,并分析了进一步提高工程菌β-胡萝卜素产量所面临的主要问题及可能的解决方案,为β-胡萝卜素的高效生产提供了思路。
β-胡萝卜素,前体物质,合成途径,系统代谢工程
β-胡萝卜素,分子式为C40H56,相对分子质量536.85,含有8个异戊二烯单位的类胡萝卜素 (图1),主要有全反式、9-顺式、13-顺式及15-顺式4种形式,是一种紫红色至暗红色有光泽的结晶粉末,稀溶液呈橘黄色。不溶于水,可溶于许多有机溶剂,如氯仿、二硫化碳、丙酮、癸烷和十二醇等,但在甲醇、乙醇中几乎不溶解。由于分子内含有共轭双键,β-胡萝卜素在高温、强酸、氧气和光照条件下不稳定,易发生氧化还原反应,但在碱性条件下较稳定[1]。自然界所有光合生物中均含有β-胡萝卜素,用于促进光吸收,防止光能破坏氧自由基并能吸引昆虫传粉以促进种子传播[2]。
β-胡萝卜素具有优越的生理功能,不仅是合成人体维生素A的前体物质,具有较强的抗氧化活性,而且对于增强人体免疫力、预防慢性疾病、促进细胞缝隙间连接交流、减少动脉硬化、延缓衰老以及有效抑制癌细胞的增殖等都具有重要意义[3],广泛用于药品、化妆品、保健品和食品添加剂等[4]。近年来,采用直接提取法、化学合成法和微生物发酵法等生产β-胡萝卜素的工作都相继展开,但都有其限制因素,人们一直探索新方法,力求实现β-胡萝卜素的大规模生产。随着系统生物学概念的提出,代谢工程的迅猛发展以及对类胡萝卜素合成途径研究的不断深入,β-胡萝卜素的产量有了大的突破,但仍存在一些问题。
本文在介绍β-胡萝卜素传统生产方法的基础上,将重点对系统代谢工程手段构建β-胡萝卜素高产菌株的研究进行深入探讨,分析存在的主要问题并提出解决办法。
1 天然β-胡萝卜素生产方法的研究
1.1 采用植物生产
高等植物的光合色素为叶绿素A、叶绿素B和类胡萝卜素,类胡萝卜素作为辅助色素广泛存在于叶绿体中,对叶绿素捕获光能加以补充。自然界中,许多植物包括绿叶蔬菜、水果、块根块茎、花卉等均含有丰富的β-胡萝卜素 (表1)。工业上,一般采取将胡萝卜皮粉碎通过有机溶剂或超临界流体萃取的方法生产β-胡萝卜素,但面临高消耗、低产出、环境污染等问题。
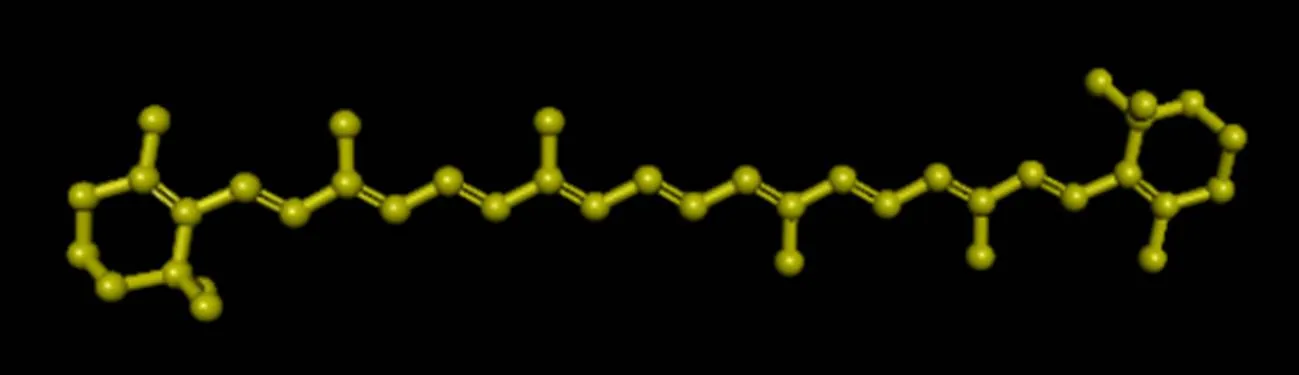
图1 β-胡萝卜素的结构式
表1 几种常见食物中类胡萝卜素和β-胡萝卜素的含量[5-6]
Table 1 Content of total carotene and β-carotene in some food[5-6]
NamesCarotenoids content (mg/100 g)β-carotene content (mg/100 g)β-carotene percentage in carotenoids (%) Sweet potato2.23±0.231.87±0.1484.10±5.07 Carrot8.85±2.006.50±1.4669.70±6.96 Pumpkin2.06±0.771.16±0.5755.10±8.19 Mango2.21±1.151.71±0.9576.90±7.55 Tomato3.09±0.100.06±0.0119.00±1.41 Green chillies2.44±0.461.13±0.8049.60±8.82 French beans1.26±0.030.39±0.0231.00±1.79
1.2 采用藻类生产
β-胡萝卜素在藻类中广泛存在[7],如佛氏绿胶藻、杜氏藻、泥生颤藻等。目前,杜氏盐藻因其能生成大量β-胡萝卜素而成为工业上最重要的杜氏藻物种[8],产量高达细胞干重的16%。Gómez等[9]发现,合成的天然β-胡萝卜素是顺式 (主要是9-顺式)和全反式的混合物,这两种异构体的比例受环境条件的影响,如温度、辐射、盐度等。终产品中,由于全反式-β-胡萝卜素容易结晶,而9-顺式结构不形成晶体,所以,两种异构体的相对比例在提取和后处理过程中也会发生变化[8]。该法在澳大利亚和以色列首先达到工业规模,科宁 (属巴斯夫公司) 成为世界上最重要的利用生产天然β-胡萝卜素的公司,中国、美国、印度等国家也在逐渐尝试。但该法生产β-胡萝卜素需要高浓度的盐水湖、强烈的光照、干旱的气候,不适用于许多国家。
1.3 采用微生物发酵生产
自然界中,除植物、藻类外,微生物也能大量合成β-胡萝卜素,如部分真菌和细菌。在真菌中,目前主要利用丝状真菌如三孢布拉氏霉菌[10]和酵母如红法夫酵母、白球拟酵母等生产β-胡萝卜素。Roukas团队[11-13]证明,通过氧胁迫、改良提取方法和优化培养条件可以提高三孢布拉氏霉菌合成β-胡萝卜素的产量。细菌中,主要利用欧文氏菌、成团泛菌等生产β-胡萝卜素,其本身含有存在于染色体上的β-胡萝卜素合成基因——牻牛儿基牻牛儿基焦磷酸合成酶基因 ()、八氢番茄红素合成酶基因 ()、八氢番茄红素脱氢酶基因 ()、番茄红素环化酶基因 ()。利用这些野生菌株生产β-胡萝卜素周期短、代谢快、相对安全,比植物、藻类效率更高,但野生菌株生活性能差,终产量低,难以实现工业化。
2 系统代谢工程策略生产β-胡萝卜素
随着高通量技术迅猛发展,逐渐阐释了基因组学、转录组学、蛋白质组学、代谢组学和通量组学,再结合新颖的计算技术,萌生了系统生物学的概念。因此,系统代谢工程 (Systems metabolic engineering) 被定义为系统层面的代谢工程——整合了系统生物学的组学和计算技术、合成生物学的精细化设计能力以及进化工程的随机突变方法[14-15],即通过大数据和模型的使用,组合不同来源的多种酶分子来构建新的代谢路径,以达到改善细胞表型的目的。
系统代谢工程的实施流程[16]通常有以下环节:首先理性设计宿主菌生产目标产物的代谢路径;然后加以实验,评估细胞的生长和代谢水平;通过测定中间代谢产物的积累量和每个反应的活性,找出代谢路径的限速步骤并利用计算技术来预测流量分布情况。上述检测和评估获得的信息用于构建新一轮生产目标产物的优化途径。系统代谢工程对于开发出目标产物产量及效率最大化、过程消耗最小化的微生物菌株具有重要的意义。
近年来,以模式生物如大肠杆菌、酿酒酵母等为出发菌株,综合运用系统代谢工程策略来生产 β-胡萝卜素的方法已成为大量合成多种类胡萝卜素产品的新模式,利用工程菌提高β-胡萝 卜素的产量有了很大进展。如Yang等[17]通过在中共表达外源基因同时引入MVA途径,使得β-胡萝卜素产量达到3.2 g/L,是目前报道的最高产量;Zhao等[18]调整代谢过程中各模块相关基因的表达以增强前体物和能量供应,产量为2.1 g/L;Nam等[19]在合成培养基中补充氨基酸从而取代复合培养基,得到2.47 g/L的β-胡萝卜素;Li等[20]利用CRISPR/Cas9的方法对中的各基因进行改造并组合调控,β-胡萝卜素的产量达到2.0 g/L。由此可见,利用工程菌生产β-胡萝卜素具有其独特的优势。
以下将详细介绍利用系统代谢工程构建β-胡萝卜素工程菌时β-胡萝卜素生物合成路径的设计、路径的优化以及宿主菌的基因工程改造等措施。
2.1 β-胡萝卜素生物合成路径的设计与优化
目前用于生产β-胡萝卜素的微生物主要是、等,在这些微生物中构建β-胡萝卜素合成途径通常包括3个功能相对独立的模块:糖酵解模块、前体物质合成模块和β-胡萝卜素合成模块,如图2所示。类胡萝卜素通过一系列的异戊二烯化合物合成,其前体物是异戊二烯焦磷酸 (IPP),共有2条合成途径即甲羟戊酸(MVA) 途径和2-甲基-D-赤藻糖醇-4-磷酸(MEP)途径。及其他原核生物通过MEP 途径缩合丙酮酸 (Pyruvate) 和甘油醛-3-磷酸 (G3P) 为IPP[21];真核细胞、细胞质以及植物线粒体利用MVA途径转换乙酰辅酶A生成IPP。
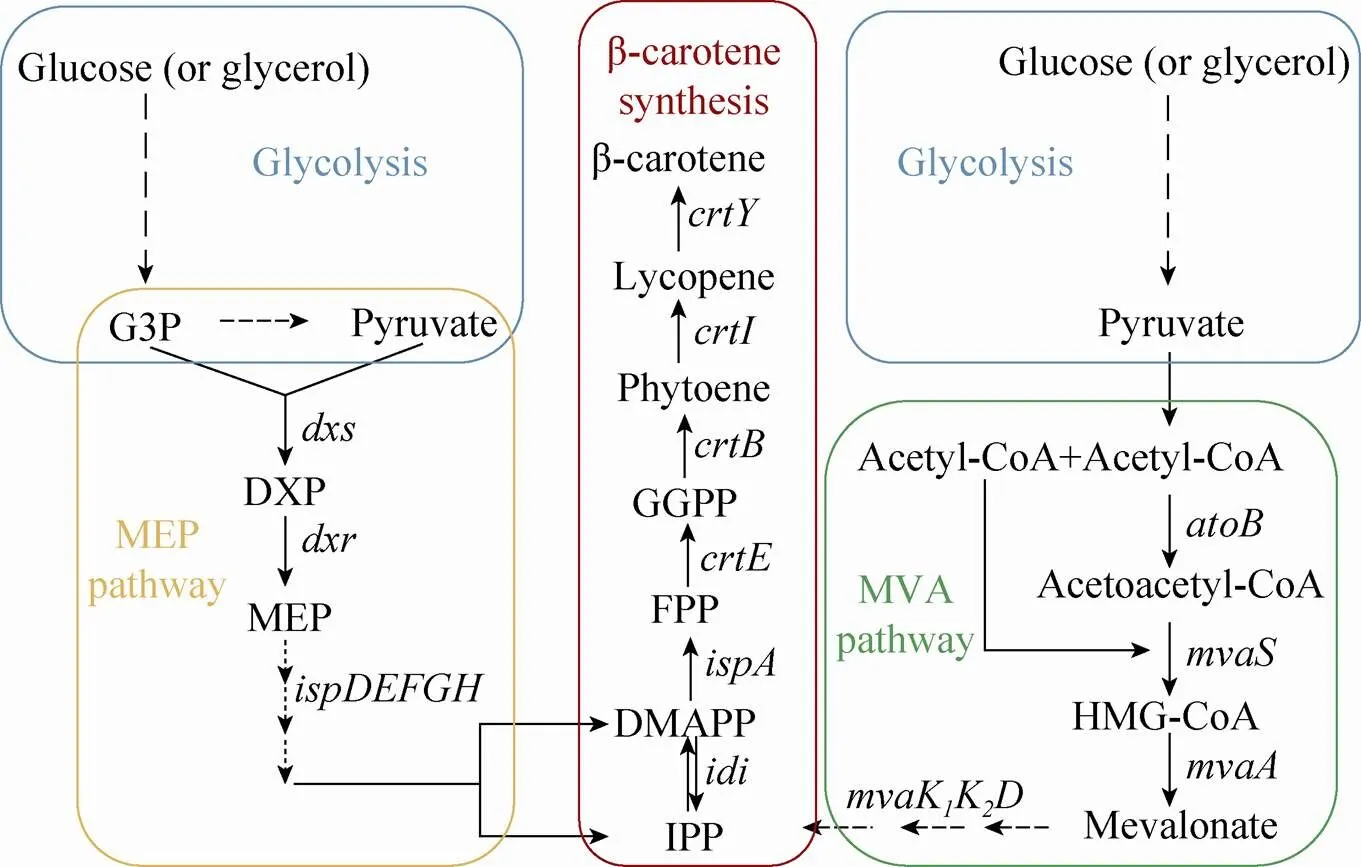
图2 β-胡萝卜素生物合成路径
IPP (C5) 及其同分异构体二甲基丙烯焦磷酸 (DMAPP) (C5),在FPP 合成酶IspA的催化下经两步连续反应合成FPP (C15),再通过编码的GGPP合成酶产生GGPP (C20),接下来由八氢番茄红素合成酶 (CrtB) 催化两分子的GGPP 形成无色的八氢番茄红素 (C40),在八氢番茄红素脱氢酶 (CrtI) 作用下,生成红色的番茄红素 (C40),再由番茄红素环化酶 (CrtY) 催化生成黄色的β-胡萝卜素 (C40)。
2.1.1 利用MEP途径合成IPP
及其他原核生物通过MEP途径为 β-胡萝卜素的合成提供前体物质IPP。葡萄糖或甘油通过糖酵解产生丙酮酸和G3P,二者经1-脱氧-D-木酮糖-5-磷酸合成酶 (Dxs) 形成1-脱氧-D-木酮糖-5-磷酸 (DXP),再由一系列类异戊二烯酶——DXP 还原异构酶 (Dxr)、4-焦磷酸胞苷-2-C-甲基-D-赤藓糖醇合成酶 (IspD)、4-焦磷酸胞苷-2-C-甲基-D-赤藓糖醇激酶 (IspE)、2-C-甲基-D-赤藓糖醇-2,4-环焦磷酸合成酶 (IspF)、1-羟基-2-甲基-2-(E)-丁烯基-4-焦磷酸合成酶 (IspG) 和4-羟基-3-甲基-2-丁烯基焦磷酸还原酶 (IspH),将DXP 转化为C5异戊二烯亚单 位——IPP和DMAPP,这两种物质通过异戊烯焦磷酸异构酶 (Idi) 相互转化[22]。
前体物丙酮酸和G3P 等量利用,缺少任何一种物质都会减少体内萜类的合成[23]。如,敲除丙酮酸激酶 (PykFA) 能够平衡二者的利用率,调控异戊二烯途径的代谢流来增强类胡萝卜素的产量[24];敲除葡萄糖-6-磷酸脱氢酶基因() 来阻断G6P到磷酸戊糖途径 (PPP) 的转化,通过RT-PCR (Quantitative real-time polymerase chain reaction) 得到的转录组分析结果显示,敲除菌株中MEP代谢路径的限速基因和显著上调[25]。磷酸烯醇式丙酮酸 (PEP) 也是重要前体物之一,当碳水化合物加入时,PEP 通过磷酸转移酶系统 (PTS) 被消耗,所以敲除PTS相关基因能够增加PEP和G3P的浓度[26]。Das等[23-27]发现,从G3P 到丙酮酸过程中通过相关酶的过表达或钝化 (如过表达磷酸烯醇式丙酮酸合成酶 (Pps)) 来控制G3P和丙酮酸的代谢流平衡后,均能显著增加β-胡萝卜素的产量。由于丙酮酸是生物体的主要代谢产物,参与许多生理反应,若要使代谢流尽可能多地走向β-胡萝卜素合成方向,必须减少副产物如乳酸、乙酸的生成。
通过调节MEP 途径提高β-胡萝卜素产量的几个方法:1) 过表达类异戊二烯关键基因[28-29],如和。Dxs和Idi被认为是类异戊二烯合成途径的限速步骤,一般通过基因修饰来增加这两个酶的活性[30]。Yuan研究小组[22,31]使用强启动子T5 对MEP途径中、、和等基因调控后,可以增强目的途径代谢流,导致β-胡萝卜素产量增加4.5倍。Alper等[32]构建启动子文库来调控MEP代谢路径上酶的表达水平,结合流式细胞仪 (Becton Dickinson FACScan) 筛选出最优表现型,通过转录组分析进行验证。Zhao等[33]使用多个不同强度的调控元件对中MEP途径的8个基因组合调控,β-胡萝卜素产量提高的幅度比仅使用强启动子效果要好得多;2) 抑制竞争路径异戊二烯焦磷酸的利用,减弱或敲除旁路代谢过程。
2.1.2 利用MVA途径合成IPP
真核生物、植物的线粒体等利用MVA途径提供前体物[34]。MVA途径可分为上游和下游两部分[35],上游途径通过乙酰辅酶A硫解酶 (AtoB)、HMG-CoA合成酶 (MvaS)、HMG-CoA 还原酶 (MvaA) 三种酶将三分子的乙酰辅酶A (Acetyl-CoA) 转化为甲羟戊酸(MVA);下游途径通过甲羟戊酸激酶 (MvaK1)、磷酸甲羟戊酸激酶 (MvaK2) 和二磷酸甲羟戊酸脱羧酶 (MvaD) 3种酶将MVA转换为IPP。
整个MVA途径开始于细胞中丰富的乙酰辅酶A,可能比MEP途径供应IPP 的效率更高,而且在中引入外源MVA途径可以避免细菌自身的反馈抑制[36-37],生产大量的异戊二烯化合物。代谢工程上一个巨大的进步是将来自肺炎双球菌和肠球菌的杂合MVA途径引入DH5α,结果重组的宿主细胞产生465 mg/L β-胡萝卜素[35]。Pitera团队[38]指出MVA 上游路径中的过表达抑制细胞生长,通过液质联用技术得到的代谢组数据表明,随着HMG-CoA的积累,呈现明显的生长抑制性状,推测对产生毒性反应,由此可知,MvaA是MVA途径的限速酶,可以通过增强同时减弱的表达促使细胞正常生长。本身具有MVA路径,Verwaal等[39]通过引入GGPP合成酶基因,产生更多的碳流,合成5.9 mg/g β-胡萝卜素;Yan等[40]通过过表达并添加麦角固醇抑制剂使β-胡萝卜素细胞干重 (DW) 达到6.3 mg/g;Xie等[41]通过对类胡萝卜素基因插入可控双功能启动子,β-胡萝卜素增加到7.4 mg/g;最近,利用顺序控制FPP的上游、下游以及竞争路径,即通过葡萄糖的浓度来控制类胡萝卜素合成途径、MVA途径和鲨烯合成途径中基因的表达水平,在120 h发酵后,中β-胡萝卜素产量达到 20.8 mg/g (即1.156 g/L)[42-43]。
2.1.3 β-胡萝卜素合成模块及其优化
野生菌——欧文氏菌、成团泛菌和三孢布拉氏霉菌中均含有β-胡萝卜素的结构基因——基因簇,利用基因工程将其整合到模式生物染色体上,以实现由前体物质到β-胡萝卜素的转化。FPP是类胡萝卜素生物合成和其他类异戊二烯分子合成的共同前体物和分支点,其在编码的八聚异戊二烯焦磷酸合成酶催化下形成泛醌[22],理论上,的表达会将代谢流量引向泛醌的合成方向,但令人吃惊的是,过表达反而导致β-胡萝卜素产量的增加。由于编码GGPP合成酶的基因具有序列多样性[44],所以在β-胡萝卜素合成结构基因的起始处应当选择一个较为有效的基因。Yoon等[45]表明,成团泛菌比菠萝泛菌中的基因效率高,在这个模块中高效控制代谢流走向终产物,β-胡萝卜素的产量很大程度上取决于CrtE的活性。
蛋白翻译速率及表达量和RBS的序列密切相关,并且RBS 文库可以较大范围地调控基因表达[46],故能够通过构建的RBS文库,筛选出使β-胡萝卜素产量较高的菌株,如系统生物学中崭新的计算方法RedLibs (Reduced libraries),即在优化代谢路径过程中,理性设计一种巧妙的组合文库,可以大量减少实验操作[47]。
目的产物的高产经常被自身酶限制,如较低的转化率和副产物的积累,而蛋白质工程能提供提高酶的特殊性质和底物特异性的方法,包括定向进化和理性设计[48-49]。定向进化是在实验室条件下筛选突变基因的理想表现型,易错PCR可以产生突变文库,DNA改组被用来重新组合存在的突变体。蛋白的理性设计建立在生物信息学的模拟和预测之上,极大地减轻了科研工作者的筛选任务[50],遗憾的是,疏水性β-胡萝卜素合成酶类均定位在细胞膜上,理化性质和晶体结构理解不够透彻[51],用这种方法有较小的进展。这些理性设计尽管能够适度地增加β-胡萝卜素其他模块中代谢流强度,但是忽略了非特异性的影响,比如中间代谢产物的毒性,隐藏的代谢途径对主要路径产生竞争,用于表达的载体对细胞产生不利影响,抑制目标产物的产量等,而组合调控能够提供更多的机会来选择样本空间并绕过这些复杂的非线性相互作用,克服以上这些问题[52],但组合调控需要高通量,经常对许多天然产物不适用。
2.1.4 能量供应的调节
β-胡萝卜素生物合成能量供给过程分为ATP途径、TCA循环途径和PPP途径。ATP和NADPH是萜类化合物合成的2个重要辅因子。生物体中,ATP通过ATP合成酶和电子转移链生成,电子首先从糖酵解和TCA循环过程产生的NADH传递到泛醌氧化还原酶,形成电化学梯度[53],最终传递给细胞色素氧化酶。合成NADPH主要有3种方式——TCA循环、PPP途径和NADH到NADPH的转换。TCA循环能够产生ATP和NADH,PPP途径能够产生NADPH,TCA 循环比其他2种途径对β-胡萝卜素产量的提高发挥更大作用[18]。在3种途径中电子传递需要各种氧化还原酶的参与,为了增加ATP 和NADPH的供应,需要利用调控元件来调节基因操纵子[18,54]。
Ajikumar等[21,55]通过多元模块化途径工程(Multivariate-modular pathway-engineering) 方法证明,MVA途径每生产1 mol IPP,消耗1.5 mol 葡萄糖或3 mol甘油,产生4 mol NADH (葡萄糖) 或7 mol NADH (甘油),导致细胞体内辅因子含量极度不平衡,而MEP途径生产1 mol IPP 消耗1.196 mol葡萄糖或2 mol甘油,且不产生额外的NADH,达到氧化还原平衡。由此可见,在转化葡萄糖或甘油到IPP时,MEP途径更有效。
另一方面,TCA 循环产生1 mol ATP、2 mol NADH、3 mol FADH2相当于9 mol ATP,但仅生成1 mol NADPH。经验证,TCA和PPP模块的组合调控产生协同效应而组合调控TCA循环与ATP途径不产生协同作用,这表明在提高类胡萝卜素产量方面增加NADPH的供应比ATP更为重要[18]。
2.2 宿主菌的基因工程改造策略
生物反应过程中,要想达到最有效地提高β-胡萝卜素产量的目的,宿主的生物系统也需要被优化,如将细胞内碳流导向β-胡萝卜素生物合成途径。
RNAi (RNA interference) 的出现,使生物合成途径上某些基因如β-胡萝卜素酮化酶、羟化酶基因沉默,阻断β-胡萝卜素的进一步代谢,使之在细胞内积累[56-57]。由于β-胡萝卜素具有抗氧化性,适应性进化已经成功地应用到中,通过周期性地加入过氧化氢使β-胡萝卜素的产量有了3倍的提高,达到18 mg/g[56,58]。多元自动化基因组工程(Multiplex automated genome engineering,MAGE) 可以靶向单细胞染色体的许多位点,或者在DNA复制过程中通过将ssDNA导向复制叉的后随链来穿过细胞群,这种修饰涵盖了基因沉默、表达调控等[52]。随后,可循迹的多元重组(Trackable multiplex recombineering,TRMR) 结合DNA合成、重组工程和分子条码技术快速修饰大肠杆菌的所有基因[59]。
为改善菌株的生产能力,能够提前鉴定出需要删除或扩增的基因是十分必要的。一种基于电脑的基于强化目标流量的通量扫描(Flux scanning based on enforced objective flux,FSEOF) 技术[60],在代谢模块中浏览所有的代谢流,以目标化合物流量的增加作为约束条件,当流量增加时筛选出该基因,这种计算方法成功地运用到提高β-胡萝卜素产量上来,FSEOF作为一个全局的策略在全基因组复制过程中筛选目标基因。随着科技的发展,鉴定需操作基因的计算方法逐渐增多,多目标进化算法(Multiobjective memetic algorithm,MOMA)[61],通过代谢调节量的极小化来确定需敲除的基因;OptForce[62],通过比较代谢流的改变来确定目的基因;然而,双层次的优化方法——OptKnock[63],利用细胞生长速率和产物的产生速率相结合来确定敲除基因,最近又出现了OptFlux软件[64]。未来,这些应用到挖掘目标基因的计算方法,将会在精确快速提高β-胡萝卜素产量的研究中发挥重要作用。
目标产物的代谢工程常常依赖于质粒,但质粒系统易丢失且会额外引入抗体,因此染色体整合成为必要,λ-Red同源重组技术使无质粒系统的能够生产β-胡萝卜素。近来,出现一个新颖的策略——化学诱导染色体进化技术(Chemically inducible chromosomal evolution,CIChE),即在将靶基因整合到染色体的过程中,减少每次只能整合一个基因的重复步骤。CIChE允许宿主通过增加目的化合物的浓度来获得一个高基因拷贝数 (到40个拷贝) 的表达,并且删除基因能保证所增加拷贝数的稳定性[65-66]。
2.3 系统代谢工程提高β-胡萝卜素产量的全局性调控
β-胡萝卜素的合成涉及多种酶,多基因回路上所有化合物的表达应该被组合起来去优化整个代谢流。BioBrick™范式能够快速地组合出一个杂合的类胡萝卜素合成途径,且途径上的每个酶拥有正确的转换率,然而,BioBrick™组装不是用高通量的方式构建大量的组合表达,这对于筛选类胡萝卜素基因的最好组合没有优势[58,67]。最近,几种使用同源重组的组装方法,例如序列和连接独立的克隆(Sequence and ligation-independent cloning,SLIC)、Gibson DNA assembly和反复重组 (Reiterative recombination) 等已经应用到构建多基因回路上[65,68-69],这些方法随机组合途径上的化合物,包括基因、启动子、RBS 区等,构建出大量的基因组合用来高通量筛选。多元模块工程(Multivariate modular metabolic engineering,MMME) 是将一个长而复杂的途径模块化为不同子集,每个子集包含转换率相同的酶,调控各个子集比调控整个代谢路径上的所有化合物更加方便高效[21]。中间代谢产物过多积累会对细胞产生毒性,有些是竞争路径的底物,加速竞争路径的相关反应,因此,中间代谢产物的扩散能够缓解细胞压力,例如,生物学家通过引入蛋白骨架在空间上调控MVA 途径上的酶类来缩小对扩散作用的限制,使甲羟戊酸产量增加 77倍[70]。
发酵条件的优化对于全局性调控发挥着不可比拟的作用,尽管利用系统代谢工程手段构建宿主菌来提高β-胡萝卜素产量已有很大进步,但对发酵条件优化研究还很少。在对生长培养基 (如复合培养基、合成培养基等) 进行优化时,要想检测不同环境下所有成分的组合是不现实的,Zhang等[26]使用响应曲面法(Response surface methodology,RSM) 筛选关键化合物的最优浓度,使类胡萝卜素产量相对于野生菌株有了几倍的提高。研究发现,对于β-胡萝卜素产量的提高,甘油作为碳源优于葡萄糖、半乳糖、木糖等,并且1%的甘油和1%的葡萄糖对于增加类胡萝卜素的产量优于2%的甘油[35]。
3 系统代谢工程改造β-胡萝卜素工程菌存在的主要问题及解决思路
正如前文提到的,许多代谢工程方法可以提高β-胡萝卜素产量,但实验操作中会遇到诸多问题,如:过量表达产类异戊二烯的基因,会影响细菌体内其他代谢路径,致使菌体不能正常生长;β-胡萝卜素合成过程有许多副产物如乳酸、醋酸;β-胡萝卜素是胞内产物,产生后如何在菌体内大量储存等。
针对上述各种问题,我们可以从以下方面着力改进:一是针对Dxs是类异戊二烯合成途径限速酶的事实,对大肠杆菌自身进行RBS 优化,以使MEP途径上游代谢路径限速酶过量表达,β-胡萝卜素产量提高13倍 (工作尚未发表)。二是考虑到过表达关键基因可能会导致中间代谢产物大量积累产生细胞毒性,因此,可根据cat、m以及cat/m值,在异源菌株中找出特异性强且比活高的同工酶,将基因引入染色体基因组。三是针对细胞生长过程中伴随碳源消耗产生大量的乙酸,阻碍细胞生长的问题,可以考虑给乙酰辅酶A合成酶基因 () 更换强启动子,以使大量乙酸转化为乙酰辅酶A,减少乙酸的同时加快TCA循环,为生物体代谢提供能量。四是对于胞内产物β-胡萝卜素存储问题,我们可以尝试选择一个更为合适的宿主,有文献报道,解脂耶氏酵母是一种产油酵母,包含一个较大的脂质体,可以给脂溶性β-胡萝卜素化合物提供较为充足的存储空间[56,71]。
另一方面,对工程菌β-胡萝卜素合成路径的优化还需要有更为可行的分析和评估方法,如完整的蛋白质组、代谢组等,以指导对工程菌的改造。在系统生物学迅猛发展的今天,生物信息学计算技术层出不穷,但目前还有很多尚未应用于β-胡萝卜素工程菌的构建,如代谢的概率性调节(Probabilistic regulation of metabolism,PROM),能够直接地、自动地、定量地整合高通量数据到一个有限制条件的模型[72],通过PROM,将来我们能为β-胡萝卜素宿主菌构建一个完整的转录组调控和相应的代谢网络模型,这种自动化推理方法更精确,更全面;迭代线性优化法强化代谢(Enhancing metabolism with iterative linear optimization,EMILiO),计算各个优化的代谢流反应[73],在优化代谢流时,可以定量预测产生最高β-胡萝卜素产量时的最优流量范围等。如此多的算法能够更精确地预测细胞的生理功能,快速地确定需要操作的基因,大大减少工作量,在提高β-胡萝卜素产量方面为我们提供了新思路。
4 展望
随着经济的发展、人们的健康意识增强和对功能性食品的需求不断增加,β-胡萝卜素以其抗氧化、抗癌变等特性受到消费者的青睐,其产量远远无法满足市场需求,建立高效的生产方法对于促进β-胡萝卜素的应用具有十分重要的意义。
利用系统代谢工程手段构建β-胡萝卜素高产菌株,在其合成路径各模块进行组合优化时,遇到一些瓶颈问题,如,碳通量经常变得不平衡,这是影响整个代谢体系反应效率的根本,对于代谢工程或者一个细胞生长体系,整体平衡调控显得尤为重要,因此,利用基因工程菌生产β-胡萝卜素的研究重点应该围绕如何有效平衡细胞工厂的碳流以及能量供应问题来开展;此外,由于β-胡萝卜素合成基因均定位在细胞膜上,其理化性质及晶体结构研究较少,这样会阻碍对相关基因的全局调控。未来推广过程中,成本仍是制约工厂能否大规模生产的关键因素,应当充分考虑缩减原料成本,用工农业废渣废气等代替葡萄糖或甘油,以耗费低、时间短、产量高的标准来生产β-胡萝卜素;随着生活水平不断提高,环境保护已成为工业生产所追求的目标,工业上要求尽可能地减少对环境如水体、土壤等的污染,以提高生活质量,所以研究者应当以环境友好型菌株 (如枯草芽胞杆菌) 作为宿主菌进行基因操作,达到环境无公害,同时发酵废液应该做合适的处理以求能够循环利用。
未来系统代谢工程不仅依赖于新路径的构建,更重要的是选择合适的调控手段来改善这些路径,如RBS区的改造、密码子优化、Red两步重组、CRISPR/Cas9等,结合基因组学、转录组学、蛋白质组学、代谢组学等一系列数据及计算技术必能达到平衡调控,使β-胡萝卜素的生产更加经济、快速、实用,在食品、医药、保健等各方面发挥更佳的性能。
REFERENCES
[1] Jomova K, Valko M. Health protective effects of carotenoids and their interactions with other biological antioxidants. Eur J Med Chem, 2013, 70: 102–110.
[2] Failla ML, Huo T, Thakkar SK.screening of relative bioaccessibility of carotenoids from foods. Asia Pac J Clin Nutr, 2008, 17(S1): 200–203.
[3] Qian C, Decker EA, Xiao H, et al. Physical and chemical stability of β-carotene-enriched nanoemulsions: influence of pH, ionic strength, temperature, and emulsifier type. Food Chem, 2012, 132(3): 1221–1229.
[4] Lintig JV. Colors with functions: elucidating the biochemical and molecular basis of carotenoid metabolism. Annu Rev Nutr, 2010, 30: 35–56.
[5] Bhaskarachary K, Rao DSS, Deosthale YG, et al. Carotene content of some common and less familiar foods of plant origin. Food Chem, 1995, 54(2): 189–193.
[6] Kandlakunta B, Rajendran A, Thingnganing L. Carotene content of some common (cereals, pulses, vegetables, spices and condiments) and unconventional sources of plant origin. Food Chem, 2008, 106: 85-89.
[7] Takaichi S. Distributions, biosyntheses and functions of carotenoids in algae. Agro Food Ind Hi Tech, 2013, 24(1): 55–58.
[8] Borowitzka MA.: biology, production, and markets//Richmond A, Hu Q, Ed. Handbook of Microalgal Culture: Applied Phycology and Biotechnology, 2nd ed. New York: John Wiley & Sons, Ltd., 2013: 359–368.
[9] Gómez PI, Barriga A, Cifuentes AS, et al. Effect of salinity on the quantity and quality of carotenoids accumulated by(strain CONC-007) and(strain ATCC 30861) Chlorophyta. Biol Res, 2003, 36(2): 185–192.
[10] Mata-Gómez LC, Montañez JC, Méndez-Zavala A, et al. Biotechnological production of carotenoids by yeasts: an overview. Microb Cell Fact, 2014, 13: 12.
[11] Roukas T. The role of oxidative stress on carotene production byin submerged fermentation. Crit Rev Biotechnol, 2016, 36(3): 424–433.
[12] Hu XM, Ma XJ, Tang P, et al. Improved β-carotene production by oxidative stress ininduced by liquid paraffin. Biotechnol Lett, 2013, 35(4): 559–563.
[13] Wang HB, Luo J, Huang XY, et al. Oxidative stress response ofinduced by H2O2during β-carotene biosynthesis. J Ind Microbiol Biotechnol, 2014, 41(3): 555–561.
[14] Lee JW, Na D, Park JM, et al. Systems metabolic engineering of microorganisms for natural and non-natural chemicals. Nat Chem Biol, 2012, 8(6): 536–546.
[15] Cho C, Choi SY, Luo ZW, et al. Recent advances in microbial production of fuels and chemicals using tools and strategies of systems metabolic engineering. Biotechnol Adv, 2015, 33(7): 1455–1466.
[16] Toya Y, Shimizu H. Flux analysis and metabolomics for systematic metabolic engineering of microorganisms. Biotechnol Adv, 2013, 31(6): 818–826.
[17] Yang JM, Guo LZ. Biosynthesis of β-carotene in engineeredusing the MEP and MVA pathways. Microb Cell Fact, 2014, 13: 160.
[18] Zhao J, Li QY, Tao S, et al. Engineering central metabolic modules offor improving β-carotene production. Metab Eng, 2013, 17: 42–50.
[19] Nam HK, Choi JG, Lee JH, et al. Increase in the production of-carotene in recombinantcultured in a chemically defined medium supplemented with amino acids. Biotechnol Lett, 2013, 35(2): 265–271.
[20] Li YF, Lin ZQ, Huang C, et al. Metabolic engineering ofusing CRISPR-Cas9 meditated genome editing. Metab Eng, 2015, 31: 13–21.
[21] Yadav VG, De Mey M, Lim CG, et al. The future of metabolic engineering and synthetic biology: towards a systematic practice. Metab Eng, 2012, 14(3): 233–241.
[22] Yuan LZ, Rouvière PE, LaRossa RA, et al. Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production in. Metab Eng, 2006, 8(1): 79–90.
[23] Das A, Yoon SH, Lee SH, et al. An update on microbial carotenoid production: application of recent metabolic engineering tools. Appl Microbiol Biotechnol, 2007, 77: 505.
[24] Farmer WR, Liao JC. Improving lycopene production inby engineering metabolic control. Nat Biotechnol, 2000, 18(5): 533–537.
[25] Zhou Y, Nambou K, Wei LJ, et al. Lycopene production in recombinant strains ofis improved by knockout of the central carbon metabolism gene coding for glucose-6-phosphate dehydrogenase. Biotechnol Lett, 2013, 35(12): 2137–2145.
[26] Zhang CQ, Chen XX, Zou RY, et al. Combining genotype improvement and statistical media optimization for isoprenoid production in. PLoS ONE, 2013, 8(10): e75164.
[27] Farmer WR, Liao JC. Precursor balancing for metabolic engineering of lycopene production in. Biotechnol Prog, 2001, 17(1): 57–61.
[28] Vickers CE, Sabri S. Isoprene//Schrader J, Bohlmann J, Eds. Affiliations Biotechnology of Isoprenoids. Switzerland: Springer, 2015: 289–317.
[29] Sun T, Miao LT, Li QY, et al. Production of lycopene by metabolically-engineered. Biotechnol Lett, 2014, 36(7): 1515–1522.
[30] Albermann C. High versus low level expression of the lycopene biosynthesis genes fromin. Biotechnol Lett, 2011, 33(2): 313–319.
[31] Suh W. High isoprenoid fluxas a host for carotenoids production//Cheng Q, Ed. Microbial Metabolic Engineering. New York: Springer, 2012, 834: 49–62.
[32] Alper H, Fischer C, Nevoigt E, et al. Tuning genetic control through promoter engineering. Proc Natl Acad Sci USA, 2005, 102(36): 12678–12683.
[33] Zhao J, Liu Y, Li QY, et al. Modulation of isoprenoid gene expression with multiple regulatory parts for improved β-carotene production. Chin J Biotech, 2013, 29(1): 41–55 (in Chinese). 赵婧, 刘怡, 李清艳, 等. 多个调控元件调控萜类合成途径基因表达提高β-胡萝卜素的生产. 生物工程学报, 2013, 29(1): 41–55.
[34] Xie WP, Lü XM, Ye LD, et al. Construction of lycopene-overproducingby combining directed evolution and metabolic engineering. Metab Eng, 2015, 30: 69–78.
[35] Yoon SH, Lee SH, Das A, et al. Combinatorial expression of bacterial whole mevalonate pathway for the production of β-carotene in. J Biotechnol, 2009, 140(3/4): 218–226.
[36] Martin VJJ, Pitera DJ, Withers ST, et al. Engineering a mevalonate pathway infor production of terpenoids. Nat Biotechnol, 2003, 21(7): 796–802.
[37] Vadali RV, Fu YC, Bennett GN, et al. Enhanced lycopene productivity by manipulation of carbon flow to isopentenyl diphosphate in. Biotechnol Prog, 2005, 21(5): 1558–1561.
[38] Pitera DJ, Paddon CJ, Newman JD, et al.Balancing a heterologous mevalonate pathway for improved isoprenoid production in. Metab Eng, 2007, 9(2): 193–207.
[39] Verwaal R, Wang J, Meijnen JP, et al. High-level production of beta-carotene inby successive transformation with carotenogenic genes from. Appl Environ Microbiol, 2007, 73(13): 4342–4350.
[40] Yan GL, Wen KR, Duan CQ. Enhancement of β-carotene production by over-expression of HMG-CoA reductase coupled with addition of ergosterol biosynthesis inhibitors in recombinant. Curr Microbiol, 2012, 64(2): 159–163.
[41] Xie WP, Liu M, Lv XM, et al. Construction of a controllable β-carotene biosynthetic pathway by decentralized assembly strategy in. Biotechnol Bioeng, 2014, 111(1): 125–133.
[42] Xie WP, Ye LD, Lv XM, et al. Sequential control of biosynthetic pathways for balanced utilization of metabolic intermediates in. Metab Eng, 2015, 28: 8–18.
[43] Liao P, Hemmerlin A, Bach TJ, et al. The potential of the mevalonate pathway for enhanced isoprenoid production. Biotechnol Adv, 2016, 34(5): 697–713.
[44] Kato S, Takaichi S, Ishikawa T, et al. Identification and functional analysis of the geranylgeranyl pyrophosphate synthase gene () and phytoene synthase gene () for carotenoid biosynthesis in. BMC Plant Biol, 2016, 16: 4.
[45] Yoon SH, Kim JE, Lee SH, et al. Engineering the lycopene synthetic pathway inby comparison of the carotenoid genes ofand. Appl Microbiol Biotechnol, 2007, 74(1): 131–139.
[46] Dai GP, Sun T, Miao LT, et al. Modulating expression of key genes within β-carotene synthetic pathway in recombinantwith RBS library to improve β-carotene production. Chin J Biotech, 2014, 30(8): 1193–1203 (in Chinese). 戴冠苹, 孙涛, 苗良田, 等. RBS文库调控重组大肠杆菌β-胡萝卜素合成途径关键基因提高β-胡萝卜素合成能力. 生物工程学报, 2014, 30(8): 1193–1203.
[47] Jeschek M, Gerngross D, Panke S. Rationally reduced libraries for combinatorial pathway optimization minimizing experimental effort. Nat Commun, 2016, 7: 11163.
[48] Zanghellini A.computational enzyme design. Curr Opin Biotechnol, 2014, 29: 132–138.
[49] Damborsky J, Brezovsky J. Computational tools for designing and engineering enzymes. Curr Opin Chem Biol, 2014, 19: 8–16.
[50] Keasling JD. Synthetic biology and the development of tools for metabolic engineering. Metab Eng, 2012, 14(3): 189–195.
[51] Schaub P, Yu QJ, Gemmecker S, et al. On the structure and function of the phytoene desaturase CRTI from, a membrane-peripheraland FAD-dependent oxidase/isomerase. PLoS ONE, 2012, 7(6): e39550.
[52] Wang HH, Isaacs FJ, Carr PA, et al. Programming cells by multiplex genome engineering and accelerated evolution. Nature, 2009, 460(7257): 894–898.
[53] Keseler IM, Collado-Vides J, Santos-Zavaleta A, et al. EcoCyc: a comprehensive database ofbiology. Nucleic Acids Res, 2011, 39(S1): D583–D590.
[54] Ma T, Deng ZX, Liu TG. Microbial production strategies and applications of lycopene and other terpenoids. World J Microbiol Biotechnol, 2016, 32(1): 15.
[55] Ajikumar PK, Xiao WH, Tyo KEJ, et al. Isoprenoid pathway optimization for taxol precursor overproduction in. Science, 2010, 330(6000): 70–74.
[56] Sandmann G. Carotenoids of biotechnological importance//Schrader J, Bohlmann J, Eds. Biotechnology of Isoprenoids. Berlin Heidelberg: Springer, 2015, 148:449-467.
[57] Varela JC, Pereira H, Vila M, et al. Production of carotenoids by microalgae: achievements and challenges. Photosynth Res, 2015, 125(3): 423–436.
[58] Wang CL, Kim JH, Kim SW. Synthetic biology and metabolic engineering for marine carotenoids: new opportunities and future prospects. Mar Drugs, 2014, 12(9): 4810–4832.
[59] Warner JR, Reeder PJ, Karimpour-Fard A, et al. Rapid profiling of a microbial genome using mixtures of barcoded oligonucleotides. Nat Biotechnol, 2010, 28(8): 856–862.
[60] Choi HS, Lee SY, Kim TY, et al.identification of gene amplification targets for improvement of lycopene production. Appl Environ Microbiol, 2010, 76(10): 3097–3105.
[61] Segrè D, Vitkup D, Church GM. Analysis of optimality in natural and perturbed metabolic networks. Proc Natl Acad Sci USA, 2002, 99(23): 15112–15117.
[62] Ranganathan S, Suthers PF, Maranas CD. OptForce: an optimization procedure for identifying all genetic manipulations leading to targeted overproductions. PLoS Comuput Biol, 2010, 6(4): e1000744.
[63] Burgard AP, Pharkya P, Maranas CD. OptKnock: a bilevel programming framework for identifying gene knockout strategies for microbial strain optimization. Biotechnol Bioeng, 2003, 84(6): 647–657.
[64] Gaspar P, Carvalho AL, Vinga S, et al. From physiology to systems metabolic engineering for the production of biochemicals by lactic acid bacteria. Biotechnol Adv, 2013, 31(6): 764–788.
[65] Li MZ, Elledge SJ. Harnessing homologous recombinationto generate recombinant DNASLIC. Nat Methods, 2007, 4(3): 251–256.
[66] Chen YY, Shen HJ, Cui YY, et al. Chromosomal evolution offor the efficient production of lycopene. BMC Biotechnol, 2013, 13: 6.
[67] Vick JE, Johnson ET, Choudhary S, et al. Optimized compatible set of BioBrick™ vectors for metabolic pathway engineering. Appl Microbiol Biotechnol, 2011, 92(6): 1275–1286.
[68] Gibson DG, Young L, Chuang RY, et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods, 2009, 6(5): 343–345.
[69] Wingler LM, Cornish VW. Reiterative recombination for theassembly of libraries of multigene pathways. Proc Natl Acad Sci USA, 2011, 108(37): 15135–15140.
[70] Dueber JE, Wu GC, Malmirchegini GR, et al. Synthetic protein scaffolds provide modular control over metabolic flux. Nat Biotechnol, 2009, 27(8): 753–759.
[71] Ye VM, Bhatia SK. Pathway engineering strategies for production of beneficial carotenoids in microbial hosts. Biotechnol Lett, 2012, 34(8): 1405–1414.
[72] Chandrasekaran S, Price ND. Probabilistic integrative modeling of genome-scale metabolic and regulatory networks inand. Proc Natl Acad Sci USA, 2010, 107(41): 17845–17850.
[73] Yang L, Cluett WR, Mahadevan R. EMILiO: a fast algorithm for genome-scale strain design. Metab Eng, 2011, 13(3): 272–281.
(本文责编 郝丽芳)
Progress in metabolic engineering of β-carotene synthesis
Yanyan Wang1, Jianmin Xing2, and Hongge Chen1
1,,450002,,2,,,100190,
β-carotene is an important natural plant pigment and has various physiological functions in organisms. With the proposition of systematic biology and progress in carotenoids biosynthesis since the 1960s, metabolic engineering has played a significant role in enhancing carotenoid production. In this review, we present β-carotene’s traditional production methods and metabolic engineering strategies for constructing β-carotene-producing strains. Meanwhile, main problems and corresponding solutions to improve β-carotene yield of engineered strains were further analyzed, for further efficient microbial production of β-carotene.
β-carotene, precursor, synthesis pathways, systems metabolic engineering
September 23, 2016; Accepted: December 23, 2016
Hongge Chen. Tel: +86-371-63555790; E-mail: honggeyz@163.com

