纳米银对小麦赤霉病菌的抑制
李琴琴,赵英虎,高莉,侯倩倩,王芳,贾万利,王英勇
纳米银对小麦赤霉病菌的抑制
李琴琴1,赵英虎1,高莉1,侯倩倩1,王芳1,贾万利1,王英勇2
1 中北大学化工与环境学院,山西太原 030051 2 中国科学院山西煤炭化学研究所煤转化国家重点实验室,山西太原 030001
采用化学还原法制备纳米银,以小麦赤霉病菌为受试菌株,研究纳米银对小麦赤霉病菌抗菌活性、对细胞内3种保护酶:超氧化物歧化酶 (SOD)、过氧化物酶 (POD)、过氧化氢酶 (CAT) 活性和对细胞渗透调节物质:丙二醛 (MDA)、可溶性蛋白、可溶性糖含量的影响。结果表明:纳米银能显著抑制小麦赤霉病菌的生长,抑制作用随着浓度的增加而不断增大,10μg/mL的纳米银对病原菌的抑制率达90%以上,有效中浓度 (50) 为0.59 μg/mL。随着纳米银处理时间 (2、4、6、8和10 h) 的增长,3种酶的活性均出现先增加后降低的变化。SOD、POD和CAT均在4 h出现最高值,10 h降至最低。纳米银使得菌体内丙二醛含量增加,可溶性蛋白和可溶性糖含量降低。纳米银破坏了病原真菌体内细胞的完整性,这可能是纳米银抑制病原菌生长的机理之一。
纳米银,小麦赤霉病菌,抗真菌活性,抑菌机理
小麦赤霉病,是由禾谷镰孢菌引起的病害,主要发生在亚洲地区,是小麦生产的重要病害之一[1-2]。小麦感染赤霉病后,会产生单端孢霉烯真菌毒素,从而导致小麦减产以及品质下降,不适合人类和动物的食用[3-4]。中国作为世界小麦生产大国,小麦赤霉病发生频率非常高,受小麦赤霉病的影响也很大[5]。纳米银是一种无机抗菌材料,有研究表明,纳米银对细菌、真菌及支原体等致病微生物的生长具有抑制作用,对某些病毒和原生动物也具有很强的杀伤力,同时不产生耐药性,可以作为一种长效且安全性高的抑菌剂[6-9]。Mishra和Singh[10]研究了纳米银对小麦根腐病菌的抗真菌活性,结果表明纳米银能显著抑制的菌丝生长。0.05 mg/mL的纳米银能明显抑制菌丝生长,0.1 mg/mL的纳米银能完全抑制病原体。Muthuramalingam等[11]研究了胆汁盐修饰的纳米银对炭疽病有很好的抑制效果。此外,纳米银还能够抑制黄瓜和南瓜白粉病 菌[12]、番茄丁香假单胞菌[13]、草莓灰霉病菌[14]、黑曲霉、温特曲霉[15]等病原菌。尽管大量的实验表明,纳米银对细菌和真菌均具有显著的抑制作用,但是纳米银对真菌具体的杀菌过程及机理还不是十分清楚。
生物体内3种重要的保护酶:超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT) 和过氧化物酶 (POD),可以防止体内活性氧的产生,清除超氧自由基、H2O2和过氧化物以及降低或抵制羟基自由基的生成等[16-18]。尹大川等[19]研究了木霉菌株T43及其抑菌活性物质对4种林木病原菌的3种保护酶 (CAT、POD、SOD) 活性的影响,结果发现,菌株T43发酵液乙酸乙酯提取物对病原菌3种保护酶活性均有不同程度的影响,可导致病原菌3种保护酶活性降低,尤其是SOD活性下降得最为显著,从而破坏了细胞的完整性。
可溶性蛋白和可溶性糖作为肌体内的渗透调节物质,当肌体受到外界压迫时,能够降低这种伤害。研究表明,可溶性蛋白和可溶性糖的变化可以反映细胞内蛋白质的合成、变性及降解等[19]。丙二醛 (MDA) 含量变化可以反映膜结构的破坏程度,是反映细胞膜脂质过氧化程度的重要指标[16]。
因此,本试验利用化学还原法制备纳米银,研究纳米银对小麦赤霉病菌的抗菌活性以及对菌体内SOD、POD、CAT三种酶活性和对丙二醛、可溶性蛋白、可溶性糖含量的影响,以此来探讨纳米银的抑菌机理,为纳米银抑菌应用提供理论依据,为解决病原真菌入侵性感染和防治植物真菌病害提供参考。
1 材料与方法
1.1 供试菌株
供试菌株:小麦赤霉病菌,由中北大学微生物实验室提供。
1.2 纳米银的制备
首先将10 mL、0.02 mol/L硝酸银 (AgNO3) 溶液和10 mL、3%聚乙烯吡咯烷酮 (PVP) 溶液混合,然后将该混合液搅拌2 h (室温),最后在搅拌的同时,逐滴滴加10 mL、0.01%硼氢化钠 (NaBH4) 溶液,制备纳米银溶胶。纳米银溶胶经过离心、去离子水和无水乙醇洗涤数遍、真空干燥得到纳米银粉末。在NaBH4溶液的滴加过程中,反应溶液逐渐变为亮黄色,说明纳米银的形成[20]。采用紫外可见分光光度计表征纳米银溶液的UV-vis吸收光谱,进一步利用透射电子显微镜 (TEM) 表征纳米银的粒径。
1.3 纳米银的抗菌活性
利用生长速率法[21]测定纳米银的抑菌活性。具体方法如下:用马铃薯葡萄糖(PDA)培养基将纳米银稀释成终浓度为10、5、2.5、1.25 μg/mL。取培养5 d的5 mm直径的菌饼,将其轻放于含上述已配制好的不同浓度纳米银的培养基平板中 (有菌丝的一面朝下)。以不添加任何物质的PDA平板作为空白对照,放入28 ℃培养箱中培养,每个处理重复3次。3 d后用十字交叉法测量病原菌的直径,计算菌丝生长抑制率、纳米银浓度的毒力回归方程以及50。
1.4 供试菌的处理
用打孔器取培养5 d、直径5 mm的菌饼,接种到PDA液体培养基中,静置培养8 d,将菌丝体用蒸馏水洗涤3次,用吸水纸吸干,准确称取菌丝0.5 g,分别放入20 mL、10 μg/mL纳米银溶液浸泡2、4、6、8、10 h,过滤菌丝体,用蒸馏水洗涤3次[22]。实验重复3次,测定纳米银对小麦赤霉病菌保护酶活性、MDA含量、可溶性蛋白含量和可溶性糖含量的影响,其中用DDS-11A型电导仪测定电导率,实验以蒸馏水作为对照。
1.5 酶活性测定
SOD酶液制备:往已处理过的菌丝体中加入5 mL、0.05 mol/L磷酸缓冲液 (pH 7.8,含有1% PVP,0.5 mmol/L巯基乙醇和0.1 mmol/LEDTA),冰浴研磨,于4 ℃、10 000 r/min冷冻离心15 min,得到上清液,置于4 ℃冰箱保存。SOD酶活性采用氮蓝四唑法[23]测定。
POD和CAT酶液的制备:往已处理过的菌丝体中加入5 mL、0.05 mol/L的磷酸缓冲液 (pH 7.0,含0.1 mmol/LEDTA),冰浴研磨,4 ℃、10 000 r/min冷冻离心15 min,得到上清液,置于4 ℃冰箱保存。POD酶活性利用愈创木酚法[23]测定。CAT酶活性采用紫外吸收法[24]测定。
1.6 丙二醛 (MDA) 含量的测定
采用硫代巴比妥酸比色法测定小麦赤霉病菌中MDA含量[23]。
1.7 可溶性蛋白含量的测定
可溶性蛋白提取:在1 g已处理过的菌丝体中加10 mL蒸馏水研磨,所得匀浆于12 000 r/min离心15 min,得上清液,定容至10 mL,得粗提液。可溶性蛋白含量采用考马斯亮蓝G-250法测定[23]。
1.8 可溶性糖含量的测定
可溶性糖提取:在1 g已处理过的菌丝体中加入10 mL蒸馏水,沸水浴20 min,冷却过滤定容至25 mL容量瓶中,得粗提液。可溶性糖含量采用蒽酮比色法测定[23]。
1.9 数据处理与分析
采用SPSS 22.0和OriginProPorable 8.5软件进行数据处理和分析。
2 结果与分析
2.1 纳米银的制备与表征
利用化学还原法制备纳米银,纳米银溶液颜色呈亮黄色。纳米银在400 nm左右出现了很强的吸收峰 (图1A),这是典型的10−20 nm纳米银的紫外特征吸收峰[25-26]。进一步通过TEM表征,纳米银为类似球形、粒径为5−30 nm的颗粒 (图1B)。
2.2 纳米银的抑菌活性
纳米银对小麦赤霉病菌的抑制效果见表1。结果表明,纳米银能抑制病原真菌的生长,抑制率随着浓度的增加而增大。其中,10 μg/mL的纳米银对小麦赤霉病菌抑制率高达93.9%,说明病原真菌对纳米银的敏感性很强。对各处理间的不同浓度进行方差分析和Duncan检验,结果表明,病原真菌的各处理间差异达到极显著水平 (<0.01)。
纳米银对病原真菌的毒力回归方程为=1.256+5.289 2,50为0.59 μg/mL,2为0.975 5。可见,纳米银对小麦赤霉病菌的抑制作用比较强。病原真菌的毒力回归方程的相关系数2大于0.9,说明其曲线与实际拟合程度相当好。
2.3 纳米银对菌体内保护酶活性的影响
2.3.1 纳米银处理时间对超氧化物歧化酶 (SOD)活性的影响:随着纳米银处理时间的延长,SOD酶活出现先升高后下降的变化趋势。SOD酶活从2 h开始迅速上升,4 h的酶活达到最大,是对照组的5.20倍,随着时间的推移,活性开始下降,10 h的酶活最低,为对照组的63.12% (图2)。方差分析表明,SOD酶活性对纳米银相对敏感,随着处理时间的不同,受纳米银的影响存在着显著性差异。
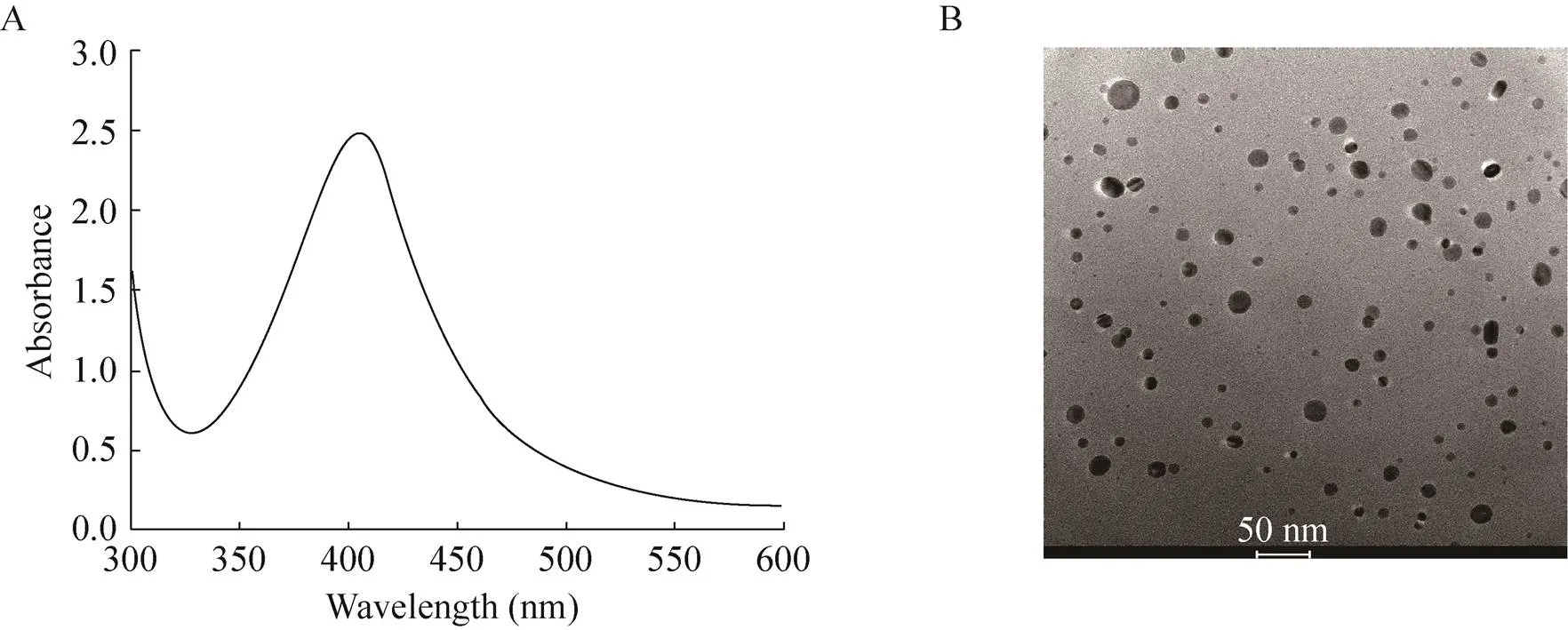
图1 纳米银粒子的UV-vis吸收光谱图 (A) 及TEM图 (B)
Values in each column with different lowercase letter are significantly different in inhibition rate (<0.05), values in each column with different capital letter are extremely significantly different in inhibition rate (<0.01).
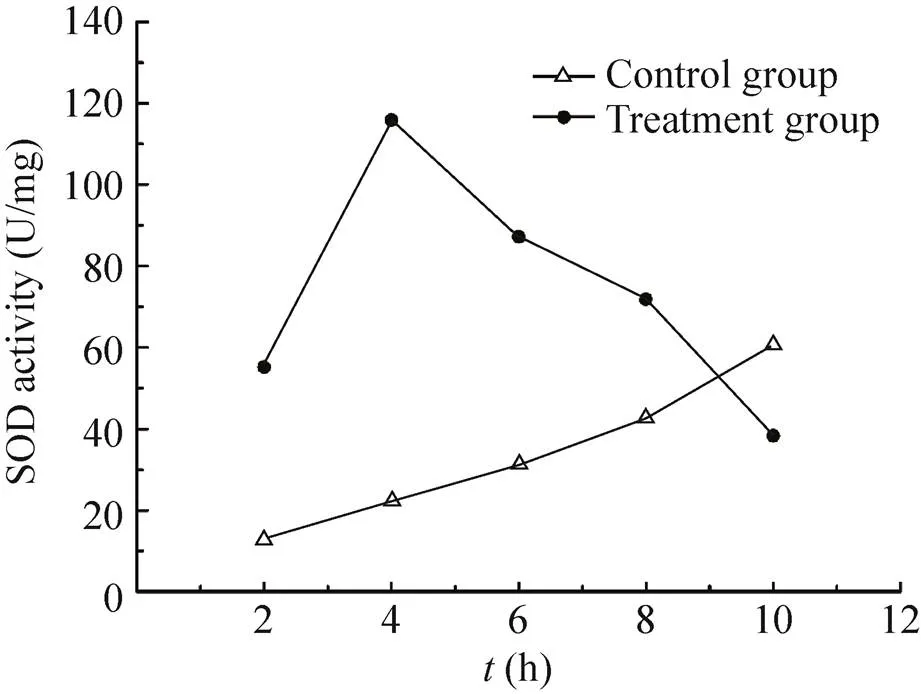
图2 纳米银处理时间对SOD活性的影响
2.3.2 纳米银处理时间对过氧化物酶 (POD) 活性的影响:POD对照组活性与SOD对照组表现出相似的变化情况,随着处理时间的增加不断升高。处理组的POD活性随着时间的延长同样呈现先升高后下降的趋势,在4 h达到最大值,为对照组的1.05倍,与SOD活性最高值出现在4 h相同,在10 h达到最小值,为对照组的14.85% (图3)。2、4、6、8、10 h各处理组POD活性相比差异显著。
2.3.3 纳米银处理时间对过氧化氢酶 (CAT) 活性的影响:对照组CAT酶活在试验时间内,呈上升趋势,纳米银对小麦赤霉病菌的CAT酶活性出现先升高后下降的变化,与SOD、POD活性呈现出相似的变化趋势,4 h的CAT酶活出现最大值,处理组的CAT活性一直低于对照组 (图4)。与其他处理时间的活性相比差异显著。
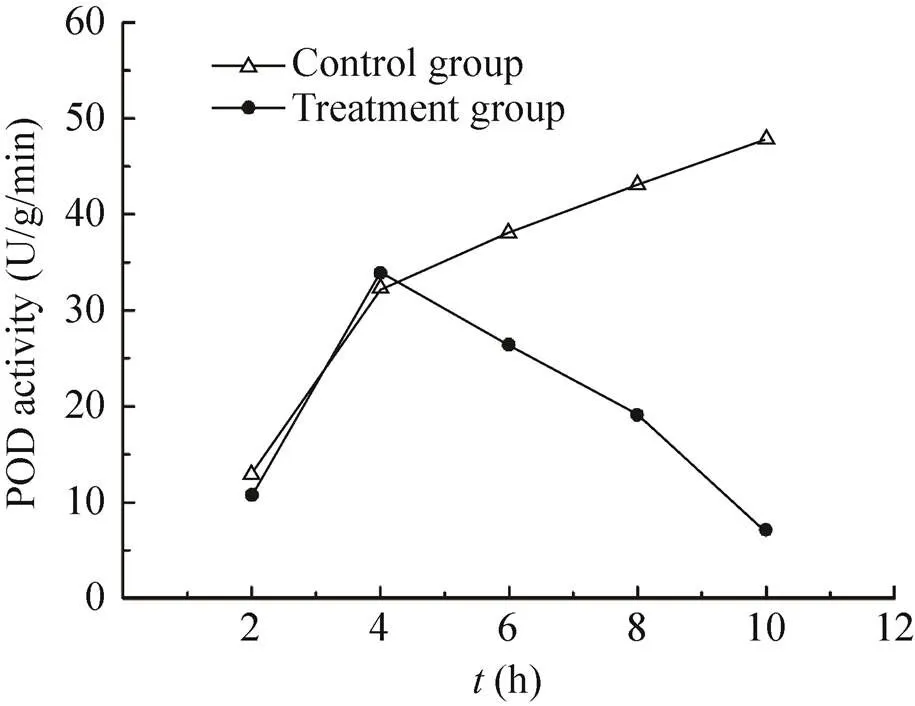
图3 纳米银处理时间对POD活性的影响
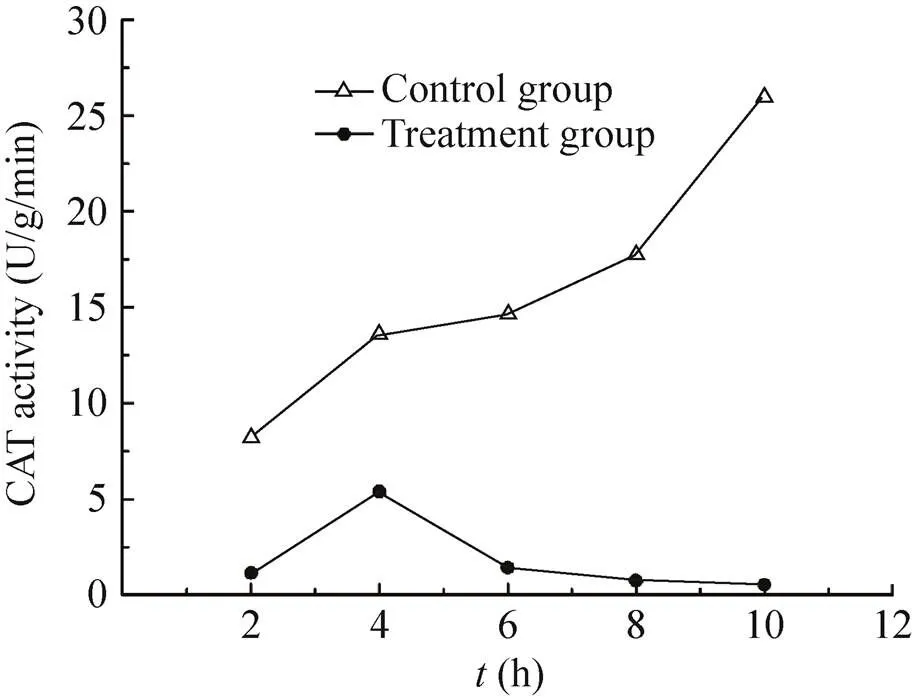
图4 纳米银处理时间对CAT活性的影响
2.4 纳米银对菌体内MDA含量的影响
处理组MDA含量呈现先升高后降低的趋势,在6 h时,迅速上升至最高值1.40 nmol/g,为对照组的2.41倍,6 h后开始出现下降趋势,10 h降至最低,为对照组的1.05倍。对照组在2−10 h,呈现平缓的上升趋势,10 h出现最大值,但始终低于处理组 (图5)。
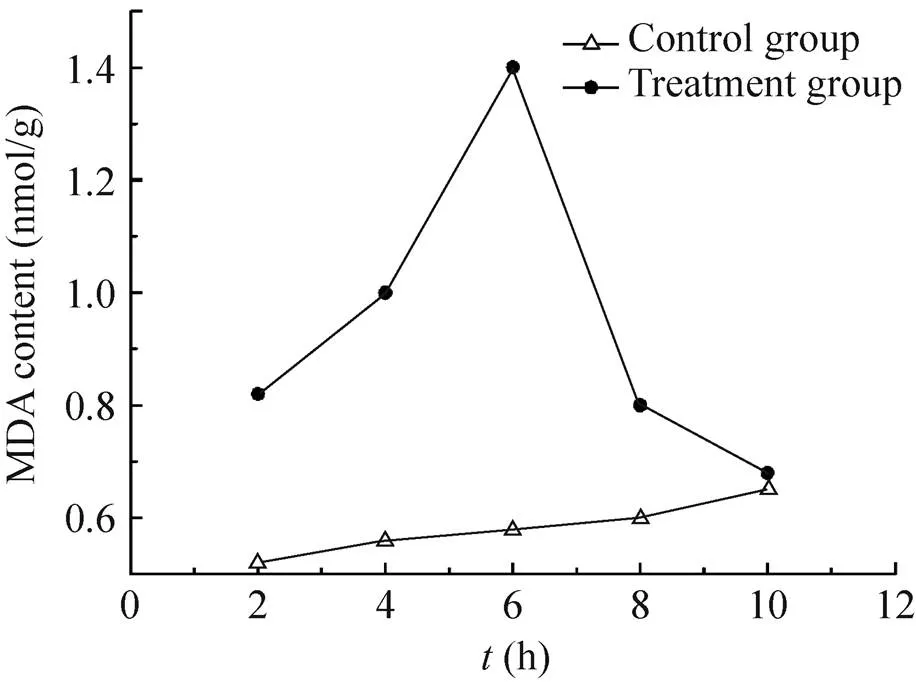
图5 纳米银处理时间对MDA含量的影响
2.5 纳米银对菌体内电导率的影响
随着处理时间的推移,纳米银处理后的小麦赤霉病菌溶液的导电率2−6 h之内呈现上升趋势,6 h出现最大值,为对照组的1.09倍,6 h之后,导电率开始下降,10 h出现最小值,为对照组的98.89%。细胞膜一旦受到破坏,膜透性就会增大,从而使细胞内的电解质外渗。上述结果说明,经纳米银处理后,小麦赤霉病菌的细胞膜受到破坏,随着处理时间的增长,菌体膜的完整性丧失,电解质出现外渗,电导率最终出现下降的现象 (图6)。
2.6 纳米银对菌体内可溶性蛋白含量的影响
纳米银处理组和对照组的可溶性蛋白含量均呈现降低的趋势。处理组蛋白含量随着时间的延长不断降低,在10 h出现最低值,为1.27 mg/g,是对照组的56.69%。对照组蛋白含量在开始时也出现降低的情况,但始终高于处理组,且降低速率低于处理组 (图7)。
2.7 纳米银对菌体内可溶性糖含量的影响
纳米银各处理组和对照组的可溶性糖含量及可溶性蛋白含量呈现同样的降低现象。处理组糖含量随着时间的增加不断降低,6 h到10 h下降缓慢,在10 h出现最低值,为0.40 mg/g,是对照组的92%。对照组在整个实验过程中与处理组趋势接近,但含量始终高于处理组 (图8)。
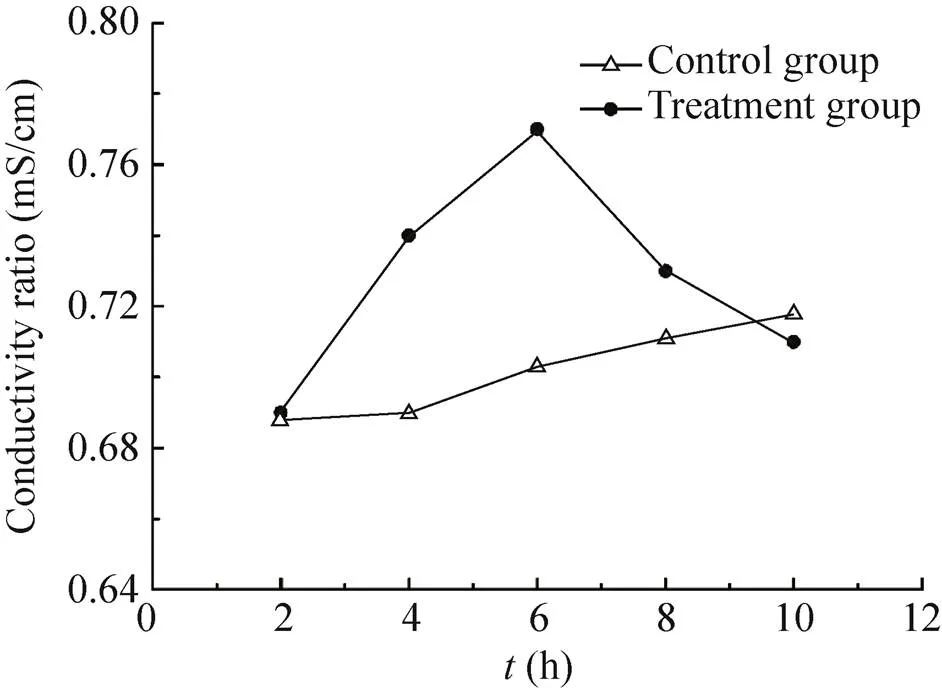
图6 纳米银处理时间对电导率含量的影响
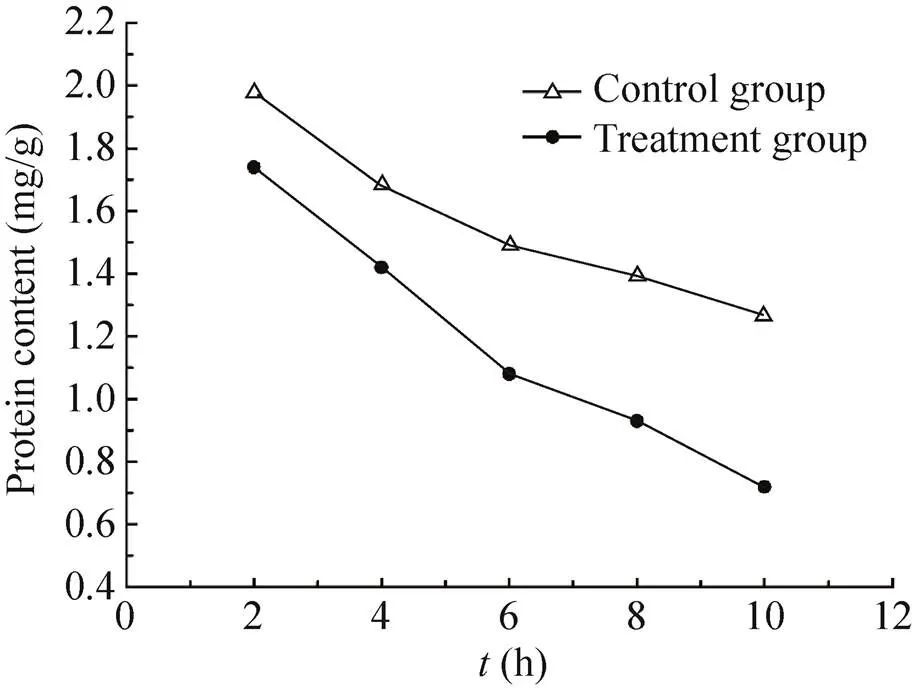
图7 纳米银处理时间对蛋白含量的影响
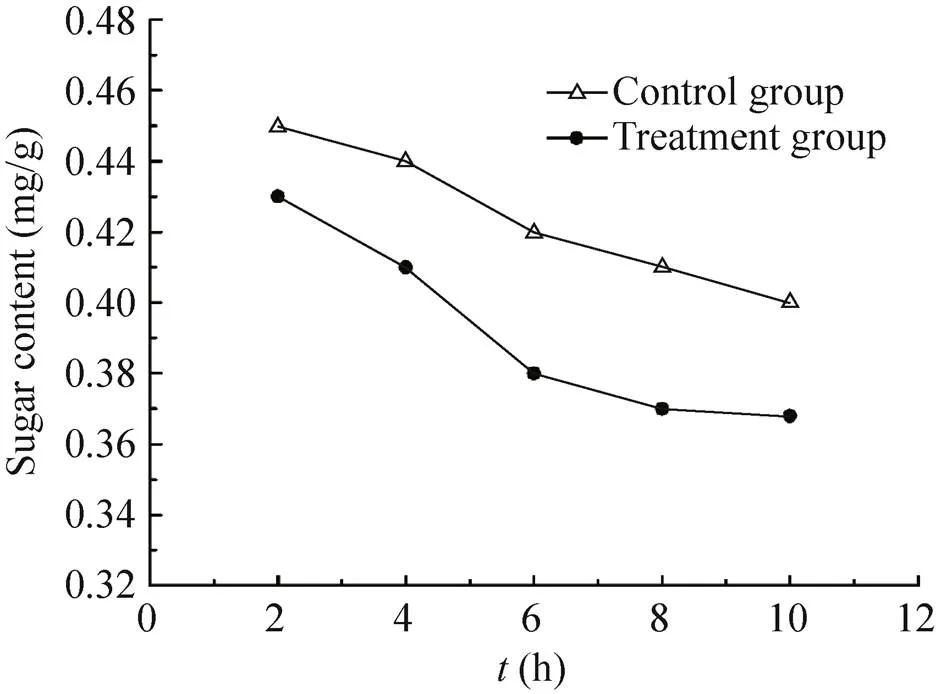
图8 纳米银处理时间对糖含量的影响
3 讨论
纳米银能显著抑制小麦赤霉病菌的生长,50为0.59 μg/mL。纳米银的抑制作用与其浓度成正比,随着浓度的增大而增大。10 μg/mL纳米银的抑菌率达到93.9%。Zhao等[27]合成了一种新型的10-Hydroxycanthin-6-one抗菌剂,表明其对小麦赤霉病菌有很强的抑制活性,50 μg/mL的10-Hydroxycanthin-6-one酯类衍生物7s (10-hydroxycanthin-6-one R=CH3CH3) 化合物能完全抑制病原菌的生长,10-meoxycanthin-6-one、10-Hydroxycanthin-6-one 酯类衍生物7s (10-Hydroxycanthin-6-one R=CH3) 和7t (10- Hydroxycanthin-6-one R=CH3CH2) 化合物的最小抑菌浓度在3.91 μg/mL到31.25 μg/mL之间。陆云等[28]研究了4种杀菌剂 (氟环唑、己唑醇、甲基硫菌灵和南宁霉素毒立) 对小麦赤霉病菌的抑制作用,发现氟环唑和己唑醇对病原真菌的抑制效果最好,其50分别是0.201 5 μg/mL和0.235 6 μg/mL;其次是甲基硫菌灵,50是5.115 7 μg/mL;南宁霉素毒力最弱,其50是389.313 24 μg/mL。因此,纳米银较一些杀菌剂有相当或更好的抑菌效果,有望成为一种新型纳米杀菌剂。
纳米银处理小麦赤霉病菌2−10 h,菌体内SOD、POD和CAT的活性随着处理时间的延长均呈现先上升后下降的趋势,在4 h达到最高值。结果表明,纳米银在抑菌过程中,影响了菌体内3种酶的活性。原因可能是随着胁迫程度的增强,氧自由基不断积累,为了适应环境,增强本身对胁迫的抵御能力,菌体的酶促系统中SOD、POD、CAT等活性也会相应发生变化,这是正常生理性抗逆反应。然而菌体细胞在抵御过程中受到了破坏,所以酶的活性出现下降,细胞濒临死亡,从而造成菌体的生长受到抑制。通过研究纳米银对3种保护酶活性的影响,得出破坏病原菌的膜保护系统是纳米银抑菌的机制之一。
有研究认为,正常情况下细胞中SOD、POD和CAT 3种保护酶协调一致,可以防止过多自由基造成的细胞毒害,一旦细胞内自由基所处动态平衡被破坏,细胞就有可能受到损伤[18]。当细胞受到外界刺激时,SOD能够嵌入到线粒体基质中,防止细胞中产生过量的活性氧[29]。CAT能够防止体内过多H2O2的产生,降低细胞发生氧化的可能性。POD能催化其他物质的同时,将H2O2还原为H2O。SOD、POD和CAT作为生物体内重要的抗氧化酶类,能够降低对细胞膜起损伤作用的活性氧自由基,防止细胞受到破 坏[30-31]。由此可知,当病原真菌受到纳米银的刺激时,会产生一系列的防御反应,当细胞内活性氧的生成能力超过其清除能力,导致3种保护酶的活性出现暂时升高的现象,但因活性氧自由基的不断增多,导致细胞受到破坏,进一步抑制菌体的生长,使3种酶的活力开始逐渐下降。高橼等[32]研究了月腺大戟根总黄酮对尖孢镰刀菌3种酶活性的影响,发现了同样的变化趋势。魏立强等[33]研究了旱芹粗提物对棉花枯萎病菌保护酶活性的影响,结果表明,随着纳米银处理时间的增加,菌体内的SOD、POD和CAT活性同样出现先上升后下降的变化趋势。因此,病原真菌体内3种保护酶系统的活性被破坏,损害活性氧自由基清除系统,导致细胞膜系统的完整性严重损伤,从而使菌体受到一定程度的破坏。
小麦赤霉病菌经纳米银处理后,病原菌的可溶性蛋白和糖含量降低,病原菌MDA含量和电导率出现先升高后下降的趋势。计红芳等[34]研究绒白乳菇发酵液提取物对杨树叶枯病菌MDA含量的影响,发现同样的变化趋势。随着纳米银处理时间的增加,小麦赤霉病菌细胞膜受到破坏,蛋白质的结构出现水解和变性,膜结构的破坏,使得MDA不断积累,从而出现升高趋势,电导率由于电解质外渗,同样出现升高的现象。电导率升高,表明菌丝体浸出液压力增加,可能是浸出液中存在渗漏的内含物,而渗漏是由于菌丝细胞膜透性遭到了破坏。随着菌体脂质过氧化程度的加剧,细胞膜的完整性丧失,进一步使得MDA和电导率出现下降趋势。纳米银可以显著抑制病原菌的活性,说明该物质可以严重破坏病原菌的抗氧化系统,使得蛋白质和糖类水解,进而使细胞膜系统受到损伤,细胞渗透性加强,最终导致细胞死亡。通过研究纳米银对小麦赤霉病菌保护酶活性的影响,为纳米银抗真菌机理以及抑菌应用提供理论依据,为防治植物真菌病害提供参考。为了进一步了解纳米银对真菌的抑菌机理,仍需要进行分子水平上的研究。
4 结论
纳米银能显著抑制小麦赤霉病菌的生长,抑制作用随着浓度的增加而不断增大,10 μg/mL的纳米银对病原菌的抑制率达90%以上,50为0.59 μg/mL。
随着纳米银处理时间的增长,3种酶的活性均出现先增加后降低的变化。SOD、POD、CAT均在4 h出现最高值,10 h降至最低。纳米银提高菌体内丙二醛含量,降低可溶性蛋白和可溶性糖含量。
REFERENCES
[1] O’Donnell K, Ward TJ, Aberra D, et al. Multilocus genotyping and molecular phylogenetics resolve a novel head blight pathogen within thespecies complex from Ethiopia. Fungal Genet Biol, 2008, 45(11): 1514–1522.
[2] Dong F, Qiu JB, Xu JH, et al. Effect of environmental factors onpopulation and associated trichothecenes in wheat grain grown in Jiangsu province, China. Int J Food Microbiol, 2016, 230: 58–63.
[3] Liu YJ, Guo YL, Ma CY, et al. Transcriptome analysis of maize resistance to. BMC Genomics, 2016, 17: 477.
[4] Lionetti V, Giancaspro A, Fabri E, et al. Cell wall traits as potential resources to improve resistance of durum wheat against. BMC Plant Biol, 2015, 15: 6.
[5] Yang JZ, Wang JS, Gong GS, et al. Effect of differenton yield and its important components of wheat. J Henan Agric Sci, 2010, (9): 91–95 (in Chinese). 杨继芝, 王继师, 龚国淑, 等. 不同禾谷镰刀菌对小麦产量及其主要性状的影响. 河南农业科学, 2010, (9): 91–95.
[6] Rajeshkumar S, Malarkodi C, Vanaja M, et al. Anticancer and enhanced antimicrobial activity of biosynthesizd silver nanoparticles against clinical pathogens. J Mol Struct, 2016, 1116: 165–173.
[7] Anisha BS, Biswas R, Chennazhi KP, et al. Chitosan-hyaluronic acid/nano silver composite sponges for drug resistant bacteria infected diabetic wounds. Int J Biol Macromol, 2013, 62: 310–320.
[8] Mishra S, Singh BR, Singh A, et al. Biofabricated silver nanoparticles act as a strong fungicide againstcausing spot blotch disease in wheat. PLoS ONE, 2014, 9(5): e97881.
[9] Sun RWY, Chen R, Chung NPY, et al. Silver nanoparticles fabricated in Hepes buffer exhibit cytoprotective activities toward HIV-1 infected cells. Chem Commun, 2005, (40): 5059–5061.
[10] Mishra S, Singh HB. Silver nanoparticles mediated altered gene expression of melanin biosynthesis genes in. Microbiol Res, 2015, 172: 16–18.
[11] Muthuramalingam TR, Shanmugam C, Gunasekaran D, et al. Bioactive bile salt-capped silver nanoparticles activity against destructive plant pathogenic fungi throughsystem. RSC Adv, 2015, 5(87): 71174–71182.
[12] Lamsal K, Kim SW, Jung JH, et al. Inhibition effects of silver nanoparticles against powdery mildews on cucumber and pumpkin. Mycobiology, 2011, 39(1): 26–32.
[13] Chu H, Kim HJ, Kim JS, et al. A nanosized Ag-silica hybrid complex prepared by γ-irradiation activates the defense response in. Radiat Phys Chem, 2012, 81(2): 180–184.
[14] Moussa SH, Tayel AA, Alsohim AS, et al. Botryticidal activity of nanosized silver-chitosan composite and its application for the control of gray mold in strawberry. J Food Sci, 2013, 78(10): M1589–M1594.
[15] Roy K, Sarkar CK, Ghosh CK. Apium graveolens leaf extract-mediated synthesis of silver nanoparticles and its activity on pathogenic fungi. Dig J Nanomater Bios, 2015, 10(2): 393–400.
[16] Devlin WS, Gustine DL. Involvement of the oxidative burst in phytoalexin accumulation and the hypersensitive reaction. Plant Physiol, 1992, 100(3): 1189–1195.
[17] Rinna A, Magdolenova Z, Hudecova A, et al. Effect of silver nanoparticles on mitogen-activated protein kinases activation: role of reactive oxygen species and implication in DNA damage. Mutagenesis, 2015, 30(1): 59–66.
[18] Chen XJ, Zhang H, Xu JY, et al. Cell wall degrading enzymes produced byand their pathogenicity to rice plants. Jiangsu J Agric Sci, 2006, 22(1): 24–28 (in Chinese). 陈夕军, 张红, 徐敬友, 等. 水稻纹枯病菌胞壁降解酶的产生及致病作用. 江苏农业学报, 2006, 22(1): 24–28.
[19] Yin DC, Deng X, Chet I, et al. Inhibiting effect and mechanism ofT43 on four major species of forest pathogen. Chin J Ecol, 2014, 33(7): 1911–1919 (in Chinese). 尹大川, 邓勋, Chet I, 等. 绿木霉() T43对四种重要林木病原菌的抑制效果及抑菌机理. 生态学杂志, 2014, 33(7): 1911–1919.
[20] Li JM. Preparation and catalytic activity of silver nanoparticles. J Ceramics, 2011, 32(3): 453–456 (in Chinese). 李菊梅. 纳米银粒子的制备及其催化性能的研究.陶瓷学报, 2011, 32(3): 453–456.
[21] Jin QD, Li FB, Li Y, et al. Synthesis and antifungal activity of novel α-alkoxyimino- (1-benzoimidazol- 2-yl) acetonitriles containing piperazine moiety. Res Chem Intermed, 2015, 41(10): 7695–7702.
[22] Sun DM, Lin ZW, Chi L, et al. Restrain ability of nanomenter silver on soybean. Soyb Sci, 2010, 29(4): 673–676 (in Chinese). 孙冬梅, 林志伟, 迟莉, 等. 纳米银对大豆菌核病核盘菌的抑制作用研究. 大豆科学, 2010, 29(4): 673–676.
[23] Li HS. Principles and Techniques of Plant Physiological Biochemical Experiment. Beijing: Higher Education Press, 2000: 164–169 (in Chinese). 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 164–169.
[24] Gao JF. Experimental Guidance for Plant Physiology. Beijing: Higher Education Press, 2006: 214–215 (in Chinese). 高俊凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006: 214–215.
[25] Mulfinger L, Solomon SD, Bahadory M, et al. Synthesis and study of silver nanoparticles. J Chem Educ, 2007, 84(2): 322.
[26] Mayer ABR, Grebner W, Wannemacher R. Preparation of silver-latex composites. J Phys Chem B, 2000, 104(31): 7278–7285.
[27] Zhao F, Dai JK, Liu D, et al. Synthesis and evaluation of ester derivatives of 10-hydroxycanthin- 6-one as potential antimicrobial agents. Molecules, 2016, 21(3): 390.
[28] Lu Y, Nie XP, Yao AQ. Toxicity determination of four kinds of fungicides on wheat scab virulence. J Yangtze Univ: Nat Sci Edit, 2013, 10(5): 22–23 (in Chinese). 陆云, 聂晓培, 姚安庆. 4种杀菌剂对小麦赤霉病菌的室内毒力测定. 长江大学学报: 自然科学版, 2013, 10(5): 22–23.
[29] Oberley LW, Clair DST, Autor AP, et al. Increase in manganese superoxide dismutase activity in the mouse heart after X-irradiation. Arch Biochem Biophys, 1987, 254(1): 69–80.
[30] Wang JL, Qiu YX, Chen HW, et al. Inhibitive action of tea-polyphenol on some plant pathogenic Fungi. Nat Prod Res Dev, 2008, 20(4): 690–694 (in Chinese). 汪金莲, 邱业先, 陈宏伟, 等. 茶多酚对几种植物病原真菌的抑制作用及机理研究. 天然产物研究与开发, 2008, 20(4): 690–694.
[31] Çay S, Köse M, Tümer F, et al. SOD activity and DNA binding properties of a new symmetric porphyrin Schiff base ligand and its metal complexes. Spectrochim Acta A Mol Biomol Spectrosc, 2015, 151: 821–838.
[32] Gao Y, Wan SL, Cai YP, et al. The inhibitory effects of total flavones extracted from the roots ofhayata. on. Acta Laser Biol Sin, 2008, 17(2): 213–219 (in Chinese). 高橼, 万赛罗, 蔡永萍, 等. 月腺大戟根总黄酮对尖孢镰刀菌抑制作用的研究. 激光生物学报, 2008, 17(2): 213–219.
[33] Wei LQ, Xie HQ, Yang DS, et al. Effects ofextracts on the content of MDA, conductivity ratio and activity of protective enzymes inf. sp.. Plant Protect, 2012, 38(3): 28–31 (in Chinese). 魏立强, 谢慧琴, 杨德松, 等. 旱芹粗提物对棉花枯萎病菌丙二醛含量、电导率及保护酶活性的影响. 植物保护, 2012, 38(3): 28–31.
[34] Ji HF, Song RQ, Yang Q. Effects of extraction fromfermenting liquor on the activity of protective enzymes, content of MDA and conductivity ratio in(Fr.) Keissler. J Beijing Fore Univ, 2007, 29(6): 156–160 (in Chinese). 计红芳, 宋瑞清, 杨谦. 绒白乳菇发酵液提取物对杨树叶枯病菌保护酶活性、丙二醛含量及电导率的影响. 北京林业大学学报, 2007, 29(6): 156–160.
(本文责编 陈宏宇)
Inhibition ofby silver nanoparticles
Qinqin Li1, Yinghu Zhao1, Li Gao1, QianqianHou1, Fang Wang1, WanliJia1, and YingyongWang2
1,,030051,,State Key Laboratory of Coal ConversionInstitute of Coal ChemistryChinese Academy of SciencesTaiyuanShanxiChina
Silver nanoparticles were prepared by chemical reduction.was used as the test strain. To study the inhibition ofby silver nanoparticles, we studied the activities of protective enzymes superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT), and the contents of osmotic adjustment substances soluble protein, soluble sugar and malonaldehyde (MDA) in. Silver nanoparticles inhibitedand the inhibitory effect was increased with the concentration of silver nanoparticles. The inhibition rate of 10 μg/mL silver nanoparticles was more than 90% and50was 0.59 μg/mL. When the treating time prolonged (2, 4, 6, 8 and 10 h), the activity of SOD, CAT and POD increased firstly and then declined. SOD, POD and CAT reached the maximum at 4 hours, and decreased to minimum at 10 hours. Silver nanoparticles also increased the MDA content and reduced the soluble sugar and protein contents in pathogens. These results indicated that cell integrity was destroyed in the presence of silver. This may be one of the inhibiting mechanisms of silver nanoparticles on the growth of.
silver nanoparticles,, antifungal activity, inhibiting mechanism
Supported by: Shanxi Provincial Projects for Science and Technology Development (No. 20140311008-7), the Foundation of Shanxi Province Key Laboratory of Functional Nanocomposites, North University of China (No. NFCM201603), Research for Shanxi Natural Science Foundation (Nos. 2012021027-3, 2014021027-3)
山西省科技攻关项目 (No. 20140311008-7),纳米功能复合材料山西省重点实验室开放基金项目 (No. NFCM201603),山西省青年科技研究基金 (Nos. 2012021027-3, 2014021027-3) 资助。
October 10, 2016; Accepted:November 30, 2016
Li Gao. Tel: +86-351-3922297; E-mail: gaoli@nuc.edu.cn
网络出版时间:2017-02-13
http://www.cnki.net/kcms/detail/11.1998.Q.20170213.1455.003.html

