黏细菌漆酶序列筛选及其重组酶酶学性质
赵秀艳,常飞,方泽民,张寅良,肖亚中
黏细菌漆酶序列筛选及其重组酶酶学性质
赵秀艳1,2,常飞1,2,方泽民1,2,张寅良1,2,肖亚中1,2
1 安徽大学生命科学学院,安徽合肥 230601 2 安徽省微生物与生物催化工程技术研究中心,安徽合肥 230601
漆酶是一种应用广泛的绿色环保的多酚氧化酶。漆酶过去被认为广泛存在于植物、昆虫和真菌中,而近年来,越来越多的细菌中也发现了漆酶的存在。黏细菌是一类重要的资源菌,但与一般细菌相比,较难分离和纯化。文中利用生物信息学的方法,综合应用Blast和隐马尔可夫模型方法对黏细菌蛋白质组数据库进行搜索,并根据多铜氧化酶的保守铜离子结合位点进行进一步筛选,获得30个候选黏细菌漆酶序列。挑选其中9个,在大肠杆菌中进行重组表达。利用2,6-甲氧基苯酚 (DMP) 等常用漆酶底物检测重组酶的催化氧化活性,其中7个重组蛋白具有漆酶催化活性。选择1个对2,6-甲氧基苯酚 (DMP) 具有较高氧化活性的重组酶 (命名为rSC-2),通过Ni-NTA亲和层析柱纯化rSC-2,测试其酶学性质。纯化的rSC-2蛋白分子量约57 kDa,在最适反应条件下,rSC-2催化DMP反应的比酶活为0.27 U/mg。催化DMP反应的最适温度为60 ℃,最适pH为7.0。rSC-2在pH 7.0−8.0有较高酶活,在60 ℃孵育1 h保留50%以上剩余酶活。低浓度的Ca2+对酶活有一定的促进作用,而较高浓度的Fe3+、Co2+、Ba2+对酶活的抑制作用较明显。这是首次对黏细菌漆酶序列进行系统性的生物信息学分析,并实现纤维堆囊菌序列来源的漆酶活性蛋白在大肠杆菌细胞中重组表达。
生物信息学,黏细菌漆酶,重组表达,分离纯化,酶学性质
漆酶 (Laccase) 是一种含铜的多酚氧化酶,属于多铜氧化酶家族,能催化多种酚类及非酚类化合物氧化,在工业染料脱色、新型药物合成、生物传感器研制和食品饮料加工等领域具有潜在应用价值[1-3]。漆酶最初在漆树的汁液中被发现,现在认为其广泛分布于植物、 动物、特别是真菌中。1993年,Givaudan等[4]从植物根际细菌生脂固氮螺菌中首次发现了细菌漆酶的存在。通过对不同微生物来源漆酶的性质比较发现,不同的漆酶同工酶蛋白发挥不同的生理功能,且物种来源不同的漆酶具有差异的酶学性质,如细菌来源的漆酶在中性及偏碱性等环境有较高催化能力[5-6],古细菌来源的漆酶热力学稳定性较好,而真菌来源的漆酶比活力较高。因此,从不同种属微生物中发现新型漆酶,对于深入理解漆酶的功能,以及促进其在生物工程领域的应用具有重要意义。
黏细菌 (Myxobacteria) 是一类革兰氏阴性单细胞生物,主要存在于富含微生物和有机质的环境中,最适生长温度在30 ℃左右,处于饥饿干旱环境中形成子实体,并在内部生成黏孢子,黏孢子对逆境有较强的抗性[7-8]。根据对底物利用能力的不同,黏细菌被分为两大类群。一类是不能利用纤维素,但可降解利用活细菌 (嗜细菌类群);另一类不能降解利用活细菌,却能分解利用纤维素 (嗜纤维素类群)[9]。与一般细菌相比,黏细菌生长缓慢,细胞壁上有复杂的胞外附属物,易于黏附携带其他污染物,较难分离和纯化。已有研究表明,黏细菌次级代谢产物具有丰富多样的生物活性,是筛选获得新型抗菌、抗肿瘤等活性化合物的重要资源[10-12],但关于黏细菌漆酶的研究未见报道。
基因序列测定技术的快速进步为利用生物信息学方法挖掘难分离培养微生物资源提供了便利。迄今,有13个黏细菌基因组序列被发布,在此基础上,我们对候选黏细菌漆酶序列进行了生物信息学分析,结合基因人工合成方法,进一步对筛选的9个候选序列进行重组表达,并对黏细菌来源的具有漆酶活性的重组蛋白rSC-2的酶学性质进行了分析。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器
2,6-甲氧基苯酚 (DMP)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸) 二铵盐 (ABTS)、多巴胺、丁香醛连氮 (SGZ)、甲氧基苯酚、愈创木酚、二茂铁、邻苯二酚、标准分子量蛋白marker和异丙基-β-D-硫代半乳糖苷 (IPTG) 购自上海生工生物工程技术服务有限公司;超声细胞破碎仪,冷冻离心机,镍离子亲和层析柱,One Drop微量紫外分光光度计,pH计,电泳仪。
1.1.2 培养基
LB 固体培养基 (g/L):胰蛋白胨10,酵母浸膏5,NaCl 10,琼脂15,自然pH值,121 ℃灭菌20 min。
液体发酵培养基 (g/L):胰蛋白胨10,NaCl 10,琼脂15,自然pH值,121 ℃灭菌20 min。
1.2 方法
1.2.1 黏细菌潜在漆酶基因序列的筛选
从NCBI下载所有已知的黏细菌目下的蛋白质组序列,以枯草芽孢杆菌的CotA蛋白序列 (PDB ID:1GSK) 和来自大肠杆菌的CueO蛋白序列 (PDB ID:3OD3) 为模板,对黏细菌基因组数据库 (http://www.ncbi. nlm.nih.gov/genome/?term=myxobacteria) 中有蛋白序列信息的氨基酸序列进行Blast比对,发现潜在黏细菌漆酶序列。保留evalue≤0.001且比对长度≥200个氨基酸的结果。
按照Ausec等[13]的方法,同时用5种漆酶多铜氧化酶 (Laccase-like multicopper oxidase,MCO) 的隐马尔可夫模型,分别表征5类不同类型的漆酶特征。以这5个模型为种子,用HMMER3.0软件分别对下载的黏细菌进行全蛋白质组比对。保留最高分数大于100的序列,对于每一条比对出的蛋白质序列,选取分数最高的种子模型作为该序列的特征。
通过ClustalO工具对这些序列进行多序列比对,找出铜离子保守位点,去除不包含4个铜离子保守位点的序列。利用MEGA6工具构建系统分类树状图。
1.2.2 黏细菌漆酶表达体系的构建
选取目标黏细菌蛋白序列,根据大肠杆菌偏好性对编码序列密码子进行优化,将优化后的序列送往商业公司进行基因合成。用pET22b构建黏细菌漆酶重组表达载体,选择BL21 (DE3)作为宿主细胞,将构建好的重组表达载体转化入BL21 (DE3) 细胞进行重组表达。
1.2.3 重组酶的制备
挑取待培养的重组大肠杆菌阳性克隆单菌落于LB液体培养基 (按1%接种量),37 ℃、 220 r/min摇床培养至对数期,转接4 mL培养液至400 mL LB液体培养基,37 ℃培养至600达到0.8,加入终浓度为0.2 mmol/L IPTG,16 ℃、150 r/min诱导表达15–18 h。收集菌体,超声破碎细胞,8 000×离心30 min,收集上清,利用Ni2+-NTA柱亲和纯化蛋白,纯化过程参照生产商提供的使用说明书进行。SDS-PAGE检测蛋白纯度,用One Drop微量紫外分光光度计测定280并计算蛋白浓度。
1.2.4 重组酶的活性测定
以DMP为底物考察重组蛋白的漆酶活 力,反应体系包括:10 μL适当稀释的酶液、 终浓度为1 mmol/L的DMP以及50 mmol/L的Na2HPO4-KH2PO4缓冲液(pH 7.0),60 ℃反应 5 min后,冰上孵育30 s终止反应,设置1个空白对照组,3个平行实验组,测定方法参照Fang等[14]。酶活力单位 (U) 定义为每分钟氧化 1 μmol DMP所需的酶量。
1.2.5 重组酶的最适反应温度和温度稳定性
将漆酶酶液用50 mmol/L Na2HPO4-KH2PO4缓冲液 (pH 7.0) 适当稀释,置于20 ℃、30 ℃、40 ℃、50 ℃、60 ℃和70 ℃的水浴中保温1 h,0 h测定初始酶活,1 h后测定剩余酶活,计算相对酶活,以最高的酶活为100%,相对酶活 (%) = (各温度条件下的酶活/最高酶活)×100%。以未处理酶液的酶活力为100%,剩余酶活 (%) = (各温度条件下的剩余酶活/最初酶活)×100%。
1.2.6 重组酶的最适pH值和pH稳定性
取等量的酶液置于不同pH值 (pH 4.5−5.5 CH3COONa-CH3COOH;pH 5.5−8.0 Na2HPO4- KH2PO4;pH 8.0−8.5 Tris-HCl) 的缓冲液中,在最适温度下测定酶活力,以0 h为对照,计算相对酶活。以最高的酶活100%,相对酶活 (%) = (各pH条件下的酶活/最高酶活)×100%。在酶对pH值的稳定性实验中,以pH 4.5−8.5的缓冲液适当稀释酶液于30 ℃保温1 h后测定其剩余酶活。
1.2.7 金属离子对重组酶活性的影响
选取K+、Ca2+、Mg2+、Na+、Zn2+、Mn2+、Fe3+、Co2+、Ba2+,用Na2HPO4/KH2PO4(50 mmol/L、pH 7.0) 配成母液浓度分别为100 mmol/L金属离子溶液,测定金属离子存在的条件下对重组酶漆酶活力的影响,以不含金属离子的反应液为对照,加入适量母液金属离子缓冲液,使其终浓度为1 mmol/L和5 mmol/L,每种金属离子的2个浓度都设3个平行,结果以平均值±标准偏差(±) 计算。
2 结果与分析
2.1 黏细菌漆酶活性蛋白候选序列的筛选及分析
从已发布的13个黏细菌蛋白质组筛选获得31条潜在漆酶序列。通过多序列比对,去除1个不完全包含4个保守铜离子结合位点的序列 (WP_002631421.1),共计30个序列作为漆酶活性蛋白候选序列。构建的30个漆酶活性蛋白候选序列系统分类进化图如图1所示。从图1可以看出,黏细菌漆酶活性蛋白候选序列大致可分为4类。
图1 候选黏细菌漆酶系统分类进化图
Fig. 1 Phylogenetic evolutionary tree of the myxobacteria laccase candidates.
类别Ⅰ包含8个候选黏细菌漆酶,来源于6个物种,分别为珊瑚状珊瑚球菌、深褐孢囊杆菌、叶柄黏球菌、黄色黏球菌、纤维堆囊菌和橙色标桩菌。隐马尔可夫模型分析显示,这8个漆酶活性蛋白属于typeB的两域小漆酶[15],氨基酸数目较少,在410−456之间。另外,这8个黏细菌漆酶活性蛋白两两之间氨基酸序列一致性超过60%,虽然来源不同,但相似性较高。
类别Ⅱ也包含了8个候选黏细菌漆酶,来源于5个物种,分别为珊瑚状珊瑚球菌、叶柄黏球菌、黄色黏球菌、太平洋邻囊菌和纤维堆囊菌。隐马尔可夫模型分析表明,这8个黏细菌漆酶活性蛋白属于普通的三域漆酶,氨基酸数目在450−502之间。值得注意的是,它们中有4个均来源于,而这4个蛋白的两两序列一致性只有30%−40%。反而是3个不同菌株来源的候选漆酶 (、和) 序列一致性较高,达到50%−60%。
类别Ⅲ包含6个候选黏细菌漆酶,来源于4个物种,分别是脱卤厌氧黏杆菌、深褐孢囊杆菌、赫黄嗜盐囊菌和纤维堆囊菌。这6个蛋白较大,氨基酸数量在591−1 359之间,两两序列一致性也只有20%−30%,虽然包含4个铜离子结合位点,但可能还拥有其他酶的活性。
类别Ⅳ同样包含了8个候选黏细菌漆酶,来源于6个物种,分别为软骨霉状菌、深褐孢囊杆菌、细小玻管状菌、太平洋邻囊菌、纤维堆囊菌和橙色标桩菌。隐马尔可夫模型分析表明这8个候选黏细菌漆酶也属于普通的三域漆酶,但氨基酸数目比类别Ⅱ大,在527–651之间。两两之间序列一致性差异较大,有的只有20%−30%,而有的高达70%。
对获得的30个候选黏细菌漆酶序列以及真菌来源且具有晶体结构的2个漆酶序列 (1KYA、1GYC) 和2个细菌漆酶(CotA、3OD3_A)序列进行全序列比对。结果表明,所比对序列的4个铜离子结合区氨基酸类型高度保守,分别为HxHG、HxH、HxxHxH和HCHxxxH (图2A),而4个底物结合区域编码序列的长度和类型差异较大 (图2B,2C)。此外,我们还标注了漆酶的4个底物结合loop区,这4段区域彼此高度特异,序列长度和氨基酸类型均不同。
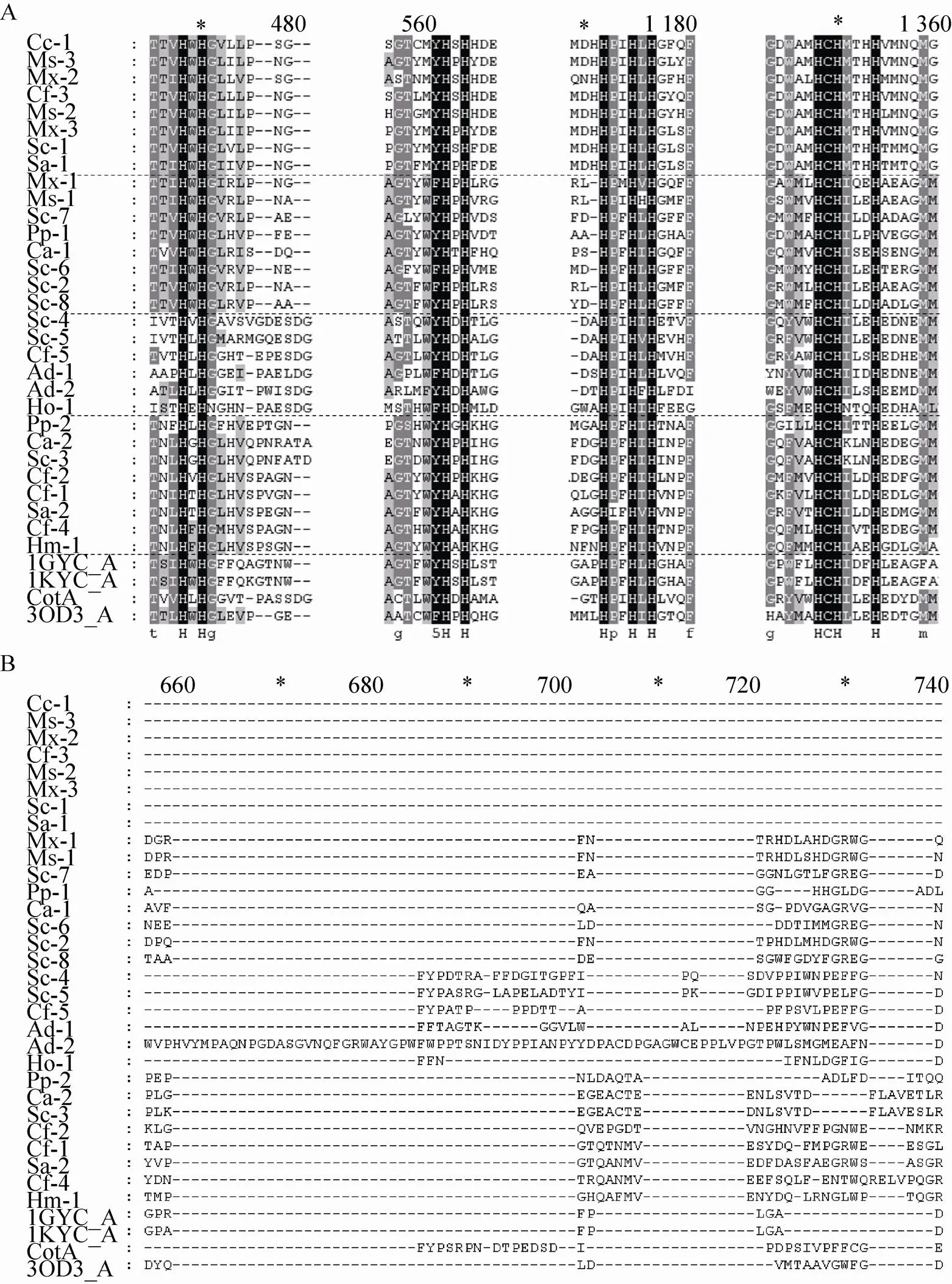
2.2 重组酶的分离纯化及其性质分析
从4个类别分别选取2个潜在黏细菌漆酶序列,共计9个潜在漆酶序列送往公司进行基因合成,并构建重组酶大肠杆菌表达体系BL21 (DE3)/pET22b-lacX。初步重组蛋白表达后,获得粗酶液,分别用底物SGZ、DMP、愈创木酚、二茂铁和邻苯二酚等检测发现,其中来自WP_012240709.1、WP_012240711.1、WP_012233138.1、WP_012234756.1、WP_002621665.1、WP_006975397.1、WP_044243002.1序列获得的7个重组蛋白具有催化活性。
选取其中一个来自类别II () 对DMP具有较高催化活性的三域漆酶SC-2 (WP_012240711.1) 的重组酶进行纯化制备,分析其酶学性质。
2.2.1 rSC-2表观分子量
成功构建表达载体pET22b-SC-2,并实现具有漆酶活性蛋白SC-2在BL21 (DE3)中的活性表达。通过Ni2+-NTA柱纯化蛋白,经过SDS-PAGE检测显示单一目标蛋白条带 (图3),说明rSC-2已被成功纯化到SDS-PAGE电泳纯。编码rSC-2的氨基酸共525个,理论计算rSC-2分子量为57.15 kDa,与蛋白电泳条带位置大小一致。
2.2.2 温度对rSC-2活性的影响
将反应体系置于各温度水浴中,测定温度对rSC-2活性的影响。由图4A可以看出,rSC-2的最适反应温度是60 ℃,50 ℃−70 ℃剩余酶活保留80%以上,80 ℃时剩余酶活40%左右。
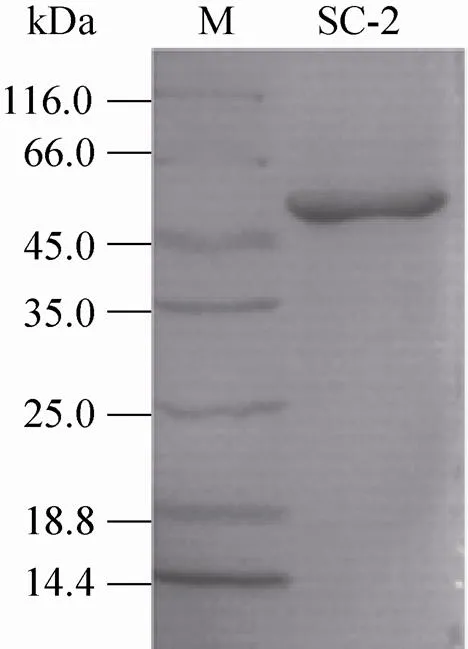
图3 rSC-2的SDS-PAGE电泳
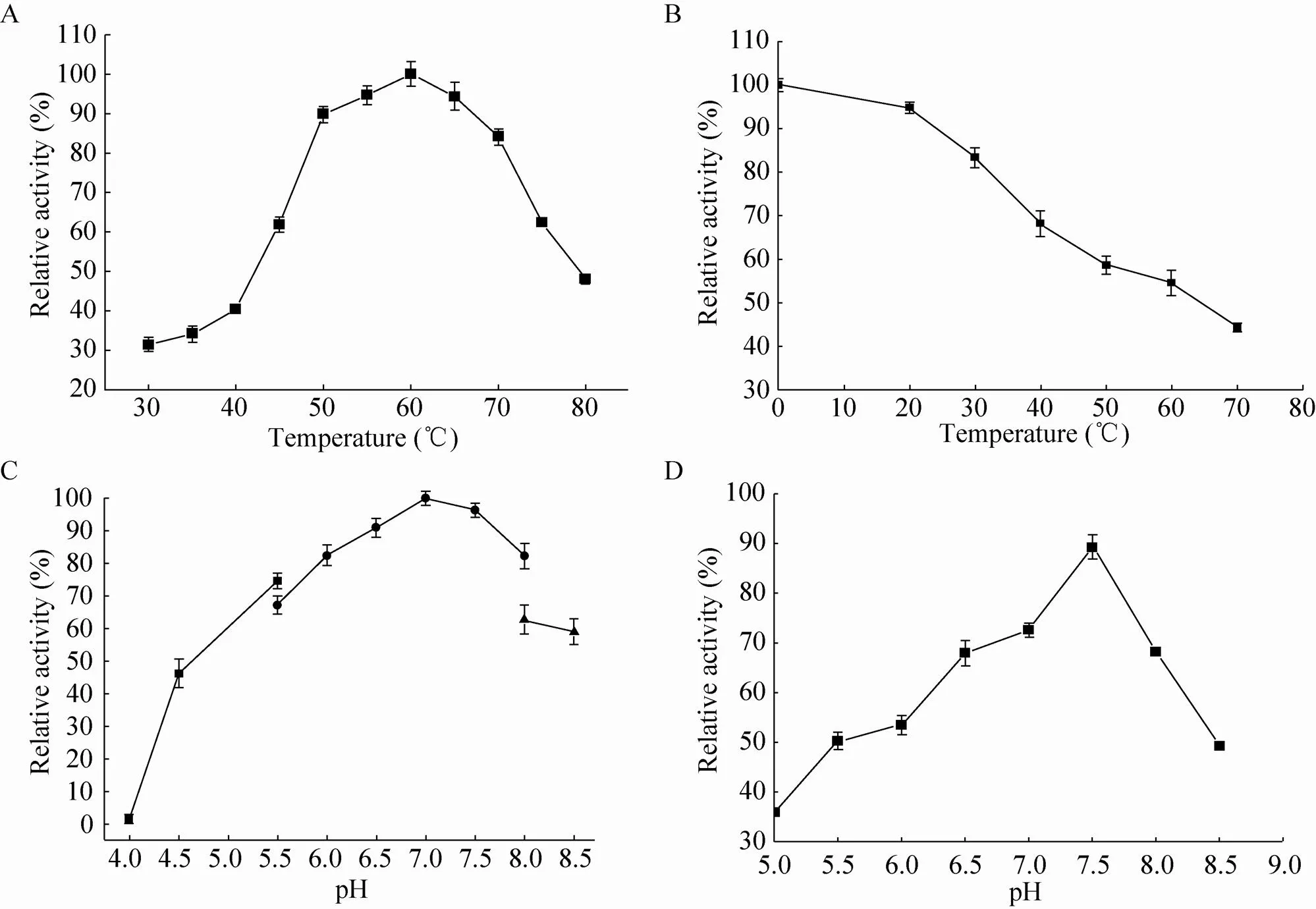
图4 温度、pH对rSC-2酶活力的影响
2.2.3 rSC-2热稳定性分析
将最适反应体系置于各温度水浴中20 ℃–70 ℃放置1 h后测定其剩余活性。由图4B可以看出,rSC-2在低温时 (0 ℃−30 ℃) 的稳定性较好,酶活损失较少,剩余酶活都在80%以上。30 ℃以后,随着温度升高,酶活下降较快,70 ℃时剩余酶活残留约45%,rSC-2适宜低温保存。
2.2.4 pH对rSC-2活性的影响
分别将各pH反应体系置于60 ℃水浴中测定不同pH对rSC-2活性的影响。结果如图4C所示,rSC-2的最适反应pH为7.0时,酶活最高,在pH为7.5时,酶活较高,剩余酶活在90%以上。
2.2.5 rSC-2的pH稳定性
将重组酶SC-2与不同pH缓冲液充分混合稀释后,置于30 ℃孵育1 h,在最适条件下测量剩余酶活。结果如图4D所示,在pH为6.5−8.0时具有较高的酶活,酶的稳定性比较好,pH 7.5时酶具有最好的保藏稳定性。
2.2.6 金属离子对rSC-2活性的影响
在反应体系中加入适量金属离子缓冲液,使金属离子终浓度分别为1 mmol/L、5 mmol/L,最适温度孵育3 min,反应5 min测量酶活。不同金属离子对rSC-2活性影响的差异较大,结果如表1所示,金属离子终浓度1 mmol/L时,Ca2+对rSC-2的活性有一定促进作用,Mn2+、Na+、K+、Mg2+对rSC-2活性影响不大,Zn2+、Fe3+、Co2+、Ba2+对rSC-2活性有不同程度的抑制作用。金属离子终浓度为5 mmol/L时,各金属离子对rSC-2活性都有不同程度的抑制作用,Fe3+、Co2+、Ba2+对rSC-2活性影响最大,实验中检测不到酶活 (表1)。
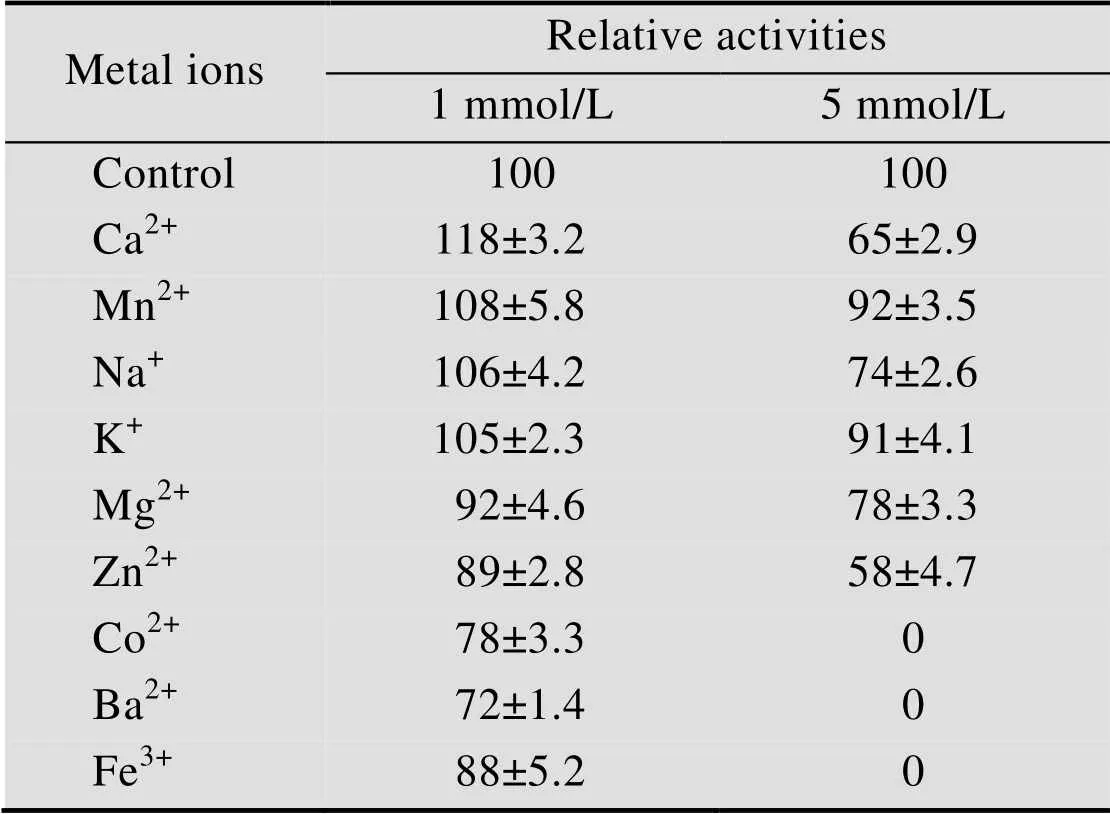
表1 金属离子对漆酶活性影响
3 讨论
细菌漆酶于1993年首次从植物根际细菌生脂固氮螺菌中被发现。自此,不断有新的细菌漆酶被报道。已有研究显示,漆酶活性蛋白在细菌中广泛存在,且已经从真细菌[16-17]、古细菌[18]、放线菌[19]等微生物中克隆并表达获得了相应的细菌漆酶活性蛋白。然而,至今未见有对黏细菌漆酶序列生物信息学分析和酶学性质研究的报道。我们利用生物信息学方法结合基因人工合成技术,筛选黏细菌漆酶序列并实现其在中异源表达,能为深入理解细菌漆酶的功能,以及促进其在生物工程领域的应用奠定基础。
Blast方法是基于启发式算法寻找进化上亲缘关系较近、全局高度相似的序列,是最常用的序列相似性比对工具;隐马尔可夫模型是一个动态的模型,可以通过训练识别同一特征的蛋白质序列,更加准确地获得进化上亲缘关系较远但具有保守特征的序列,基于隐马尔可夫模型的方法越来越多地用在生物信息学中。我们分别用Blast和HMMER的方法对黏细菌进行了全蛋白质组的比对,从13个黏细菌蛋白质组筛选获得30个漆酶活性蛋白候选序列,且两种方法获得的序列完全相同,由于这两种方法完全独立,因此也说明获得的序列可信度较高。
Kües等对来自6个真菌基因组的45个多铜氧化酶序列进行生物信息学分析,结果显示,这些序列聚类为6个亚家族,包括漆酶亚家族1 (Laccase sensustricto subfamily 1)、漆酶亚家族2 (Laccase sensustricto subfamily 2)、真菌铁基氧化酶亚家族 (Fungal ferroxidases)、铁基氧化酶/漆酶亚家族 (Ferroxidase/laccase)、真菌色素多铜氧化酶亚家族 (Fungal pigment MCOs) 以及真菌抗坏血酸氧化酶 (Fungal ascorbate oxidases),这些蛋白在微生物中发挥不同的生理功能,如参与木质素的分解、菌丝体的发育、对植物的致病性等[20]。与Kües等的结果类似,我们对获得的30个黏细菌来源多铜氧化酶序列的生物信息学分析显示,其可分为4个类别 (Ⅰ–Ⅳ),且同物种来源的多铜氧化酶序列一致性较低;同时,潜在黏细菌漆酶序列的4个铜离子结合区序列之间和底物结合区序列之间也存在差异,暗示其在黏细菌中也可能发挥不同的生理功能。
为了了解黏细菌漆酶功能,掌握其酶学性质,选取不同类别来源共计9个序列进行基因合成,并构建重组酶大肠杆菌表达体系。检测发现,有7个重组蛋白具有催化丁香醛连氮氧化活性,其中rSC-2具有最高活性,rSC-1次之。丁香醛连氮被认为是鉴别漆酶与酪氨酸酶等的专一性底物。因此,rSC-2和rSC-1可被认为是细菌漆酶。同时,以结构信息已知的真菌漆酶为参考,全序列比对结果表明,分布于类别Ⅱ中的潜在黏细菌漆酶与真菌漆酶的序列相似性最高 (图2)。因此,选择归类于类别Ⅱ的rSC-2进行深入研究。
一般情况下,真菌来源漆酶催化酚类底物氧化的最适pH在5.0左右,当催化pH高于7.0时,酶活力迅速降低[21-23];而细菌来源漆酶通常在pH 7.0左右具有最适的催化活力[24-25]。对rSC-2酶学性质的初步分析表明,与其他细菌来源漆酶蛋白类似,rSC-2拥有中性偏碱的最适催化pH (7.0−7.5)。然而,与rSC-2不同,来自牛瘤胃微生物元基因组文库的细菌漆酶RL5[26]催化丁香醛连氮的最适pH为4.5。另外,rSC-2具有较好的耐热性,在60 ℃水浴1 h,残留55%活性,高于海洋来源细菌漆酶Lac15 (45℃半衰期为72 min)[11],但低于枯草芽孢杆菌来源细菌漆酶CotA[27]。总之,对rSC-2酶学性质的初步研究表明,对于某些偏碱性的工业废水如造纸和染料废水等,使用真菌漆酶处理时活性较低,rSC-2可能具有较好的应用潜力。
REFERENCES
[1] Shradd ha, Shekher R, Sehgal S, et al. Laccase: microbial sources, production, purification, and potential biotechnological applications. Enzyme Res, 2011, 2011: 217861.
[2] Riva S. Laccases: blue enzymes for green chemistry. Trends Biotechnol, 2006, 24(5): 219–226.
[3] Reiss R, Ihssen J, RichterM, et al. Laccaselaccase-like multi-copper oxidase: a comparative study of similar enzymes with diverse substrate spectra. PLoS ONE, 2013, 8(6): e65633.
[4] Givaudan A, Effosse A, Faure D, et al. Polyphenol oxidase inisolated from rice rhizosphere: evidence for laccase activity in non-motile strainsof. FEMS Microbiol Lett, 1993, 108(2): 205–210.
[5] Fang ZM, Li TL, Chang F, et al. A new marine bacterial laccase with chloride-enhancing, alkaline- dependent activity and dye decolorization ability. Bioresour Technol, 2012, 111: 36–41.
[6] Ruijssenaars HJ, Hartmans S. A clonedmulticopper oxidase exhibiting alkaline laccase activity. Appl Microbiol Biotechnol, 2004, 65(2): 177–182.
[7] Volz C, Kegler C, Müller R. Enhancer binding proteins act as hetero-oligomers and link secondary metabolite production to myxococcal development, motility, and predation. Chem Biol, 2012, 19(11): 1447–1459.
[8] Cao P, Dey A, Vassallo CN, et al. Howmyxobacteria cooperate. J Mol Biol, 2015, 427(23): 3709–3721.
[9] Muñoz-Dorado J, Marcos-Torres FJ, García-Bravo E, et al. Myxobacteria: moving, killing, feeding, and surviving together. Front Microbiol, 2016, 7: 781.
[10] Wang DT, Ma ZL. The molecular biology of myxobacterium. Chem Life, 2010, 30(5): 779–782 (in Chinese).王德韬, 马中良. 黏细菌的分子生物学. 生命的化学, 2010, 30(5): 779–782.
[11] Zhao TF, Gong GL. Myxobacteria: natural pharmaceutical factories. Biotechnol Bull, 2014, 30(12): 40–46 (in Chinese). 赵婷峰, 龚国利. 黏细菌: 天然的制药工厂. 生物技术通报, 2014, 30(12): 40–46.
[12] Vaksman Z, Kaplan HB.growth, development, and isolation. Curr Protoc Microbiol, 2015, 39: 7A.1.1–7A.1.21.
[13] Ausec L, Zakrzewski M, Goesmann A, et al. Bioinformatic analysis reveals high diversity of bacterial genes for laccase-like enzymes. PLoS ONE, 2011, 6(10): e25724.
[14] Fang ZM, Li TL, Wang Q, et al.A bacterial laccase from marine microbial metagenome exhibiting chloride tolerance and dye decolorization ability. Appl Microbiol Biotechnol, 2011, 89(4): 1103–1110.
[15] Ihssen J, Reiss R, Luchsinger R, et al. Biochemical properties and yields of diverse bacterial laccase-like multicopper oxidases expressed in. Sci Rep, 2015, 5: 10465.
[16] Roberts SA, Weichsel A, Grass G, et al. Crystal structure and electron transfer kinetics of CueO, a multicopper oxidase required for copper homeostasis in. Proc Natl Acad Sci USA, 2002, 99(5): 2766–2771.
[17] Singh SK, Roberts SA, McDevitt SF, et al. Crystal structures of multicopper oxidase CueO bound to copper (Ⅰ) and silver (Ⅰ): functional role of a methionine-rich sequence. J Biol Chem, 2011, 286(43): 37849–37857.
[18] Uthandi S, Prunetti L, De Vera IMS, et al. Enhanced archaeal laccase production in recombinantby modification of N-terminal propeptide and twin arginine translocation motifs. J Ind Microbiol Biotechnol, 2012, 39(10): 1523–1532.
[19] Tishchenko S, Gabdulkhakov A, Trubitsina L, et al. Crystallization and X-ray diffraction studies of a two-domain laccase from. Acta Crystallogr F Struct Biol Commun, 2015, 71(9): 1200–1204.
[20] Kües U, Rühl M. Multi plemulti-copper oxidase gene families in basidiomycetes—what for?. Curr Genomics, 2011, 12(2): 72–94.
[21] Liu J, Cai Y, Liao X, et al. Purification and characterization of a novel thermal stable laccase fromsp. SYBC-L3 and its use in dye decolorization. Biol Environ, 2012, 113: 1–13.
[22] Baldrian P. Fungal laccases-occurrence and properties. FEMS Microbiol Rev, 2006, 30(2): 215–242.
[23] Hildén K, Hakala TK, Lundell T. Thermotolerant and thermostable laccases. Biotechnol Lett, 2009, 31(8): 1117–1128.
[24] Vrsanska M, Voberkova S, Langer V, et al. Induction of laccase, lignin peroxidase and manganese peroxidase activities in white-rot fungi using copper complexes. Molecules, 2016, 21(11): 1553.
[25] Majeau JA, Brar SK, Tyagi RD. Laccases for removal of recalcitrant and emerging pollutants. Bioresource Technol, 2010, 101(7): 2331–2350.
[26] Beloqui A, Pita M, Polaina J, et al. Novel polyphenol oxidase mined from a metagenome expression library of bovine rumen: biochemical properties, structural analysis, and phylogenetic relationships. J Biol Chem, 2006, 281(32): 22933–22942.
[27] Su JM, Bao P, Bai TL, et al. CotA, a multicopper oxidase fromWH4, exhibits manganese-oxidase activity. PLoS ONE, 2013, 8(4): e60573.
(本文责编 陈宏宇)
Bioinformatic analysis and characterization of myxobacteria laccase-like multicopper oxidases
Xiuyan Zhao1,2, Fei Chang1,2, Zemin Fang1,2, Yinliang Zhang1,2, and Yazhong Xiao1,2
1 School of Life Sciences, Anhui University, Hefei 230601, Anhui, China 2 Anhui Provincial Engineering Technology Research Center of Microorganisms and Biocatalysis, Hefei 230601, Anhui, China
Laccase is a widely-used environment-friendly copper-containing oxidase found in many plants, insects and fungi. Recently, more and more laccases are also found in bacteria. Myxobacteria are an important bacteria resource. However, myxobacteria are much more difficult to isolate and purify than other bacteria. We used bioinformatic approach to screen myxobacteria proteomes available in NCBI. Based on conserved sequences of four copper binding sites in multicopper oxidase, 30 potential laccase sequences were obtained. Among them, nine genes were synthesized and expressed inBL21 (DE3). Seven proteins showed laccase activity when tested with traditional laccase substrates. One protein, named rSC-2, was chosen for further research because it exhibited the highest activity towards 2,6-dimethyl phenol (DMP). The molecular weight of rSC-2 was 57 kDa. Its specific activity to DMP was 0.27 U/mg. The optimal temperature and the optimal pH were 60 ℃ and 7.0, respectively. About 50% of the original activity was retained after incubation at 60 ℃ and pH 7.0−8.0 for 1 h. Metals showed different effects on rSC-2. rSC-2 activity was enhanced by several metalsat concentration of 1 mmol/L, such as Ca2+and Mn2+. With a higher concentration of 5 mmol/L, the activity of rSC-2 was apparently inhibited. This is the first report of bioinformatics screening myxobacteria laccases in combination with expression in
bioinformatics, myxobacteria laccase, recombinant expression, separation and purification, enzymology characterization
Supported by:National Natural Science Foundation of China (No. 31600078).
国家自然科学基金(No. 31600078) 资助。
September 23, 2016; Accepted: January 3, 2017
Yinliang Zhang. Tel/Fax: +86-551-63861929; E-mail: ylzhang@ahu.edu.cn Yazhong Xiao. Tel/Fax: +86-551-63861929; E-mail: yzxiao@ahu.edu.cn

