玻璃化冻融囊胚助孕妊娠妇女娩出胎盘Grb10表达分析研究*
林典梁,全 松,康跃凡,易劲松,余爱丽,林 元
(1.福建医科大学附属福建省妇幼保健院辅助生殖技术研究室,福州 350001;2.南方医科大学南方医院妇产科生殖医学中心,广州 510515)
·论 著·
玻璃化冻融囊胚助孕妊娠妇女娩出胎盘Grb10表达分析研究*
林典梁1,全 松2△,康跃凡1,易劲松1,余爱丽1,林 元1
(1.福建医科大学附属福建省妇幼保健院辅助生殖技术研究室,福州 350001;2.南方医科大学南方医院妇产科生殖医学中心,广州 510515)
目的 对玻璃化冻融囊胚助孕妊娠妇女娩出胎盘中生长因子受体结合蛋白10(Grb10)表达进行分析,评价其安全性。方法 收集2012年1月至2014年5月在福建省妇幼保健院产科门诊玻璃化冻融囊胚助孕妊娠的妇女(观察组)50例及同期自然妊娠妇女(对照组)50例病例数据和胎盘标本。采用免疫组织化学、Western blot检测胎盘Grb10蛋白的表达,Real-time PCR检测Grb10 mRNA表达。对两组妊娠妇女的产科结局及胎盘Grb10的表达进行比较分析。结果 两组孕龄、胎龄,胎儿性别、体质量、身长、头围、腹围比较差异均无统计学意义(P>0.05),娩出胎盘面积、胎盘质量比较差异有统计学意义(P<0.05)。两组胎盘组织Grb10蛋白表达率、表达强度、免疫组织化学评分比较差异均无统计学意义(P>0.05)。Real-time PCR、Western blot分析结果进一步显示两组胎盘组织中Grb10 mRNA与蛋白表达差异均无统计学意义(P>0.05)。结论 玻璃化冻融囊胚助孕有可能会增加娩出胎盘的面积与质量,但发育相关分子Grb10在胎盘的表达未见明显改变。
囊胚;玻璃化冷冻;胎盘;Grb10
辅助生殖技术(assisted reproductive technology,ART)用于临床已30多年,其非自然生殖的特性及缺乏临床前安全性研究而直接临床应用的背景,日益引起人们对其生殖遗传安全性的关注。虽然目前未发现ART可直接导致子代出现明显畸形,但不断有报道指出,ART子代不良健康风险增加,生长发育问题就是其中之一,胎儿胎盘过度生长或低出生体质量儿的风险增高,但原因尚不明确,人们担心可能与ART的一系列操作相关。
囊胚培养与胚胎冷冻为ART重要的衍生技术,近年来研究发现采用玻璃化冻融囊胚移植治疗不孕症患者能产生较好的助孕结局,其临床妊娠率、胚胎种植率显着高于冻融卵裂期胚胎移植。但囊胚培养与玻璃化冷冻技术应用于临床时间较短,尚缺乏对于出生后婴幼儿大样本的长期随访资料,其安全性仍是人们关注的焦点。
印记基因生长因子受体结合蛋白10(growth factor receptor-bound protein10,Grb10)是一种可以控制肌肉增长的蛋白。可能改变肌肉的生长并促进愈合、肌肉再生和修复过程。2011年报道了一项小鼠行为学研究显示印记基因Grb10的母本表达涉及胎儿成长、新陈代谢、脂肪储存,而父本表达调控着成年小鼠的行为活动,是胚胎发育及多种生理活动中的重要基因。囊胚培养与玻璃化冷冻有可能通过干扰Grb10等印记基因而影响子代生长发育潜能。尤其在胚胎期,滋养层细胞较内细胞团对环境因素的干扰更为敏感,经过玻璃化冷冻损伤,很可能胎盘组织发生表观遗传修饰异常的风险增加。玻璃化冻融囊胚助孕产科结局及其娩出胎盘Grb10表达情况如何?尚未有文献报道,因此本文对玻璃化冻融囊胚助孕妊娠妇女娩出胎盘Grb10表达水平进行分析,对其安全性进行评估,现报道如下。
1 资料与方法
1.1 一般资料 本研究方案经福建省妇幼保健院医学伦理委员会讨论批准,在进行研究前与患者进行详细沟通,在充分知情同意的基础上,获得患者夫妇双方签字同意后,实施研究方案。收集2012年1月至2014年5月在福建省妇幼保健院产科门诊玻璃化冻融囊胚助孕妊娠妇女(观察组)50例及按年龄配对同期自然妊娠妇女(对照组)50例病例数据和胎盘标本。并对两组孕妇的人口学资料进行比较分析无显著差异者纳入试验对象。入选标准:孕龄20~35岁;单胎;第1次妊娠;身体健康。排除标准:24周前妊娠丢失病例。所有入选对象分别记录姓名、孕龄、末次月经、预产期、新生儿性别、新生儿体质量、新生儿评分、身长、胎盘面积和体质量、头围、腹围等指标。所有对象分娩时均收集胎盘标本。
1.2 方法
1.2.1 胎盘标本收集 两组孕妇分娩时,均对胎盘进行详细检查,完成胎盘测量,称取胎盘质量,并记录所有胎盘相关数据。分娩后立即收集胎盘组织,避开胎盘梗死和血管瘤部分,从脐带植入点旁5 cm处纵向切开胎盘组织。收集胎盘中间部分绒毛,以尽量减少其他部分对基因表达结果的影响。所有胎盘组织在冰预冷的PBS中充分漂洗后,分装于样品冷冻保存管中,立即投入液氮中迅速冷冻,后移入-80 ℃冰箱中保存,用于蛋白和基因检测。用于组织学分析的胎盘组织用4%多聚甲醛固定保存。
1.2.2 免疫组织化学检测胎盘组织中Grb10蛋白表达 用4%多聚甲醛(0.1 mol/L PBS,pH 7.0~7.6,含0.1% DEPC)进行固定,经70%乙醇30 min、80%乙醇30 min、90%乙醇2次×30 min、95%乙醇2次×30 min、100%乙醇2次×30 min、二甲苯透明2次×30 min、55 ℃石蜡中2次×30 min,用铜制模具包埋组织块。切片后,将厚度3~5 μm的组织切片附于经多聚赖氨酸附膜的载玻片上,60 ℃烘烤过夜;将切片浸于二甲苯中2次×5 min、100%乙醇2次×5 min、95%乙醇2次×5 min、90%乙醇2次×5 min、85%乙醇2次×5 min、75%乙醇2次×5 min,自来水冲洗,PBS洗2次进行脱蜡、入水。置入1%甲醇双氧水,室温10 min,蒸馏水洗1次,0.1 mol/L PBS洗3次×5 min。将切片放入0.01 mol/L柠檬酸盐缓冲液(pH 6.0)中,在微波炉内微波辐射10 min,0.1 mol/L PBS洗3次×5 min进行抗原修复。切片上滴加正常山羊血清封闭液,室温20 min。甩去多余液体。切片上滴加第一抗体,4 ℃过夜,0.1 mol/L PBS洗3次×5 min。切片上滴加生物素化的二抗体(IgG),37 ℃ 20 min,0.1 mol/L PBS洗3次×5 min;切片上滴加辣根酶标记链霉卵白素工作液(S-A/HRP),37 ℃ 20 min,0.1 mol/L PBS洗3次×5 min。DAB显色:使用DAB显色试剂盒1 mL蒸馏水加显色剂A、B、C各1滴,混匀,加至标本上,显色6 min,充分水洗。苏木素染液复染细胞核1 min,充分水洗,1%盐酸乙醇分化,1%氨水返蓝,充分水洗,经70%乙醇5 min、80%乙醇5 min、90%乙醇2次×5 min、95%乙醇2次×5 min、100%乙醇脱水2次×5 min、二甲苯透明2次×5 min,中性树脂封片。按以下评分标准: A为阳性细胞数分级,<1%为0、1%~10%为1、11%~50%为2、51%~80%为3、81%~100%为4;B为阳性细胞显色强度分级0(阴性)、1(弱阳性)、2(阳性)、3(强阳性);免疫组织化学评分=A×B。对所有切片进行镜下观察分析胎盘组织中Grb10蛋白的表达。
1.2.3 Real-time PCR检测Grb10 mRNA表达 Trizol法提取胎盘组织总RNA(Trizol裂解液购自杭州博日科技),将总RNA 1 μg逆转录为cDNA(逆转录试剂盒购自Bioer公司),取5 μL cDNA应用ABI7500型荧光定量PCR仪进行Real-time PCR(SYBR Green荧光染料购自Roche公司)。引物由上海生工合成,引物序列及长度见表1。Real-time PCR总反应体系20 μL,使用Ultra SYBR Mixture 完成扩增,扩增程序为:95 ℃ 10 min,95 ℃ 15 s;60 ℃ 60 s,45个循环。PCR产物经2%琼脂糖凝胶电泳,无引物二聚体和非特异扩增产物出现。通过实时监测PCR产物的动态积累量,得到各管标本的扩增曲线及目的序列的Ct值,同时检测该管标本管家基因GAPDH的Ct值,计算各管标本待测序列的△Ct值(△Ct=目的基因Ct值-该管样品GAPDH的Ct值),该管标本目的基因的相对表达量为2-ΔCt值。
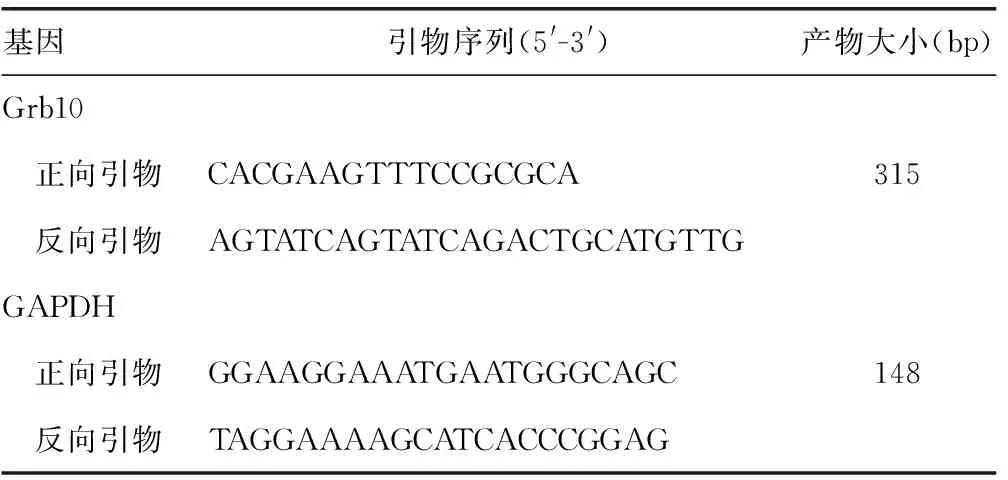
表1 实验引物序列
1.2.4 Western blot检测Grb10蛋白表达 胎盘组织匀浆后提取总蛋白,测定蛋白浓度备用。制备好SDS-PAGE聚丙烯酰胺凝胶,取相应体积总蛋白样品与5×上样缓冲液,混匀,95 ℃变性10 min,将样品加到凝胶孔中,电压调至80 V,使样品通过浓缩胶与分离胶。凝胶电泳结束后,通过电转移将凝胶上分离的蛋白条带转印至PVDF膜上,然后将膜放入非标记一抗及辣根过氧化物酶标记的二抗溶液中孵育、标记检测。待PVDF膜稍晾干,加入化学发光试剂孵育1 min,迅速用保鲜膜包好后置于暗盒内与Kodak X胶片贴在一起曝光,时间为1 min左右。X胶片经显影、定影后扫描记录,用image J软件分析灰度值。

2 结 果
2.1 两组新生儿结果比较 两组孕龄、胎龄,Apgar评分,胎儿性别、体质量、身长、头围、腹围比较差异均无统计学意义(P>0.05)。见表2。
2.2 两组病例娩出胎盘情况 两组胎盘面积、胎盘质量比较差异有统计学意义(P<0.05)。见表3。
2.3 两组病例娩出胎盘组织Grb10表达免疫组织化学分析
2.3.1 HE染色 胎盘是由胎儿的丛密绒毛膜与母体的基蜕膜共同组成的圆盘形结构中央厚,周边薄。胎盘的胎儿面光滑,表面覆有羊膜,脐带附于中央或稍偏,透过羊膜可见呈放射状走行的脐血管分支。胎盘的母体面粗糙,为剥离后的基蜕膜,可见15~30个由浅沟分隔的胎盘小叶。它由大量的丛密绒毛膜组成。丛密绒毛膜由三级绒毛干组成,绒毛干由其内的结缔组织和血管及包围在外周的细胞滋养层与合体滋养层组成,见图1。HE染色后组织学分析两组胎盘均未见绒毛膜病变,如滋养层细胞过度增生、绒毛内结缔组织变性水肿、滋养层细胞病变等病理学改变。本研究收集的标本均为健康胎盘,两组均有可比性。
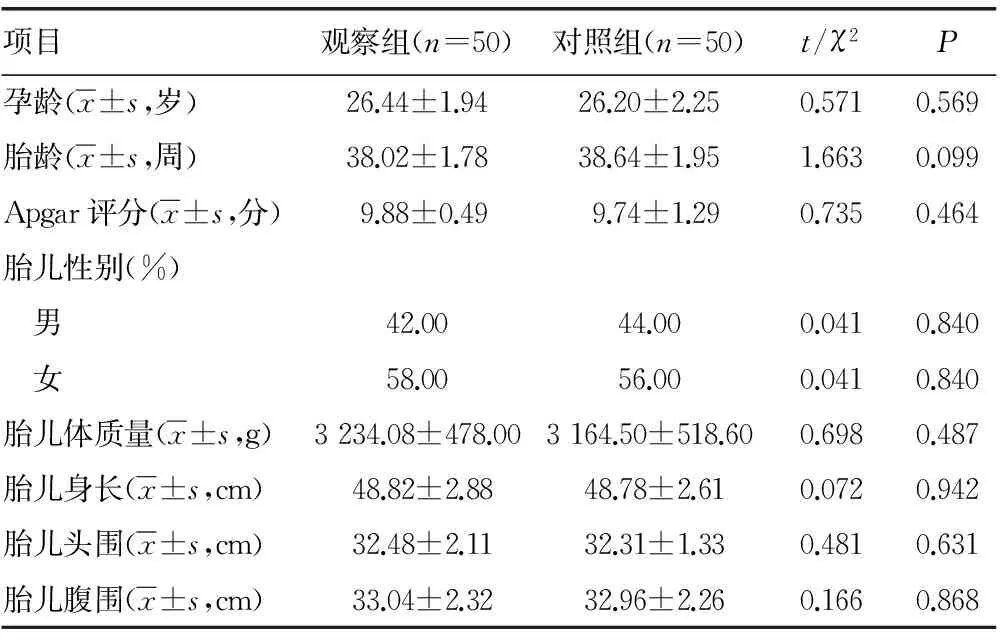
表2 两组病例新生儿结果比较
表3 两组病例娩出胎盘情况±s)
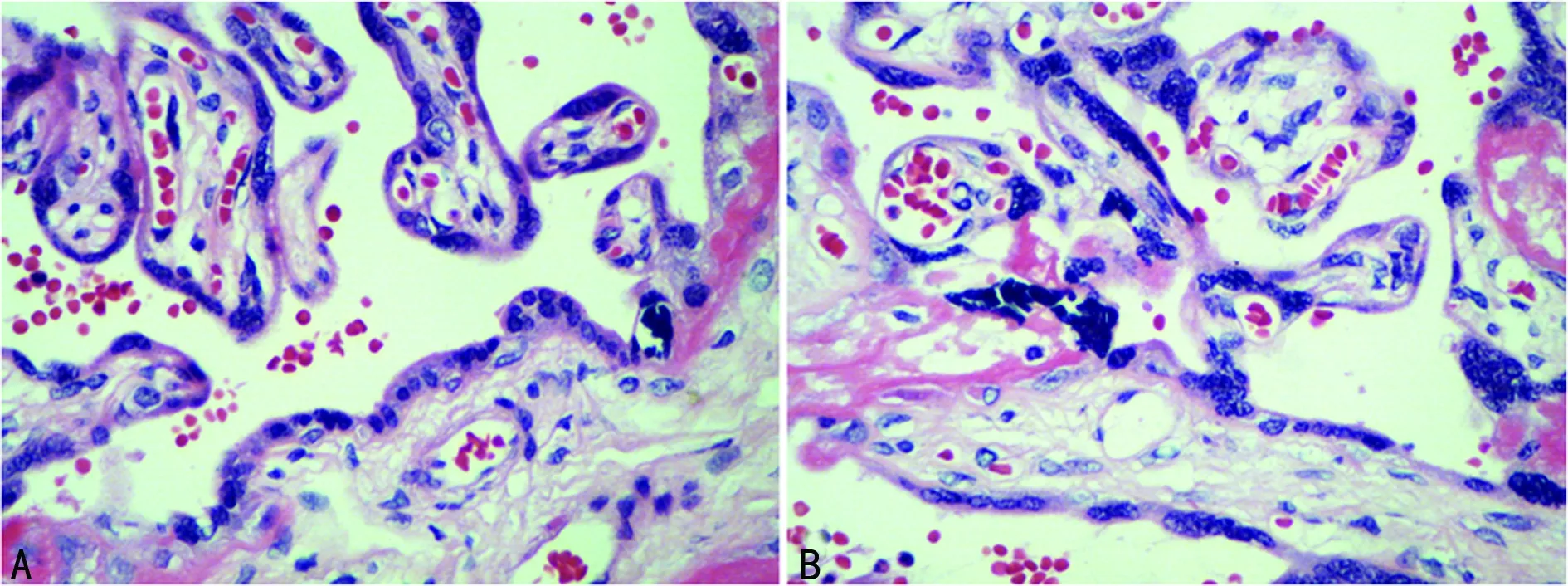
A:观察组;B:对照组。
图1 HE染色(×400)
2.3.2 免疫组织化学染色 两组胎盘细胞滋养层与合体滋养层细胞均不同程度的Grb10的表达,见图2。两组胎盘组织Grb10蛋白在表达率、表达强度、免疫组织化学评分比较差异无统计学意义(P>0.05)。见表4。
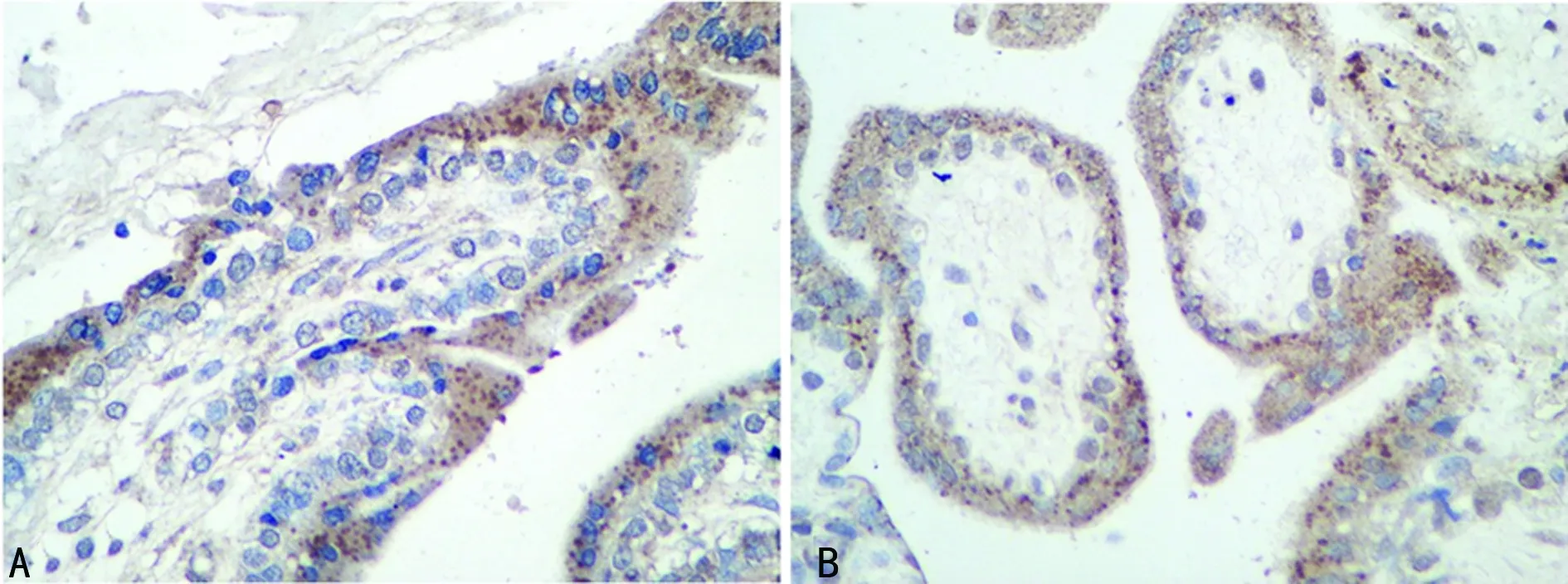
A:观察组;B:对照组。
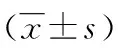
图2 免疫组织化学染色(×400)表4 两组病例娩出胎盘组织Grb10表达免疫组织化学 分析结果比较
2.4 两组病例娩出胎盘组织Grb10 mRNA表达比较 结果显示观察组(1.02±0.02)与对照组(0.99±0.03)比较差异无统计学意义(t=1.437,P>0.05)。见图3。

图3 Real-time PCR检测Grb10 mRNA在胎盘 组织中的表达
2.5 两组娩出胎盘组织Grb10蛋白表达比较 结果显示观察组(1.44±0.11)与对照组(1.31±0.47)比较差异无统计学意义(t=1.108,P>0.05)。见图4。

图4 Western blot检测Grb10蛋白在胎盘组织 中的表达
3 讨 论
囊胚培养与胚胎冷冻保存为ART重要的衍生技术,促排卵周期剩余胚胎培养成囊胚后冷冻保存,可以减少多胎的发生,以及减胎、卵巢过度刺激综合征(OHSS)的风险,减少患者刺激卵巢的次数、多次促排卵费用,增加累积成功率。近年研究发现采用玻璃化冷冻技术,冻融囊胚移植治疗不孕症患者能产生较好的助孕结局,其临床妊娠率、胚胎种植率显着高于冻融卵裂期胚胎移植。尤其对于OHSS高危患者,由于其具有年龄小、卵巢反应性好、胚胎回收率高的特点,容易成功培养出高质量的囊胚,冷冻保存,选择OHSS症状消失后择期解冻移植,能产生较好的妊娠结局。在2011年Zhu等[1]完成了110周期新鲜囊胚和136周期玻璃化冻融囊胚移植,比较发现解冻囊胚移植的临床妊娠率和种植率为37.0%和55.1%,显着高于新鲜囊胚移植的25.2%和36.4%。有学者[2-3]也对新鲜囊胚与解冻囊胚移植进了比较分析,在59周期对111枚囊胚行解冻移植,临床妊娠率和种植率分别为59.3%和43.2%,继续妊娠率为47.5%,单胎率和双胎率分别为60.7%和39.3%,两组间差异无统计学意义(P>0.05)。早期研究[4]也发现对于OHSS高危患者,容易成功培养出高质量的囊胚,应采用本文报道的方案实施囊胚解冻移植比较安全高效,即防止因怀孕加重迟发型OHSS,又能获得较高的临床妊娠结局。
正是由于解冻囊胚的成功率高,其临床应用日益广泛,以后囊胚解冻移植出生的子代会越来越多,对该技术的安全性评价及妊娠妇女的围产监测研究迫在眉睫。本研究分别对玻璃化冻融囊胚助孕妊娠与自然妊娠病例娩出胎盘进行观察比较分析,两组胎盘面积、胎盘质量比较差异有统计学意义(P<0.05)。提示玻璃化冻融囊胚助孕娩出胎盘大于自然妊娠。潘漪莲等[5]回顾性分析产前检查及分娩的760例辅助生育受孕双胎孕妇(ART组)和764例自然受孕双胎孕妇(对照组)的妊娠期并发症及新生儿结局。结果发现ART组孕妇平均年龄(32.7±3.5)岁高于对照组(30.0±3.7)岁,差异有统计学意义(P<0.05);ART组前置胎盘、产后出血及妊娠期糖尿病发生率高于对照组,差异有统计学意义(P<0.05);ART组择期剖宫产率为85.52%,高于对照组(80.09%),其急诊剖宫产导致早产的比例低于对照组,差异有统计学意义(P<0.05);新生儿出生体质量、窒息率、先天畸形发生率及病死率比较差异无统计学意义(P>0.05)。认为ART在双胎妊娠中会增加前置胎盘、产后出血及妊娠期糖尿病的发生率,但并不增加其他产科主要并发症及围产儿风险,辅助生育受孕双胎孕妇并无预防性减胎的必要。姚娟[6]也回顾分析接受辅助生育技术成功妊娠、并获完整随访的1 107例孕妇(观察组),选择同期出生并与观察组母亲年龄及分娩时间均相当的正常受孕母亲1 138例作为对照组,比较两组孕妇围产期情况和两组新生儿并发症发生情况。观察组的双胎或多胎妊娠率、剖宫产率、早产率和早期先兆流产率均显着高于对照组,差异有统计学意义(P<0.05);而对照组的胎儿宫内窘迫的发生率明显高于观察组,差异有统计学意义(P<0.05)。观察组的死胎率、低出生体质量率、出生缺陷率和新生儿病死率均高于对照组,但仅有低出生体质量率差异有统计学意义(P<0.05)。其部分结果也支持本研究结果,有待于进一步扩大样本证实。
胎盘是由胎儿的丛密绒毛膜与母体的基蜕膜共同组成的圆盘形结构,进行物质交换是胎盘的主要功能,胎儿通过胎盘从母血中获得营养和O2,排出代谢产物和CO2。胎盘的合体滋养层能分泌数种激素,对维持妊娠起重要作用。滋养细胞来源于形成中胚泡的滋养内胚层,是胚泡中最先分化的细胞。滋养细胞的增殖、分化、凋亡和程序性侵入是胚胎发育、胎盘形成及胎儿生长所必需的。滋养细胞的功能异常可导致子痫前期、子痫、不明原因的流产、胎儿生长受限等妊娠相关性疾病及葡萄胎、侵袭性葡萄胎、绒癌等妊娠滋养细胞疾病的发生。已经有研究表明[7-8],Grb10可能对早期胚胎发育有着重要的影响,是胚胎期发育过程中多脏器表达的一个基因。小鼠行为学研究[9]中显示印记基因Grb10的母本表达涉及胎儿成长、新陈代谢、脂肪储存,而父本表达调控着成年小鼠的社会行为,是胚胎发育及多种生理活动中的重要基因[10-11]。对胎盘Grb10表达水平进行分析可以反应子代生长发育安全性[12-13]。本研究首次经过免疫组织化学染色后,发现玻璃化冻融囊胚助孕妊娠组与自然妊娠组胎盘细胞滋养层与合体滋养层细胞均有不同程度的Grb10表达。两组胎盘组织Grb10蛋白在表达率、表达强度、免疫组织化学评分比较差异无统计学意义(P>0.05)。Real-time PCR结果显示,玻璃化冻融囊胚助孕妊娠组与自然妊娠组胎盘组织中Grb10在转录水平差异无统计学意义(P>0.05)。Western blot结果显示,玻璃化冻融囊胚助孕妊娠组与自然妊娠组胎盘组织中Grb10蛋白质表达水平组间差异无统计学意义(P>0.05)。提示囊胚培养与冻融移植尚未对胎盘Grb10的表达产生影响。人类印记基因Grb10在胚胎形成时期,由母方表达,而在胎儿形成后,脑中为父本优先表达,母方等位基因在周围组织和器官中表达。囊胚培养与冻融移植对胎盘Grb10等印记基因[14]表观遗传修饰方面是否产生影响有待进一步研究。
[1]Zhu D,Zhang J,Cao S,et al.Vitrified-warmed blastocyst transfer cycles yield higher pregnancy and implantation rates compared with fresh blastocyst transfer cycles-time for a new embryo transfer strategy?[J].Fertil Steril,2011,95:1691-1695.
[2]Ku PY,Lee RK,Lin SY,et al.Comparison of the clinical outcomes between fresh blastocyst and vitrified-thawed blastocyst transfer[J].J Assist Reprod Genet,2012,29:1353-1356.
[3]Hong SW,Sepilian V,Chung HM,et al.Cryopreserved human blastocysts after vitrification result in excellent implantation and clinical pregnancy rates[J].Fertil Steril,2009,92:2062-2064.
[4]Lin DL,Jing R,Cairong C,et al.Frozen two day 3 embryos and subsequently produced blastocysts by vitrification:advantages for IVF/ICSI patients at high risk of ovarian hyperstimulation syndrome[J].Int J Clin Exp Med,2016,9(3):6986-6999.
[5]潘漪莲,张艳,陆海茜,等.辅助生殖与自然受孕双胎妊娠围产结局比较-附1524例临床分析[J].生殖与避孕,2015,35(10):724-729.
[6]姚娟.辅助生育技术胎儿的围产期结局研究[J].中外医学研究,2014(14):48-49.
[7]Deng Y,Zhang M,Riedel H.Mitogenic roles of Gab1 and Grb10 as direct cellular partners in the regulation of MAP kinase signaling[J].J Cell Bioc,2008,105(5):1172-1182.
[8]Monami G,Emiliozzi V,Morrione A.Grb10/Nedd4-mediated multiubiquitination of the insulin-like growth factor receptor regulates receptor internalization[J].J Cell Physiol,2008,216(2):426-437.
[9]刘齐,王燕,陈岩,等.Grb10基因在小鼠胚期特异性表达分析[J].遗传,2009,31(7):732-740.
[10]Kim M,Semple I,Kim B,et al.Drosophila Gyf/GRB10 interacting GYF protein is an autophagy regulator that controls neuron and muscle homeostasis[J].Autophagy 2015,11(8):1358-1372.
[11]Mroue R,Huang B,Braunstein S,et al.Correction:Monoallelic Loss of the Imprinted Gene Grb10 Promotes Tumor Formation in Irradiated Nf1+/-Mice[J].PLoS Genet,2015,11(6):e1005327.
[12]Mukhopadhyay A,Ravikumar G,Dwarkanath P,et al.Placental expression of the insulin receptor binding protein GRB10:Relation to human fetoplacental growth and fetal gender[J].Placenta,2015,36(11):1225-1230.
[13]Adnani L,Langevin LM,Gautier E,et al.Zac1 regulates the differentiation and migration of neocortical neurons via pac1[J].J Neurosci,2015,35(39):13430-13447.
[14]Bretz CL,Langohr IM,Lee S,et al.Epigenetic instability at imprinting control regions in a Kras(G12D)-induced T-cell neoplasm[J].Epigenetics,2015,10(12):1111-1120.
Placental Grb10 expression analysis for evaluation of security for blastocyst vitrification*
LinDianliang1,QuanSong2△,KangYuefan1,YiJinsong1,YuAili1,LinYuan1
(1.HumanAssistedReproductiveResearchUnit,FujianProvincialMaternityandChildren′sHospitalofFujianMedicalUniversity,Fuzhou,Fujian350001,China;2.CenterforReproductiveMedicine,DepartmentofObstetricsandGynecology,NanfangHospital,SouthernMedicalUniversity,Guangzhou,Guangdong510515,China)
Objective To analyze the expression of the placenta Grb10 from women conceived by transferred thawed blastocyst,and to evaluate the security of blastocysts vitrification.Methods A cross-sectional study was performed in the Department of Obstetrics and Gynecology of Fujian Provincial Maternity and Children′s Hospital from January 2012 to May 2014,50 women conceived by transferring thawing blastocyst and 50 natural pregnancy control women were enrolled in this study.The expression of Grb10 protein was detected by immunohistochemistry and Western blot,and the expression of Grb10 mRNA was detected by Real-time PCR method.Results Comparison of two cases of gestational age, gestational age, fetal sex, fetal body weight, body length, head circumference, abdominal circumference,there were no significant differences(P>0.05),comparison of placental area, placental weight,the difference was statistically significant(P<0.05).Real-time PCR and Western blot results showed that,there was no significant difference in the expression of Grb10 mRNA and protein between the two groups(P>0.05).Conclusion Blastocysts vitrification may increase the area and quality of delivery of placenta,however,there was no significant change in the expression of Grb10 in placenta.
blastula;vitrification;placenta;Grb10
10.3969/j.issn.1671-8348.2017.11.001
福建省自然科学基金(2014J01277);福建省卫生系统中青年骨干人才培养项目(2013-ZQN-JC-7);福建省妇幼保健院科研基金(闽妇幼13-08,13-09,10-01)。 作者简介:林典梁(1973-),副主任医师,博士,主要从事人类辅助生殖技术研究。△
,E-mail:quansong@smu.edu.cn。
R715
A
1671-8348(2017)11-1441-04
2016-11-11
2017-01-27)

