山东省辣椒炭疽病病原菌的鉴定及高效防治药剂的筛选
高杨杨,禾丽菲,李北兴,林琎,慕卫,刘峰
(1山东农业大学植物保护学院,山东泰安 271018;2山东省蔬菜病虫生物学重点实验室,山东泰安 271018;3山东省高校农药毒理与应用技术重点实验室,山东泰安 271018;4山东农业大学农药环境毒理研究中心,山东泰安 271018)
山东省辣椒炭疽病病原菌的鉴定及高效防治药剂的筛选
高杨杨1,2,禾丽菲1,2,李北兴3,4,林琎1,3,慕卫1,4,刘峰1,3
(1山东农业大学植物保护学院,山东泰安 271018;2山东省蔬菜病虫生物学重点实验室,山东泰安 271018;3山东省高校农药毒理与应用技术重点实验室,山东泰安 271018;4山东农业大学农药环境毒理研究中心,山东泰安 271018)
【目的】明确山东省露地辣椒主产区炭疽病致病菌的种类,评价不同药剂对致病菌的毒力和活体接种防效,筛选高效防治药剂。【方法】从山东省菏泽、济宁等5个辣椒主产区采集感炭疽病的辣椒果实,经分离、纯化培养后,观察菌落及分生孢子的形态、大小和病原菌的致病性,利用真菌通用引物ITS4和ITS5对4个典型代表菌株的rDNA-ITS进行扩增,对扩增产物进行回收和测序,并利用MEGA 5.1软件进行基于病原菌的rDNA-ITS序列和GenBank中相关炭疽菌序列的系统发育树构建,确定病原菌的种类。采用菌丝生长速率法和孢子萌发法测定11种杀菌剂对辣椒炭疽病菌的毒力,通过活体接种试验验证药剂对辣椒炭疽病的防效。【结果】分离得到的27个菌株形态特征相同,气生菌丝较发达,初呈白色,而后逐渐变为浅灰色,分生孢子无色单胞,椭圆形,一端稍尖,大小为(7.48—14.69)μm×(2.52—5.64)μm。将所分离得到的菌株接种于刺伤果实或无伤口果实,两者均可发病,但刺伤果实上病斑发展快。病菌既侵染未成熟的辣椒果实,也侵染成熟的果实,病斑呈椭圆形凹陷,表面有橘黄色的分生孢子团。所选取的4个代表性菌株的rDNA-ITS序列的长度为562、541、557和553 bp,通过系统进化树分析,4个代表菌株与炭疽菌属尖孢炭疽菌(Colletotrichum acutatum)聚在同一分支上,亲缘关系置信度为100%。室内毒力测定试验表明,吡唑醚菌酯、咯菌腈和啶菌唑对尖孢炭疽菌的菌丝生长和孢子萌发均具有较高的抑制活性。活体接种试验表明,吡唑醚菌酯、咯菌腈和啶菌唑对辣椒炭疽病具有较好的预防和治疗作用,在浓度为400 μg·mL-1时,对辣椒炭疽病的预防效果和治疗效果均大于60%,高于对照药剂嘧菌酯的防效。【结论】引起山东省露地辣椒主产区辣椒炭疽病的致病菌为尖孢炭疽菌。吡唑醚菌酯、咯菌腈和啶菌唑对该菌具有较高的毒力和活体防效,在辣椒炭疽病的田间防治中具有较大的应用潜力。
辣椒炭疽病;尖孢炭疽菌;杀菌剂;室内毒力;防治效果
0 引言
【研究意义】近年来,山东省露地辣椒种植面积逐年扩大,已成为重要的蔬菜和经济作物之一。辣椒炭疽病是影响辣椒产量和品质的一种主要病害。辣椒炭疽病发生高峰期在7月初至9月中旬,此时正值山东省高温多雨的季节,导致炭疽病防治难度加大,严重时病果率高达50%—60%。辣椒炭疽病的防治措施很多,包括农业防治、生物防治和化学防治。农业防治措施主要以种植抗性品种为主,目前中国辣椒和下垂辣椒是已鉴定出的高抗炭疽病的材料,但是由于存在种间杂交障碍,难以直接应用于育种中,加上辣椒抗性基因资源的有限性及不同地区优势炭疽菌种类的不同,严重阻碍了抗性品种的培育及应用[1-2]。生物防治措施手段尚不成熟,对辣椒炭疽病仅有一定缓解作用,难以广泛应用于生产实践中[3]。在实际生产中该病主要依靠化学防治[4],因此,明确山东省辣椒炭疽病病原菌的种类,筛选新的高效防治药剂,对满足生产需求具有重要意义。【前人研究进展】目前,化学防治辣椒炭疽病主要存在以下问题:(1)目前国内登记用于防治辣椒炭疽病的药剂种类主要包括甲氧基丙烯酸酯类、铜制剂、苯并咪唑类、二硫代氨基甲酸盐类、唑类杀菌剂,还包括氟啶胺、苦参碱·蛇床素、恶霉灵·乙蒜素、二氰蒽醌等药剂。但有研究发现多菌灵、甲基硫菌灵、代森锰锌和咪鲜胺等常用杀菌剂对尖孢炭疽菌引起的辣椒炭疽病的田间防治效果不理想[4-5]。尖孢炭疽菌(Colletotrichum acutatum)寄主范围极广,除侵染辣椒外,还可侵染草莓、苹果、枇杷、柑橘、芒果等重要的经济作物[6]。有报道显示尖孢炭疽菌对苯菌灵等苯并咪唑类药剂具有较强的耐受力[7-8]。三唑类杀菌剂的过量使用对果实膨大存在一定风险;(2)炭疽病的致病菌种类多,不同种对药剂的敏感性存在差异[9-10],再加上各地用药背景的不同,导致田间防治效果不稳定。在中国辣椒炭疽病致病菌主要有胶胞炭疽菌(C. gloeosporioides)、平头炭疽菌(C. truncatum)、球状炭疽菌(C. coccodes)和尖孢炭疽菌[11-13],其中胶胞炭疽菌主要分布在中部地区,平头炭疽病菌分布在中部和南部部分地区,尖孢炭疽菌主要分布在中部和南部地区[13]。笔者调查中发现,山东地区辣椒炭疽病的防治以单一喷施甲基硫菌灵、多菌灵等苯并咪唑类药剂为主。加上辣椒炭疽病发生周期长,农民盲目加大施药次数(7—10次),导致用药量增加而防效增加不明显等问题。一般病原菌的鉴定采用形态学的方法,而后辅以分子生物学技术以保证鉴定结果的可靠性和科学性[14]。【本研究切入点】目前,对引起山东省部分地区辣椒炭疽病的病原菌种类缺乏系统研究,而不同种类炭疽病菌对药剂敏感性存在差异[9-10],生产上用于该病防治的药剂多为老品种杀菌剂,不利于辣椒炭疽病的高效防治。【拟解决的关键问题】利用形态学与分子生物学的手段鉴定所分离纯化菌株的种类,并通过室内毒力和活体接种试验相结合的方法测定病原菌对新型杀菌剂的敏感性,为山东省辣椒炭疽病的科学防治提供指导。
1 材料与方法
1.1 供试材料
1.1.1 病原菌的分离和培养 病果采自山东省济宁、菏泽和德州等主要露地辣椒种植区,采集信息如表1。先采用组织分离法进行分离[4],剪取病果的病健交界处组织,用75%的酒精消毒30 s,后用无菌水漂洗3次,置于PDA培养基上培养,待生长2—3 d后将长出的菌落进行纯化并采用单孢分离的技术进行分离,所得到的纯培养物在 4℃冰箱中保存备用。室内毒力测定时选择用于分子生物学鉴定的4个代表菌株,分别为采自济宁市金乡县的菌株 JN7、采自菏泽市巨野县的菌株HZ2、采自潍坊市寿光市的菌株WF4、采自泰安市岱岳区的菌株TA1;由于各菌株致病力无差异,离体活体防效测定时选择采自泰安市岱岳区的菌株TA1。

表1 采集信息Table 1 Collecting information
1.1.2 辣椒品种、所用培养基及供试药剂 由表 1可知目前京信红2号和黄线7318是主要的种植品种,因此致病力试验中辣椒品种选用黄线7318;活体接种试验中辣椒品种选择京信红2号。
培养基为马铃薯琼脂培养基(potato dextrose agar,PDA):马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 L;水琼脂培养基(water agar,WA):琼脂10 g,葡萄糖20 g,水1 L。
供试药剂共11种:98%咯菌腈(fludioxonil),浙江省杭州宇龙化工有限公司;90.9%啶菌唑(pyrisoxazole),沈阳科创化学品有限公司;96.5%苯醚甲环唑(difenoconazole)江苏优士化学有限公司;98.3%吡唑醚菌酯(pyraclostrobin),山东康乔生物科技有限公司;98.5%多菌灵(carbendazim),苏蓝丰生物化工股份有限公司;95%甲基硫菌灵(thiophanate-methyl),安徽广信农化股份有限公司;96%戊唑醇(tebuconazole),上虞颖泰精细化工有限公司;95%异菌脲(iprodione),江苏蓝丰生物化工股份有限公司;96.8%氟菌唑(trifumizole),上海生农生化制品有限公司;98.7%百菌清(chlorothalonil),江阴苏利化学股份有限公司;95%嘧菌酯(azoxystrobin),江苏辉丰农化股份有限公司。其中,多菌灵原药用0.1 mol·L-1的HCl溶解,其余10种药剂原药用丙酮溶解,均配制成质量浓度为1×105μg·mL-1的母液,于4℃冰箱中保存,用于室内毒力测定。99%水杨肟酸(salicylhydroxamic acid,SHAM)由日本东京化成工业株式会社生产,溶于甲醇制成1×104μg·mL-1的母液,用于QoIs类杀菌剂室内毒力测定。
250 g·L-1吡唑醚菌酯EC(巴斯夫植物保护(江苏)有限公司),50%咯菌腈 WP(先正达苏州作物保护有限公司),25%啶菌唑EC(沈阳科创化学品有限公司),250 g·L-1嘧菌酯SC(浙江世佳科技有限公司),用于活体防效的测定。
1.2 试验方法
1.2.1 田间病害调查及症状观察 于2015年,对山东省济宁、菏泽和德州等露地辣椒种植区辣椒炭疽病的发生和危害进行调查,并对田间自然发病的辣椒果实进行拍照记录。
1.2.2 病原菌形态观察 将分离得到的菌株接种在PDA培养基上,25℃黑暗培养8 d后观察记录菌落的形状、颜色及基质颜色[14]。在光学电子显微镜(Olympus IX-71,Japan)下观察分生孢子的形态、大小并拍照。
1.2.3 病原菌致病力鉴定 在辣椒种植温室中摘取未接触过药剂的成熟和未成熟的辣椒果实(品种黄线7318),先用75%酒精对辣椒果实表面进行消毒,再利用无菌水冲洗3遍后晾干备用。将辣椒置于含滤纸的保鲜盒(16 cm×10 cm×6 cm)中培养,滤纸用灭菌去离子水浸湿以便保湿,选择孢子悬浮液接种的方式。
孢子悬浮液制备:将纯化的27个菌株分别接种在PDA平板上,25℃黑暗培养8 d后,加入10 mL的无菌水刮洗菌丝,所得到的悬浮液经3层纱布过滤,滤液于10 000 r/min离心5 min,弃掉上清液,将分生孢子重新悬浮在10 mL的无菌水中。在显微镜下使用血球计数板来计算孢子悬浮液的浓度,最终将孢子悬浮液浓度调至1×105个/mL。
伤口接种:利用消毒的接种针刺伤辣椒果实,伤口深度1 mm左右,用移液器吸取孢子悬浮液10 μL(浓度为1×105个/mL)置于伤口处,每个果实接种两处,每个处理接种10个果实,将接种后的果实在培养箱中(25℃;L﹕D = 12 h﹕12 h;相对湿度85% 以上)培养7 d后,观察病害发生情况及病斑形态。
无伤口接种:与针刺接种的唯一区别是不刺伤辣椒,其余操作相同。
待接种后的辣椒发病后,根据柯赫式法则,将病原菌重新进行分离纯化,观察新分离物与接种菌是否相同。
1.2.4 病原菌的分子生物学鉴定 病原菌DNA的提取:在所采集的 27株菌中随机选取 4个代表菌株(JN7、HZ2、WF4、TA1)进行病原菌的分子生物学鉴定。将4个典型代表菌株接种到PDA平板上进行活化,25℃黑暗培养7 d后,利用灭菌的玻璃片将菌丝刮下,称取菌丝0.5 g,采用CTAB的方法提取DNA[15]。
rDNA-ITS的PCR扩增:采用真菌核糖体基因转录间隔区的通用引物ITS4和ITS5,对4个代表菌株的基因组DNA进行PCR扩增。PCR扩增反应体系总体积为50 μL,反应液包括引物ITS4和ITS5各1 μL(20 μmoL·L-1),dNTP 4 μL(2.5 mmoL·L-1),模板DNA 2 μL,Taq DNA聚合酶0.5 μL(1 U·μL-1),10× PCR buffer 5 μL,ddH2O 36.5 μL,用PCR仪进行扩增。PCR扩增的条件:94℃预变性5 min,94℃变性30 s, 56℃退火30 s,72℃延伸50 s,共32个循环,最后72℃延伸10 min,4℃保存。
PCR的扩增产物经1%的琼脂糖凝胶电泳检验后,用凝胶成像仪进行观察并拍照,利用DNA凝胶回收试剂盒(BioTeke)进行胶回收,回收产物交由铂尚生物技术(上海)有限公司进行测序。
序列分析和数据处理:将测序结果在GenBank数据库里进行序列比对,通过NCBI提供的Blast工具,搜索同源性较高的序列。将目标序列和GenBank中搜索得到的相关炭疽菌序列放在同一个 FASTA格式编辑成的文本文档中,利用程序Clustal W进行序列比对,将两端的引物序列去掉,利用MEGA 5.1软件中的最大简约法(maximum parsimony,MP)构建系统发育树,分析亲缘关系。
1.2.5 室内药剂筛选 菌丝生长速率法[16]:将预先准备好的各供试药剂母液用0.1% T-80水溶液稀释后,加入到冷却至50℃左右的PDA培养基中,混合均匀后将培养基倒入9 cm的培养皿中,获得一系列有效试验浓度的培养平板,其中咯菌腈、啶菌唑、苯醚甲环唑和吡唑醚菌酯的系列浓度均为0、0.01、0.02、0.04、 0.08、0.16 μg·mL-1,多菌灵和甲基硫菌灵的系列浓度为0、0.04、0.08、0.12、0.16、0.20 μg·mL-1,戊唑醇、异菌脲和嘧菌酯的系列浓度为 0、0.5、1、2、4、8 μg·mL-1,氟菌唑和百菌清的系列浓度为0、5、10、20、 40、60 μg·mL-1。为抑制旁路呼吸作用[17],吡唑醚菌酯和嘧菌酯的 PDA平板中加入适当体积的水杨肟酸(SHAM)至终浓度为100 μg·mL-1。每个处理重复4次。以加入等量的T-80溶液的PDA平板为空白对照。以加入含溶剂的T-80溶液的PDA平板为溶剂对照,溶剂用量选择采用最小稀释倍数法确定,其中吡唑醚菌酯和嘧菌酯的溶剂均为丙酮和甲醇,多菌灵的溶剂为0.1 mol·L-1HCl,其余药剂的溶剂为丙酮。用打孔器在培养8 d的菌落(JN7、HZ2、WF4、TA1)边缘打取菌饼(8 mm),将含有菌丝的一面朝下,接种在上述培养皿的中央。25℃黑暗培养6 d后,利用十字交叉法垂直方向量取菌落直径(cm),计算菌丝生长的抑制率。
孢子萌发法[18]:将供试药剂的母液用0.1%的T-80水溶液稀释,再加入到冷却的WA培养基中混匀后,倒入直径为9 cm的培养皿中,制成相应有效试验浓度的平板。其中吡唑醚菌酯和咯菌腈的系列浓度为 0、 0.004、0.008、0.016、0.032、0.064 μg·mL-1,啶菌唑的系列浓度为0、0.03、0.06、0.09、0.12、0.15 μg·mL-1,嘧菌酯的系列浓度为0、0.05、0.1、0.2、0.4、0.8 μg·mL-1,苯醚甲环唑、多菌灵、甲基硫菌灵、戊唑醇和异菌脲的系列浓度为0、5、10、20、40、80 μg·mL-1,氟菌唑和百菌清的系列浓度为0、30、60、120、180、240 μg·mL-1。供试药剂吡唑醚菌酯和嘧菌酯的WA平板上需要加入适当体积的水杨肟酸至 100 μg·mL-1以抑制旁路呼吸作用,并设置空白对照和溶剂对照,每个处理重复4次。对照设置方法同菌丝生长速率法。利用无菌水冲洗培养8 d的菌落(JN7、HZ2、WF4、TA1),后经灭菌的双层纱布过滤,滤液经离心机10 000 r/min离心5 min后弃掉上清液,用灭菌水将分生孢子重悬
调节至浓度为1×105个/mL。利用移液器吸取100 μL
的孢子悬浮液打在凝固的WA平板中,使用涂布器将孢子悬浮液在WA培养基上涂布均匀。25℃黑暗培养8 h后观察分生孢子的萌发情况,当芽管长度超过孢子长度的一半时视为萌发,每个平板至少观察200个以上的分生孢子,最后计算孢子萌发抑制率。
相对毒力指数[19]:在试验的登记药剂(嘧菌酯、苯醚甲环唑、多菌灵、甲基硫菌灵、戊唑醇、异菌脲、百菌清)中选择对辣椒炭疽病病原菌菌丝生长和孢子萌发均具有较高抑制作用的药剂为标准药剂,参照以下公式计算相对毒力指数。相对毒力指数(RTI)= 标准药剂的EC50/试验药剂的EC50。
1.2.6 4种试验药剂对辣椒炭疽病的预防和治疗效果[20]由于4个代表菌株的致病力无明显差异,所以活体防效试验选择TA1为供试菌株。根据前期室内毒力测定结果,选取4个对病原菌菌丝生长和孢子萌发都具有较高抑制活性的药剂进行活体试验,其中嘧菌酯为对照药剂。
在试验基地中采集未接触过药剂的大小和健康状况一致的辣椒果实(京信红2号),利用无菌水冲洗3次后晾干,置于含有浸湿滤纸的保鲜盒(16 cm×10 cm×6 cm)中。
为了评估药剂的治疗效果,试验所采集的辣椒果实先按照上述方法接种孢子悬浮液,24 h后按照上述方法喷施相同浓度的药液,对照果实喷施清水。每个处理20个果实,将试验辣椒在培养箱(25℃;L﹕D = 12 h﹕12 h;相对湿度85%以上)中培养7 d后,在病斑的垂直方向上量取直径(mm)后取平均值计算防效,试验共重复两次。
2 结果
2.1 辣椒炭疽病的危害及田间症状
2015年辣椒炭疽病在山东省露地辣椒种植区大面积发生,而且发展蔓延极快,严重地块病果率达到50%—60%。露地辣椒整个生长期一般从 4月初到 9月中旬,期间经历高温和多雨的夏季,温湿度条件有利于辣椒炭疽病的发生。该类病害只危害辣椒果实。发病初期在果实上产生淡褐色凹陷的小点,后逐渐蔓延至椭圆形的凹陷斑,而且病斑上产生大量橘黄色的分生孢子(图1),成为再侵染源危害其他健康果实。
2.2 病原菌的分离纯化及形态特征
从采集的样品中共分离得到27个菌株,分别置于PDA平板上25℃黑暗培养8 d后观察分生孢子形态、大小、菌落形态和颜色等。经观察发现27个菌株的形态特征相同均表现为分生孢子单胞,无色,长椭圆形,一端稍尖,大小为(7.48—14.69)μm ×(2.52—5.64) μm(图2-A),菌落边缘光滑圆形,气生菌丝较为发达初为白色,后期逐渐变为灰白色,基质具有明显的灰黑色同心轮纹(图2-B、2-C)。由于27个菌株形态特征一致,致病症状相同,致病力无显著差异,因此随机选取4个代表菌株(JN7、HZ2、WF4、TA1)进行后续试验。

图1 田间辣椒炭疽病病情发展Fig. 1 The development of pepper anthracnose in the field
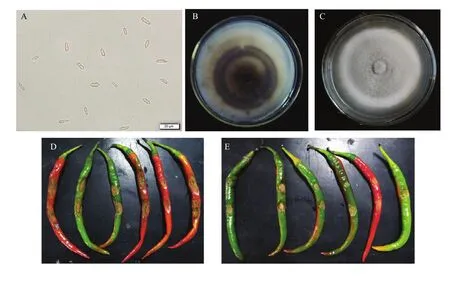
图2 辣椒炭疽病菌的形态特征及致病力Fig. 2 Morphology and pathogenicity of the pathogen causing the anthracnose on pepper
2.3 病原菌的致病性
该类病原菌既可以侵染成熟的辣椒果实,也可以侵染未成熟的辣椒果实(图2-D、2-E)。通过针刺接种法接种的辣椒果实,在接种后第3天开始发病,病斑扩展速度快,到第7天病斑直径可达到10—21 mm(图 2-D)。若为无伤口接种的辣椒果实,在接种后第5天开始发病,随后病斑开始扩展,但与伤口接种相比无伤口接种的病斑扩展速度较慢(图 2-E)。病斑凹陷、长椭圆形、中央产生大量橘黄色的分生孢子团(图2- D、2-E),分生孢子团干后可见同心环状的黑色的分生孢子盘,其人工接种发病症状与田间自然发病情况一致。根据柯赫式法则将病斑重新进行组织分离,得到的分离物与接种菌一致,证明该菌为辣椒炭疽病的致病菌。
在分离的 27株菌对成熟和未成熟的辣椒果实的致病性对比试验中,所有菌株对成熟果实和未成熟的果实均具有致病性。从发病率和病斑直径来看,所有菌株的致病力无显著差异,同时在成熟果实上的病斑直径大于未成熟果实(表2)。
2.4 病原菌的rDNA-ITS 序列分析
以所选取的代表菌株JN7、HZ2、WF4、TA1的基因组DNA为模板,对其进行rDNA-ITS基因的PCR扩增,获得长度为562、541、557和553 bp大小的ITS序列(图3)。将测序结果提交至GenBank,获得登录号分别为KX830854-KX830857,Blast结果表明供试菌株与KJ627843、KC816048等几个尖孢炭疽菌的ITS序列99%相同。
将所分离菌株的rDNA-ITS序列与炭疽菌属的相关种进行比较,以Pestalotia algeriensis为外群,构建系统发育树,发育树显示菌株 KX830854-KX830857与尖孢炭疽菌聚在同一分支,并且与尖孢炭疽菌KJ627843、KC816048、KT215297等的ITS序列的亲缘关系置信度为 100%,胶胞炭疽菌聚在另一分支,而外群菌株P. algeriensis则以较远的亲缘关系处在系统发育树的外围(图4)。

表2 分离菌株在离体辣椒果实上的致病性Table 2 The pathogenicity of pathogen on the detached pepper fruits

图3 RDNA-ITS片段扩增产物电泳图谱Fig. 3 PCR amplification pattern
2.5 防治药剂的室内筛选
2.5.1 对菌丝生长的抑制活性 11种药剂中除百菌清外,其余药剂对4株尖孢炭疽菌的菌丝生长均具有良好的抑制作用,其中吡唑醚菌酯、咯菌腈、啶菌唑、苯醚甲环唑、多菌灵和甲基硫菌灵的毒力较高,平均 EC50分别为 0.1226、0.0306、0.0493、0.1248、 0.1345和0.1941 μg·mL-1,而嘧菌酯、戊唑醇、异菌脲和氟菌唑对菌丝生长的抑制活性相对较低,EC50均大于2.1 μg·mL-1(表3)。
2.5.2 对孢子萌发的抑制活性 吡唑醚菌酯、咯菌腈、啶菌唑和嘧菌酯对尖孢炭疽菌的孢子萌发有较高的抑制毒力,平均 EC50为 0.0138、0.0468、0.1172和0.3593 μg·mL-1,而其余杀菌剂对尖孢炭疽菌孢子萌发的抑制活性低,EC50均大于 21 μg·mL-1(表3)。
通过表3可以发现在登记药剂多菌灵、甲基硫菌灵、戊唑醇、苯醚甲环唑和嘧菌酯中,嘧菌酯对辣椒炭疽病菌的菌丝生长和孢子萌发均有较高的抑制毒力,因此选择嘧菌酯为标准参考药剂。其中吡唑醚菌酯、咯菌腈和啶菌唑对尖孢炭疽菌的菌丝生长和孢子萌发的抑制毒力均高于嘧菌酯的3倍。
2.6 4种试验药剂对辣椒炭疽病的预防和治疗作用
该4种药剂对辣椒炭疽病均有一定的防治效果,且各药剂的预防作用均大于其治疗作用,防治效果随着药剂浓度的提高而增加。预防活性试验中,咯菌腈400 μg·mL-1的防治效果最高为72.74%,其次为吡唑醚菌酯和啶菌
唑400 μg·mL-1防治效果分别为70.01%和61.61%,上述3种药剂400 μg·mL-1处理对辣椒炭疽病的防治效果均显著高于嘧菌酯 400 μg·mL-1处理(P<0.01)。治疗活性试验中,吡唑醚菌酯400 μg·mL-1防治效果最高为 68.34%,其次为咯菌腈和啶菌
唑 400 μg·mL-1处理,防治效果分别为63.69%和61.00%,这3种药剂400 μg·mL-1的处理对辣椒炭疽病的防治效果也显著高于嘧菌酯400 μg·mL-1处理(P<0.01)(表4、图5)。

表3 11种药剂抑制尖孢炭疽菌菌丝生长和孢子萌发的毒力Table 3 Inhibitory effect of 11 fungicides on mycelial growth and spore germination of C. acutatum
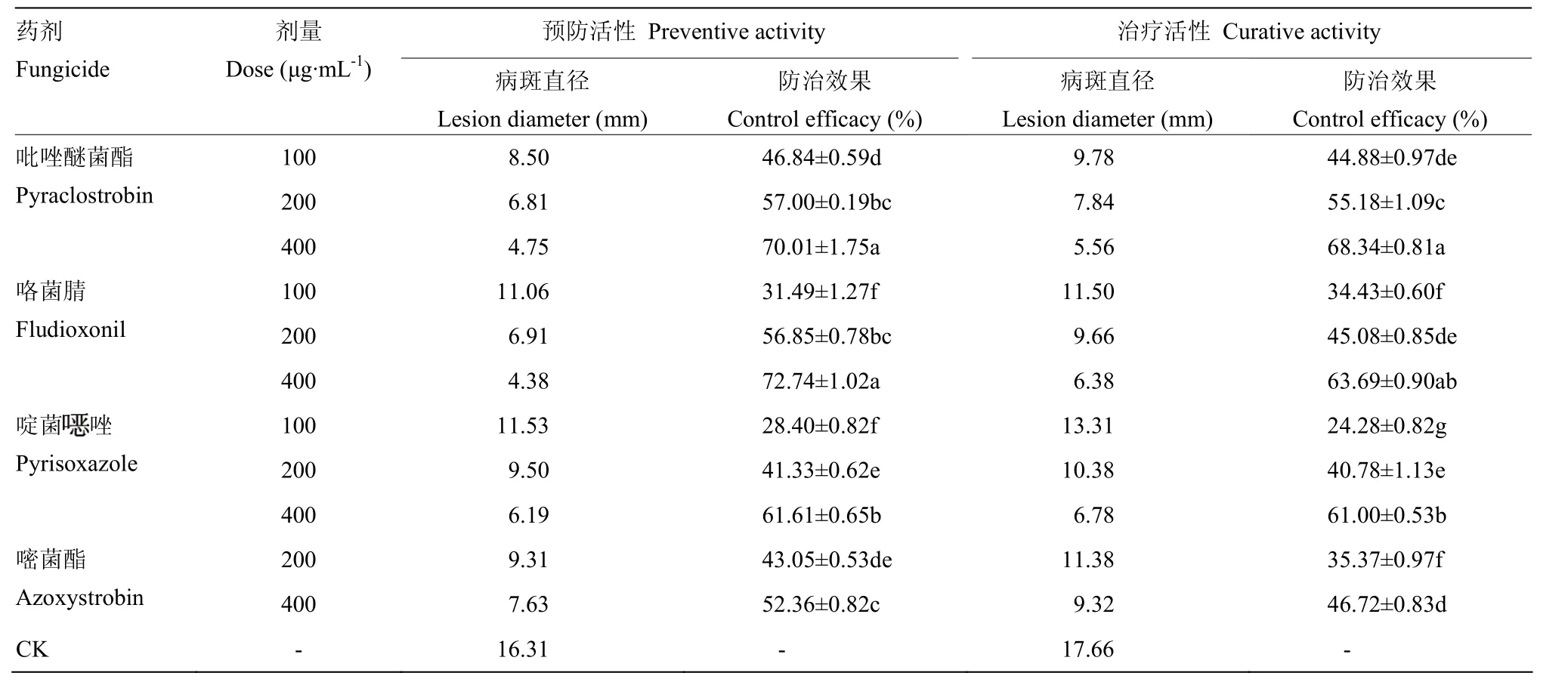
表4 4种药剂对辣椒炭疽病的预防作用和治疗作用Table 4 The preventive and curative activity of four fungicides against pepper anthracnose

图5 4种药剂对辣椒炭疽病的预防和治疗防效Fig. 5 Preventive and curative activity of the four fungicides against pepper anthracnose
3 讨论
炭疽菌属是一个复杂的属,包括多个致病种,并且部分种致病力极强,给农业生产带来了巨大损失[21-22]。目前,在美国的佛罗里达州和俄亥俄州等地[23-24],尖孢炭疽菌是辣椒炭疽病的主要致病菌。2012年,夏花等[4]在湖南辣椒种植区也首次报道了尖孢炭疽菌。由于尖孢炭疽菌寄主范围广,可为害辣椒、草莓、苹果、茄子、芒果和银杏等作物[25-26],并且该类病菌引起的炭疽病蔓延快、防治难度大[4],对农业生产影响极大。所以,确定致病菌的种类对于该病的科学防治具有重要意义。起初炭疽病菌的鉴定是基于形态学层面,随着分子生物学等技术不断发展,给炭疽菌的鉴定提供了科学的依据[27-29]。
本研究所分离菌株特征是在PDA培养基上,气生菌丝初为白色后期转变为灰白色,基质后期出现黑色的同心轮纹,分生孢子单生,长椭圆形,一端尖,与夏花等报道的尖孢炭疽菌特征一致[4,14]。夏花等[4]发现尖孢炭疽菌与胶胞炭疽菌引起的炭疽病症状虽然一致,但是尖孢炭疽菌既可以侵染成熟的辣椒果实也可以侵染未成熟的辣椒果实,而胶胞炭疽菌只侵染成熟的辣椒果实。本研究所分离的炭疽病菌既侵染未成熟辣椒果实也侵染成熟的辣椒果实。同时该病菌引起的辣椒炭疽病,病斑长椭圆形凹陷,中央产生大量橘黄色的分生孢子团,与夏花等[4]所描述的尖孢炭疽病菌的致病症状相同。系统进化树分析表明,试验菌株与胶胞炭疽菌并未分在同一分化枝上,证明两者的亲缘关系较远,同时试验菌株与尖孢炭疽菌聚在同一分支并且两者亲缘关系的置信度高达 100%。因此可以断定本研究所采集的菌株为尖孢炭疽菌,后续还会继续进行多点、多年的跟踪采集和鉴定。
在植物病害管理过程中,要做到杀菌剂的科学使用需要兼顾防治效益和抗性治理。本研究中3种药剂在低浓度时,防治效果并不理想,加之与多菌灵、甲基硫菌灵等常规药剂相比目前零售价格较高,所以为提高防治效益,在实际生产中可考虑与常规药剂混用以及在发病前或初期保护性施药。陈娟芳等[36]研究发现吡唑醚菌酯和甲基硫菌灵复配对红色炭疽病菌和黑点炭疽病菌具有很好的抑制效果。PERES等证明尖孢炭疽菌对苯并咪唑类药剂已产生抗性[7-8]。在本研究中苯并咪唑类杀菌剂对尖孢炭疽病菌的孢子萌发抑制作用低,但对菌丝生长仍具有较高的活性,未见抗性现象,可能与该地区目前苯并咪唑类药剂使用状况有关。通过对采集地用药习惯的调查,发现多数农户在前期以有机硫类、苯并咪唑类药剂为主,后期以三唑类及与其他杀菌剂混用为主。尽管如此,田间仍需要持续监测该地区尖孢炭疽病菌的抗性发展状况。为实现辣椒炭疽病的科学高效防治,田间具体的施药模式也需进一步探索。
4 结论
山东省露地辣椒主产区炭疽病主要由尖孢炭疽菌引起。吡唑醚菌酯、咯菌腈和啶菌唑对尖孢炭疽菌具有较好的抑制效果,在辣椒炭疽病的防治中具有一定的应用潜力。
[1] 孙春英, 毛胜利, 张正海, 王立浩, 张宝玺. 辣椒抗炭疽病遗传和育种研究进展. 园艺学报, 2013, 40(3): 579-590.
SUN C Y, MAO S L, ZHANG Z H, WANG L H, ZHANG B X. Progress on genetics and breeding of resistance to anthracnose (Colletotrichum spp.) in pepper. Acta Horticulturae Sinica, 2013, 40(3): 579-590. (in Chinese)
[2] KIM S H, YOON J B, PARK H G. Inheritance of anthracnose resistance in a new genetic resource, Capsicum baccatum PI594137. Journal of Crop Science and Biotechnology, 2008, 11(1): 13-16.
[3] 曾庆华, 肖仲久, 向金玉, 韩红绪. 3 种杀菌剂对黑点型辣椒炭疽病菌的室内毒力测定. 贵州农业科学, 2010, 38(5): 93-94.
ZENG Q H, XIAO Z J, XIANG J Y, HAN H X. Indoor toxicity determination of 3 fungicides to anthrax germ with black spots of hot pepper. Guizhou Agricultural Sciences, 2010, 38(5): 93-94. (in Chinese)
[4] 夏花, 朱宏建, 周倩, 高必达. 湖南芷江辣椒上一种新炭疽病的病原鉴定. 植物病理学报, 2012, 42(2): 120-125.
XIA H, ZHU H J, ZHOU Q, GAO B D. Pathogen identification of a new anthracnose of pepper in Zhijiang, Hunan. Acta PhytopathologicaSinica, 2012, 42(2): 120-125. (in Chinese)
[5] 刘冰, 王连英, 黄新根, 崔汝强, 宋水林. 1 种辣椒新炭疽病的初步鉴定及室内药剂筛选. 生物灾害科学, 2013, 36(3): 262-264.
LIU B, WANG L Y, HUANG X G, CUI R Q, SONG S L. Identification of a new anthracnose of peppers and screening of fungicides. Biological Disaster Science, 2013, 36(3): 262-264. (in Chinese)
[6] 陈国庆. 中国柑橘炭疽病病原种类及种群遗传多样性研究[D].杭州: 浙江大学, 2010.
CHEN G Q. Species of citrus anthracnose pathogens and the population genetic diversity of dominant species Colletotrichum gloeosporioides in China[D]. Hangzhou: Zhejiang University, 2010. (in Chinese)
[7] PERES N A R, SOUZA N L, ZITKO S E, TIMMER L W. Activity of benomyl of control of postbloom fruit drop of citrus caused by Colletotrichum acutatum. Plant Disease, 2002, 86(6): 620-624.
[8] TALHINHAS P, SREENIVASAPRASAD S, NEVES-MARTINS J, OLIVEIRA H. Molecular and phenotypic analyses reveal association of diverse Colletotrichum acutatum groups and a low level of C. gloeosporioides with olive anthracnose. Applied and Environmental Microbiology, 2005, 71(6): 2987-2998.
[9] CHUNG W H, ISHII H, NISHIMURA K, FUKAYA M, YANO K, KAJITANI Y. Fungicide sensitivity and phylogenetic relationship of anthracnose fungi isolated from various fruit crops in Japan. Plant Disease, 2006, 90(4): 506-512.
[10] 满益龙, 谭新球, 司乃国, 陈岳, 张卓, 刘勇, 张德咏. 不同辣椒炭疽病菌对唑菌酯的敏感性差异. 植物保护, 2016, 42(5): 171-176.
MAN Y L, TAN X Q, SI N G, CHEN Y, ZHANG Z, LIU Y, ZHANG D Y. Sensitivity differentiation of different Colletotrichum spp. strains causing anthracnose of Capsicum annuum L. plants to pyraoxystrobin. Plant Protection, 2016, 42(5): 171-176. (in Chinese)
[11] 申铉珠, 徐同, 章初龙, 陈竹君. 韩国与中国的辣椒炭疽病菌菌株的比较研究. 浙江大学学报 (农业与生命科学版), 2000, 26(6): 629-634.
SHIN H J, XU T, ZHANG C L, CHEN Z J. The comparative study of capsicum anthracnose pathogens from Korea with that of China. Journal of Zhejiang University (Agriculture and Life Sciences), 2000, 26(6): 629-634. (in Chinese)
[12] LIAO C Y, CHEN M Y, CHEN Y K, WANG T C, SHEU Z M, KUO K C, CHANG P F, CHUNG K R, LEE M H. Characterization of three Colletotrichum acutatum isolates from Capsicum spp. European Journal of Plant Pathology, 2012, 133: 599-608.
[13] DIAO Y Z, ZHANG C, LIU F, WANG W Z, LIU L, CAI L, LIU X L. Colletotrichum species causing anthracnose disease of chili in China. Persoonia Molecular Phylogeny and Evolution of Fungi, 2017, 38: 20-37.
[14] THAN P P, JEEWON R K D HYDE, PONGSUPASAMIT S, MONGKOLPORN O, TAYLOR P W J. Characterization and pathogenicity of Colletotrichum species associated with anthracnose on chilli (Capsicum, spp.) in Thailand. Plant Pathology, 2008, 57(3): 562-572.
[15] 易润华, 朱西儒, 周而勋. 简化 CTAB法快速微量提取丝状真菌
DNA. 湛江海洋大学学报, 2003, 23(6): 72-73. YI R H, ZHU X R, ZHOU E X. Simplified CTAB method for rapid extraction of filamentous fungi DNA. Journal of Zhanjiang Ocean University, 2003, 23(6): 72-73. (in Chinese)
[16] 孙广宇, 宗兆锋. 植物病理学实验技术. 北京: 中国农业出版社, 2002: 139-146.
SUN G Y, ZONG Z F. Plant Pathology Experiment Technology. Beijing: China Agriculture Press, 2002: 139-146. (in Chinese)
[17] LIANG H J, DI Y L, LI J L, YOU H, ZHU F X. Baseline sensitivity of pyraclostrobin and toxicity of SHAM to Sclerotinia sclerotiorum. Plant Disease, 2015, 99(2): 267-273.
[18] 中华人民共和国农业部. NY/T 1156.1—2006 农药室内生物测定试验准则杀菌剂第1部分: 抑制病原真菌孢子萌发试验凹玻片法. 北京: 中国农业出版社, 2006.
Ministry of Agriculture of the People’s Republic of China. NY/T 1156.1—2006 Pesticides guidelines for laboratory bioactivity tests Part 1: Determining fungicide inhibition of pathogen spore germination on concave slides. Beijing: China Agriculture Press, 2006. (in Chinese)
[19] LI J L, LIU X Y, DI Y L, LIANG H J, ZHU F X. Baseline sensitivity and control efficacy of DMI fungicide epoxiconazole against Sclerotinia sclerotiorum. European Journal of Plant Pathology, 2014, 141(2): 237-246.
[20] 金丽华, 陈长军, 王建新, 陈雨, 周明国. 旁路氧化作用对嘧菌酯抑制辣椒炭疽菌孢子萌发和菌丝生长的影响. 植物病理学报, 2007, 37(3): 289-295.
JIN L H, CHEN C J, WANG J X, CHEN Y, ZHOU M G. Impact of alternative respiration on response of conidial germination and mycelial growth of Colletotrichum capsici to azoxystrobin. Acta Phytopathologica Sinica, 2007, 37(3): 289-295. (in Chinese)
[21] DAMM U, BARONCELLI R, CAI L, KUBO Y, O’CONNELL R, WEIR B, CANNON P F. Colletotrichum: species, ecology and interactions. IMA Fungus, 2010, 1(2): 161-165.
[22] CANNON P F, DAMM U, JOHNSTON P R, WEIR B S.Colletotrichum—current status and future directions. Studies in Mycology, 2012, 73(1): 181-213.
[23] LEWIS-IVEY M L, NAVA-DIAZ C, MILLER S A. Identification and management of Colletotrichum acutatum on immature bell peppers. Plant Disease, 2004, 88(11): 1198-1204.
[24] HARP T L, PERNEZNY K, LEWIS-IVEY M L, MILLER S A, KUHN P J, DATNOFF L. The etiology of recent pepper anthracnose outbreaks in Florida. Crop Protection, 2008, 27: 1380-1384.
[25] LIAO C Y, CHEN M Y, CHEN Y K, KUO K C, CHUNG K R, LEE M H. Formation of highly branched hyphae by Colletotrichum acutatum within the fruit cuticles of Capsicum spp. Plant Pathology, 2012, 61(2): 262-270.
[26] PERES N A, TIMMER L W, ADASKAVEG J E, CORRELL J C. Lifestyles of Colletotrichum acutatum. Plant Disease, 2005, 89(8): 784-796.
[27] GUERBER J C, LIU B, CORRELL J C, JOHNSTON P R. Characterization of diversity in Colletotrichum acutatum sensu lato by sequence analysis of two gene introns, mt DNA and intron RFLPs, and mating compatibility. Mycologia, 2003, 95(5): 872-895.
[28] MACKENZIE S J, PERES N A, BARQUERO M P, ARAUZ L F, TIMMER L W. Host range and genetic relatedness of Colletotrichum acutatum isolates from fruit crops and leatherleaf fern in Florida. Phytopathology, 2009, 99(5): 620-631.
[29] CAI L, HYDE K D, TAYLOR P W J, WEIR B S, WALLER J M, ABANG M M, ZHANG J Z, YANG Y L, PHOULIVONG S, LIU Z Y, PRIHASTUTI H, SHIVAS R G, MC KENZIE E H C, JOHNSTON P R. A polyphasic approach for studying Colletotrichum. Fungal Diversity, 2009, 39(1): 183-204.
[30] 刘君丽, 司乃国, 陈亮, 张冬明, 张宗俭. 创制杀菌剂啶菌恶唑的生物活性及应用研究(Ⅲ)——番茄叶霉病. 农药, 2004, 43(3): 103-105.
LIU J L, SI N G, CHEN L, ZHANG D M, ZHANG Z J. Biological activity against tomato leaf mold and application of a novel fungicide, SYP-Z048(iii). Chinese Journal of Pesticides, 2004, 43(3): 103-105. (in Chinese)
[31] 司乃国, 张宗俭, 刘君丽, 李志念, 张冬明, 陈亮, 王力钟. 创制杀菌剂啶菌恶唑的生物活性及应用研究(Ⅰ) ——番茄灰霉病. 农药, 2004, 43(1): 16-18.
SI N G, ZHANG Z J, LIU J L, LI Z N, ZHANG D M, CHEN L, WANG L Z. Biological activity and application of a novel fungicide: SYP-Z048(i). Chinese Journal of Pesticides, 2004, 43(1): 16-18. (in Chinese)
[32] DUAN Y B, GE C Y, LIU S M, CHEN C J, ZHOU M G. Effect of phenylpyrrole fungicide fludioxonil on morphological and physiological characteristics of Sclerotinia sclerotiorum. Pesticide Biochemistry and Physiology, 2013, 106(1): 61-67.
[33] KANETIS L, RSTER H, ADASKAVEG J E. Comparative efficacy of the new postharvest fungicides azoxystrobin, fludioxonil, and pyrimethanil for managing citrus green mold. Plant Disease, 2007, 91(11): 1502-1511.
[34] 杨丽娟, 柏亚罗. 甲氧基丙烯酸酯类杀菌剂——吡唑醚菌酯. 现代农药, 2012, 11(4): 46-51.
YANG L J, BAI Y L. Strobilurin fungicide——pyraclostrobin. Modern Agrochemicals, 2012, 11(4): 46-51. (in Chinese)
[35] WU D X, ZHANG R S, HAN X, WANG J X, ZHOU M G, CHEN C J. Resistance risk assessment for fludioxonil in Stemphylium solani. Annals of Applied Biology, 2015, 167(2): 277-284.
[36] 陈娟芳, 任佐华, 彭伟业, 刘翔, 邹茜, 刘二明. 吡唑醚菌酯和甲基硫菌灵对 2种辣椒炭疽病菌的室内联合毒力测定. 现代农药, 2016, 15(1): 44-47.
CHEN J F, REN Z H, PENG W Y, LIU X, ZOU X, LIU E M. Joint-toxicity of mixtures of pyraclostrobin with thiophanate-methyl against two kinds of Colletotrichum spp. Modern Agrochemicals, 2016, 15(1): 44-47. (in Chinese)
(责任编辑 岳梅)
Identification of the Pathogen Causing Pepper Anthracnose in Shandong Province and Screening of Highly Effective Fungicides
GAO YangYang1,2, HE LiFei1,2, LI BeiXing3,4, LIN Jin1,3, MU Wei1,4, LIU Feng1,3
(1College of Plant Protection, Shandong Agricultural University, Taian 271018, Shandong;2Shandong Provincial Key Laboratory for Biology of Vegetable Diseases and Insect Pests, Taian 271018, Shandong;3Key Laboratory of Pesticide Toxicology & Application Technique, Shandong Agricultural University, Taian 271018, Shandong;4Research Center of Pesticide Environmental Toxicology, Shandong Agricultural University, Taian 271018, Shandong)
【Objective】The objective of this study is to identify the pathogen species of pepper anthracnose in major pepper growing areas in Shandong Province, and to screen the highly effective fungicides by inhibitory activity test in vitro and relative control efficacy trials on detached pepper fruits inoculated with conidial suspension. 【Method】 The isolates of pepper anthracnose were collected from the major pepper producing areas in Jining, Heze, Weifang, Taian and Dezhou. After isolation and purification,the isolates were identified by using the methods of morphological characteristics analysis, its pathogenicity test on detached pepper fruits and molecular diagnostics. Morphology parameters mainly include the colony and conidial morphology, conidial size. The internal transcribed spacer (ITS) rDNA region of the four typical isolates was amplified by using the fungal universal primers ITS4 and ITS5, and then the amplified product was recycled and sequenced. MEGA 5.1 was used to generate phylogenetic tree to confirm the pathogen species. The inhibitory activity in vitro of 11 fungicides to Colletotrichum acutatum isolate was determined by the inhibition of the 11 fungicides against mycelial growth and spore germination of the pathogen. Control efficacies of the selected fungicides against pepper anthracnose were determined on the detached pepper fruits.【Result】All of the twenty-seven isolates exhibited similar morphology, which produced white to pale grey colonies. The oval conidia were single-celled with a sub-cute end, (7.48-14.69) μm × (2.52-5.64) μm in size. Both of the mature and immature pepper fruits with or without wound could be infected by this pathogen, and disease spot expanded rapidly on wounded pepper fruits. Typical symptom of pepper anthracnose was sunken and necrotic lesion that covered with massive orange conidia. The rDNA-ITS sequence length of the four representative isolates was 562, 541, 557 and 553 bp (GenBank Accession No KX830854-KX830857), respectively. Phylogenetic tree analysis indicated that the four representative isolates and C. acutatum were divided into one group, and the bootstrap value was 100%. The inhibitory activity test in vitro indicated that pyraclostrobin, fludioxonil, and pyrisoxazole exhibited strong inhibitory activity against mycelial growth and spore germination of C. acutatum. Moreover, pyraclostrobin, fludioxonil and pyrisoxazole at the dose of 400 μg·mL-1also showed high preventive and curative activity against C. acutatum on detached pepper fruits, with the efficacy greater than 60%, which showed significantly higher efficacy than the preventive and curative activity of azoxystrobin.【Conclusion】 The major pathogenic fungus of pepper anthracnose in Shandong Province was identified as C. acutatum. Pyraclostrobin, fludioxonil and pyrisoxazole showed excellent inhibitory activity against C. acutatum both in vitro and in vivo, make these fungicides become potential candidates for the control of pepper anthracnose in the field.
pepper anthracnose; Colletotrichum acutatum; fungicides; inhibitory activity in vitro; control efficacy
2016-11-14;接受日期:2017-02-10
国家重点研发计划(2016YFD0200500)
联系方式:高杨杨,E-mail:2541467231@qq.com。通信作者刘峰,Tel/Fax:0538-8242611;E-mail:fliu@sdau.edu.cn

