新生儿围产期不同血糖水平对HIE预后的意义
张良江,薛彦锐,杨波平,陈树娴
(广东省潮州市潮安区人民医院儿科,广东 潮州 515638)
新生儿围产期不同血糖水平对HIE预后的意义
张良江,薛彦锐,杨波平,陈树娴
(广东省潮州市潮安区人民医院儿科,广东 潮州 515638)
目的 评估新生儿缺血缺氧性脑病(HIE)血糖紊乱与远期预后的关联性。方法 回顾性分析2010年1月至2014年12月在广东省潮州市潮安区人民医院住院的HIE患儿114例,以发病18个月后贝利婴儿发展量表(BSID)<80分为标准分为智能异常组77例和智能正常组37例,分析血糖异常情况与远期预后的关联性。结果 智能正常组高血糖、低血糖,及反复高血糖、反复低血糖比例均低于智能异常组,组间比较差异均有统计学意义(χ2值分别为8.274、9.003、4.404、7.881,均P<0.05),而两组高血糖合并低血糖、反复高血糖合并低血糖发生率组间比较差异均无统计学意义(χ2值分别为0.030、0.720,均P>0.05);经Logistic回归分析结果表明高血糖、低血糖、反复高血糖、反复低血糖4个因素均为BSID评分<80分的危险因素(χ2值分别为5.571、5.996、7.227、5.179,均P<0.05)。结论 HIE患儿发病早期内血糖紊乱发生率较高,而高血糖和低血糖均与远期不良预后存在关联性。
围产期;缺血缺氧性脑病;血糖;智能;远期预后
新生儿缺血缺氧性脑病(hypoxic ischaemic ence ̄phalopathy,HIE)是围产期最严重的并发症之一,是新生儿死亡和神经功能障碍的主要原因。随着我国妇幼保健事业的发展,HIE的死亡率已经降至1.5‰~3‰,但因窒息造成不同程度伤残的HIE患儿仍保持在30万左右[1]。目前,亚低温疗法是最常用的治疗HIE方法,发病后6h内采用该方法能明显改善HIE预后,但仍有部分患儿死亡和遗留神经功能障碍[2];Shankaran等[3]的研究发现,更长或更深度的低温疗法也无法降低死亡率,因此寻找能影响和判断预后的因素有重要的临床意义。有研究对血糖异常和HIE预后的关系进行了探索,其认为两者存在明显的相关性[4];但也有学者认为血糖紊乱并不影响HIE预后[5]。目前的研究多以HIE短期预后作为终点指标,远期预后评价极少涉及,因此两者的确切联系仍不明确。为进一步明确血糖异常对HIE远期预后的影响,本研究回顾性分析了部分病例,为临床决策提供更具体、充分的依据。
1资料和方法
1.1一般资料
回顾性分析2010年1月至2014年12月在广东省潮州市潮安区人民医院分娩确诊为HIE的新生儿,入选标准:①孕周≥36周,单胎妊娠,性别不限;②病史、临床症状和影像学检查确诊HIE,病程<12h;③住院期间有至少4次血糖监测数据,监测时间必须在静脉补糖后4h;④18个月后未死亡同时接受神经功能检测的患儿。排除标准:①合并心、肝、肾、血液系统疾病;②颅内出血、低钙血症、先天性疾病、遗传代谢性疾病、产伤、宫内感染等引起的脑损伤。
1.2检查指标
患儿病情资料包括:年龄、性别、孕周、体重、分娩方式、Apgar评分、并发症、实验室检查(本院临床采集末梢血测血糖)和影像学检查。
1.3评价指标
①低血糖:末梢血血糖≤40mg/dL;②高血糖:末梢血血糖>150mg/dL;③神经功能评价:采用贝利婴儿发展量表(Bayley Scales of Infant Development,BSID),该量表由Bayley于1969年编制,用于评定2个月~2.5岁婴幼儿心理智能发展,包括运动量表、智力量表和行为记录3个部分,其中智力发育指数(MDI)与运动发育指数(PDI)用于评定运动和智能的发展水平,是目前临床上广泛应用的儿童智能量表之一。本研究采用易受蓉1990年修订的中国城市常模计算MDI和PDI,测试结果按发展指数等级的分布进行评分,130分以上为非常优秀,120~129分为优秀,110~119分为中上,90~109分为中等,80~89分为中下,70~79分为临界状态,69分为发育迟缓[6],本研究以BSID评分<80分为智能发育异常。
1.4统计学方法

2结果
2.1一般情况
本次共有114例患儿符合入选标准,以发病18个月后BSID<80分为标准分为智能异常组和智能正常组,其中智能正常组37例(32.46%),智能异常组77例(67.54%),两组性别、剖宫产率、孕周和并发症发生率组间比较差异均无统计学意义(均P>0.05);而智能异常组出生时体重、Apgar评分、轻度HIE发生率均低于正常组,重度HIE发生率高于正常组(均P<0.05),见表1。


项目智能正常组(n=37)智能异常组(n=77)t/χ2/ZP出生时体重(kg)3.58±0.633.13±0.65t=4.9340.044性别(男/女)25(67.57)/12(32.43)41(53.25)/36(46.75)χ2=0.0430.836孕周(周)37.25±1.1838.03±0.97t=1.1300.241HIE严重程度 轻13(35.13)11(14.29)χ2=6.5360.011 中17(45.95)29(37.66)χ2=0.7120.522 重7(18.92)37(48.05)χ2=8.9500.003剖宫产27(72.97)56(72.73)χ2=0.0010.978Apgar评分3(1~4)2(0~4)Z=5.1830.027并发症★30(81.08)52(67.53)χ2=2.2720.132
注:★包括胎膜早破、脐带脱垂、脐带缠绕、羊水粪染、肩先露、胎盘早剥、子宫破裂、胎儿窘迫等。
2.2血糖情况
智能正常组高血糖、低血糖,以及反复高血糖、反复低血糖发生率均低于智能异常组,组间比较差异均有统计学意义(均P<0.05),而两组高血糖合并低血糖、反复高血糖合并低血糖发生率组间比较差异均无统计学意义(均P>0.05),见表2。
表2 两组血糖异常情况比较结果[n(%)]
Table 2 Comparison of abnormal blood sugar between two groups [n(%)]
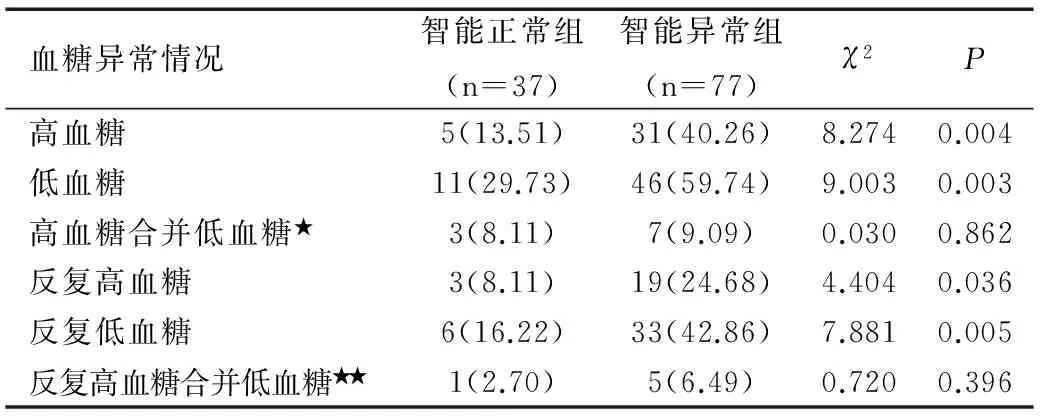
注:★指出现了1次高血糖和低血糖;★★指出现了2次及以上的高血糖和低血糖。
2.3智能异常危险因素Logistic回归分析
以入组时作为BSID评分<80分为自变量,高血糖、低血糖、高血糖合并低血糖、反复高血糖、反复低血糖、反复高血糖合并低血糖作为因变量引入Logistic回归分析,结果表明高血糖、低血糖、反复高血糖、反复低血糖4个因素均为BSID评分<80分的危险因素(均P<0.05),而高血糖合并低血糖、反复高血糖合并低血糖与BSID评分<80分无明显关联性,见表3。
表3 智能异常危险因素Logistic回归分析
Table 3 Logistic regression analysis of risk factors for intelligent abnormality

3讨论
3.1血糖与神经功能损伤预后的关联性
葡萄糖是体内重要能量的来源,代谢紊乱可引起明显的神经元损伤,新生儿娩出母体后经胎盘提供的血糖即停止,体内的血糖稳态主要依靠储存的肝糖原、激素水平和食物的摄取。由于HIE引起代谢和激素水平的紊乱,低血糖或高血糖在HIE患儿中经常发生,可对神经功能造成不同程度的影响[1]。本研究结果表明,产后早期血糖紊乱与HIE远期预后有关。本研究结果与动物实验结果一致,缺氧时低血糖犬神经元无氧糖酵解比血糖正常犬增强,导致磷酸肌酸、三磷酸腺苷(ATP)等高能磷酸储备迅速耗竭,低血糖还可以选择性地抑制猪体内腺苷诱导的脑血管扩张[7]。高血糖可使缺氧的猪、乳羊和成年大鼠神经元氧消耗减少和酸性物质生成增多,导致神经功能损伤加重,而创伤出现后的治疗已无明显效果[8]。由于母体接受激素而出现的高血糖同样可以加重脑损伤,这也是临床上糖皮质激素催熟后高血糖时程更长和神经系统并发症更多的原因[9]。在大鼠心脏骤停的模型中单纯注射葡萄糖可引起神经组织损伤,而联合胰岛素注射时脑组织病理损伤明显减轻[10]。值得注意的是,由于本研究为回顾性分析,无法确认血糖水平与HIE预后存在因果关系。同时,HIE患儿出现低血糖合并高血糖时与HIE预后无关,表明医源性因素可能起主要作用。
HIE患儿由于窒息、缺氧、禁食、合并感染等创伤造成肝糖原储备衰竭,糖异生功能不成熟,容易出现低血糖,而且发生率很高[11]。虽然新生儿低血糖的标准目前尚有很大的争议,但低血糖对神经功能的影响在足月和早产儿均有充分的研究,PET/CT对HIE患儿脑组织进行扫描发现病灶周围脑组织糖代谢严重紊乱,而亚急性期全脑组织糖代谢率与HIE严重程度和短期预后呈负相关[12],发病3天后的MRI也表明低血糖和窒息性脑损伤影像学表现相互重叠[13],而Nadeem等[5]对52例足月HIE患儿进行了24个月的调查,结果发现低血糖与神经功能预后无关,两者关系需要更多研究加以明确。
3.2颅脑损伤患儿血糖升高的病理生理机制
血糖升高的主要原因是机体在应激状态下儿茶酚胺、胰高血糖素及皮质醇等水平上升,增加肝糖原分解及糖异生,同时机体存在胰岛素分泌相对减少或胰岛素抵抗等。另外,重度缺氧可导致胰岛素受体数量及受体最大特异性结合率降低,胰岛素靶细胞受体无法产生预期的生物效应,因此高血糖是严重颅脑损伤的表现[1]。动物实验表明,窒息可导致血糖稳态失衡,最后引起神经功能障碍,而诱导性高血糖能降低神经元细胞对缺氧的反应,增加细胞间隙过氧化产物和天冬氨酸盐的水平,加快神经元凋亡[14]。Al Shafouri等[15]认为急性脑缺氧之前的高血糖可明显加重神经损伤,Spies等[16]则认为早期的高血糖与HIE患儿远期的粗大运动功能障碍有关。相比于低血糖,对HIE和医源性因素以外的高血糖研究目前比较匮乏,其与HIE的预后更不明确。
3.3本研究的不足
本研究也存在若干不足之处:①病例为回顾性分析,同时排除了死亡病例,无法确定血糖与HIE预后的因果关系,确切的证据需要前瞻性的研究;②由于诊疗习惯的原因,无法收集患儿确诊HIE前的血糖数据,可能会低估血糖异常的实际发生率;③患儿发病后的葡萄糖滴注速度和剂量无公认的标准,临床实践中患儿补液方法也未作统一规定,其对血糖异常的贡献值难以量化,因此同时出现高血糖和低血糖的患儿可能受外源性葡萄糖的影响较大;④所收集的血糖值均来源于末梢血,患儿静脉血血糖值无法得到,而且测量时间也未统一,后续的研究需要对各种影响因素进行规范化。
综上所述,HIE患儿发病早期内血糖紊乱发生率较高,而高血糖和低血糖均与远期不良预后存在关联性,后续的研究应该进一步确证血糖紊乱对神经功能损伤的预测作用。
[1]李相红.新生儿缺氧缺血性脑病急性期血糖变化及临床意义的研究进展[J].中国中西医结合儿科学,2012,4(1):43-44.
[2]Jacobs S E,Berg M,Hunt R,etal.Cooling for newborns with hypoxic ischaemic encephalopathy[J/CD].Cochrane Database Syst Rev,2013,(1):CD003311.
[3]Shankaran S, Laptook A R, Pappas A,etal.Effect of depth and duration of cooling on deaths in the NICU among neonates with hypoxic ischemic encephalopathy:a randomized clinical trial[J].JAMA,2014,312(24):2629-2639.
[4]Basu P, Som S, Choudhuri N,etal.Contribution of the blood glucose level in perinatal asphyxia[J].Eur J Pediatr,2009,168(7):833-838.
[5]Nadeem M,Murray D M,Boylan G B,etal.Early blood glucose profile and neurodevelopmental outcome at two years in neonatal hypoxic-ischaemic encephalopathy[J].BMC Pediatr,2011,11:10.
[6]周艺,喻璨,蒋丽仙.135 名低出生体重儿的贝利婴幼儿发展量表测试分析[J].昆明医科大学学报,2013,34(11):102-104.
[7]Kyng K J,Skajaa T,Kerrn-Jespersen S,etal.A piglet model of neonatal hypoxic-ischemic encephalopathy[J].J Vis Exp,2015,(99):e52454.
[8]Hosono T, Kamo A, Hakotani S,etal.Effect of hypothermia on motor function of adult rats after neonatal hyperthermic hypoxic-ischemic brain insult[J].Eur J Appl Physiol,2010,109(1):35-39.
[9]Reynolds R M.Programming effects of glucocorticoids[J].Clin Obstet Gynecol,2013,56(3):602-609.
[10]Liu Y, Li X, Xie C,etal.Prevention effects and possible molecular mechanism of mulberry leaf extract and its formulation on rats with insulin-insensitivity[J].PLoS One,2016,11(4):e0152728.
[11]Basu S K, Kaiser J R, Guffey D,etal.Hypoglycaemia and hyperglycaemia are associated with unfavourable outcome in infants with hypoxic ischaemic encephalopathy:a post hoc analysis of the CoolCap Study[J].Arch Dis Child Fetal Neonatal Ed,2016,101(2):F149-F155.
[12]Shi Y, Zhao J N, Liu L,etal.Changes of positron emission tomography in newborn infants at different gestational ages, and neonatal hypoxic-ischemic encephalopathy[J].Pediatr Neurol,2012,46(2):116-123.
[13]Wong D S,Poskitt K J,Chau V,etal.Brain injury patterns in hypoglycemia in neonatal encephalopathy[J].AJNR Am J Neuroradiol,2013,34(7):1456-1461.
[14]姚华.20例危重儿合并高渗血症的回顾分析[J].中国妇幼健康研究,2014,25(1):135-137.
[15]Al Shafouri N, Narvey M, Srinivasan G,etal.High glucose variability is associated with poor neurodevelopmental outcomes in neonatal hypoxic ischemic encephalopathy[J].J Neonatal Perinatal Med,2015,8(2):119-124.
[16]Spies E E, Lababidi S L, McBride M C.Early hyperglycemia is associated with poor gross motor outcome in asphyxiated term newborns[J].Pediatr Neurol,2014,50(6):586-590.
[专业责任编辑:李占魁]
Prognostic significance of different perinatal blood glucose levels for HIE neonates
ZHANG Liang-jiang, XUE Yan-rui, YANG Bo-ping, CHEN Shu-xian
(DepartmentofPediatrics,People’sHospitalofChaoanDistrictinChaozhou,GuangdongChozhou515638,China)
Objective To evaluate the correlation of neonatal hypoxic ischemic encephalopathy (HIE) long-term prognosis and blood sugar disorder. Methods From January 2010 to December 2014, 114 patients of HIE hospitalized in People’s Hospital of Chaoan District in Chaozhou were retrospective analyzed. They were divided into abnormal intelligence group (n=77) and normal intelligence groups (n=37) according to Bayley Scales of Infant Development (BSID)<80 in 18 months latter. Correlation of blood glucose abnormalities and long-term prognosis was analyzed. Results Proportions of hyperglycemia, hypoglycemia and repeated hyperglycemia and repeated hypoglycemia in normal intelligence group were lower than those in abnormal intelligence group with significant differences (χ2value was 8.274, 9.003, 4.404 and 7.881, respectively, allP<0.05). There were no significant differences in the incidence of hyperglycemia complicating hypoglycemia and repeated hyperglycemia complicating hypoglycemia between two groups (χ2value was 0.030 and 0.720, respectively, bothP>0.05). Logistic regression analysis showed that hyperglycemia, hypoglycemia, repeated hyperglycemia and repeated hypoglycemia were risk factors for BSID score<80 (χ2value was 5.571, 5.996, 7.227 and 5.179, respectively, allP<0.05). Conclusion The incidence of blood sugar disorder in early stage of HIE is high. Hypoglycemia and hyperglycemia are positively correlated with poor long-term prognosis.
perinatal period; hypoxic ischemic encephalopathy (HIE); blood glucose; intelligence; long-term prognosis
2016-10-11
张良江(1980-),男,副主任医师,主要从事新生儿疾病临床诊疗工作。
10.3969/j.issn.1673-5293.2017.03.006
R714.7
A
1673-5293(2017)03-0237-03

