伴有门静脉高压症的早期肝癌病人肝切除与微波消融的疗效比较
王鹤霖 戴朝六 赵阳 贾昌俊 苏洋 卜献民 徐锋 彭松林 赵闯 赵亮
·论 著·(肝癌的综合治疗专题)
伴有门静脉高压症的早期肝癌病人肝切除与微波消融的疗效比较
王鹤霖 戴朝六 赵阳 贾昌俊 苏洋 卜献民 徐锋 彭松林 赵闯 赵亮
目的 通过对病毒性肝炎相关的早期肝癌合并门静脉高压症病人肝切除与微波消融的疗效比较,探究肝切除的疗效和安全性。方法 回顾性分析2012年1月至2016年7月收治的89例病毒性肝炎相关的巴塞罗那分期早期肝癌合并门静脉高压症的病人,将病人分为肝切除组(41例)及微波消融组(48例),并分析预后的影响因素、比较两组的术后生存率。结果 肝切除组肿瘤直径大于消融组,分别为(3.6±1.7) cm和(2.4±0.95) cm,P=0.01。而肝脏储备功能肝切除组则优于微波消融组(吲哚菁绿15 min滞留率>10%),分别为19%和66.7%,P=0.01,经由单因素和多因素分析,术前甲胎蛋白(AFP)>400 μg/L(P=0.019)及围手术期输血(P=0.001)是全部89例早期肝癌合并门静脉高压症病人术后总生存期的独立危险因素,尽管两组的术后总生存期相似(P=0.908),但肝切除组在术后累积肿瘤无复发生存期上具有比微波消融组更好的预后(P=0.033)。结论 肝切除对具有良好肝脏储备功能的巴塞罗那早期肝癌伴门静脉高压症病人是一种安全、有效的治疗选择,而微波消融治疗则适用于肝脏储备功能较差的小肝癌病人。
肝细胞癌; 门静脉高压症; 肝切除; 微波消融
肝癌作为一种常见的消化系统恶性肿瘤,在欠发达国家和发达国家中分别位列癌症致死性疾病的第二位和第六位,在亚洲及非洲国家等肝癌高发地区,肝癌与病毒性肝炎关系密切,约20%~55%的肝癌病人同时合并有肝硬化和门静脉高压症[1-3]。然而,欧洲肝脏研究学会(European Association for the Study of the Liver, EASL)和美国肝病研究学会(American Association for the Study of Liver Diseases , AASLD)对肝切除在肝癌合并门静脉高压症病人的治疗中持谨慎态度,推荐将肝移植和肝癌消融作为首选治疗方案[4-5]。一方面,鉴于肝脏器官供需严重失衡,肝移植难以惠及大多数早期肝癌病人;另一方面,近年来越来越多的研究结果表明,肝切除对早期肝癌合并门静脉高压症病人同样有值得肯定的安全性和疗效[6-14],因此,肝切除对于合并门静脉高压症的早期肝癌病人究竟疗效如何,成为了目前早期肝癌治疗中的争议热点。
本研究通过回顾性分析早期肝癌合并门静脉高压症病人资料,比较肝癌切除与微波消融治疗在术后并发症、总生存期及肿瘤无复发生存期等方面的差异,探究肝切除对早期肝癌合并门静脉高压症病人的安全性及疗效。
资料与方法
一、一般资料
本研究回顾性收集中国医科大学附属盛京医院2012年1月至2016年7月期间,收治并接受根治性治疗的早期肝癌合并门静脉高压症病人89例,其中经肝癌切除治疗的病人41例(开腹肝切除30例,腹腔镜下肝切除11例),设为肝切除组;经微波消融治疗的病人48例(开腹微波消融11例,腹腔镜微波消融29例,超声引导下经皮经肝微波消融8例),设为消融组。
二、定义
1.肝癌 依据卫生部原发性肝癌诊疗规范(2011年版)[15]为诊断标准。
2.早期肝癌 依据巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer,BCLC)分期(2010)中早期肝癌(BCLC A期)的定义包括:一般健康状态完全正常;肝功能Child-Pugh分级为A级或B级;单个肿瘤或2~3个肿瘤且直径均<3 cm[4,15]。
3.门静脉高压症 门静脉高压症的临床诊断采用间接诊断标准,即:①连续三次测定血小板计数<100×109/L和/或白细胞计数<4×109/L;②脾大(超声下脾肋间厚>4.5 cm或CT或MRI下脾脏最大径>10 cm);③超声下门静脉宽度大约14 mm或脾静脉宽度大于10 mm;④经由内镜或CT/MRI确定的食管静脉曲张。以上4条标准符合两条或以上者临床诊断为门静脉高压症[9,16-17]。
4.肝功能的Child-Pugh评分 依据Pugh等[18]改良的评分标准进行分级。
5.外周血细胞减少分级 依据Lv等[19]提出的非酒精性肝硬化门静脉高压症的外周血细胞减少分级标准(表1)。
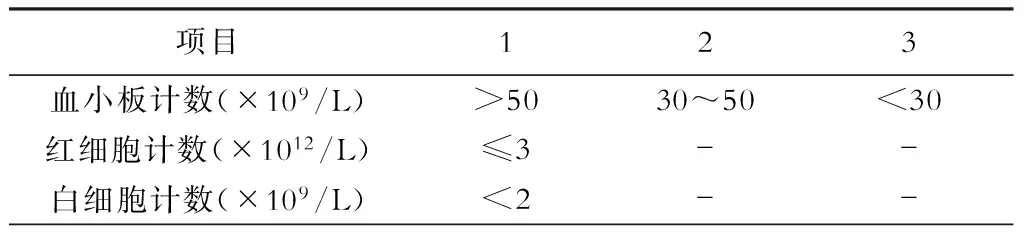
表1 外周血细胞减少分级评分
注:总分<2分为轻度;2~3分为中度;总分>3为重度
6.终末期肝病模型(model for end-stage liver disease,MELD) 依据Kamath等[20]提出的MELD评分改良公式,即:
R=3.8 ln[胆红素(mg/dl)]+11.2 ln(INR)+9.6 ln [肌酐(mg/dl)]+6.4×(病因:胆汁性或酒精性0,其他1)。(胆红素:1 mg/dl=17.1 μmol/L;肌酐:1 mg/dl=88.4 μmol/L)
7.术后并发症分级 术后并发症的诊断及分级依据Clavien等[21-22]提出的术后并发症Clavien-Dindo分级标准。
三、纳入标准和排除标准
1.纳入标准 ①临床诊断为病毒性肝炎相关的原发性肝癌;②临床诊断为门静脉高压症;③术前影像学评估结合术中情况,诊断符合BCLC 早期肝癌(A期)标准;④病人术前肝功能Child-Pugh分级为A级或B级;⑤病人行肝癌切除术或微波消融治疗。
2.排除标准 ①肝转移癌;②术前5年内患有或合并其他脏器恶性肿瘤;③合并肝癌破裂出血;④合并重度肝肾功能不全、顽固性腹水、肝性脑病或术前Child-Pugh分级为C级;⑤合并其他重要脏器功能不全。
四、治疗方案的选择
治疗方案的制定基于病人一般状态、肿瘤大小及位置、术前肝功能Child-Pugh分级、肝功能储备情况如吲哚菁绿15 min滞留率(ICG R15)等,在保留足够剩余肝体积的前提下为病人制定可供选择的治疗方案。原则上,微波消融的适用于最大径≤5 cm的单发肿瘤;或2~3个肿瘤,且最大直径≤3 cm;无血管、胆管和邻近器官侵犯及远处转移的病人。术前ICG R15<14%可作为肝切除术后肝衰竭发生率较低的界限,而ICG R15>45%或术后剩余肝体积<50%的病人不应行肝脏切除[14-15]。同时,对合并上消化道出血或门静脉高压症状较重病人,在病人可耐受的前提下可考虑同期行脾动脉结扎术、脾切除和(或)贲门周围血管离断术,减少术后因门静脉高压症发生上消化道出血的可能。手术方案的选择均征得病人及家属同意,并签署手术同意书。
五、随访
采用查询复查资料及电话随访等方式,了解病人生存情况、术后并发症及肿瘤复发转移等情况,89例病人中81例获得确切随访,失访8例。随访时间4~56个月,中位随访时间23个月。随访时间截止至观察终点或2016年11月。
六、统计学方法
结 果
一、临床一般情况
肝切除组与消融组的临床基本资料比较中可以看出,两组在病灶直径及术前ICG R15上差异具有统计学意义(P=0.001),即肝切除组肿瘤直径较大,而消融组普遍肝脏储备功能较差。其他观察指标,包括年龄、性别、肝炎病毒复制、血液生化指标、病灶个数、术前外周血细胞减少评分、肝功能Child-Pugh评分、MELD评分等差异均无统计学意义。两组病人均无围手术期死亡,两组间术后出现Clavien-Dindo分级并发症总人数(P=0.558)及Ⅲa级以上人数(P=0.057)比较,差异无统计学意义(表2、3)。
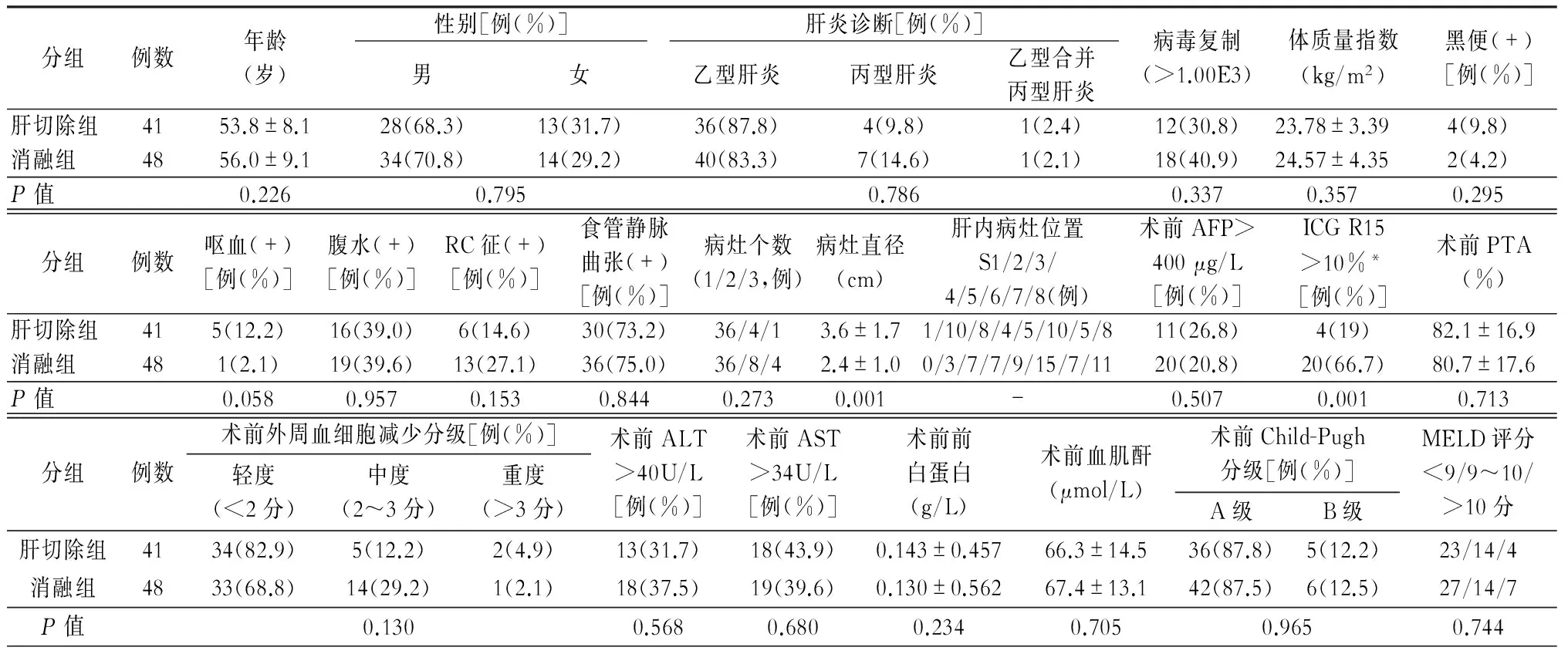
表2 肝切除组与消融组病人的临床基本特点
注:*行术前ICG R15测定病人为51例(肝切除组21例,消融组30例)
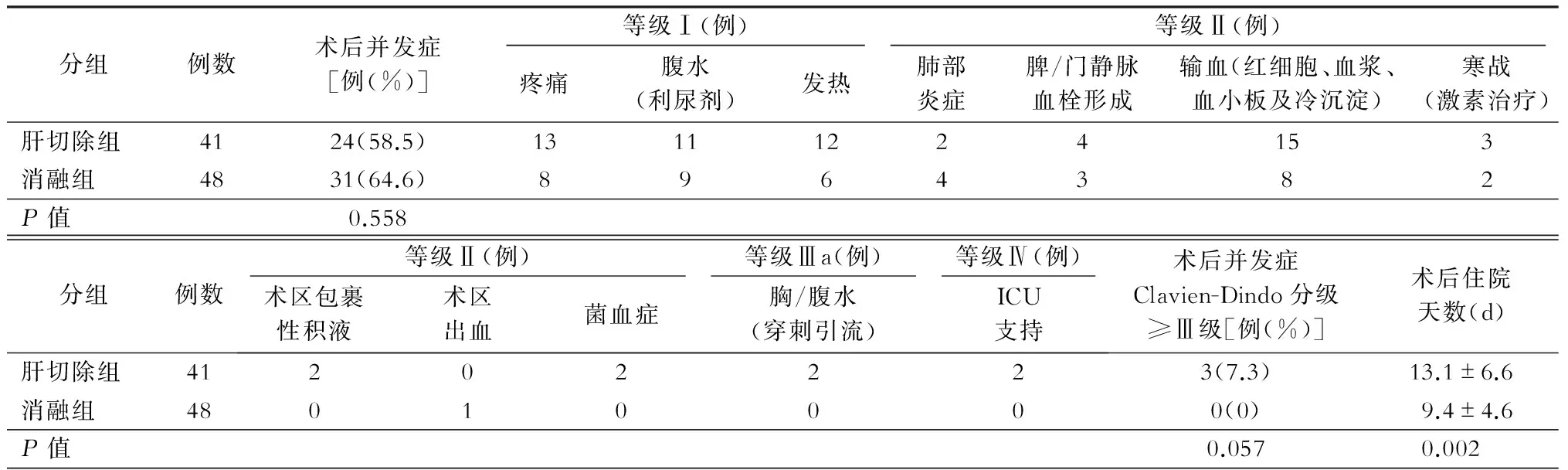
表3 肝切除组与消融组病人术后并发症Clavien-Dindo分级
二、总生存期和肿瘤无复发生存期的影响因素分析
在全部89例早期肝癌合并门静脉高压症病人的总生存期分析中,术前甲胎蛋白(AFP)>400 μg/L(P=0.019)及围手术期输血(P=0.001)是影响术后累积生存期的独立危险因素(表4)。术前AFP>400 μg/L(P=0.023),外周血评分>3分(P=0.013)及手术治疗方案的选择(P=0.037)是肿瘤无复发生存期预后不佳的独立危险因素(表5)。
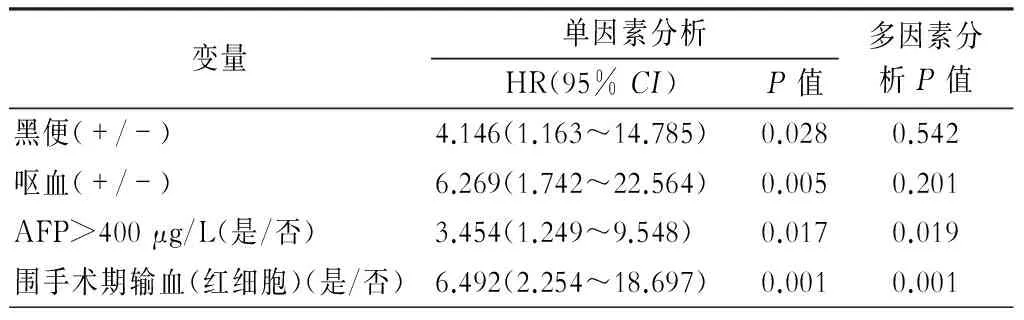
表4 全部89例肝癌合并门静脉高压病人术
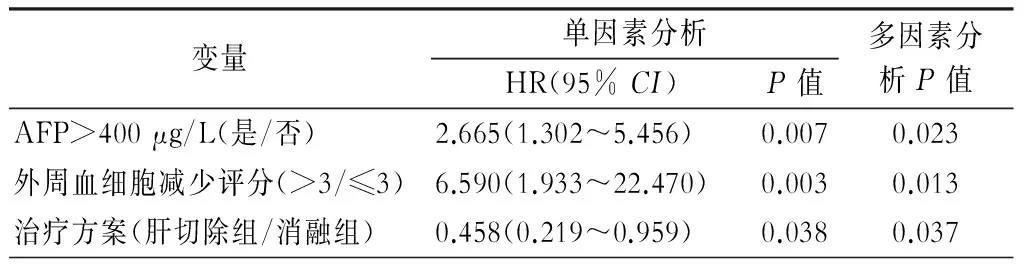
表5 全部89例肝癌合并门静脉高压病人肿瘤
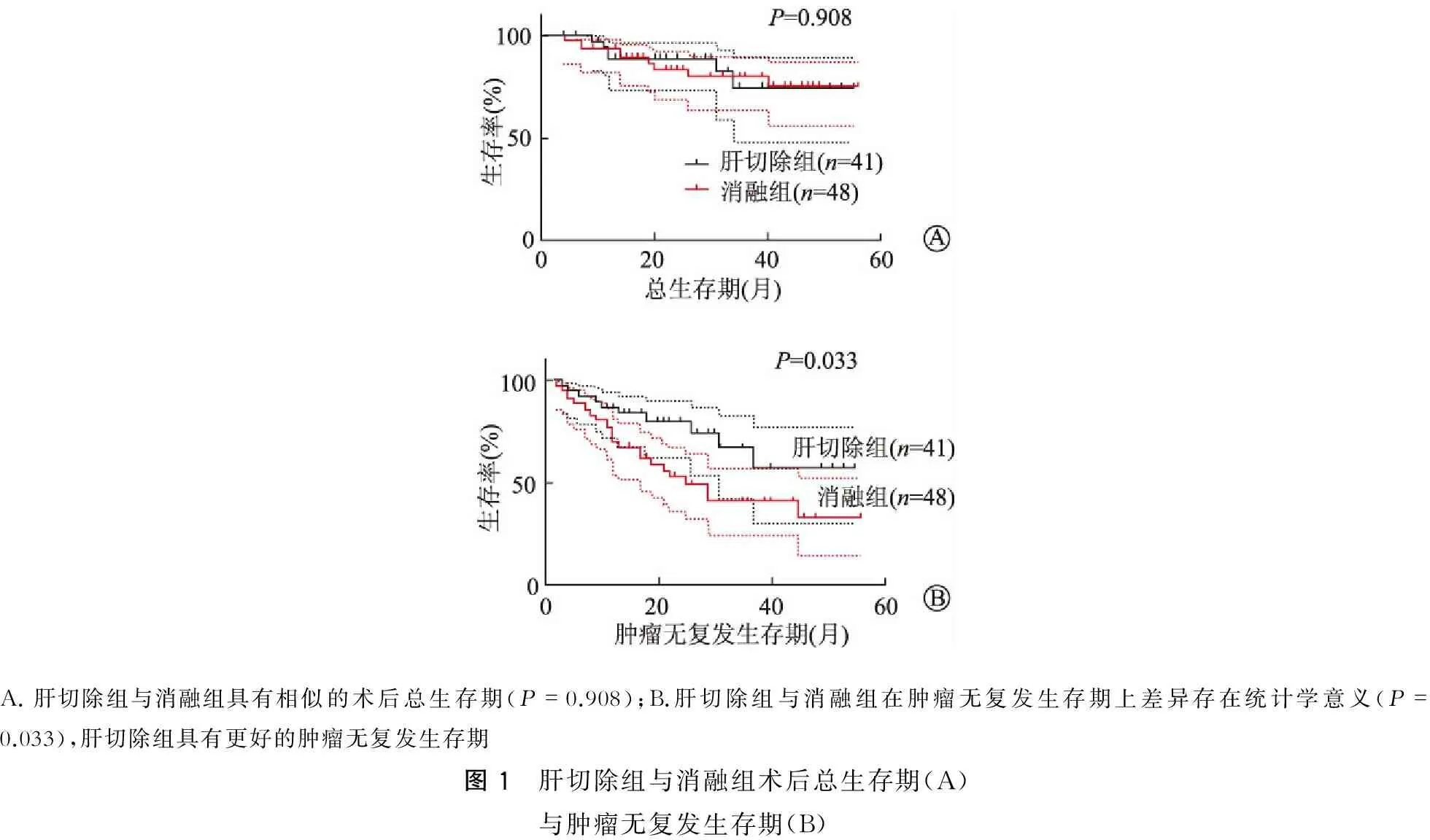
A.肝切除组与消融组具有相似的术后总生存期(P=0.908);B.肝切除组与消融组在肿瘤无复发生存期上差异存在统计学意义(P=0.033),肝切除组具有更好的肿瘤无复发生存期图1 肝切除组与消融组术后总生存期(A)与肿瘤无复发生存期(B)
讨 论
EASL和AASLD对早期肝癌病人行肝切除持谨慎态度,认为肝癌合并门静脉高压症病人肝切除术后可能出现更多的术后相关并发症及围手术期死亡[4-5]。而这一系列结论主要基于巴塞罗那标准中一组29例的队列研究,认为以肝静脉压力梯度(HVPG)≥10 mmHg为诊断标准的肝癌合并门静脉高压病人与对照组相比,具有更高的肝功能失代偿的风险(73.3%和0%,P<0.0002)[23]。由于HVPG测定的有创性,随后陆续有研究采用门静脉高压的间接诊断标准证实,临床显著的门静脉高压症可能是肝切除预后不佳的独立危险因素[16,24-25]。尽管肝移植对符合米兰标准下的肝硬化病人(无论是否伴有门静脉高压症)疗效确切[26],但由于肝脏供体严重短缺的全球性难题,肝移植难以惠及大多数早期肝癌病人,消融似乎成为了早期肝癌合并门静脉高压症病人治疗的唯一选择。
然而在我们的研究中,回顾性分析了89例早期肝癌合并门静脉高压症病人,均为病毒性肝炎相关的肝癌病人,其中肝切除组41例,消融组48例。两组术后并发症总人数(P=0.558)及Ⅲ级以上并发症人数(P=0.057)差异无统计学意义,对比分析两组术后1年、2年及3年累积生存率分别为95%和94%、89%和83%及74%和80%,累积总生存期差异无统计学意义(P=0.908,图1A)。经多因素分析,术前AFP>400 μg/L(P=0.019)和围手术期输血(P=0.001)是术后总生存期不佳的独立危险因素。而术前AFP>400 μg/L(P=0.023),外周血细胞减少评分>3分(P=0.013)及手术治疗方案的选择(P=0.037)则是肿瘤无复发生存期预后不佳的独立危险因素。从生存曲线可以看出,肝切除相较于微波消融治疗,具有更好的肿瘤无复发生存期。因而,对于肝癌合并门静脉高压症的早期肝癌病人,只要肝脏储备功能较好,提示手术切除可获得与消融治疗相似甚至更好的远期预后。
近年来国内外一系列研究成果也得出了与我们相同或相似的观点:Wang等[12]2011年的研究中,回顾性分析了605例BCLC 0期及A期肝癌病人,对比分析手术切除组与消融组,两组间总生存期差异无统计学意义(0期P=0.073;A期P=0.088),但在术后无病生存期上手术切除组明显优于消融组(0期,P=0.006;A期,P<0.001);2015年,在Kao等[13]发表的一项基于1265例BCLC早期及极早期肝癌的队列研究中,635例BCLC早期肝癌合并门静脉高压症病人中,手术组的总生存期要明显优于消融组(P=0.006)和经导管动脉栓塞化疗术组(P<0.001),手术方案的选择(相较于手术切除,消融治疗,P=0.012;TACE,P<0.001)是预后不佳的独立危险因素。2016年Harada等[14]发表的一项121例BCLC 0期及A期队列研究中,经逆概率加权法处理后,肝切除组与消融组相比两组在术后总生存期上差异无统计学意义(P=0.485),而手术组肿瘤无复发生存期明显优于消融组(P=0.00014),消融组相比肝切除组具有更少的术后并发症及更短的平均住院日。
临床研究中,对早期肝癌伴门静脉高压症病人肝切除的安全性和疗效的观点正在悄然改变。这一方面归功于临床中充分的术前评估和严格的病人筛选,肝功能Child-Pugh评分、MELD评分、ICG R15及肝脏三维重建下的残肝体积测定等都成为了术前评估及治疗方案制定的重要依据;另一面也从侧面反映出了在肝癌合并门静脉高压症治疗上手术技术及围手术期护理的渐进性发展,在早前的队列研究中,围手术期病死率甚至高达10%以上[7,27-29],而在我们研究回顾的2012~2016年的病例中,围手术期死亡率为0。随着介入及重症医学的发展,在更为充分的多学科支持下,围手术期严重并发症及病死率较早期研究均呈现出明显的下降趋势。相关研究也认为,肝癌合并门静脉高压症的病人术后并发症主要因门静脉高压症继发的上消化道出血或继发于严重肝硬化的肝功能失代偿,而术后远期病死率主要与肿瘤进展相关[6],因而在谨慎的肝脏切除同时,缓解门静脉压力,改善肝功能,扩大了手术切除的适应证,可达到改善早期肝癌的远期预后之目的[30-31]。
需要强调的是,肯定早期肝癌的手术切除治疗,并不意味着否定消融治疗。就如本组资料所提示的,对于肝硬化较为严重、肝脏储备功能较差、且肿瘤直径较小(≤3 cm),尤其是肿瘤位于某些特殊部位(如S8、S4a肝段),或手术难度大、评估难以耐受手术切除的病人,可选择微波消融治疗,至于选择超声引导下,还是腹腔镜下或开腹下消融则需与影像科医生共同会诊决定。从本组资料也可以看出小肝癌消融治疗效果在总体生存率与肝切除组相似,甚至在术后严重并发症和术后住院日上具有一定的优势。消融治疗可列为小肝癌合并门静脉高压症、肝脏储备功能较差病人的治疗首选。
我们的研究也存在相应的局限性:①实验设计为回顾性研究,较随机对照研究证据级别较低;②研究的样本量相对较小,随访时间相对不足,仍需后续数据对结论的进一步支持和验证;③实验结果为单中心研究结果,可能与其他中心结果不符,后续仍需要多中心研究进一步验证。
综上,我们的研究结果表明,对于病毒性肝炎相关的早期肝癌合并门静脉高压症病人,肝切除与消融治疗具有相似的术后总生存期,且有更好的肿瘤无复发生存期。肝切除对肝脏储备功能良好的巴塞罗那早期肝癌合并门静脉高压症病人是一种安全有效的治疗选择,微波消融治疗则适用于肝脏储备功能不良或位置特殊的小肝癌。
1 Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012.CA Cancer J Clin,2015,65:87-108.DOI: 10.3322/caac.21262.
2 Alswat KA,Sanai FM,Altuwaijri M,et al.Clinical characteristics of patients with hepatocellular carcinoma in a middle eastern population. Hepat Mon,2013,13:e7612. DOI:10.5812/hepatmon.7612.
3 Zhong JH,Li H,Xiao N,et al.Hepatic resection is safe and effective for patients with hepatocellular carcinoma and portal hypertension.PLoS ONE,2014,9:e108755.DOI: 10.1371/journal.pone.0108755.
4 Bruix J,Sherman M.Management of hepatocellular carcinoma: an update.Hepatology,2011,53:1020-1022.DOI:10.1002/ hep.24199.
5 European Association forthe Study ofthe Liver; European Organizationfor Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines:management of hepatocellular carcinoma.J Hepatol,2012,56:908-943.DOI:10.1016/j.jhep.2011.12.001.
6 Ishizawa T,Hasegawa K,Aoki T,et al.Neither multiple tumors nor portal hypertension are surgical contraindications for hepatocellular carcinoma. Gastroenterology,2008,134:1908-1916.DOI:10.1053/j.gastro.2008.02.091.
7 Ruzzenente A, Valdegamberi A, Campagnaro T, et al. Hepatocellular carcinoma in cirrhotic patients with portal hypertension: is liver resection always contraindicated? World J Gastroenterol,2011,17:5083-5088.DOI: 10.3748/ wjg.v17.i46.5083.
8 Cucchetti A,Ercolani G,Pinna AD,et al.Is portal hypertension a contraindication to hepatic resection? Ann Surg,2009,250:922-928.DOI:10.1097/SLA.0b013e3181b977a5.
9 He W, Zeng Q, Zheng Y, et al. The role of clinically significant portal hypertension in hepatic resection for hepatocellular carcinoma patients: a propensity score matching analysis.BMC Cancer,2015,15:263.DOI:10.1186/s 12885-015-1280-3.
10Xiao H,Zhang B, Mei B, et al. Hepatic resection for hepatocellular carcinoma in patients with portal hypertension: a long-term benefit compared with transarterial chemoembolization and thermal ablation. Medicine (Baltimore),2015,94:e495.DOI: 10.1097/MD.0000000000000495.
11Dai Y, Li C, Wen TF, et al. Comparison of liver resection and transplantation for Child-pugh A cirrhotic patient with very early hepatocellular carcinoma and portal hypertension. Pak J Med Sci,2014,30:996-1000.DOI: 10.12669/pjms.305.5038.
12Wang JH, Wang CC, Hung CH, et al. Survival comparison between surgical resection and radiofrequency ablation for patients in BCLC very early/early stage hepatocellular carcinoma. J Hepatol,2012,56:412-418.DOI: 10.1016/j.jhep. 2011.05.020.
13Kao WY, Chao Y, Chang CC, et al. Prognosis of early-stage hepatocellular carcinoma: the clinical implications of substages of barcelona clinic liver cancer system based on a cohort of 1265 patients. Medicine (Baltimore), 2015, 94: e1929. DOI: 10.1097/MD.0000000000001929.
14Harada N, Shirabe K, Maeda T, et al. Comparison of the outcomes of patients with hepatocellular carcinoma and portal hypertension after liver resection versus radiofrequency ablation. World J Surg,2016,40:1709-1719.DOI:10.1007/s00268-016-3465-6.
15中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版). 临床肿瘤学杂志, 2011, 6: 929-946.
16Llovet JM, Bru C,Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis,1999,19:329-338. DOI: 10.1055/s-2007-1007122.
17Pagliaro L,Spina L.The Italian programme on liver cirrhosis.Ital J Gastroenterol,1987,19: 295-297.
18Pugh RN,Pietroni MC, Williams R, et al. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg,1973,60:646-649.DOI:10.1002/bjs.1800600817.
19Lv Y, Han X, Gong X, et al. Grading of peripheral cytopenias caused by nonalcoholic cirrhotic portal hypertension and its clinical significance. Cell BiochemBiophys,2015,71:1141-1145.DOI:10.1007/s 12013-014-0321-x.
20Kamath PS,Wiesner RH,Malinchoc M,et al.A model to predict survival in patients with end-stage liver disease. Hepatology,2001,33:464-470.DOI:10.1053/jhep.2001.22172.
21Dindo D,Demartines N,Clavien PA.Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg, 2004,240:205-213.DOI:10.1097/01.sla.0000133083.54934.ae.
22Clavien PA,Barkun J,de Oliveira ML,et al.The Clavien-Dindo classification of surgical complications: five-year experience.Ann Surg,2009,250:187-196.DOI:10.1097/SLA.0b013e3181b13ca2.
23Bruix J,Castells A,Bosch J,et al.Surgical resection of hepatocellular carcinoma in cirrhotic patients: prognostic value of preoperative portal pressure.Gastroenterology,1996,111:1018-1022.DOI:10.1016/S0016-5085(96)70070-7.
24Llovet JM,Fuster J,Bruix J.Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation. Hepatology, 1999, 30: 1434-1440. DOI: 10.1002/hep.510300629.
25Choi Gi H,Park Jun Y,Hwang Ho K,et al.Predictive factors for long-term survival in patients with clinically significant portal hypertension following resection of hepatocellular carcinoma.Liver Int,2011,31:485-493.DOI:10.1111/j.1478-3231.2010.02436.x.
26Jarnagin WR. Management of small hepatocellular carcinoma: a review of transplantation,resection,and ablation.Ann Surg Oncol,2010,17:1226-1233.DOI: 10.1245/s10434-010-0978-3.
27Zhong JH,Ke Y,Gong WF,et al.Hepatic resection associated with good survival for selected patients with intermediate and advanced-stage hepatocellular carcinoma.Ann Surg,2014,260:329-340.DOI: 10.1097/SLA.0000000000000236.
28Capussotti L,Ferrero A,Vigano L,et al.Portal hypertension: contraindication to liver surgery? World J Surg,2006,30: 992-999. DOI: 10.1007/s00268-005-0524-9.
29Kawano Y,Sasaki A,Kai S,et al.Short- and long-term outcomes after hepatic resection for hepatocellular carcinoma with concomitant esophageal varices in patients with cirrhosis. Ann SurgOncol,2008,15:1670-1676.DOI: 10.1245/s10434-008-9880-7.
30Chen XP,Wu ZD,Huang ZY,et al.Use of hepatectomy and splenectomy to treat hepatocellular carcinoma with cirrhotic hypersplenism.Br J Surg,2005,92:334-339.DOI: 10.1002/bjs.4776.
31Kim SH,Kim DY,Lim JH,et al.Role of splenectomy in patients with hepatocellular carcinoma and hypersplenism. ANZ J Surg,2013,83:865-870.DOI: 10.1111/j.1445-2197. 2012.06241.x.
Comparison of liver resection vs. microwave ablation for patients with hepatocellular carcinoma and portal hypertension in early stage
WangHelin,DaiChaoliu,ZhaoYang,JiaChangjun,SuYang,BuXianmin,XuFeng,PengSonglin,ZhaoChuang,ZhaoLiang.
DepartmentofHepatobiliarySurgery,ShengjingHospitalofChinaMedicalUniversity,Shenyang110004,China
DaiChaoliu,Email:daicl@sj-hospial.org
Objective This article aims to compare the outcomes between hepatic resection and microwave ablation for patients with hepatitis virus-related hepatocellular carcinoma (HCC) and portal hypertension in early stage, in order to evaluate the safety and efficacy of hepatic resection. Methods A series of 89 hepatitis virus-related HCC and portal hypertension in BCLC early stage from 2012 to 2016 were retrospectively analyzed. Patients were divided into 2 groups: hepatic resection group (n=41) and microwave ablation group (n=48). Then the predictive factors of prognosis were analyzed and the outcomes of survival rate were compared. Results As compared with the microwave ablation group, Patients in the liver resection group had bigger tumor sizes (3.6±1.7 cmvs. 2.4±0.95 cm,P=0.01) and better liver reserve function (ICG R15>10%: 19%vs. 66.7%,P=0.01) than in the microvave ablation group. Univariate and multivariate analysis revealed that the AFP level >400 μg/L (P=0.019) and perioperative blood transfusion (P=0.001) were predictive factors of overall survival in the entire study population of 89 patients with HCC and portal hypertension in BCLC early stage. Although the overall survival of hepatic resection group and microwave ablation group was comparable (P=0.908), the hepatic resection group had better outcomes of the recurrence-free survival (P=0.033). Conclusions Under the premise of good liver reserve function, the hepatic resection is a safe and effective option for patients with HCC and portal hypertension in BCLC early stage. And microwave ablation is applicable for the patients with small HCC and poor liver reserve function.
Hepatocellular carcinoma; Portal hypertension; Hepatic resection; Microwave ablation
辽宁省自然科学基金(2013021072);沈阳市科学技术计划(F10-205-1-56)
110004 沈阳,中国医科大学附属盛京医院肝胆脾外科
戴朝六,Email:daicl@sj-hospial.org
R735.2
A
10.3969/j.issn.1003-5591.2017.02.008
2017-03-13)

