转化生长因子β1基因沉默脂肪干细胞移植对盐敏感性高血压大鼠心肌纤维化和心肌细胞的影响研究
方汉军,李锋华,许 成,廉秋芳
·论著·
转化生长因子β1基因沉默脂肪干细胞移植对盐敏感性高血压大鼠心肌纤维化和心肌细胞的影响研究
方汉军1,李锋华1,许 成1,廉秋芳2
目的 探讨转化生长因子β1(TGF-β1)基因沉默脂肪干细胞(ADSCs)移植对盐敏感性高血压大鼠心肌纤维化和心肌细胞凋亡的影响。方法 本实验于2015年6月—2016年7月在陕西省医学实验动物中心实验室完成。体外培养ADSCs,构建TGF-β1为靶向基因的mRNA和siRNA表达质粒,病毒转染至ADSCs,取第三代ADSCs进行慢病毒转染,转染时分为空白组、对照组、TGF-β1-siRNA转染组。采用Western blot法检测基因转染后第3天和第14天不同基因转染组ADSCs TGF-β1蛋白表达情况。选取80只SPF级雄性Dahl盐敏感大鼠构建盐敏感性高血压大鼠模型,采用随机数字表法分为正盐组、高盐组、ADSCs组及TGF-β1基因沉默组,每组20只。正盐组给予0.3%氯化钠饮食;高盐组给予8%氯化钠饮食;ADSCs组予8%氯化钠饮食6周后尾静脉移植ADSCs,持续3 d;TGF-β1基因沉默组大鼠给予8%氯化钠饮食6周后尾静脉移植TGF-β1基因沉默ADSCs,持续3 d。细胞移植2周后,采用反转录-聚合酶链反应(RT-PCR)检测4组大鼠心肌组织TGF-β1mRNA表达情况,采用Western blot法检测4组大鼠心肌组织TGF-β1蛋白表达情况,采用超声心动图检测4组大鼠左心室射血分数(LVEF)和缩短分数(FS),并计算左心室质量指数(LVMI),VG染色测算胶原容积积分,HE染色观察心肌细胞形态,荧光显微镜下观察心肌组织中CM-Dil标记的ADSCs分布情况,采用TUNEL法检测4组大鼠心肌细胞凋亡情况。结果 (1)荧光显微镜下显示,CM-Dil标记的ADSCs呈橘红色,标记率为97%。(2)基因转染后第3天和第14天空白组和对照组ADSCs TGF-β1蛋白相对表达量比较,差异无统计学意义(P>0.05),而TGF-β1-siRNA转染组ADSCs TGF-β1蛋白相对表达量低于空白组和对照组(P<0.05)。(3)细胞移植2周后,TGF-β1基因沉默组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量低于正盐组、高盐组及ADSCs组,ADSCs组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量低于正盐组、高盐组,高盐组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量高于正盐组(P<0.05)。(4)细胞移植2周后,高盐组和ADSCs组大鼠LVEF和FS低于正盐组和TGF-β1基因沉默组,LVMI高于正盐组和TGF-β1基因沉默组(P<0.05);ADSCs组和TGF-β1基因沉默组大鼠LVEF和FS高于高盐组,LVMI低于高盐组(P<0.05);正盐组与TGF-β1基因沉默组大鼠LVEF、FS及LVMI比较,差异无统计学意义(P>0.05)。(5)细胞移植2周后,高盐组、ADSCs组和TGF-β1基因沉默组大鼠胶原容积积分高于正盐组,ADSCs组和TGF-β1基因沉默组大鼠胶原容积积分低于高盐组,TGF-β1基因沉默组大鼠胶原容积积分低于ADSCs组(P<0.05)。(6)HE染色结果显示,细胞移植2周后高盐组大鼠心肌出现明显纤维化且巨噬细胞浸润明显增多,ADSCs组大鼠心肌纤维化较轻,TGF-β1沉默组大鼠心脏纤维化最轻、巨噬细胞浸润最少。(7)荧光显微镜下显示,细胞移植2周后正盐组和高盐组大鼠心肌组织中未发现CM-Dil标记的ADSCs,TGF-β1基因沉默组大鼠心肌组织中CM-Dil标记的ADSCs多于ADSCs组(P<0.05)。(8)细胞移植2周后,正盐组大鼠心肌细胞凋亡率为0,ADSCs组和TGF-β1基因沉默组大鼠心肌细胞凋亡率低于高盐组,TGF-β1基因沉默组大鼠心肌细胞凋亡率低于ADSCs组(P<0.05)。结论 TGF-β1基因沉默ADSCs移植能有效减轻盐敏感性高血压大鼠心肌纤维化,减少心肌细胞凋亡。
高血压;大鼠,近交Dahl;脂肪干细胞;转化生长因子β1;基因沉默;心肌;纤维化;细胞凋亡
据统计,目前我国约有3亿高血压患者,且高血压发病率呈逐年升高趋势、发病人群逐渐年轻化,其中50%以上高血压属于盐敏感性高血压。有研究结果显示,盐敏感性高血压患者心脑血管疾病发病率远高于盐不敏感性高血压患者[1],尽管盐敏感性高血压的发病机制尚未完全明确,但有学者提出盐敏感性高血压可能会引起心肌纤维化[2-4]。
间充质干细胞是一类具有多向分化潜能的多能干细胞,近年来多项研究发现间充质干细胞可参与受损组织的修复[5-7],尤其是心肌纤维化的修复[8]。脂肪干细胞(adipose-derived stromal cells,ADSCs)作为一种源于脂肪组织的间充质干细胞,近年来颇受医学研究者的青睐。研究显示,ADSCs可以修复心肌损伤,向心肌细胞分化[9-14];此外,其还可以分泌多种生长因子[15-16],其中转化生长因子β1(TGF-β1)是目前发现的与心肌纤维化关系最密切的一种生长因子[17-18]。TGF-β1可以促进心肌组织中胶原基因表达和心肌成纤维细胞转化,进而导致心肌细胞外基质(EMC)合成、沉积增多,最终导致心肌纤维化[19-22]。因此,移植分泌TGF-β1的ADSCs对盐敏感性高血压所致的心肌纤维化的治疗效果有限。基于上述观点推测,移植TGF-β1基因沉默的ADSCs治疗心肌纤维化应有效。本研究通过探究TGF-β1基因沉默的ADSCs移植对盐敏感性高血压大鼠心肌纤维化和心肌细胞凋亡的影响,旨在为盐敏感性高血压的治疗提供新思路。
1 材料与方法
1.1 实验动物 本实验于2015年6月—2016年7月在陕西省医学实验动物中心实验室完成。80只SPF级雄性Dahl盐敏感大鼠〔生产许可证号为SCXK(陕)2011-008,动物实验许可证号为SYXK(陕)2010-002〕均由陕西省医学实验动物中心实验室提供,日龄42~49 d,体质量150~160 g,饲养环境:室温25 ℃,湿度50%~80%,自由饮水和觅食。
1.2 主要实验材料及仪器 冻存原代ADSCs来源于陕西省医学实验动物中心实验室;胰蛋白酶购自美国Sigma公司;磷酸盐缓冲液(PBS)由Hyclone提供;细胞培养箱购自Heraeus Sepatech公司;DMEM培养基、胎牛血清均购自Hyclone,Trizol试剂盒购自Invitrogen;BCA蛋白浓度测试试剂盒(增强型)、5×SDS蛋白上样缓冲液、20×TBS缓冲液均购自南京建成生物工程研究所。本实验细胞处理过程中使用的超净工作台由艺斯高(上海)贸易有限公司提供。TGF-β1一抗为兔抗人多克隆抗体,TGF-β1二抗为辣根过氧化物酶(HRP)标记的山羊抗兔多克隆抗体;GAPDH一抗为单克隆小鼠抗人抗体,GAPDH二抗为HRP标记的山羊抗小鼠多克隆抗体,所有抗体均购自艾康生物技术(杭州)有限公司。
1.3 方法
1.3.1 体外培养ADSCs 将冻存原代ADSCs置于60 ℃恒温水浴箱,30 s内快速复苏。融化后将ADSCs迅疾转入EP管中,加入DMEM培养基后重复小心吹打细胞使其均匀分布,随后离心弃上清液。将复苏后的细胞用DMEM完全培养基调整密度为1×106/ml。进行三代培养后采用胰蛋白酶溶液消化2~3 min,终止消化;离心弃上清重悬细胞。调整细胞密度为1×106/ml,培养7 d。离心去上清液洗涤,将人内皮祖细胞密度调整为8×105/ml,随后向细胞悬液中加入5 μl CM-Dil进行细胞标记;置于培养箱中标记孵化25~30 min后离心弃上清PBS重悬细胞,重复标记两次。荧光显微镜下观察细胞标记情况,细胞呈鲜艳的橘红色且颜色均匀为ADSCs标记成功。
1.3.2 基因转染 构建TGF-β1为靶向基因的mRNA和siRNA表达质粒,pLenti X1 Puro-shTGFβ-1-eGFP,以绿色荧光蛋白(GFP)为报告基因。取5×106个第三代ADSCs接种于10 cm培养皿中,于细胞培养箱中培养过夜,转染24 h前离心去旧培养液,再向细胞中加入5 ml DMEM完全培养液。将ADSCs分为空白组(未经处理的ADSCs)、对照组(转染对照慢病毒的ADSCs)、TGF-β1siRNA转染组(转染TGF-β1siRNA慢病毒的ADSCs)。制备DNA-Lipofectamine 2000复合物。在对照组和TGF-β1siRNA转染组细胞中分别滴加对照慢病毒和DNA-Lipofectamine 2000复合物,于细胞培养箱中培养24 h后更换培养液。48 h后收集并洗涤细胞继续培养,采用Western blot法检测4组ADSCs基因转染后第3天、第14天TGF-β1蛋白表达情况。
1.3.3 分组及干预方法 采用随机数字表法将80只盐敏感性高血压大鼠分为正盐组、高盐组、ADSCs组及TGF-β1基因沉默组,每组20只。正盐组大鼠给予0.3%氯化钠饮食;高盐组大鼠给予8%氯化钠饮食; ADSCs组大鼠给予8%氯化钠饮食6周后尾静脉移植CM-Dil标记的ADSCs 3×106个/L,持续3 d;TGF-β1基因沉默组大鼠给予8%氯化钠饮食6周后尾静脉移植CM-Dil标记的TGF-β1基因沉默的ADSCs 3×106个/L,持续3 d。
1.4 反转录-聚合酶链反应(RT-PCR)法检测TGF-β1mRNA表达情况 细胞移植2周后分别从4组选取5只大鼠进行处死,取高盐组、ADSCs组及TGF-β1基因沉默组心肌损伤组织,取正盐组大鼠同一部位心肌组织。采用RT-PCR法检测心肌组织TGF-β1mRNA相对表达量。通过Oligo 7.36 Demo软件设计引物,FABP-5上游引物:5′-GCTAATGGTGGACCGCAAC-3′,下游引物:5′-CAGTGAGCACTGAAGCGA-3′,扩增片段212 bp;内参GAPDH上游引物:5′-GTGCTGAGTATGTCGTGGA-3′,下游引物:5′-CACAGTCTTCTGAGTGGCA-3′,扩增片段121 bp。提取细胞RNA并反转录为cDNA,以GAPDH基因作为内参,检测目的基因TGF-β1mRNA的相对表达量。
1.5 Western blot法检测TGF-β1蛋白表达情况 细胞移植2周后分别从4组选取5只大鼠处死,取高盐组、ADSCs组及TGF-β1基因沉默组大鼠心肌损伤组织,取正盐组大鼠同一部位心肌组织。根据BCA试剂盒(购自北京益德益华生物有限公司)说明书提取、测定心肌组织蛋白含量,具体如下:将细胞裂解并稀释至相同的蛋白浓度,100 ℃煮沸5 min使蛋白变性。每组取蛋白40 μg,10%SDS-PAGE凝胶电泳(70 V,30 min;100 V,90 min);转膜(200 mA,3 h)至聚偏二氟乙烯(PVDF)膜;5%脱脂牛奶室温封闭2 h(或4 ℃过夜);一抗1∶500室温孵育2 h(或4 ℃过夜);TBS洗涤3次,PBS洗涤1次;之后进行蛋白免疫印迹反应,拍照记录后采用软件分析图像,测定4组大鼠心肌组织TGF-β1蛋白相对表达量。
1.6 左心室射血分数(LVEF)、缩短分数(FS)、左心室质量指数(LVMI)检测方法 细胞移植2周后分别从4组选取5只小鼠,麻醉后采用脱毛膏去除左胸口毛发,使用医用胶条将大鼠四肢固定在导电块(分别用导电胶涂抹导电块处)上,胸部涂抹耦合剂进行超声检测。提取大鼠超声存储参数,并采用Vevo770高分辨超声成像系统检测LVEF和FS。称重处死大鼠后迅速打开胸腔,分离大鼠左心室,计算LVMI。剥离高盐组、ADSCs组及TGF-β1基因沉默组大鼠心肌损伤组织及正盐组大鼠同部位心肌组织,分别将其作出3份组织切片,其中1份石蜡切片用于测算胶原容积积分,1份冰冻组织切片用于HE染色,1份冰冻组织切片用于观察大鼠心肌组织中ADSCs分布情况。
1.7 VG染色测算胶原容积积分 将HE染色后的切片进行常规脱蜡至水,按VG染色试剂盒(福州迈新)说明书中的具体步骤进行操作。在计算机图像分析系统中随机取每张切片的8个视野(×200倍),计算每张切片8个视野的胶原容积积分,取6张切片胶原容积积分的平均值。
1.8 HE染色 将由低浓度到高浓度的乙醇作为脱水剂,逐渐脱去组织切片中的水分。再将组织块置于既溶于乙醇又溶于石蜡的二甲苯中透明,以二甲苯替换出组织块中的乙醇,随后进行浸蜡包埋。将包埋好的蜡块固定于切片机上,切成5~8 μm厚薄片。将薄片烫平,再贴到载玻片上,45 ℃恒温烘干。脱蜡后采用HE染色法染色。染色后的切片经纯乙醇脱水,再经二甲苯透明。将已透明的切片滴上加拿大树胶,盖上盖玻片封固。待树胶干燥后,荧光显微镜下观察4组大鼠心肌细胞形态。
1.9 移植后心肌组织中ADSCs分布情况 将冰冻组织切片进行4′,6-二脒基-2苯基吲哚染色。干燥后,显微镜下随机选取每张切片的3个视野进行拍照记录,假设每张照片的总亮度为1,每张照片选取一个光亮度点,采用ACDsee 5.0软件确定其坐标。在图像中随机选取8个视野,计数每个视野中CM-Dil标记的ADSCs数。
1.10 TUNEL法检测心肌细胞凋亡情况 细胞移植2周后分别从4组选取5只大鼠进行处死,取高盐组、ADSCs组及TGF-β1基因沉默组大鼠心肌损伤组织,取正盐组大鼠同一部位心肌组织。每只大鼠心肌组织切片共计数5个,石蜡切片常规脱蜡至水;滴加1滴复合消化液(蛋白酶K与胃蛋白酶),25 ℃孵化20 min;洗涤后滴加TUNEL标记反应混合液50 μl,在湿盒中37 ℃孵育1 h;滴加POD2转化液50 μl,湿盒37 ℃孵育30 min;PBS冲洗3次,DAB显色;HE复染,显微镜下显示棕黄色细胞核的细胞为凋亡细胞,计数凋亡细胞数量并计算细胞凋亡率。
2 结果
2.1ADSCs形态 成功分离出的ADSCs经体外传代培养72h后呈梭形,胞质可见明显突起,多角形等杂细胞消失,细胞呈成纤维细胞样,胞质丰富,核大,平行排列或漩涡状生长,漩涡中心细胞多层分布,细胞形态符合ADSCs一般生物学特性,见图1A。荧光显微镜下经CM-Dil标记的ADSCs可呈橘红色,标记成功率为97%,见图1B。
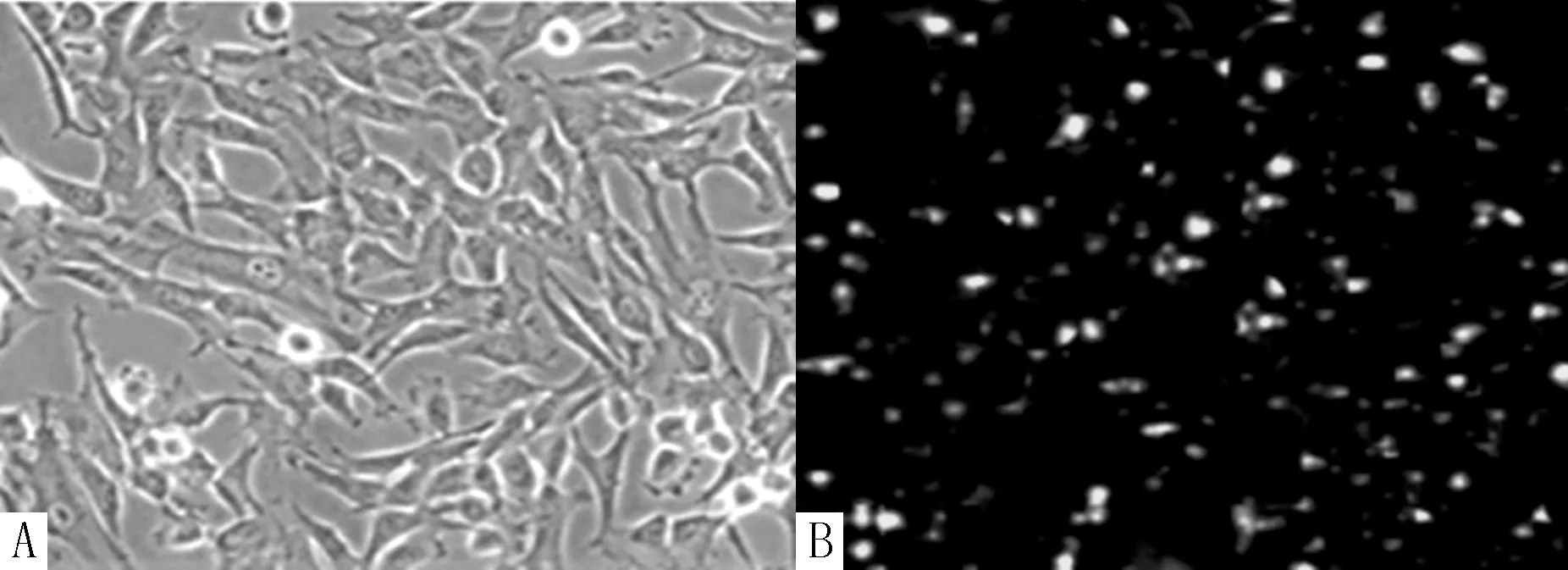
注:A为ADSCs传代培养72h后形态,B为CM-Dil标记的ADSCs形态
图1 显微镜下ADSCs形态(×200)
Figure1ADSCsMorphologyundermicroscope
2.2 不同基因转染组转染ADSCs基因后TGF-β1蛋白表达情况 基因转染后第3天和第14天3组ADSCsTGF-β1蛋白相对表达量比较,差异有统计学意义(P<0.05);其中空白组和对照组ADSCsTGF-β1蛋白相对表达量比较,差异无统计学意义(P>0.05);而TGF-β1siRNA转染组ADSCsTGF-β1蛋白相对表达量低于空白组和对照组,差异有统计学意义(P<0.05,见表1、图2)。
Table 1 Comparison of relative expression quantity of TGF-β1protein in different gene transfection groups after gene transfection of ADSCs

组别第3天第14天空白组5868±2256137±383对照组5739±2015803±240TGF⁃β1siRNA转染组2669±074ab2912±162abF值31112045P值<001<001
注:与空白组比较,aP<0.05;与对照组比较,bP<0.05
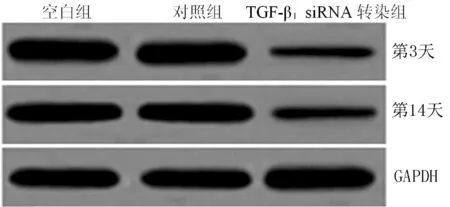
图2 不同基因转染组转染ADSCs基因后TGF-β1蛋白电泳结果
Figure 2 Electrophoretic results of TGF-β1protein in different gene transfection groups after gene transfection of ADSCs
2.3 4组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量比较 4组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量比较,差异有统计学意义(P<0.05);其中TGF-β1基因沉默组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量低于正盐组、高盐组及ADSCs组,ADSCs组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量低于正盐组、高盐组,高盐组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量高于正盐组,差异有统计学意义(P<0.05,见表2、图3~4)。
2.4 4组大鼠LVEF、FS及LVMI比较 4组大鼠LVEF、FS及LVMI比较,差异有统计学意义(P<0.05);其中高盐组和ADSCs组大鼠LVEF和FS低于正盐组和TGF-β1基因沉默组,LVMI高于正盐组和TGF-β1基因沉默组,差异有统计学意义(P<0.05);ADSCs组和TGF-β1基因沉默组大鼠LVEF和FS高于高盐组,LVMI低于高盐组,差异有统计学意义(P<0.05);正盐组与TGF-β1基因沉默组大鼠LVEF、FS及LVMI比较,差异无统计学意义(P>0.05,见表3)。
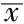
Table2ComparisonofrelativeexpressionquantityofTGF-β1mRNAandTGF-β1proteinofmyocardialtissueamongthefourgroups
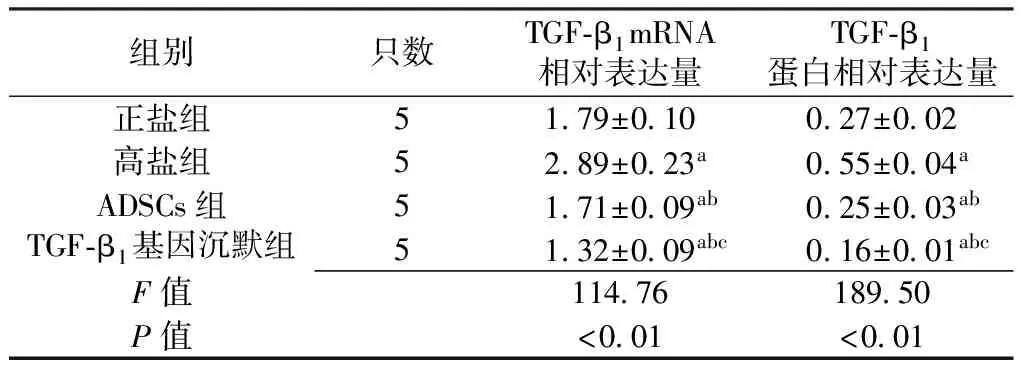
组别只数TGF⁃β1mRNA相对表达量TGF⁃β1蛋白相对表达量正盐组5179±010027±002高盐组5289±023a055±004aADSCs组5171±009ab025±003abTGF⁃β1基因沉默组5132±009abc016±001abcF值1147618950P值<001<001
注:TGF-β1=转化生长因子β1;与正常组比较,aP<0.05;与ADSCs组比较,bP<0.05;与ADSCs组比较,cP<0.05
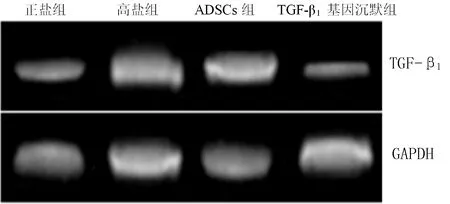
注:TGF-β1=转化生长因子β1
图3 4组大鼠心肌组织TGF-β1mRNA表达情况
Figure 3 TGF-β1mRNA expression of myocardial tissue of the four groups
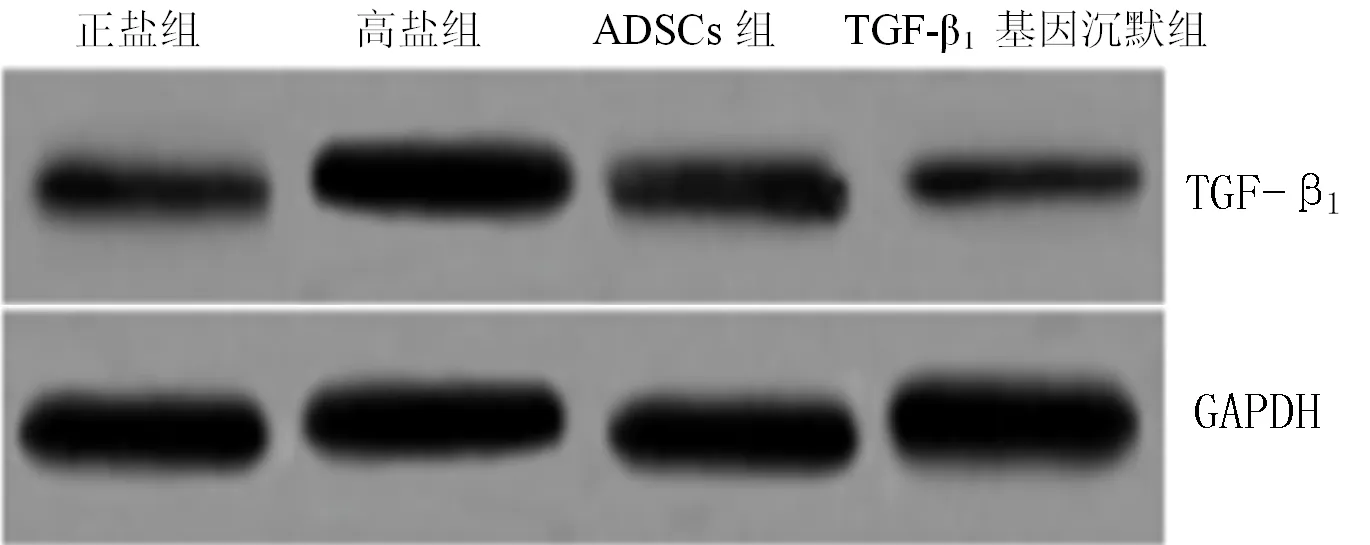
图4 4组大鼠心肌组织TGF-β1蛋白电泳结果
Figure 4 Electrophoretic results of TGF-β1protein of myocardial tissue the four groups
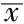
表3 4组大鼠LVEF、FS及LVMI比较(±s)
注:LVEF=左心室射血分数,FS=缩短分数,LVMI=左心室质量指数;与正盐组比较,aP<0.05;与高盐组比较,bP<0.05;与ADSCs组比较,cP<0.05
2.5 4组大鼠胶原容积积分比较 正盐组大鼠胶原容积积分为(0.149±0.047)分,高盐组为(0.260±0.026)分,ADSCs组为(0.187±0.035)分,TGF-β1基因沉默组为(0.157±0.051)分。4组大鼠胶原容积积分比较,差异有统计学意义(F=7.62,P<0.01);其中高盐组、ADSCs组和TGF-β1基因沉默组大鼠胶原容积积分高于正盐组,ADSCs组和TGF-β1基因沉默组大鼠胶原容积积分低于高盐组,TGF-β1基因沉默组大鼠胶原容积积分低于ADSCs组,差异有统计学意义(P<0.05)。
2.6 4组大鼠心肌细胞形态 正盐组大鼠心肌细胞排列有序,心肌间质无炎性细胞浸润及纤维化瘢痕形成(见图5A);高盐组大鼠心肌纤维化明显,巨噬细胞浸润明显增多(见图5B);与高盐组相比,ADSCs组大鼠心肌组织尽管有较多巨噬细胞浸润,但心肌细胞排列较有序且无纤维化瘢痕形成,心肌纤维化程度较轻(见图5C);TGF-β1基因沉默组大鼠心脏纤维化程度最轻,巨噬细胞浸润最少,与正盐组大鼠表现相似(见图5D)。
注:A为正盐组,B为高盐组,C为ADSCs组,D为TGF-β1基因沉默组
图5 4组大鼠心肌细胞形态(HE染色,×200)
Figure 5 Myocardial cells morphology of the four groups
2.7 4组大鼠CM-Dil标记的ADSCs比较 正盐组和高盐组大鼠心肌组织中未发现CM-Dil标记的ADSCs,ADSCs组大鼠心肌组织中CM-Dil标记的ADSCs为(19.64±2.14)个,TGF-β1基因沉默组为(33.24±3.19)个。TGF-β1基因沉默组大鼠心肌组织中CM-Dil标记的ADSCs多于ADSCs组,差异有统计学意义(t=7.92,P<0.05,见图6)。
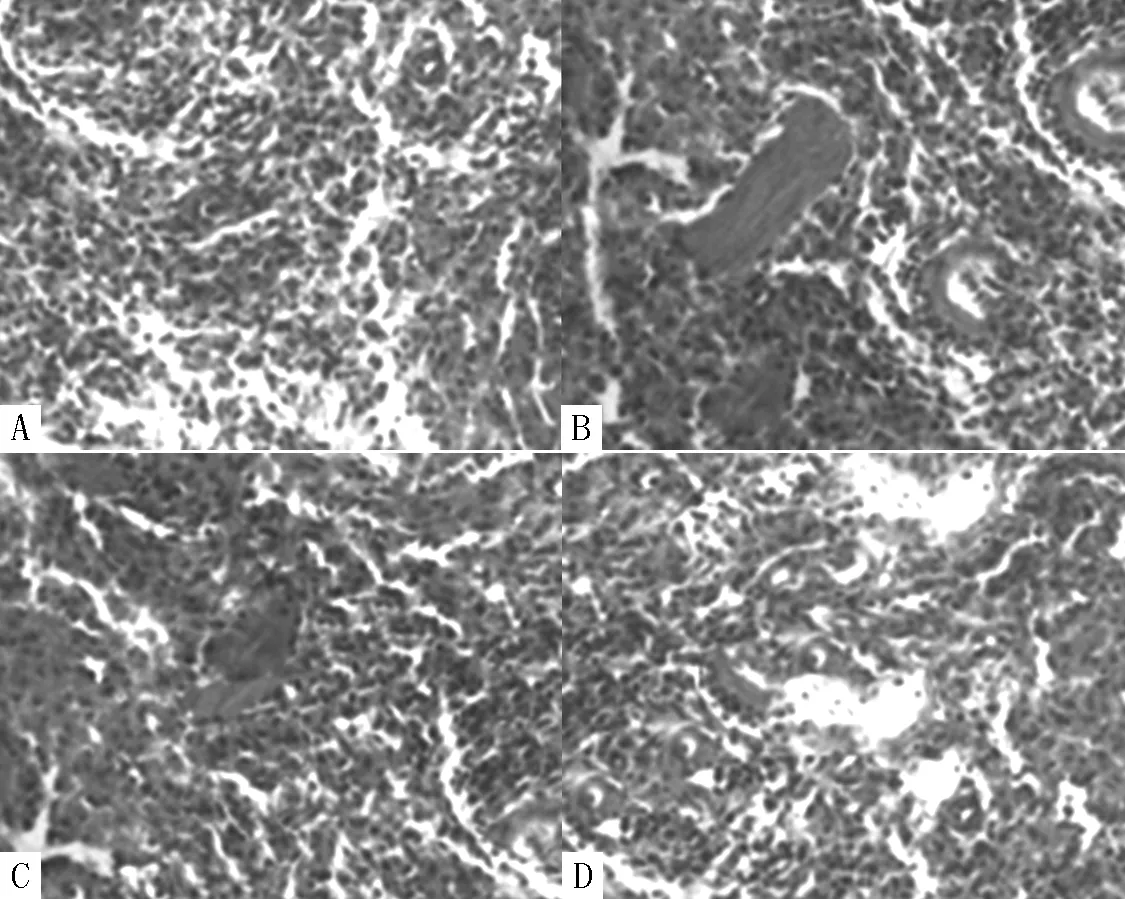
2.8 4组大鼠心肌细胞凋亡率比较 正盐组大鼠心肌细胞凋亡率为0,高盐组大鼠心肌细胞凋亡率为(29.24±6.03)%,ADSCs组大鼠心肌细胞凋亡率为(14.27±2.61)%,TGF-β1基因沉默组大鼠心肌细胞凋亡率为(5.59±0.73)%。高盐组、ADSCs组和TGF-β1基因沉默组大鼠心肌细胞凋亡率比较,差异有统计学意义(F=49.12,P<0.01);其中ADSCs组和TGF-β1基因沉默组大鼠心肌细胞凋亡率低于高盐组,TGF-β1基因沉默组大鼠心肌细胞凋亡率低于ADSCs组,差异有统计学意义(P<0.05,见图7)。

注:A为正盐组,B为高盐组,C为ADSCs组,D为TGF-β1基因沉默组
图6 4组大鼠心肌组织中CM-Dil标记的ADSCs(4′,6-二脒基-2苯基吲哚染色,×200)
Figure 6 CM-Dil marked ADSCs of myocardial tissue of the four groups
注:A为正盐组,B为高盐组,C为ADSCs组,D为TGF-β1基因沉默组
图7 4组大鼠心肌细胞凋亡情况(HE染色,×200)
Figure 7 Apoptosis of myocardial cell of the four groups
3 讨论
心肌纤维化是诸多心血管疾病的终末期典型症状,其能导致心力衰竭、心律失常等,可严重威胁患者的生命安全。有临床研究表明,盐敏感性高血压可能导致大鼠心肌纤维化、心功能明显下降及心肌细胞凋亡增加[23]。心肌纤维化是盐敏感性高血压的重要伴随症状,纤维化心肌常伴随心肌组织炎性反应,而炎性反应被认为是心肌纤维化的始发环节和加剧原因[24-26]。
本研究结果显示,基因转染后第3天和第14天空白组和对照组ADSCs TGF-β1蛋白相对表达量间无差异,但TGF-β1siRNA转染组ADSCs TGF-β1蛋白相对表达量低于空白组和对照组,提示基因转染后ADSCs TGF-β1表达水平明显降低,且其低表达水平可持续14 d。本研究移植TGF-β1基因沉默的ADSCs后,于心肌损伤组织中观察到较多CM-Dil标记的ADSCs,且TGF-β1基因沉默组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量低于正盐组、高盐组及ADSCs组,ADSCs组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量低于正盐组、高盐组,高盐组大鼠心肌组织TGF-β1mRNA、蛋白相对表达量高于正盐组。提示ADSCs可以靶向性地向盐敏感性高血压大鼠心肌损伤部位迁移募集,且成功移植TGF-β1基因沉默的ADSCs。
李谦等[23]研究结果显示,高盐饮食可促使盐敏感性高血压大鼠心脏射血功能、心肌收缩能力及左心室发育发生异常;此外,盐敏感性高血压大鼠心肌纤维化严重、胶原沉积增加。本研究结果显示,细胞移植2周后,高盐组和ADSCs组大鼠LVEF和FS低于正盐组和TGF-β1基因沉默组,LVMI高于正盐组和TGF-β1基因沉默组;ADSCs组和TGF-β1基因沉默组大鼠LVEF和FS高于高盐组,LVMI低于高盐组;TGF-β1基因沉默组大鼠LVEF和FS高于ADSCs组,LVMI低于ADSCs组;高盐组、ADSCs组和TGF-β1基因沉默组大鼠胶原容积积分高于正盐组,ADSCs组和TGF-β1基因沉默组大鼠胶原容积积分低于高盐组,TGF-β1基因沉默组大鼠胶原容积积分低于ADSCs组;正盐组大鼠心肌细胞凋亡率为0,ADSCs组和TGF-β1基因沉默组大鼠心肌细胞凋亡率低于高盐组,TGF-β1基因沉默组大鼠心肌细胞凋亡率低于ADSCs组。提示细胞移植2周后TGF-β1基因沉默ADSCs移植可以有效缓解盐敏感性高血压大鼠心肌纤维化、减少心肌细胞凋亡,与诸多研究显示ADSCs移植能明显改善心功能、降低心肌损伤相一致[27-30]。有研究显示,ADSCs移植可有效抑制炎性细胞增殖[31],降低促炎性细胞合成[32]。本研究HE染色结果显示,高盐组大鼠心肌出现明显纤维化且巨噬细胞浸润明显增多,ADSCs组大鼠心肌纤维化较轻,TGF-β1沉默组大鼠心脏纤维化最轻、巨噬细胞浸润最少,分析原因可能与TGF-β1基因沉默ADSCs移植后心肌纤维化减轻有关,但具体原因有待进一步探讨。
综上所述,基因沉默TGF-β1ADSCs移植能有效减轻盐敏感性高血压大鼠心肌纤维化、减少心肌细胞凋亡。
作者贡献: 方汉军进行实验实施、资料收集整理、撰写论文初稿、成文并对文章负责; 李锋华、许成辅助实验实施、 资料收集整理、实验评估;廉秋芳进行实验设计、质量控制及审校。
本文无利益冲突。
[1]DOAEI S,GHOLAMALIZADEH M.The association of genetic variations with sensitivity of blood pressure to dietary salt:A narrative literature review[J].ARYA Atheroscler,2014,10(3):169-174.
[2]刘美丽,宋海旭,邵晓平,等.趋化因子配体16在高盐诱导的盐敏感性高血压大鼠心肌重构中的作用[J].解放军医学杂志,2015,40(11):873-879.
[3]张国华.TGF-β1/Smads信号通路在高血压心肌纤维化中的调控机制研究进展[J].山东医药,2014,54(7):85-87.
[4]ZHAO M,ZHENG S,YANG J,et al.Suppression of TGF-β1/Smad Signaling Pathway by Sesamin Contributes to the Attenuation of Myocardial Fibrosis in Spontaneously Hypertensive Rats[J].PLos One,2015,10(3):e0121312.DOI:10.1371/journal.pone.0121312.
[5]TANG Y,GAN X,CHEHELTANI R,et al.Targeted delivery of vascular endothelial growth factor improves stem cell therapy in a rat myocardial infarction model[J].Nanomedicine,2014,10(8):1711-1718.DOI:10.1016/j.nano.2014.06.001.
[6]RUSSO V,YOUNG S,HAMILTON A,et al.Mesenchymal stem cell delivery strategies to promote cardiac regeneration following ischemic injury[J].Biomaterials,2014,35(13):3956-3974.DOI:10.1016/j.biomaterials.2014.01.075.
[7]YEH T S,FANG Y H,LU C H,et al.Baculovirus-transduced,VEGF-expressing adipose-derived stem cell sheet for the treatment of myocardium infarction[J].Biomaterials,2014,35(1):174-184.DOI:10.1016/j.biomaterials.2013.09.080.
[8]龙仙萍,邓文文,赵然尊,等.沉默Nrf2基因的骨髓间充质干细胞移植对大鼠心肌梗死后心室重构和纤维化的影响[J].中国动脉硬化杂志,2015,23(5):469-474.
[9]孙惠萍,王宝珠,马依彤.大鼠脂肪干细胞联合碱性成纤维生长因子治疗大鼠心肌梗死[J].中华生物医学工程杂志,2014,20(1):29-33.DOI:10.3760/cma.j.issn.1674-1927.2014.01.007.
[10]覃杰,闫翠,陈极锋,等.碱性成纤维生长因子在脂肪干细胞治疗心肌梗死中的作用[J].新医学,2015,46(1):11-15.DOI:10.3969/g.issn.0253-9802.2015.01.003.
[11]李佳丹.脂肪间充质干细胞对大鼠急性心肌梗死后心功能的影响及机制初步探讨[D].北京:中国人民解放军医学院,2014.
[12]汪晓强,杨向群.脂肪干细胞治疗心肌梗死的机制与新策略[J].中华细胞与干细胞杂志(电子版),2014,4(3):50-55.
[13]樊艳,王建军,魏峰,等.脂肪间充质干细胞移植对心肌梗死后炎症反应及心室重构的影响[J].中国组织工程研究,2014,18(6):900-905.DOI:10.3969/j.issn.2095-4344.2014.06.013.
[14]石园园,杨向群.脂肪源性干细胞向心肌细胞诱导分化的研究进展[J].组织工程与重建外科杂志,2014,10(6):351-354.DOI:10.3969/j.issn.1673-0364.2014.06.014.
[15]赵珮娟,程辰,谢芸,等.脂肪来源干细胞相关生长因子及其作用的研究进展[J].组织工程与重建外科杂志,2013,9(5):285-288.
[16]赵佳佳.脂肪干细胞来源的生长因子对皮肤成纤维细胞迁移和增殖的影响[D].武汉:华中科技大学,2013.
[17]张国华.TGF-β1/Smads信号通路在高血压心肌纤维化中的调控机制研究进展[J].山东医药,2014,54(7):85-87.
[18]丁文金,敖碧凤,欧阳伟炜,等.TGF-β1在不同原因致心肌纤维化中的作用[J].科技导报,2016,34(2):221-225.
[19]CHEN R,XUE J,XIE M.Puerarin prevents isoprenaline-induced myocardial fibrosis in mice by reduction of myocardial TGF-β1expression[J].J Nutr Biochem,2012,23(9):1080-1085.DOI:10.1016/j.jnutbio.2011.05.015.
[20]BEAUMONT J,LPEZ B,HERMIDA N,et al.microRNA-122 down-regulation may play a role in severe myocardial fibrosis in human aortic stenosis through TGF-β1up-regulation[J].Clin Sci(Lond) ,2014 ,126(7):497-506.DOI:10.1042/CS20130538.
[21]SHEN X C,YANG Y P,XIAO T T,et al.Protective effect of oxymatrine on myocardial fibrosis induced by acute myocardial infarction in rats involved in TGF-β-Smads signal pathway[J].J Asian Nat Prod Res,2011,13(3):215-24.DOI:10.1080/10286020.2010.550883.
[22]ZHANG Y,SHAO L,MA A,et al.Telmisartan delays myocardial fibrosis in rats with hypertensive left ventricular hypertrophy by TGF-β1Smad signal pathway[J].Hypertension Research Official Journal of the Japanese Society of Hypertension,2013,37(1):43-49.
[23]李谦,马礼坤,何立峰,等.伊马替尼对醋酸去氧皮质酮诱导的盐敏感性高血压大鼠心肌纤维化的干预作用[J].中国病理生理杂志,2012,28(1):53-58.
[24]HABIBI J,DEMARCO V G,MA L,et al.Mineralocorticoid receptor blockade improves diastolic function independent of blood pressure reduction in a transgenic model of RAAS overexpression[J].Am J Physiol Heart Circ Physiol,2011,300(4):H1484-H1491.
[25]USHER M G,DUAN S Z,IVASCHENKO C Y,et al.Myeloid mineralocorticoid receptor controls macrophage polarization and cardiovascular hypertrophy and remodeling in mice[J].J Clin Invest,2010,120(9):3350-3364.
[26]DOOLEY R,HARVEY B J,THOMAS W.The regulation of cell growth and survival by aldosterone[J].Front Biosci(Landmark Ed),2011,16:440-457.
[27]ISHII M,SHIBATA R,YAMAMOTO T,et al.Abstract 10894:Adipose-derived Stem Cell Sheets Created by a Novel Magnetite Tissue Engineering Method for Myocardial Infarction[J].Circulation,2012(21):A10894.
[28]LEE H W,HAN C L,PARK J H,et al.Effects of Intracoronary Administration of Autologous Adipose Tissue-Derived Stem Cells on Acute Myocardial Infarction in a Porcine Model[J].Yonsei Medical Journal,2015,56(6):1522-1529.
[29]MAZO M,HERNNDEZ S,GAVIRA J J,et al.Treatment of reperfused ischemia with adipose-derived stem cells in a preclinical Swine model of myocardial infarction[J].Cell Transplant,2012,21(12):2723-2733.
[30]RIGOL M,SOLANES N,FARRÉ J,et al.Effects of adipose tissue-derived stem cell therapy after myocardial infarction:impact of the route of administration[J].J Card Fail,2010,16(4):357-366.DOI:10.1016/j.cardfail.2009.12.006.
[31]CROP M J,BAAN C C,KOREVAAR S S,et al.Inflammatory conditions affect gene expression and function of human adipose tissue-derived mesenchymal stem cells[J].Clin Exp Immunol,2010,162(3):474-486.DOI:10.1111/j.1365-2249.2010.04256.x.
[32]孔志华,袁玉林,熊志,等.脂肪干细胞的免疫学性质分析[J].现代诊断与治疗,2014,25(22):5080-5082.
(本文编辑:谢武英)
Impact of Transplantation of TGF-β1Gene Silencing Adipose-derived Stromal Cells on Myocardial Fibrosis and Apoptosis of Salt-sensitive Hypertensive Rats
FANGHan-jun1,LIFeng-hua1,XUCheng1,LIANQiu-fang2
1.DepartmentofLargeVascularSurgery,XianyangHospitalofYan′anUniversity,Xianyang712000,China2.DepartmentofCardiovascularMedicine,XianyangHospitalofYan′anUniversity,Xianyang712000,ChinaCorrespondingauthor:LIANQiu-fang,E-mail:liupeitjyd@163.com
Objective To investigate the impact of transplantation of TGF-β1gene silencing adipose-derived stromal cells(ADSCs)on myocardial fibrosis and apoptosis of salt-sensitive hypertensive rats.Methods This experiment was completed in the Central Laboratory for Medical Experimental Animals of Shaanxi Province from June 2015 to July 2016.ADSCs was cultured in vitro,mRNA and siRNA expressed plasmids with TGF-β1targeted gene were constructed and infected by virus;the third-generation ADSCs were infected by slow virus and divided into blank group,control group and experiment group(with TGF-β1-siRNA transfection).Western blot method was used to detect the protein expression of TGF-β1of the above three groups after 3 and 14 days of gene transfection.A total of 80 SPF male Dahl salt-sensitive rats were selected to prepare the salt-sensitive hypertensive rats model,and they were divided into A group,B group,C group and D group according to random number table,each of 20 rats.Rats of A group
0.3% NaCl diet,rats of B group received 8% NaCl diet,rats of C group received caudal vein transplantation of ADSCs after 6 weeks of 8% NaCl diet for 3 days,while rats of D group received caudal vein transplantation of TGF-β1gene silencing ADSCs after 6 weeks of 8% NaCl diet for 3 days.After 2 weeks of transplantation,T-PCR was used to detect the mRNA expression of TGF-β1of myocardial tissue,Western Blot method was used to detect the protein expression of TGF-β1of myocardial tissue,ultrasonic cardiogram was used to detect the LVEF and FS,meanwhile LVMI was calculated,VG staining method was used to observe and calculate the collagen volume fraction,HE staining method was used to observe the myocardial cell morphology,CM-Dil marked ADSCs in myocardial tissue was observed by fluorescence microscope,and TUNEL method was used to detect the apoptosis of myocardial cells.Results (1)Fluorescence microscope found that,CM-Dil marked ADSCs were red,and the marking percentage was 97%.(2)No statistically significant differences of relative expression quantity of TGF-β1protein of ADSCs was found between blank group and control after 3 or 14 days of gene transfection(P>0.05),while relative expression quantity of TGF-β1protein of ADSCs of experiment group was statistically significantly lower than that of blank group and control group,respectively(P<0.05).(3)After 2 weeks of transplantation,relative expression quantity of TGF-β1mRNA and TGF-β1protein of myocardial tissue of D group was statistically significantly lower than that of A group,B group and C group,respectively,relative expression quantity of TGF-β1mRNA and TGF-β1protein of myocardial tissue of C group was statistically significantly lower than that of A group and B group,respectively,while relative expression quantity of TGF-β1mRNA and TGF-β1protein of myocardial tissue of B group was statistically significantly higher than that of A group(P<0.05).(4)After 2 weeks of transplantation,LVEF and FS of B group and C group were statistically significantly lower than those of A group and D group,while LVMI of B group and C group was statistically significantly higher than that of A group and D group,respectively(P<0.05);LVEF and FS of C group were statistically significantly higher than those of B group,while LVMI of C group was statistically significantly lower than that of control group(P<0.05);no statistically significant differences of LVEF,FS or LVMI was found between A group and D group(P>0.05).After 2 weeks of transplantation,collagen volume fraction of B group,C group and D group was statistically significantly higher than that of A group,respectively,while collagen volume fraction of C group and D group was statistically significantly lower than that of B group,respectively,collagen volume fraction of D group was statistically significantly lower than that of C group(P<0.05).(6)After 2 weeks of transplantation,HE staining results showed that,myocardial tissue of B group occurred obvious fibrosis and microphages infiltration,myocardial tissue of C group occurred mild fibrosis,while myocardial tissue of C group occurred a little fibrosis and microphages infiltration.(7)After 2 weeks of transplantation,no CM-Dil marked ADSCs of A group or B group was found by fluorescence microscope,while CM-Dil marked ADSCs of D group was statistically significantly more than that of C group(P<0.05).(8)After 2 weeks of transplantation,myocardial cell apoptosis rate of A group was 0,myocardial cell apoptosis rate of C group and D group was statistically significantly lower than that of B group,while myocardial cell apoptosis rate of D group was statistically significantly lower than that of C group(P<0.05).Conclusion Transplantation of TGF-β1gene silencing ADSCs can effectively relive the myocardial fibrosis and reduce the myocardial cell apoptosis of salt-sensitive hypertensive rats.
Hypertension;Rats,inbred Dahl;Adipose derived stem cells;Transforming growth factor beta1;Gene silencing;Myocardium;Fibrosis;Apoptosis
国家自然科学基金资助项目(81660079):钠钾对Dahl盐敏感大鼠肾髓质PHD2/HIF-1α通路的影响及机制研究;陕西省自然科学基础研究计划项目(2016JM8123):钠钾对Dahl大鼠肾髓质HIF辅氨酰羟化酶2的影响及机制研究
廉秋芳,E-mail:liupeitjyd@163.com
R 544.1
A
10.3969/j.issn.1008-5971.2017.02.015
2016-11-06;
2017-02-15)
方汉军,李锋华,许成,等.转化生长因子β1基因沉默脂肪干细胞移植对盐敏感性高血压大鼠心肌纤维化和心肌细胞的影响研究[J].实用心脑肺血管病杂志,2017,25(2):58-65.[www.syxnf.net]
FANG H J,LI F H,XU C,et al.Impact of transplantation of TGF-β1gene silencing adipose-derived stromal cells on myocardial fibrosis and apoptosis of salt-sensitive hypertensive rats[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2017,25(2):58-65.
1.712000陕西省咸阳市,延安大学咸阳医院心脏大血管外科
2.712000陕西省咸阳市,延安大学咸阳医院心血管内科

