猪油的水酶法提取工艺及其产品品质研究
王庆玲, 蒋 将, 刘元法*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品营养与安全协同创新中心,江苏 无锡214122)
猪油的水酶法提取工艺及其产品品质研究
王庆玲1,2, 蒋 将1,2, 刘元法*1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品营养与安全协同创新中心,江苏 无锡214122)
首次采用水酶法提取猪油并对其提取条件进行了研究,以提油率为评价指标,比较了4种蛋白酶(Alcalase 2.4L,Neutrase 1.5MG,Flavourzyme 1000L和 Protamex)的作用效果。结果表明:碱性蛋白酶Alcalase 2.4L的作用效果最好。选取碱性蛋白酶为酶解用酶,确定酶法提取猪油的最佳酶解工艺为:酶解时间2.0 h,pH 8.0,料液质量体积比为1 g∶1 mL,酶解温度55℃,加酶量为底物质量分数的1.0%,该条件下提油率可达到96.82%。与传统方式得到的猪油产品比较,酶法提取的猪油基本理化指标均较优。
猪油;酶法;提油率;品质
猪油作为一种可食性动物油脂,具有独特的风味功能,在加热时可以弥漫出令人垂涎的香味[1],在我国居民生活中一直占有相当重要的地位[2]。猪油的饱和脂肪酸主要以棕榈酸和硬脂酸为主,不饱和脂肪酸以油酸、亚油酸为主,其中较低含量的花生四烯酸,能够降低血脂,并可与亚油酸、亚麻酸合成具有多种重要生理功能的“前列腺素”[1]。同时猪油中棕榈酸主要分布在甘油酯的Sn-2位,可作为制1,3-二油酸-2-棕榈酸甘油三酯(OPO)的原料[3]。目前,各婴儿配方乳粉厂家均致力于模拟母乳成分,OPO作为一种新型母乳脂肪替代品已经引起了大家的广泛注意。故猪油可应用于婴儿奶粉配方中,为人乳替代脂肪的开发提供良好的原料[4]。
目前传统提取猪油的方式主要包括干法和湿法。传统干法存在出油率低、色泽较深和过氧化值升高的缺陷[5],而传统湿法制取的猪油存在水分含量大、风味差、易酸败的缺点。由于制油方法上存在一定弊端,毛猪油通常需经一定精炼才能满足消费需求。水酶法作为一种新型提油技术,处理条件温和,在增加提油率的同时能较好地保护油脂有效成分不遭受破坏[6],但是目前尚未有关于水酶法提取猪油的研究报道。本课题研究的主要目的以猪背部肥膘为原料,对水酶法提取猪油的提取工艺条件进行优化,旨在为猪油的生产、开发和利用提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
猪背部肥膘肉,购自无锡天鹏食品公司;工业湿法提取毛猪油和精炼猪油,由益海嘉里集团提供;工业干法提取毛猪油和精炼猪油,由众品集团提 供 ;Alcalase 2.4L,Protamex,Neutrase 1.5MG,Flavourzyme 1000L,诺维信(中国)生物技术有限公司产品;无水乙醇,体积分数95%乙醇,乙醚,硫代硫酸钠,异辛烷,冰醋酸,石油醚,氢氧化钾,三氟化硼等(均为分析纯),国药集团化学试剂有限公司产品;FAME混标(1895-1AMP),Sigma公司产品。
AL204型电子天平,梅特勒-托利多仪器 (上海)有限公司产品;JJ-1B型强力恒速电动搅拌器,江苏省金坛市金南仪器厂产品;Deltax型酸度计,梅特勒仪器上海有限公司产品;HH-601型超级恒温水浴,江苏省金坛市精达仪器制造厂产品;Alpha-1500型紫外可见分光光度计,上海谱元仪器有限公司产品;RT-TDL-50A型低速台式大容量离心机,无锡瑞江分析仪器有限公司产品;GC-2014型气相色谱仪,日本岛津公司产品。
1.2 实验方法
1.2.1 原料基本营养成分的测定 水分含量的测定:参考GB/T 9695.15—2008《肉与肉制品 水分含量测定》中的直接干燥法;粗蛋白质的测定:参考GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》中的凯式定氮法;灰分的测定:参考GB/T 9695.18—2008《肉与肉制品 总灰分测定》;粗脂肪的测定:参考GB/T 9695.7—2008《肉与肉制品 总脂肪含量测定》,并将粗脂肪含量定为原料中猪油的含量。
1.2.2 猪油的酶法提取工艺 将-20℃冷冻贮存的猪膘肉在-4℃解冻后绞成糜状,用去离子水调节料液比,调节温度,用2 mol/L NaOH调节混合体系的pH,加入一定量的蛋白酶进行酶解反应,酶解反应一段时间后,离心转速4 500 r/min条件下离心15 min,分离得到上层清油。撮率按下式(1)计算。

式(1)中,P为提油率,M0为提取的猪油质量,M为原料的猪油质量。
1.2.3 猪油的干法和湿法提取条件
1)干法提取:将猪膘肉切成细小颗粒(1cm×1cm),用电磁炉小火力熬制(约160℃)5 min后,冷却至55℃,离心转速4 500 r/min条件下离心15 min。
2)湿法提取:将猪膘肉绞成糜状,用去离子水调节料液质量体积比为1 g∶1 mL,调节温度为55℃或100℃,熬制2 h后,离心转速4 500 r/min条件下离心15 min。
1.2.4 猪油氧化稳定性的测定 以过氧化值(POV)和硫代巴比妥酸值(TBARS)共同评价油脂的氧化稳定性,其中POV值参考GB/T 5538—2005《动植物油脂过氧化值测定》中的硫代硫酸钠滴定法,而TBARS测定方法参照Racanicci等[7]方法并有所改动,TBARS结果表示为丙二醛的含量。
1.2.5 猪油理化性质测定 水分及挥发物含量:参考GB/T 5528—2008《动植物油脂 水分及挥发物含量测定》中的直接干燥法;熔点:参考GB/T 12766—2008《动物油脂 熔点测定》;色泽:参考GB/T 22460—2008《动植物油脂罗维朋色泽的测定》;酸值:参考GB/T 5530—2005《动植物油脂 酸值和酸度测定》中的热乙醇测定法;碘值:参考GB/T 5532—2008《动植物油脂 碘值的测定》中的硫代硫酸钠滴定法;POV:参考GB/T 5538—2005《动植物油脂 过氧化值测定》中的硫代硫酸钠滴定法。
1.2.6 脂肪酸组成分析 样品甲酯化,采用三氟化硼法[8];脂肪酸分析,采用Agilent 7820A气相色谱仪,TRACE TR-FAME毛细管色谱柱 (60 m×0.25 mm×0.25 μm),进样口温度和检测器温度都设置为250℃。色谱柱升温程序:初始温度60℃,保留3 min后,以5℃/min升温至175℃并保留15 min,接着以2℃/min升温至220℃保留10 min;载气为高纯氮气,体积流量1.2 mL/min。根据FAME混标的气相色谱图,分析样品的脂肪酸组成,并根据峰面积确定脂肪酸含量。
1.2.7 数据统计分析 实验数据重复3次平行3次,结果表示为平均值±标准偏差,图表由SigmaPlot 11.0,Origin 8.0和Excel 2010分析。
2 结果与讨论
2.1 猪背部肥膘肉基本组成
本实验中所用猪背部肥膘肉的基本成分见表1。

表1 猪背部肥膘肉基本组成Table 1 Basic components of the pig fatback
由表1可知猪背部肥膘肉中的粗蛋白质质量分数仅占5.01%,而粗脂肪质量分数达到83.98%。
2.2 猪油的酶法提取工艺条件的优化
2.2.1 酶种类对提油率的影响 由于不同蛋白酶对蛋白质的作用位点不同,水解效果存在差异,需要对蛋白酶进行一定的筛选。在参考文献的基础上,选择4种蛋白酶(碱性蛋白酶、中性蛋白酶、风味蛋白酶、复合蛋白酶)对猪脂肪组织分别进行酶解,参考相关酶制剂产品的使用说明,确定各种蛋白酶的水解条件,如表2所示。

表2 蛋白酶的反应条件Table 2 Hydrolysis conditions of various enzymes
蛋白酶水解能力的差异主要是由蛋白酶对肽键的专一性不同引起的[9],由图1可以看出,在加酶量(0.8%)较低时,Alcalase 2.4L的效果明显优于其他3种酶,提油率Alcalase 2.4L>Protamex>Neutrase 1.5MG>Flavourzyme 1000L;而随着酶用量的增加,提油率也相应的提高,Protamex的提油效果开始接近Alcalase 2.4L。综合考虑酶的作用效果和价格等因素,Alcalase 2.4L价格低廉且提油率高,故选用Alcalase 2.4L作为猪油的提取酶。

图1 不同蛋白酶对提油率的影响Fig.1 Effect of proteases on oil extraction yields
2.2.2 酶解时间对提油率的影响 在料液质量体积比为1 g∶1 mL,温度为50℃,pH值为8.0,加酶量为0.5%的条件下,研究酶解时间对提油率的影响。酶解时间的长短是使细胞能否较大程度破碎的关键因素之一[10],如图2所示,随着酶解时间的延长,细胞破碎程度增大,有利于油滴的释放,提油率随之增加,但是当酶解时间达到2 h后提油率变化不大,这主要是因为酶和底物的作用已经较彻底。综合考虑提油率、生产周期、生产成本等因素,选取酶解时间为2 h。

图2 酶解时间与提油率之间的关系Fig.2 Relationship between hydrolysis time and oil extraction yield
2.2.3 pH对提油率的影响 选定酶解时间为2 h,在料液质量体积比为1 g∶1 mL、温度为50℃,加酶量为0.5%的条件下,研究不同pH对提油率的影响,结果如图3所示。可以看出,当pH值在6.0~9.0范围内时,提油率随着pH的增加先升高后降低,这是因为酶在一定的条件下都有其特定的最适pH值,在此条件下酶表现出最大活力,当pH值过高或过低时,酶的活力都会受到影响[11],从而影响猪油的提油率。但是在pH 5.0时,猪油提油率出现异常升高现象,可能是因为在pH 5.0条件下,虽然酶活较低,但由于接近蛋白质的等电点,蛋白质之间会相互作用,发生聚集,有利于油的释放,从而导致提油率升高。为了验证这一点,在不加酶条件下,分别在pH 2.0、4.5、8.0条件下提油,比较pH对提油率的影响,结果如图3柱状图所示,可以看出,在pH 4.5时提油率的确出现异常升高的现象,从而证实以上推测。
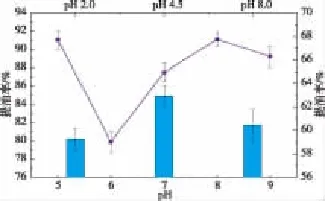
图3 pH与提油率之间的关系Fig.3 Relationship between pH and oil extraction yield
POV值和TBARS值是反应脂肪氧化程度的参数,POV值反映了油脂氧化的初级产物含量[12],而TBARS值可以反映了油脂氧化的次级产物含量[13]。通过图4,比较第0—14天的POV值可以明显看出,pH 2.0、4.5的猪油POV值明显高于pH 8.0,不利于猪油的贮藏稳定。TBARS值的变化趋势与POV值一致,进一步证实了酸性环境对猪油的氧化稳定性不利,这可能是因为在酸性条件下,较多甘三酯会水解生成游离脂肪酸,大量游离脂肪酸的存在使油脂易氧化。综合考虑提油率和油脂的氧化稳定性,选取pH 8.0为最适酶解pH。

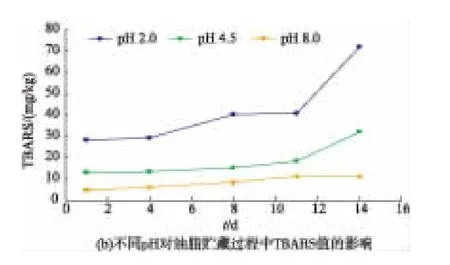
图4 不同pH对油脂贮藏过程中POV值和TBARS值的影响Fig.4 Effect of pH on POV and TBARS during storage
2.2.4 料液比对提油率的影响 选定酶解时间为2 h,pH 8.0,在温度为50℃,加酶量为0.5%的条件下,研究不同料液质量体积比 (2∶1、1∶1、1∶2、1∶3、1∶4(g/mL))对提油率的影响,结果如图5所示。当料液比较大时,体系黏度大,流动性差,抑制了酶分子的迁移和油分子的游离[14],故提油率降低;料液比过小时,导致酶和底物的浓度降低,影响酶反应速度,导致提油率下降。因此将料液比确定在1 g∶1 mL。

图5 提油率与料液比之间的关系Fig.5 Relationship between the ratio of material to water and oil extraction yield
2.2.5 温度对提油率的影响 选定酶解时间为2 h,pH 8.0,料液比1 g∶1 mL,在加酶量为0.5%的条件下,研究温度对提油率的影响。温度对酶促反应较复杂,一方面温度升高,酶促反应速率加快,但当温度过高时,酶会逐渐变性而失活,使酶反应速率下降,而且温度过高也会影响油的品质[11]。由图6可以看出,在45~60℃温度范围内,随着反应温度的升高,提油率逐渐增加,但是当温度达到65℃时,由于酶活性受到抑制,酶解效果变差,提油率出现下降的趋势。

图6 提油率与温度之间的关系Fig.6 Relationship between temperature and oil extraction yield
同时由图7可以看出,在14 d的贮藏时间里,POV值和TBARS值随温度的升高而明显增加,说明在提油过程中过高的温度会降低猪油的氧化稳定性,不利于油脂的保藏。综合考虑提油率和氧化稳定性两方面因素,选定酶解温度为55℃。

图7 不同温度对贮藏过程中POV值和TBARS值的影响Fig.7 Effect of temperature on POV and TBARS during storage
2.2.6 加酶量对提油率的影响 选定酶解时间为2 h,pH 8.0,料液质量体积比 1 g∶1 mL,在温度55℃条件下,研究加酶量对提油率的影响,结果如图8所示,可以看出,随着加酶量的增加,提油率逐渐上升,这是因为在底物浓度一定时,与底物作用的酶量越大,反应速度越快,酶解越彻底[15]。当加酶量为1.0%时,提油率趋于平缓。综合考虑提油率和经济成本,选取加酶量为1.0%为最适加酶量,此时提油率可达到96.82%。

图8 提油率与加酶量之间的关系Fig.8 Relationship between the enzyme amount and oil extraction yield
2.3 猪油基本理化指标测定
在理化性质方面,将酶法提取的猪油(AEE)与工业湿法提取毛猪油(C1-1)和精炼猪油(C1-2)、工业干法提取毛猪油(C2-1)和精炼猪油(C2-2)、实验室湿法提取猪油(AE)、实验室湿法提取猪油(DE)进行比较,全面评价酶法提取猪油的品质,结果如表3和图9所示。与传统的干法和湿法得到猪油样品相比,AEE的色泽(0.5R+1.6Y)最浅。通过图9也可以更直观地看出,液态的AEE更透亮,固态的AEE颜色也更洁白,这是因为酶法提取过程条件温和,避免了过多有色物质的生成;虽然AEE水分含量较干法提取猪油样品(C2-1和DE)的水分含量稍高,但是仍满足国家一级食用猪油标准,故在生产过程中不需进行脱水;AEE的酸价较低,可能因为水酶法提取过程碱的加入中和了部分游离脂肪酸[16];POV值和丙二醛含量可反应油脂的氧化程度,而碘价是衡量油脂不饱和程度的重要指标[17],油脂中不饱和脂肪酸含量越高,碘值越大。由表3可知,AEE的POV值(0.509 meq/kg=0.006 4%)和丙二醛质量均比较低,甚至低于精炼猪油,而碘价相对较高,这说明酶法提油工艺可以使原料中存在的不饱和脂肪酸较好的保留下来[18]。

表3 猪油部分理化指标比较Table 3 Physicochemical indexes of lards obtained by different processes

图9 不同方式得到猪油颜色比较Fig.9 Solid and liquid lard samples from different processes
与国家食用猪油标准GB/T8937—2206进行对比,发现酶法提取猪油的水分、酸价、碘值、POV值和皂化值等指标均达到国家一级食用猪油标准。猪油品质高,可以免除精炼的繁琐步骤,提高生产效率,降低能耗及成本。
2.4 猪油脂肪酸组成分析
不同方式得到猪油的脂肪酸组成如表4所示,可以看出AEE与工业来源毛猪油(C1-1、C2-1)脂肪酸质量分数略有不同,这主要是由于提油原料的来源不同而引起。当原料相同时,比较AEE、DE、AE可以看出,不同方式得到的猪油的脂肪酸组成及质量分数并无明显差异,说明酶法提取过程对油的脂肪酸组成并无显著影响,这一结果与Latif[19]和Puangsri[20]等的研究相吻合,从而表明酶法提取过程安全有效。
3 结语
本文中较系统地研究了水酶法提取猪油工艺,在酶解时间为2 h,pH 8.0,料液质量体积比1 g∶1 mL,温度55℃,加酶量为1%条件下,提油率可以达到96.82%。对不同方式得到的猪油的品质分析表明,水酶法提取猪油的各项理化指标均优于传统方式提取的猪油样品,并且达到国家一级食用猪油标准,因而可以免除精炼的繁琐步骤,缩短猪油的生产周期,节约生产成本。同时脂肪酸分析结果表明,水酶法提油技术安全有效,不会影响猪油的脂肪酸组成。水酶法作为提取猪油的一种新方式,条件温和而有效,可以弥补传统提取方式的不足,对猪油的工业生产具有一定指导意义。
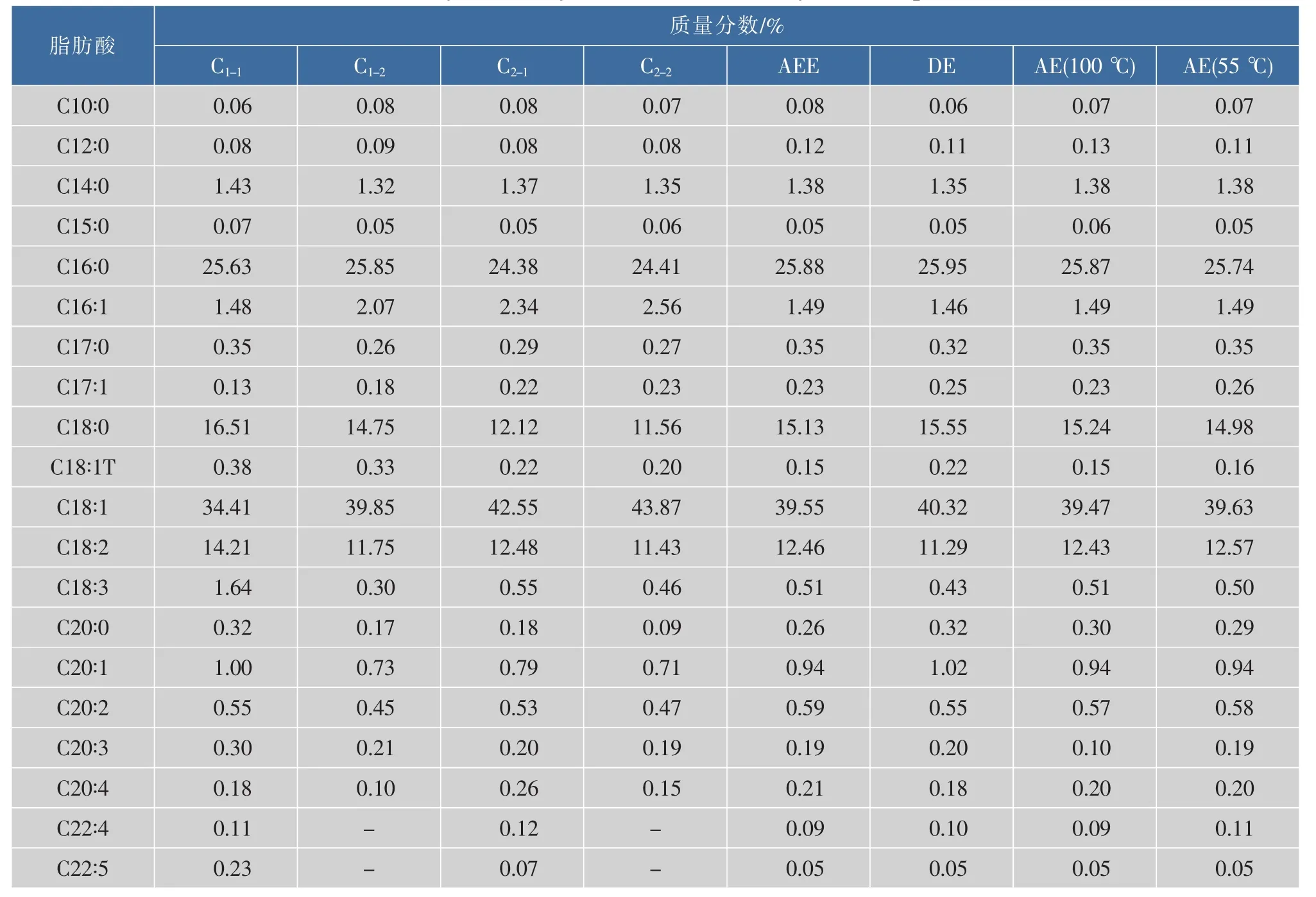
表4 猪油的脂肪酸组成比较Table 4 Fatty acid analysis of lards obtained by different processes
[1]冀聪伟.低胆固醇猪油基焙烤起酥油的研究[D].无锡:江南大学食品学院,2012.
[2]MA Yuan,ZHU Shenghua,HU Chunmei,et al.Research of VE composite antioxidant properties in lard[J].The Food Industry,2012(1):48-50.(in Chinese)
[3]LI Xinqian,DENG Li,YE Xianchun,et al.Enzymatic acidolysis of lard to produce 1,3-dioleoyl-2-palmitoylglycerol by Candida sp.99-125 lipase[J].Chinese Journal of Bioprocess Engineering,2013(3):13-17.(in Chinese)
[4]SHAHIDI F.Bailey’s Industrial Oil and Fat Products[M].6th edition.New York:John Wiley&Sons,2005:161-212.
[5]ZHANG Songpei.The development of pig grease and its application in food[J].Meat Industry,2002(4):22-25.(in Chinese)
[6]TANG Feng,XU Xueqin,LI Jue,et al.Investigation of aqueous enzymatic extracting of fish oil from the entrails of chub[J].Food Science and Technology,2007,32(11):216-218.(in Chinese)
[7]RACANICCI A M C,DANIELSEN B,SKIBSTED L H.Mate(Ilex paraguariensis)as a source of water extractable antioxidant for use in chicken meat[J].European Food Research and Technology,2008,227:255-260.
[8]FENG Guoxia,HUANG Jianhua,WANG Xingguo,et al.Quality change of soybean oil during frying[J].China Oils and Fats,2014(9):40-43.(in Chinese)
[9]王茵.紫菜降血压肽的酶法制备及降压效果的研究[D].福州:福建农林大学生命科学学院,2009.
[10]罗明亮.水酶法提取蓖麻油工艺研究[D].长沙:中南林业科技大学生命科学学院,2014.
[11]LU Jianfeng,LIN Lin,ZHANG Weiwei,et al.Aqueous enzymatic extraction of fish oil from viscera of vhannel vatfish(Ictalurus punctatus)[J].Food Science,2010,31(22):75-80.(in Chinese)
[12]GE Linmei,GAO Haiyan,CHEN Hangjun,et al.Effect of processing on lipid oxidation and antioxidant ability of torreya grandis [J].Journal of the Chinese Cereals and Oils Association,2011,26(5):42-46.(in Chinese)
[13]SUN Yue'e,WANG Weidong.Domestic and foreign research progress on analysis methods of lipid oxidation[J].Journal of the Chinese Cereals and Oils Association,2010,25(9):123-128.(in Chinese)
[14]PENG Yaoyao,WANG Qianqian,WANG Aimei,et al.Aqueous enzymatic extraction of Paeonia suffruticosa seed oil[J].China Oils and Fats,2014(6):12-17.(in Chinese)
[15]谭春兰.水酶法在菜籽加工中的应用研究[D].成都:西华大学食品与生物工程学院,2007.
[16]ZHANG S B,LU Q Y,YANG H S,LI Y,WANG S.Aqueous enzymatic extraction of oil and protein hydrolysates from roasted peanut seeds[J].Journal of the American Oil Chemists'Society,2011,88:727-732.
[17]阮剑均.米糠毛油的氧化稳定性及其营养价值评估的研究[D].南京:南京农业大学动物科技学院,2012.
[18]张伟伟.斑点叉尾鮰内脏油提取、精制及其氧化稳定性的研究[D].合肥:合肥工业大学食品科学与工程学院,2010.
[19]LATIF S,DIOSADYAND L L,ANWAR F.Enzyme-assisted aqueous extraction of oil and protein from canola(Brassica napus L.)seeds[J].European Journal of Lipid Science and Technology,2008,110(10):887-892.
[20]PUANGSRI T,ABDULKARIM S M,GHAZALI H M.Properties of Carica papaya L.(Papaya)seed oil following extraction using solvent and aqueous enzymatic methods[J].Journal of Food Lipids,2005(12):62-67.
Aqueous Enzymatic Extraction of Lard and its Product Quality
WANG Qingling1,2, JIANG Jiang1,2, LIU Yuanfa*1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Collaborative innovation center of food nutrition and safety,Jiangnan University,Wuxi 214122,China)
Extraction of lard with aqueous enzymatic method was studied.Four proteases,Alcalase 2.4L,Neutrase 1.5MG,Flavourzyme 1000L and Protamex were evaluated for their efficiency in oil release,and Alcalase 2.4L was found to the most effective for oil-extraction.The optimal hydrolysis parameters for Alcalase 2.4L were hydrolysis time 2.0 h,temperature 55℃,pH 8.0,ratio of material to water 1 g∶1 mL and enzyme amount 1%(E/S),which resulted in an oil extraction yield of 96.82%. Lard obtained by the enzymatic extraction was superior to those by traditional methods according to physicochemical properties.
lard,aqueous enzymatic method,oil extraction yield,quality
TS 224
A
1673—1689(2017)02—0164—08
2015-03-26
国家自然科学基金项目(31301497);国家863计划项目(2011 AA100806;2013AA102103)。
*通信作者:刘元法(1974—),男,山东淄博人,工学博士,教授,博士研究生导师,主要从事油脂深加工研究。E-mail:foodscilyf@163.com
王庆玲,蒋将,刘元法.猪油的水酶法提取工艺及其产品品质研究[J].食品与生物技术学报,2017,36(02):164-171.

