蜗牛消化酶提取河蟹微孢子虫基因组反应条件的优化
刘洪岩,赵彦华,孙梦玲,薛晖
(江苏省淡水水产研究所,江苏 南京 210017)
蜗牛消化酶提取河蟹微孢子虫基因组反应条件的优化
刘洪岩,赵彦华,孙梦玲,薛晖
(江苏省淡水水产研究所,江苏 南京 210017)
PCR是目前能够特异地检测河蟹微孢子虫的最灵敏的方法。河蟹微孢子虫孢子壁坚厚不易破碎,对许多化学物质有很强的抵抗性,常规的核酸抽提方法效果不够理想。本文通过对比PCR的结果,研究蜗牛消化酶对DNA抽提效果的影响,确定了酶作用的最佳反应条件,提高了PCR检测河蟹微孢子虫的灵敏性。结果显示:蜗牛消化酶提取微孢子虫DNA的酶促反应温度为37℃,底物浓度为20 mg,酶的使用浓度为酶/底物重量比400 mg/g,酶促反应时间为4 h。实验表明,使用蜗牛消化酶处理样品,有助于更加灵敏地检测出微孢子虫。该研究结果将有助于提高河蟹微孢子虫病的检验检测能力,对河蟹微孢子虫的检疫和防治具有积极意义。
河蟹微孢子虫;DNA抽提方法;PCR
2015年大规模发病于江苏的河蟹微孢子虫病对江苏省的河蟹产业造成了重大损伤,致死率约为40%~50%[1]。微孢子虫(Microsporidia)是一类专性细胞内寄生的单细胞真核生物,有着寄主广泛,能感染许多经济动物,如家蚕(Bombyxmori)、蜜蜂(Apis mellifera),河蟹(Eriocheir sinensis)等节肢动物以及鱼类,给生产者造成不同程度的经济损失[2];还能感染啮齿类动物、皮毛动物、灵长类动物及人类,引起动物和人类的疾病[3]。
目前对于河蟹微孢子虫的检测方法普遍采用PCR技术[4]。微孢子虫孢子具有蛋白性孢子外壁和含几丁质的孢子内壁。微孢子虫的孢子壁能够维持形态和抵抗外界不利环境。但是由于孢子壁的坚韧,给微孢子虫基因组DNA提取增加了难度。制备河蟹微孢子虫基因组DNA是后续实验能够顺利进行的关键,提高基因组提取的完整性,是提高河蟹微孢子虫分子检测灵敏度的有效手段。
蜗牛消化酶是一种复合酶系,由几丁质酶、葡萄糖酶、甘露聚糖酶和纤维素酶构成[5],其中的几丁质酶可以特异性的水解几丁质,从而瓦解微孢子虫的孢子壁,提取微孢子虫的基因组DNA。由于没有纯化的河蟹微孢子虫,提取的基因组为河蟹与微孢子虫基因组的混合物,因此不能使用琼脂糖凝胶电泳直接检测基因组提取的情况。为了能够反映基因组提取的情况,实验采用了PCR的方法,特异性扩增微孢子虫基因组的片段,根据反应产物的浓度,间接反映出微孢子虫基因组的浓度,检测微孢子虫基因组提取的完整性。
为了优选灵敏的微孢子虫基因组DNA抽提方法。该研究将评价蜗牛消化酶作用于河蟹微孢子虫基因组提取过程中,消化时间,酶浓度,底物浓度和反应温度四种因素对PCR检测河蟹微孢子虫的影响。
1 材料与方法
1.1 材料
中华绒螯蟹病蟹由兴化水产站提供;蜗牛消化酶购于上海生工;β-巯基乙醇,山梨醇购于Sigma;组织提取试剂盒购于TAKARA;Taq酶购于TAKARA。
1.2 中华绒螯蟹微孢子虫基因组提取
取5 mg病变的河蟹肝胰腺,加入终浓度10% SDS 50 μL,终浓度1 mg/mL蛋白酶K 25 μL,37℃水浴消化2 h,95℃处理10 min,加入不同浓度的蜗牛消化酶,处理相应时间,加入550 μL饱和酚,颠倒混匀,静置2 min,4℃12 000 r/min离心5 min,取上清加入等量的酚/氯仿(25∶24,v/v)抽提(4℃12 000 r/min离心5 min),重复1次,再加等量氯仿抽提1次(4℃12 000 r/min离心5 min),取上清,并加入上清1/10体积3 mol/L NaAc(pH值5.4)及2倍体积(20℃预冷的无水乙醇),充分混合后(20℃沉淀3 h,12 000 r/min)离心10 min,去上清,加入75%乙醇洗盐,干燥10 min,加入10 μL TE溶解。
1.3 蜗牛消化酶水解条件优化
影响酶活的因素主要有酶促反应时间,酶浓度和底物浓度。因此,实验研究了反应时间(1、4、8 h),酶浓度(酶/组织重量比为40 mg/g、400 mg/g、4 g/ g),底物浓度(10、20、40 mg),反应温度(34、37、40℃),测定各单因素条件下蜗牛消化酶对基因组提取的影响[6]。
1.4 正交实验设计
在上述单因素实验基础上,研究时间,酶浓度,底物浓度三种因素对蜗牛消化酶对基因组提取的作用,从而选出最佳作用条件[7],见表1。
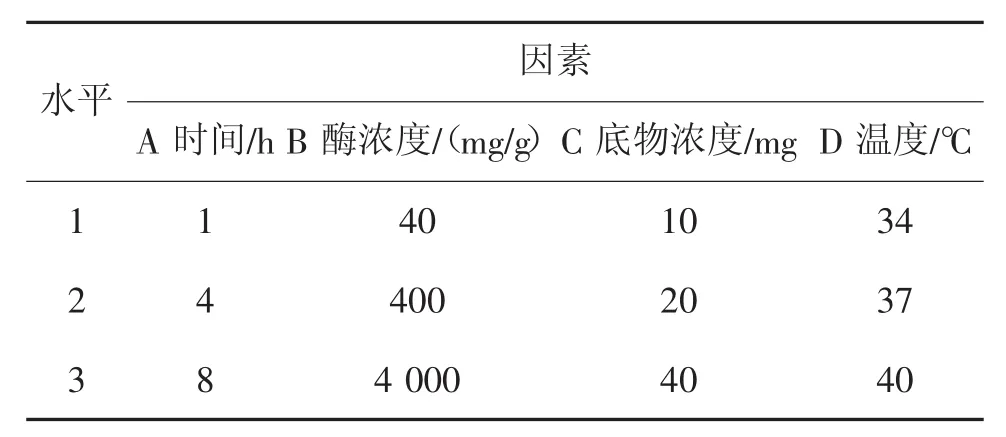
表1 正交实验因素及水平
1.5 PCR和荧光定量PCR反应
中华绒螯蟹微孢子虫核糖体18 sRNA具有高度的特异性,根据序(GenBank accession No. HE584635.1),据此设计普通PCR和实时荧光定量PCR的引物。引物序列为:上游引物5'-AGTAGTGATGGCGATTAGAGACCG-3',下游引物5'-TGAGTCAAATTAAGC-3',均由上海生工公司合成。普通PCR结束后进行凝胶成像,PCR产物经2%琼脂糖电泳分析,凝胶成像系统(Gel Doc2000,Bio-Rad Co.)拍照成像。
2 结果与分析
2.1 反应时间对提取结果的影响
反应时间是酶促反应优化的一个重要因素[8]。反应时间短,酶促反应不能完全进行,从而影响基因组提取的效果;反应时间过长,实验过程变得拖沓,浪费时间,而且增加交叉污染的机会。因此,要确定酶促反应的时间,从而优化反应条件。反应样品取样为5 mg,酶添加量为酶底物重量比为40 mg/ g,反应温度为35℃情况下进行。
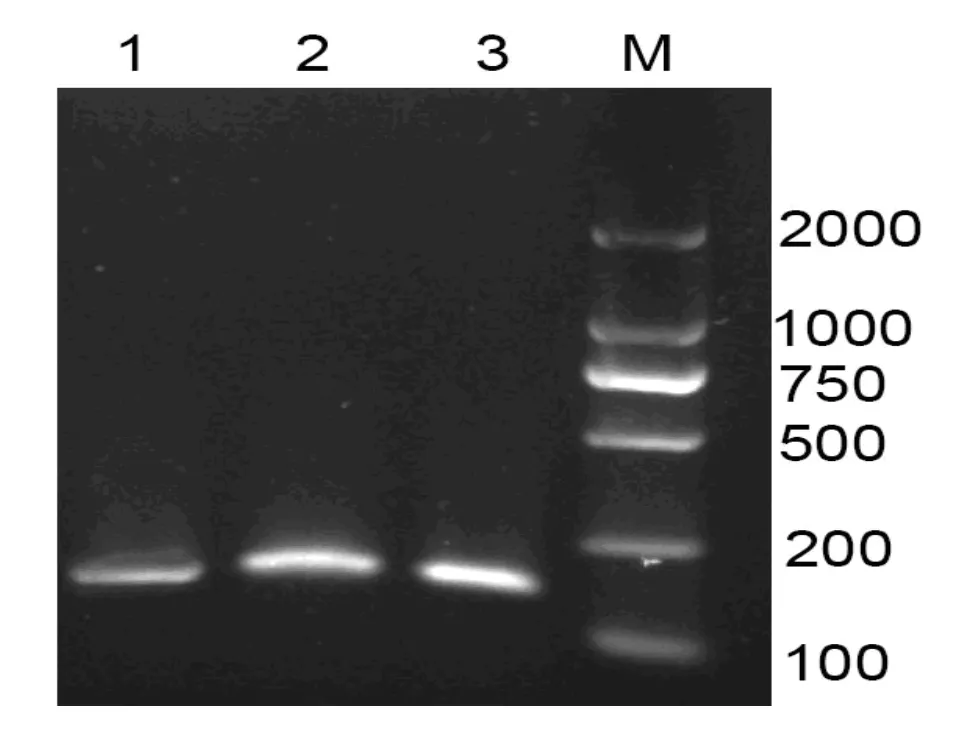
图1 反应时间对提取结果的影响
由图1可以看出,随着反应时间的增加,PCR产物的亮度增加,但是4 h和8 h处理的结果相差不大。从节约时间和充分反应的角度,选取4 h为最佳消化时间。
2.2 酶浓度对提取结果的影响
酶促反应中酶的使用浓度是影响酶促反应的关键因素[9]。酶的浓度在较低的时候,是酶促反应的限制因素;而酶浓度较高时,再增加酶浓度不能提高反应速率,表现为零级反应。所以,实验中要确定酶促反应酶的使用浓度,从而对基因组提取的条件进行优化。反应在样品取样为5 mg,消化时间为4 h,反应温度为35℃情况下进行。
根据图2结果显示,酶浓度为400 mg/g的时候,反应最充分,增加反应的酶浓度不再能够使反应更加充分。据此,选取400 mg/g为最佳反应酶浓度。
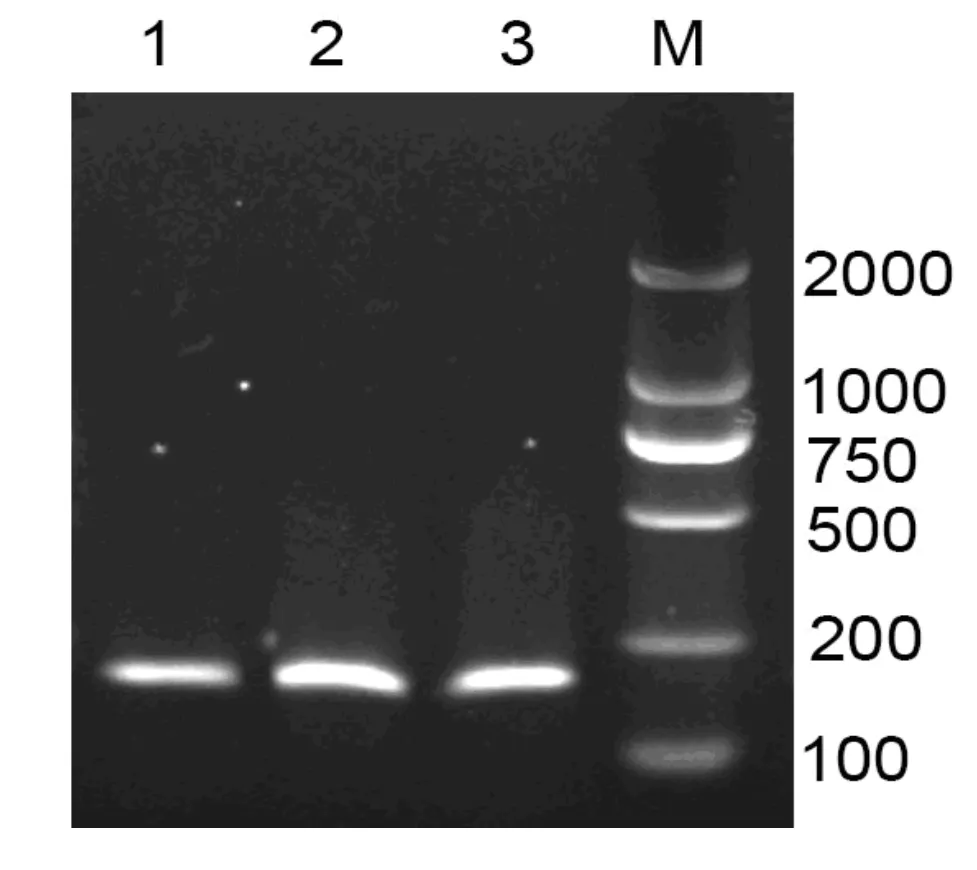
图2 酶浓度对基因组提取的影响
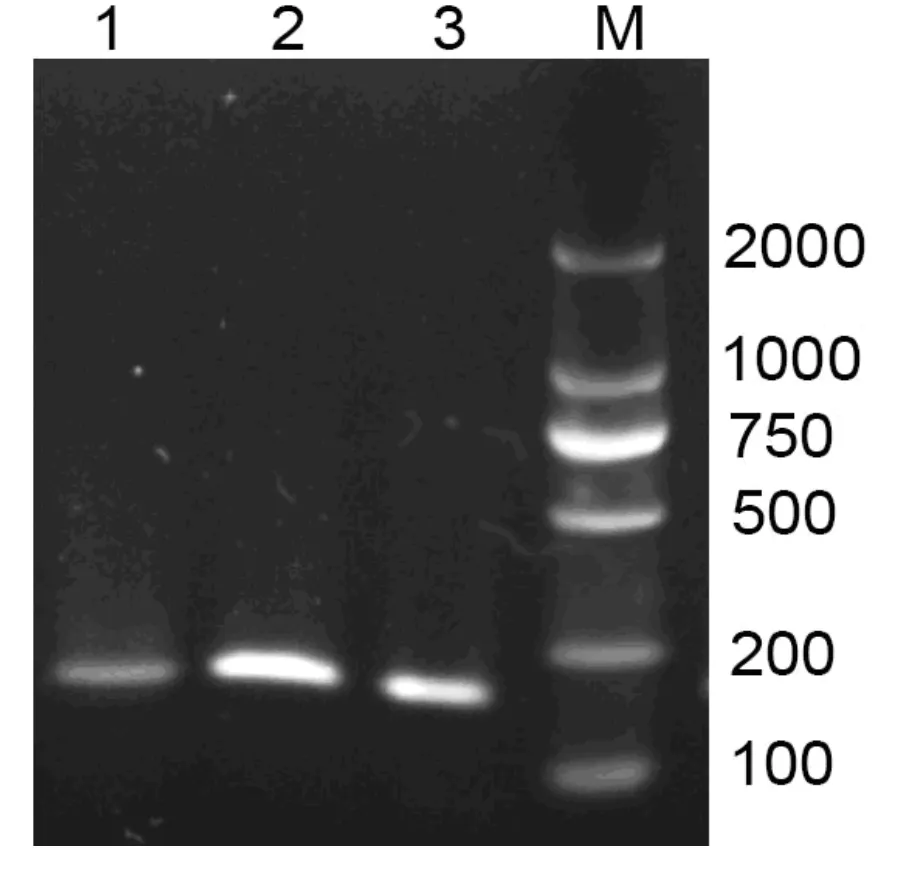
图3 底物浓度对基因组提取的影响
2.3 底物浓度对提取结果的影响
当酶浓度不变时,底物浓度可以影响反应速率[10]。当底物浓度低时,底物浓度是酶促反应的限制因素,随着底物浓度的增加,酶的催化速率增加;当底物浓度达到相当高时,底物浓度对反应速率影响变小,最后反应速率与底物浓度几乎无关,反应达到最大速率。由此得知,当底物浓度达到最大时,蜗牛消化酶活力将不受底物的影响,从而选出最优的样品使用量。反应时间为4 h,酶添加量为酶底物重量比为400 mg/g,反应温度为35℃情况下进行。
底物浓度实验结果如图3。增加底物浓度,可以增加反应速率,但是当底物浓度达到最大值之后,增加底物浓度,由于反应不充分,会使得基因组提取的灵敏性受到限制,因此,选择20 mg肝胰腺为一个反应的最佳底物浓度。
2.4 反应温度对提取结果的影响
酶促反应受温度的影响较大[8]。酶是蛋白质,反应温度低于最佳温度的时候,温度是反应的限制因素,随着温度的提高,酶促反应速率加快;随着温度继续升高,温度到达最佳反应温度以后,酶促反应的效率随着温度的升高急速降低,最终会导致酶失活。为了确定酶促反应的最佳温度,提高基因组提取的效果而进行了温度优化实验。反应在样品取样为20 mg,酶添加量为酶底物重量比为400 mg/g,消化时间为4 h。
由图4可知,反应的温度在6℃范围内变化,对酶的消化作用影响不大。
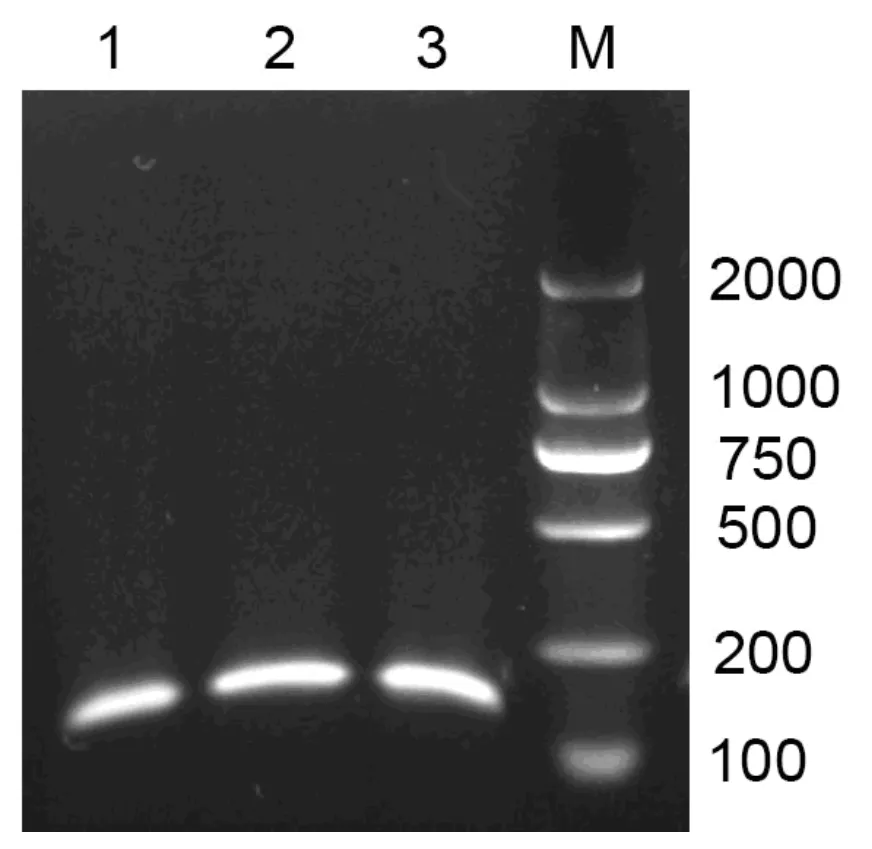
图4 反应温度对基因组提取的影响
2.5 正交实验结果
在单因素实验的基础上,采用L9(34)正交实验的方法,研究酶促反应时间、底物浓度、酶浓度和酶促反应时间四个因素对中华绒螯蟹微孢子虫基因组提取的影响。确定影响蜗牛消化酶作用的主次因素及相互关系。实验结果及统计分析见表2。
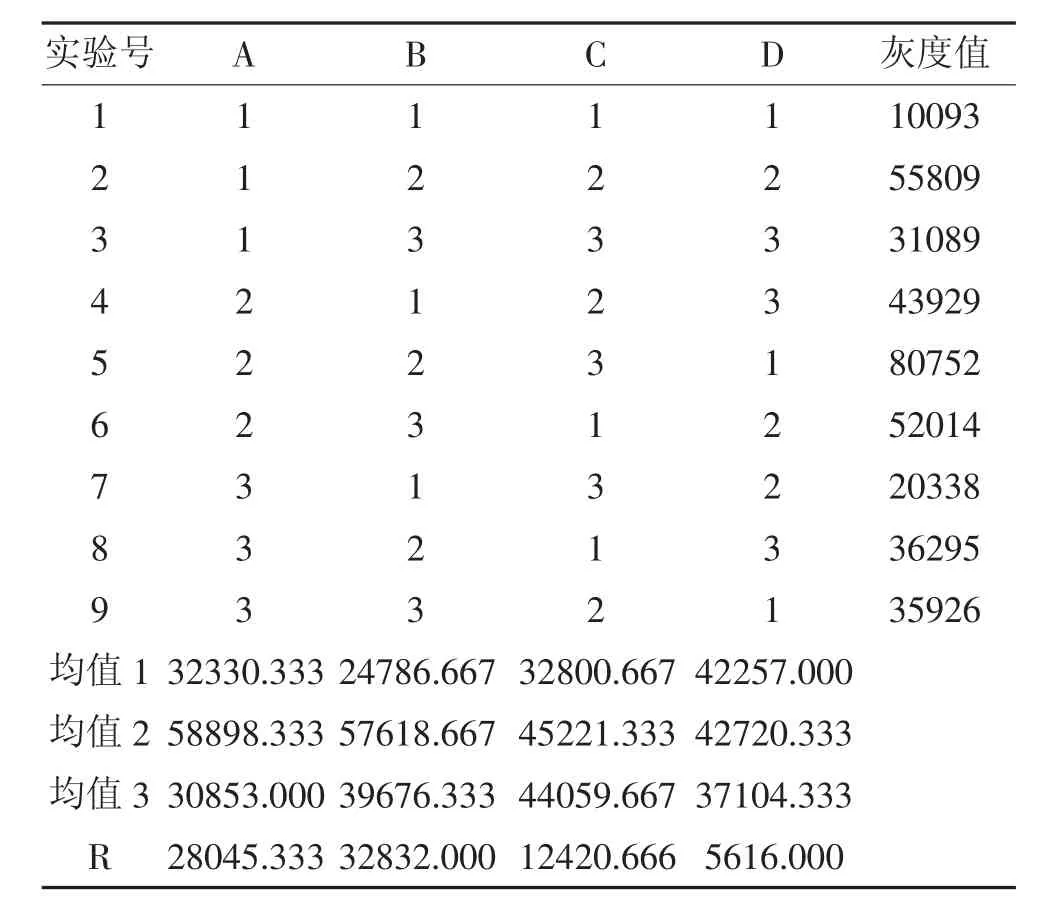
表2 蜗牛消化酶L9(34)正交实验结果
从表2可知,以PCR结果的灰度值为衡量指标时,各因素的最优组合为:A2B2C2D2[7]。由极差R可知,B因素(蜗牛消化酶的浓度)对蜗牛消化酶酶活力的影响最大,其次为A因素(消化反应时间),D因素(反应温度)影响最小。
3 结论
结合单因素实验和正交实验确定蜗牛消化酶作用于中华绒螯蟹基因组提取的最佳条件。并通过方差分析和单因素多重比较得到的最佳条件为:酶促反应温度为37℃,底物浓度为20 mg,酶的使用浓度为酶底物重量比400 mg/g,酶促反应时间为4 h。
[1]Ding Z,Meng Q,Liu H.First case of hepatopancreatic necrosis disease in pond-reared Chinese mitten crab,Eriocheir sinensis,associated with microsporidian[J].Journal of Fish Diseases,2016(39):1043-1051.
[2]Wang W,Chen J.Ultrastructural study on a novel microsporidian,Endoreticulatus eriocheirsp.nov.(Microsporidia,Encephalitozoonidae),parasiteofChinesemittencrab,Eriocheir sinensis(Crustacea,Decapoda)[J].Journal of invertebrate pathology,2007(94):77-83.
[3]章晋勇,吴英松.鱼类微孢子虫的研究进展[J].水生生物学报,2004,28(9):563-568.
[4]王永宾,刘吉平.微孢子虫检测技术的研究进展[J].中国寄生虫学与寄生虫病杂志,2009,27(02):161-166.
[5]刘欣,杨凌,戴晓冬,等.一种来源于蜗牛酶的β-葡萄糖苷酶的纯化[J].中国微生态学杂志,2010,22(12):1103-1104.
[6]张楠,杨兴明,徐阳春.高温纤维素降解菌的筛选和酶活性测定及鉴定[J].南京农业大学学报,2010,33(3):82-87.
[7]刘瑞江,张业旺.正交试验设计和分析方法研究[J].实验技术与管理,2010,27(9):52-55.
[8]郑美娟,郭金玲.几种耐高温淀粉酶的酶活影响因素研究[J].食品研究与开发,2016,37(15):53-56.
[9]李鸿玉,厉重先.促进剂H对纤维素滤纸酶活及酶促反应动力学特性的影响[J].食品工业科技,2007,28(6):90-95.
[10]庞广昌,潘葳,陈庆森.不同蛋白酶水解酪蛋白类大分子底物的规律研究[J].食品科学,2004,25(03):36-40.
Optimizing condition of extracting genomic DNA on Hepatospora eriocheir by snail digestive enzyme
Liu Hongyan,Zhao Yanhua,Sun Mengling,Xue Hui(Freshwater Fisheries Research Institute of Jiangsu Province,Nanjing 210017,China)
PCR is the most sensitive and specific method to detect Microsporidia ofEriocheir sinensis(Hepatospora eriocheir)at present.Hepatospora eriocheirhas solid spore wall,which could resist to many chemicals. As a result,the effect of conventional methods for DNA extracting was not ideal.In order to improve the sensitivity of PCR detection ofHepatospora eriocheir,the experimental conditions of snail digestive enzyme activity assaywere researched.Four influencing factors enzymatic reaction time,reaction-temperature,substrate concentration,and enzyme concentration were studied by a single factor test.Finally,orthogonal experiment,variance analysis and multiple comparisons were combined together,and the optimum conditions of determination of snail digestive enzyme activity were determined.The results showed that:when the enzyme concentration was 4 000 mg/g and substrate were 20 mg,enzymatic reaction time was 37℃,reaction time was 4 hours,the effect of DNA extraction was best.
Microsporidia;Eriocheir sinensis;extraction of DNA;PCR
Q173
A
1004-2091(2017)04-0035-05
10.3969/j.issn.1004-2091.2017.04.008
2016-12-16)
江苏省科技计划现代农业项目(BE2016392)
刘洪岩(1986-),女,研究实习员,主要从事水产病害研究.E-mail:njsfdxliuhongyan@163.com
薛晖(1968-),男,高级工程师.E-mail:jsxuehui@163.com

