LC-MS/MS快速测定人血浆中氯沙坦浓度及其生物等效性研究
黄 明,张全英,宗顺麟
LC-MS/MS快速测定人血浆中氯沙坦浓度及其生物等效性研究
黄 明,张全英*,宗顺麟
目的 建立人血浆中氯沙坦LC-MS/MS测定方法,计算氯沙坦人体药动学参数并评价两制剂生物等效性。方法 采用单剂量双周期交叉试验设计,完成试验的23例受试者空腹口服受试或参比制剂氯沙坦钾片100 mg后,用甲醇一步沉淀血浆蛋白,并用LC-MS/MS法测定人血浆中氯沙坦浓度。用DAS 3.2.3软件计算氯沙坦人体药动学参数,并评价两制剂生物等效性。结果 服用受试和参比制剂后,血浆中氯沙坦的Cmax分别为(697.3±301.7)和(674.1±350.5) ng/mL,AUC0-12 h分别为(994±240)和(1 005±287)ng·h/mL,tmax分别为(1.23±0.38)和(1.37±0.75) h,t1/2分别为(2.04±0.28)和(2.00±0.40)h,生物利用度为102.4%±21.1%。结论 建立的分析测试方法灵敏、简便、准确,受试制剂与参比制剂生物等效。
氯沙坦;高效液相-串联质谱方法;药动学;生物等效性
0 引言
氯沙坦钾(Losartan potassium)是非肽类血管紧张素Ⅱ受体拮抗剂,可竞争性抑制AT1受体,降低血管阻力,具有良好的抗高血压作用,主要用于高血压的治疗[1]。国内外文献报道测定人血浆中氯沙坦浓度的方法有HPLC法、LC-MS法和LC-MS/MS法。血浆样品前处理方法有:①液液萃取法[2-7]:样品经提取、吹干、复溶等步骤后测定,操作繁琐且提取回收率不高。②在线固相萃取法[8]:可获得更干净的样品,但是流动相中含有的三乙胺具有离子淬灭作用,且整套系统价格昂贵。③蛋白沉淀法[9]:样品经乙腈沉淀蛋白,检测方法最低定量限为3.000 ng/mL。本研究建立了甲醇一步沉淀蛋白法处理氯沙坦血浆样品,检测方法最低定量限为1.000 ng/mL,低于文献报道[2-10],可用于氯沙坦钾片一致性评价研究。
1 材料
1.1 仪器与试剂 液质联用仪:API-4000三重四极杆串联质谱仪,美国AB Sciex公司;Agilent1200高效液相色谱仪,主要包含真空脱气机、四元输液泵、自动进样器、恒温器和柱温箱,美国Agilent公司;数据处理系统为Analyst 1.4.2,AB Sciex公司。分析天平:XS 105DU型(Max2=41 g,d2=0.01 mg),瑞士METTLER TOLEDO公司。低温高速离心机:Heraeus Biofuge Stratos,德国Thermo公司。涡旋混合器:Vortex Genie-2,美国Scientific Industries公司。纯水机:Milli-Q,美国MILLIPORE公司。甲醇和甲酸:HPLC级,TEDIA COMPANY。乙酸铵:分析纯,国药集团化学试剂有限公司。水:灭菌注射用水,安徽双鹤药业有限责任公司。空白血浆来自健康志愿者。
1.2 试验药物和对照品 氯沙坦钾片(受试制剂,批号:31112002,规格100 mg/片)由浙江某制药有限公司生产。氯沙坦钾片(参比制剂,科素亚®,批号:120281,规格100 mg/片)由杭州默沙东制药有限公司生产。氯沙坦钾对照品(批号:100597-200501,分子量461.01,氯沙坦分子量422.91,纯度100.0%)购自中国食品药品检定研究院。内标厄贝沙坦对照品(批号:201111-8,纯度100.0%)由浙江某制药有限公司生产。
2 方法
2.1 色谱、质谱条件 色谱条件:保护柱:Phenomenex Security GuardTMC18(4 mm×3.0 mm);色谱柱:WATERS公司Xterra®RP18(4.6 mm×100 mm,3.5 μm);流动相:甲醇-10 mmoL/L乙酸铵水溶液(含0.2%甲酸)=66∶34(v/v);流速900 μL/min;分析时间7.0 min;进样量20 μL;柱温30 ℃。
质谱条件:电喷雾(ESI)离子源,正离子电离模式,雾化气50 psi,加热辅助气60 psi,离子源温度650 ℃,喷雾电压4 500 V;采用多反应监测(MRM),氯沙坦检测离子对m/z423.2→207.0,去簇电压(DP) 60 V,射入电压(EP) 10 V,碰撞能量(CE) 31 V,碰撞室射出电压(CXP) 5 V。内标厄贝沙坦检测离子对m/z429.3→207.0,去簇电压(DP) 70 V,射入电压(EP) 10 V,碰撞能量(CE) 30 V,碰撞室射出电压(CXP) 15 V。
2.2 工作液配制 氯沙坦标准曲线储备液及工作液:称量氯沙坦钾对照品10.90 mg(相当于氯沙坦 10.00 mg)于10 mL量瓶用甲醇定容,混匀得1.000 mg/mL的氯沙坦标准曲线储备液,用甲醇稀释,得浓度为0.020 00、0.060 00、0.200 0、0.600 0、2.000、6.000、20.00、30.00 μg/mL的标准曲线系列工作液。
氯沙坦质控储备液及工作液:称量氯沙坦钾对照品10.90 mg(相当于氯沙坦10.00 mg)于10 mL量瓶用甲醇定容,混匀得1.000 mg/mL的氯沙坦质控储备液,用甲醇稀释得浓度为0.040 00、1.200、24.00 μg/mL的质控工作液。
内标厄贝沙坦储备液及工作液:称量厄贝沙坦对照品10.00 mg于10 mL量瓶用甲醇定容,混匀得1.000 mg/mL的内标厄贝沙坦储备液,并于100 mL量瓶用甲醇稀释得0.100 0 μg/mL的内标厄贝沙坦工作液。
2.3 血浆样品前处理 取血浆样品200 μL置1.5 mL离心管中,加入内标厄贝沙坦工作液50 μL,混匀,加甲醇600 μL沉淀血浆蛋白,涡旋1 min,于4 ℃、23 755×g高速离心10 min。离心完毕后取上清液400 μL置进样瓶中,加入水相200 μL,混匀后,置于自动进样器中进样测定氯沙坦浓度。
2.4 人体药代动力学与生物等效性临床试验设计 临床试验方案经苏州大学附属第二医院伦理委员会批准。24例男性受试者均签署知情同意书,体重指数均在19~24 kg/m2范围内,心电图正常,肝、肾功能正常,均符合受试者入选标准。采用随机、双周期交叉试验设计。参加试验的24位受试者随机分成2组,每组12例,分别于2个周期试验当日空腹口服受试或参比制剂1片,250 mL温开水送服,清洗期为1周。于服药前和服药后0.25、0.50、0.75、1.0、1.5、2.0、2.5、3.0、4.0、6.0、8.0、10.0、12.0 h由肘静脉取血3 mL。所有血浆样品置肝素化采血管中,离心(2 304×g,4 ℃,5 min),分离上层血浆,于-30 ℃冰箱中保存,待测。用DAS 3.2.3软件计算药动学参数,并评价受试与参比制剂的生物等效性。
3 结果
3.1 特异性 分别取氯沙坦对照品溶液、厄贝沙坦对照品溶液、空白血浆按“2.3”项方法操作后样品,空白血浆190 μL和氯沙坦对照品溶液(2.000 μg/mL)10 μL混匀后按“2.3”项方法操作后样品,受试者口服氯沙坦钾片100 mg后 0.5 h的血浆按“2.3”项方法操作后样品,进样测定。结果显示,在本实验条件下,氯沙坦的保留时间约3.59 min,内标厄贝沙坦的保留时间为4.34 min左右,内源性物质不干扰氯沙坦和内标厄贝沙坦的测定,见图1。
3.2 标准曲线与最低定量限 取空白血浆190 μL,分别加入氯沙坦标准曲线工作液10 μL,制备成血浆中氯沙坦浓度为1.000、3.000、10.00、30.00、100.0、300.0、1 000、1 500 ng/mL的标准曲线血浆样品,按“2.3”项方法操作,进行测定,记录色谱图,以氯沙坦浓度C为横坐标,氯沙坦峰面积As与内标厄贝沙坦峰面积Ai比值f为纵坐标,进行线性回归(权重系数为1/C2)。回归方程为f=0.009 1 C-0.000 011 3,r=0.999 4。结果表明,氯沙坦线性范围为1.000~1 500 ng/mL,最低定量限LLOQ为1.000 ng/mL。
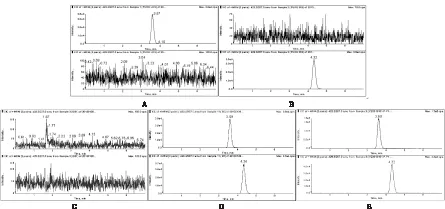
图1 血浆中氯沙坦的LC-MS/MS图
注:A.氯沙坦对照品溶液(100.0 ng/mL),B.厄贝沙坦对照品溶液(25.00 ng/mL),C.空白血浆,D.空白血浆190 μL和氯沙坦对照品溶
液(2.000 μg/mL)10 μL混匀后按“2.3”项方法操作后样品(血浆含氯沙坦100.0 ng/mL),E.受试者口服氯沙坦钾片100 mg后0.5 h的
血浆按“2.3”项方法操作后样品(血浆含氯沙坦262.4 ng/mL)
3.3 精密度与准确度 取空白血浆190 μL,分别加入氯沙坦最低定量限和质控工作液10 μL,制备成血浆中氯沙坦浓度分别为1.000 ng/mL的最低定量限样品和2.000、60.00、1 200 ng/mL的质控样品,每个浓度6个样品,按“2.3”项方法操作,测定3批,根据每批随行标准曲线,计算每个样品的实测浓度,用Excel软件单因素方差分析计算批内和批间精密度,同时计算每个样品的相对偏差,结果显示,最低定量限样品批内和批间RSD均小于20%,RE均在±20%范围内。低、中、高3个浓度质控样品批内和批间RSD均<15%,RE均在±15%范围内。
3.4 提取回收率 按精密度与准确度的实验方法制备含氯沙坦浓度分别为2.000、60.00、1 200 ng/mL的血浆样品,按“2.3”项操作,以其进样得到的峰面积除以空白血浆经蛋白沉淀后,直接加入低、中、高氯沙坦质控系列工作液及内标厄贝沙坦工作液后进样得到的峰面积,计算血浆中氯沙坦和内标厄贝沙坦的提取回收率。血浆中氯沙坦低、中、高浓度的提取回收率分别为107.8%±5.5%、103.1%±3.0%和103.5%±4.2%;厄贝沙坦的提取回收率为101.2%±1.7%。
3.5 基质效应 取6个不同来源的空白血浆190 μL置1.5 mL离心管中,分别加入甲醇600 μL沉淀血浆蛋白,涡旋1 min,4 ℃离心(23 755×g)10 min,取空白上清液700 μL作为血浆基质;另取纯化水190 μL置离心管中,同法处理得对照基质。分别取血浆基质和对照基质700 μL,加入氯沙坦质控工作液10 μL和内标厄贝沙坦工作液50 μL,混匀,吸取400 μL该混匀溶液样品置进样瓶中,加入水相200 μL,混匀。上述样本每个浓度取6份,按“2.1”项下色谱条件及质谱条件测定,获得氯沙坦和内标厄贝沙坦峰面积,根据每一浓度样本2种基质中的峰面积比值计算基质效应。血浆中氯沙坦低、中、高浓度的基质效应分别为97.6%±3.7%、97.0%±1.1%和100.2%±4.2%;厄贝沙坦的基质效应为98.2%±2.0%。
3.6 稳定性 按“3.3”项下方法,分别制备低、中、高3个浓度质控血浆样品,各15份,每个浓度各取3份分别进行如下考察:①-30 ℃反复冻融3次;②-30 ℃冰冻保存35 d;③室温放置6 h;④待测样品于自动进样器4 ℃放置22 h;⑤血浆蛋白沉淀离心后,上清液样品室温放置6 h。按“2.3”项下方法处理后进样测定(除条件④直接进样测定,条件⑤吸取上清液400 μL和水相200 μL混匀)。所有血浆样品实测浓度的RE均在±15%范围内,RSD≤15%。结果显示,氯沙坦血浆样品-30 ℃反复冻融3次、-30 ℃冰冻保存35 d和室温放置6 h,待测样品于自动进样器4 ℃放置22 h,血浆蛋白沉淀离心后,上清液样品室温放置6 h情况下均稳定。本实验亦考察了氯沙坦和内标厄贝沙坦储备液的稳定性。结果显示,室温放置6 h和2~8 ℃冷藏9 d情况下,氯沙坦和内标厄贝沙坦储备液均稳定。
3.7 生物等效性评价 完成试验的23例受试者口服受试和参比制剂氯沙坦钾片后氯沙坦的平均血药浓度-时间曲线见图2,主要药动学参数见表1。Cmax几何均值比90%置信区间为88.6%~128.0%,AUC0-12 h为95.1%~106.1%,AUC0-∞为95.0%~105.9%。以上结果符合《中华人民共和国药典(2010版)》相关要求(Cmax在75%~133%范围,且AUC在80%~125%范围),因此,判定受试制剂氯沙坦钾片(100 mg)与参比制剂氯沙坦钾片(科素亚®,100 mg)生物等效。
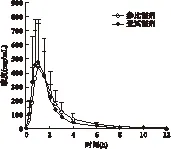
图2 单剂量分别口服受试和参比制剂后氯沙坦的平均 血药浓度-时间曲线表1 单剂量口服受试和参比制剂后氯沙坦的主要 药动学参数

药动学参数受试制剂参比制剂t1/2(h)2.04±0.282.00±0.40tmax(h)1.23±0.381.37±0.75Cmax(ng/mL)697.3±301.7674.1±350.5AUC0-12h(ng·h/mL)994±2401005±287AUC0-∞(ng·h/mL)1002±2401014±289CL/F(L/h)104.7±22.4107.0±33.5Vd(L)308.9±87.3306.0±103.1F(%)102.4±21.1
4 讨论
本研究对色谱和质谱条件进行了优化考察,水相中加入乙酸铵,有利于氯沙坦和内标峰形的改善,未加入醋酸铵,色谱峰拖尾严重。另外,选择0.2%甲酸时,待测物的响应较高且保留时间适中。血浆样品沉淀蛋白,离心后,取上清液400 μL,并加入水相200 μL,是为了将进样样品中水的比例提高至接近流动相的比例,防止发生二次化学平衡现象,改善峰形。同时,上清液中加入水相,进样测定样品含有的血浆内源性基质相对减少,避免了基质效应。
本研究建立的LC-MS/MS法测定人血浆中氯沙坦浓度,特异性高,测定时间短,另外采用甲醇一步沉淀蛋白的血浆样品前处理方法,操作简单快捷,发挥了LC-MS/MS法的快速定量优势,可用于氯沙坦钾片一致性评价研究。
本研究中,受试和参比制剂的主要药动学参数t1/2和tmax与文献[2-7,10]基本一致,Cmax、AUC0-∞与文献[7,10]基本一致。Cmax90%置信区间为88.6%~128.0%,不在2015版药典要求的80.00%~125.00%范围内。若以2015版药典为判定标准,则无法判定两制剂生物等效,由此看来,我国生物等效性的评价标准已经提高,与欧美国家标准同步。
[1] 邹网岗.治疗高血压药物氯沙坦钾的临床应用[J].临床医学,2015,25(2):208.
[2] 曾欣,罗丹,冉黎灵,等.HPLC-MS/MS法检测人血浆中氯沙坦、E-3174、氢氯噻嗪浓度及生物等效性评价[J].中南药学,2014,12(7):650-654.
[3] 苑菲,许剑安,汪红,等.LC-MS/MS法测定氯沙坦及其代谢物的血浆浓度及氯沙坦钾片生物等效性评价[J].中国临床药学杂志,2013,22(1):13-18.
[4] 金杰.健康志愿者氯沙坦钾片的生物等效性研究[J].中国医药指南,2013,11(1):3-5.
[5] 陈露露,谭志荣,阳国平,等.氯沙坦钾片的生物等效性及CYP2C9*3基因多态性对氯沙坦药代动力学的影响[J].中国临床药理学与治疗学杂志,2015,20(2):175-181.
[6] 王嫣然,王彩平,谢荟茹,等.HPLC-MS/MS 同时测定人体血浆中氯沙坦钾与其代谢物氯沙坦羧酸(E -3174)的浓度及其药动学应用[J].中国药学杂志,2014,49(12):1056-1061.
[7] 刘睿斌,刘俊敏,苏其果,等.氯沙坦钾片人体生物等效性研究[J].中国药房杂志,2010,21(26):2438-2440.
[8] Iwasa T,Takano T,Hara K,et al.Method for the simultaneous determination of losartan and its major metabolite,EXP-3174,in human plasma by liquid chromatography-electrospray ionization tandem mass spectrometry[J].J Chromatogr B Biomed Sci Appl,1999,734(2):325-330.
[9] 马萍,李鹏飞,童卫杭,等.氯沙坦钾片在健康人体的生物等效性[J].中国临床药理学杂志,2012,28(3):179-182.
[10]孙鲁宁,刘园园,赵燕荣,等.HPLC-MS法同时测定人血浆中氯沙坦及其代谢物EXP3174[J].药学与临床研究,2009,17(2):115-119.
Rapid determination of losartan in human plasma by LC-MS/MS and study on its bioequivalence
HUANG Ming,ZHANG Quan-ying*,ZONG Shun-lin
(Clinical Pharmacology Laboratory,the Second Affiliated Hospital of Soochow University,Suzhou 215004,China)
Objective To establish an LC-MS/MS method for the determination of losartan in human plasma,and evaluate the bioequivalence of losartan potassium tablet in healthy volunteers.Methods A single oral dose of test and reference formulations was given to 23 healthy male volunteers according to a randomized crossover design.Plasma concentration was determined by LC-MS/MS after deproteinized with methanol.The pharmacokinetic parameters were calculated by DAS 3.2.3.Results The main pharmacokinetic parameters of losartan in test and reference preparations were as follows:Cmax(697.3±301.7) and (674.1±350.5) ng/mL,AUC0-12 h(994±240) and (1 005±287) ng·h/mL,tmax(1.23±0.38) and (1.37±0.75) h,t1/2(2.04±0.28) and (2.00±0.40) h,respectively.The relative bioavailability of test formulations was 102.4%±21.1%.Conclusion LC-MS/MS method is proved to be sensitive,convenient and accurate.Losartan potassium tablet is bioequivalent to the reference tablet.
Losartan;LC-MS/MS;Pharmacokinetics;Bioequivalence
2016-08-17
苏州大学附属第二医院临床药理实验室,江苏 苏州 215004
*通信作者
10.14053/j.cnki.ppcr.201704021

