新疆羊种布鲁氏菌分离株的鉴定与L7/L12蛋白的原核表达和生物信息学分析
刘升,江雅丽,付强,史慧君,李爽,孟露萍,郭飞,张辉,陈创夫
(1.新疆石河子大学动物科技学院,新疆石河子 832000;2.新疆石河子大学生命科学学院,新疆石河子 832003;3.新疆农业大学动物医学学院,乌鲁木齐 830052;4.新疆石河子大学医学院,新疆石河子 832003)
新疆羊种布鲁氏菌分离株的鉴定与L7/L12蛋白的原核表达和生物信息学分析
刘升1,江雅丽2,付强3,史慧君3,李爽1,孟露萍1,郭飞4,张辉1,陈创夫1
(1.新疆石河子大学动物科技学院,新疆石河子 832000;2.新疆石河子大学生命科学学院,新疆石河子 832003;3.新疆农业大学动物医学学院,乌鲁木齐 830052;4.新疆石河子大学医学院,新疆石河子 832003)
【目的】分离并鉴定新疆羊种布鲁氏菌。原核表达该菌的L7/L12蛋白,检测该蛋白的反应原性及进行部分生物学分析。【方法】采用细菌划线培养、形态学观察、PCR检测以及生化试验进行布鲁氏菌分离鉴定。利用常规分子生物学方法表达并纯化羊种布鲁氏菌分离株的L7/L12蛋白,应用Western Blot分析融合蛋白的反应原性。使用生物信息学软件对该蛋白进行了生物信息学分析。【结果】分离鉴定确定该菌株为羊种布鲁氏菌。经过测序与酶切鉴定,正确构建了表达载体pET-28a-L7/L12. SDS-PAGE试验显示纯化的L7/L12蛋白为单一条带;经过Western Blot检测,该融合蛋白具有良好的反应原性。生物信息学分析显示,该蛋白无跨膜区结构,不存在信号肽,二级结构α-螺旋为主并利用 Phyre2 服务器成功构建了该蛋白的三维模型。【结论】鉴定出该分离菌株,表达并纯化了该菌的L7/L12融合蛋白,Western Blot证明该蛋白具有良好的反应原性,为后续该蛋白的亚单位疫苗研究奠定了基础。
羊种布鲁氏菌;L7/L12;蛋白纯化;反应原性;生物学
0 引 言
【研究意义】布鲁氏菌病(Brucellosis)简称布病,是由革兰氏染色阴性、兼胞内寄生的布鲁氏菌(Brucella)引起的一种人兽共患传染病[1]。动物感染后,主要引起母畜的不孕、流产和公畜的睾丸炎等[2]。人感染后,主要表现为发热、脊柱炎、关节炎、骨髓炎等,严重时可导致患者丧失劳动力[3]。全世界每年超过50×104人被感染,造成的直接经济损失近30×108美元[4]。新疆是我国重要的牧区,也是我国布鲁氏菌病的高发区,据不完全统计,布鲁氏菌病在新疆80余县、市和13个兵团师局均有不同程度的流行,造成的经济损失达几个亿[5-6]。研究对新疆羊种布鲁氏菌分离株L7/L12蛋白进行表达、鉴定,生物信息学初步分析其结构性质,期待能对后续研制适合新疆本地化新型亚单位疫苗制备提供帮助。【前人研究进展】L7/L12是布鲁氏菌的一种核糖体蛋白,该蛋白参与布鲁氏菌胞内蛋白合成[7]。目前,对L7/L12蛋白的研究主要集中于保护性抗原和布鲁氏菌致病过程中的作用机制研究。现有报道,利用L7/L12蛋白免疫动物后,可诱导机体产生细胞免疫和体液免疫应答,并且具有一定的保护力[8]。利用减毒沙门氏菌异源表达牛种布鲁氏菌的L7/L12融合蛋白免疫动物后,可保护机体免受牛种布鲁氏菌野毒株的感染[9]。此外,一些研究也发现,L7/L12蛋白能够刺激牛外周血淋巴细胞的增殖,使其分泌IFN-γ,并且L7/L12蛋白对布鲁氏菌脂多糖诱导的巨噬细胞的凋亡有促进作用[10]。Sergio等证明L7/L12蛋白可以诱导T细胞的活化,刺激CD4+细胞释放IFN-γ因子,对牛布鲁氏菌病具有较好的防御能力[11,12]。【本研究切入点】从新疆某羊场流产羔羊体内分离出鉴定出布鲁氏菌,并原核表达其L7/L12蛋白,进行部分生物信息学分析。【拟解决的关键问题】研究新疆该羊场布鲁氏菌的感染情况,为该羊场免疫措施的制定提供了依据。对L7/L12蛋白原核表达、生物信息学分析,为制备本地化该分离株新型亚单位疫苗提供依据。
1 材料与方法
1.1 材 料
1.1.1 羊胎儿与菌株
新疆地区某羊场流产胎儿1只,12 h内收集新鲜病料;E.coliDH5α、E.coliBL21(DE3)为研究室保存;pMD19-T Simple载体购自Takara公司;表达载体pET-28a购自Promega公司。
1.1.2 主要试剂
卡那霉素、氨苄霉素、IPTG和NC膜购自Solarbio公司;2×EsTaqMasterMix、普通琼脂糖凝胶DNA回收试剂盒、高纯度质粒小提试剂盒、DNA分子量Marker、辣根过氧化物酶标记兔抗羊IgG均购自北京康为世纪生物公司;限制性核酸内切酶(BamHⅠ、XhoⅠ)、T4DNA连接酶、solutionⅠ连接酶均购自Takara公司;膜封闭液、DAB增强型显色试剂盒从天根生化科技有限公司购置;蛋白分子量Marker购自Thermo公司;蛋白纯化HisTrapTM FF柱购自美国GE Healthcare公司,弗氏完全佐剂购自Sigma公司。
1.1.3 主要仪器
PCR仪(BIO-RAD);UVP凝胶成像系统;高速冷冻离心机(Sigma,2-16K);CO2恒温培养箱(DNP-9162);Nanodrop 2000分光光度计;AKTAxpress智能多维纯化系统(蛋白纯化仪);生物安全柜(Esco,Class Ⅱ-biohazard safe cabinet);微量移液器(eppendorf)。
1.1.4 培养基
布鲁氏菌固体培养基(TSA)、布鲁氏菌液体培养基(TSB)、布鲁氏菌鉴别培养基(BMB)、酵母提取物、胰蛋白胨购自英国OXOID公司;氯化钠购置于上海生工生物工程股份有限公司。
1.2 方 法
1.2.1 引物
研究所用的引物均由北京六合华大基因科技股份有限公司合成。列出引物序列。表1
表1 PCR引物序列
Table 1 Nucleotide sequences of PCR primers
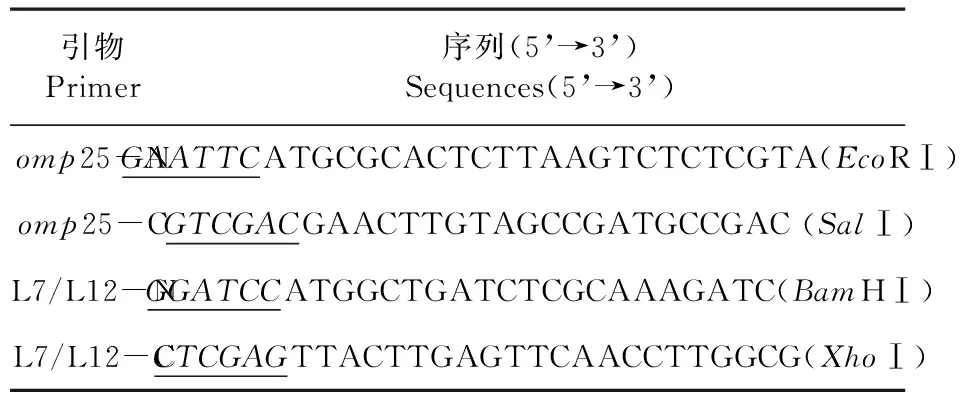
引物Primer序列(5’→3’)Sequences(5’→3’)omp25-NGAATTCATGCGCACTCTTAAGTCTCTCGTA(EcoRⅠ)omp25-CGTCGACGAACTTGTAGCCGATGCCGAC(SalⅠ)L7/L12-NGGATCCATGGCTGATCTCGCAAAGATC(BamHⅠ)L7/L12-CCTCGAGTTACTTGAGTTCAACCTTGGCG(XhoⅠ)
1.2.2 细菌分离与培养
P2级别实验室内于生物安全柜中,取流产胎儿的脾脏划线培养于布鲁氏菌鉴别培养基,在37℃,5% CO2的环境中培养细菌。48~72 h后对细菌进行形态学观察,利用改良萋-尼染色法对细菌染色后进行形态学观察,初步鉴定阳性的布鲁氏菌。
1.2.3 PCR鉴定
将初步鉴定为阳性的布鲁氏菌扩大培养后,取0.5 mL菌液热灭活后,作为PCR模版,利用omp25-N和omp25-C引物进行PCR扩增。PCR反应条件为:95℃ 5 min,94℃ 30 s,55℃ 45 s,72℃ 55 s,30个循环,72℃ 7 min。PCR产物用2%琼脂糖凝胶电泳进行分析。
1.2.4 生化鉴定
将PCR鉴定为阳性的布鲁氏菌按照《可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定》送至中国疾病预防控制中心传染病预防控制所,对布鲁氏菌进行生化鉴定,并命名。
1.2.5 L7/L12基因的扩增
以热灭活的该分离株为模板,用L7/L12-N和L7/L12-C的引物,进行PCR扩增。PCR反应条件为:95℃ 5 min,94℃ 30 s,60℃ 30 s,72℃ 30 s,35个循环,72℃ 7 min。PCR产物用2%琼脂糖凝胶电泳进行分析。
1.2.6 pMD19-T-L7/L12克隆载体的构建
PCR产物经过回收后,与pMD19-T simple载体连接。连接产物通过热击转化的方法转化至E.coli DH5α的感受态细胞中。经过氨苄抗性筛选和PCR鉴定后,将阳性克隆菌进行扩繁培养,提取质粒后,用限制性内切酶BamH I和XhoI进行酶切鉴定。将酶切鉴定正确的阳性菌送至北京六合华大基因科技股份有限公司进行DNA测序分析。
1.2.7 pET-28a-L7/L12表达载体的构建
将pMD19-T-L7/L12质粒和pET-28a质粒同时进行双酶切,酶切后的pET-28a载体片段和L7/L12目的基因片段进行凝胶回收,将两个片段使用solution I连接。连接产物通过热击转化的方法转化至E.coliBL21感受态细胞中。经过抗性筛选和PCR鉴定后,将阳性克隆菌进行扩繁培养,提取质粒后,用限制性内切酶BamHI和XhoI进行酶切鉴定。将酶切鉴定正确的阳性菌送至北京六合华大基因科技股份有限公司进行DNA测序分析。
1.2.8 重组蛋白L7/L12的诱导表达
将测序正确的克隆菌接种于LB液体培养基中,37℃过夜培养后,按1∶100的比例转接至新鲜的LB液体培养基中,振荡培养OD600nm≈0.4~0.6,取1 mL作为对照,剩余菌液中加入IPTG(终浓度为1 mmol/L)诱导表达。在至诱导后0、2、4、6和8 h分别取样1 mL,离心后,弃去上清,对细菌沉淀进行处理后,SDS-PAGE电泳分析。
1.2.9 重组蛋白L7/L12的纯化
将重组蛋白L7/L12诱导表达的菌体重悬于Lysis Buffer(50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L imidazole,pH 8.0)中,液氮和42℃水浴反复冻融三次后超声破菌,每次超声10s,间歇10s,99次/周期,直至菌体清亮为止。12 000 r/min离心15 min,取上清和沉淀,分别进行SDS-PAGE电泳,检测重组蛋白的表达位置。根据重组蛋白的表达位置,用AKTA express智能多维纯化系统(蛋白纯化仪)纯化目的蛋白。将纯化后的目的蛋白进行SDS-PAGE电泳,检测蛋白的纯化效果。
1.2.10 重组蛋白L7/L12的反应原性检测
利用Western Blot分析重组蛋白L7/L12的反应原性。纯化后的重组蛋白L7/L12经SDS-PAGE电泳后,转膜至NC膜上,用封闭液37℃封闭1 h,随后用TBST Buffer(20 mM Tris-HCl,150 mM NaCl,0.05%(v/v) Tween 20)漂洗三次;用布鲁氏菌阳性血清作为一抗,37℃孵育1 h,TBST Buffer漂洗三次;用辣根过氧化物酶标记兔抗羊IgG(1∶5 000)作为二抗,37℃孵育1 h,TBST Buffer漂洗三次;利用DAB底物显色试剂盒进行显色,观察重组蛋白L7/L12的反应原性。
1.2.11 生物信息学分析目的蛋白
通过 TMHMM Server v.2.0 软件(http://www.cbs.dtu.dk/services/TMHMM/ ) 在线分析L7/L12蛋白的氨基酸序列,预测其蛋白跨膜区;应用SignalP 4.1 Server在线预测 L7/L12 蛋白的信号肽 (http://www.cbs.dtu.dk/services/SignalP/);SOPMA在线软件预测 L7/L12蛋白的二级结构(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl );Phyre2 构建L7/L12蛋白三维结构模型(http://www.sbg.bio.ic.ac.uk/phyre2/webscripts/jobmonitor.cgi? Jobid = d97 9042d57b9240b);使用 PDBsum Generate( http: //www.ebi.ac.uk/thornton-srv/databases/ pdb-sum / Generate.html ) 在线对蛋白质结构模型进行评估。
2 结果与分析
2.1 布鲁氏菌形态学观察及omp25 PCR鉴定结果
取流产羊胎儿脾脏病料,培养72 h后,肉眼观察到5个边缘整齐、呈露滴状、折光较亮的单克隆菌落,符合布鲁氏菌的菌落形态。对5个单克隆菌落进行改良萋-尼染色,发现其中有1个菌落镜下为单一的红色短球杆菌。将该菌落扩繁后,进行PCR鉴定,在大约650 bp处出现了预期大小的条带。通过以上的结果,初次判定布鲁氏菌,命名为015株。图1
2.2 生化鉴定
经中国疾病预防控制中心传染病预防控制所对布鲁氏菌的鉴定结果表明,从流产胎儿脾脏中分离获得的布鲁氏菌为羊种布鲁氏菌生物3型。表2
2.3 L7/L12基因的扩增
以金属浴灭活的015株为模板,高保真扩增出目的片段,位于375 bp左右,鉴定结果与预期一致。图2
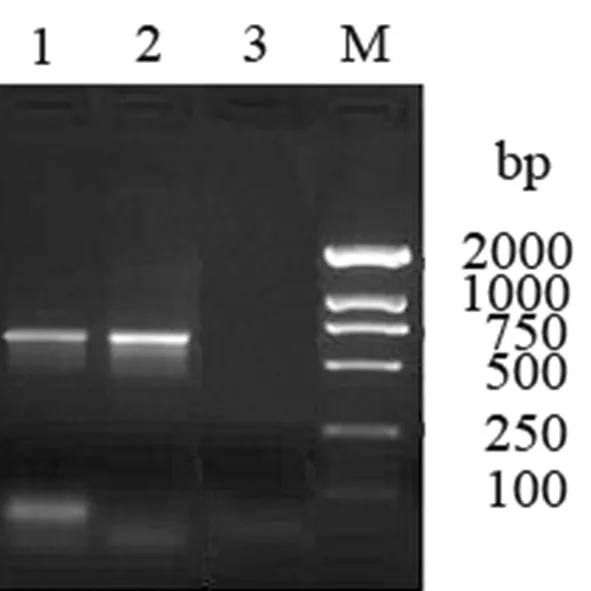
1:布鲁氏菌015株;2:布鲁氏菌16M株;3:阴性对照;M:DNA marker DL2 000
Lane 1:Brucella015; Lane 2:Brucella16M; Lane 3: negative control; Lane M: DNA marker DL2,000
图1 布鲁氏菌omp25基因PCR鉴定
Fig.1 Identification ofBrucellaomp25 gene PCR

1-3:PCR产物,4:阴性对照,M: DNA markerⅡ
Lane 1-3: the product of L7/L12 gene; Lane 4: negative control; Lane M: DNA markerⅡ
图 2 L7/L12基因的扩增
Fig.2 Amplification of L7/L12 gene by PCR表2 布鲁氏菌015株的生化鉴定结果
Table 2 Biochemical identification of theBrucella015 strain
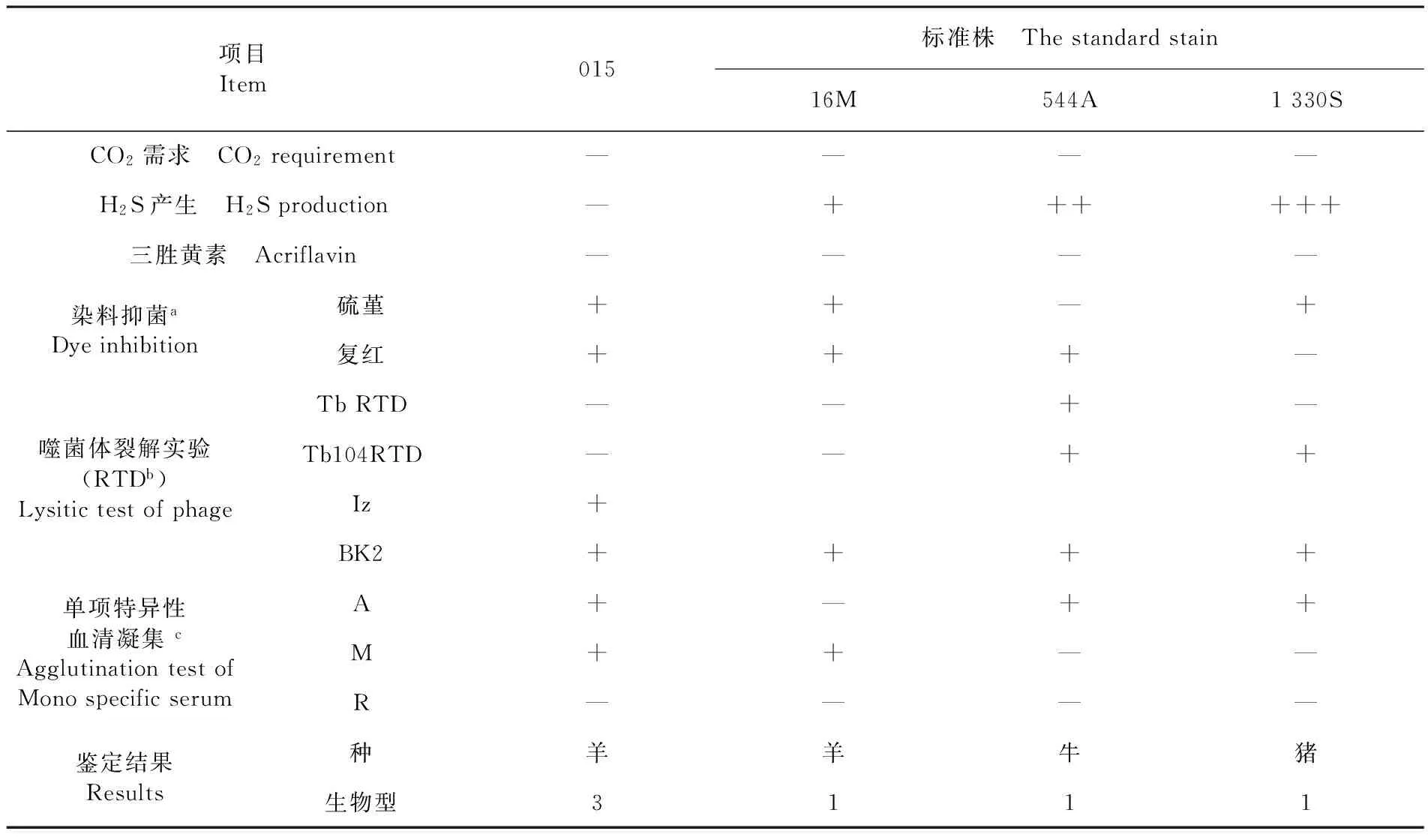
项目Item015标准株 Thestandardstain16M544A1330SCO2需求 CO2requirement————H2S产生 H2Sproduction—++++++三胜黄素 Acriflavin————染料抑菌aDyeinhibition硫堇++—+复红+++—噬菌体裂解实验(RTDb)LysitictestofphageTbRTD——+—Tb104RTD——++Iz+BK2++++单项特异性血清凝集cAgglutinationtestofMonospecificserumA+—++M++——R————鉴定结果Results种羊羊牛猪生物型3111
a: 布鲁氏菌固体培基中染料浓度20 μg/mL (1:50 000);b:RTD:常规试验稀释度(在增殖菌中完全裂解的最高稀释度);c:A=A单因子血清,M=M单因子血清,R=R单因子血清;d:16M、544A、1 330S分别为羊种、牛种、猪种布鲁氏菌标准株
a: Dye concetration ofBrucellaagar medium 20 μg/mL (1:50,000); b: RTD: The rac of rational test dilution (the highest dilution rate, at which the Tb phage completely lysesBrucellaspp; c: A-A mono-specific serum, M=M mono-specific serum, R=R mono-specific serum; d: 16M, 544A, 1,330S are the standard stains ofBrucellamelitensis,Brucellaabortus,Brucellasuis
2.4 pET-28a-L7/L12表达载体的构建
重组质粒pET28a-L7/L12经BamHⅠ和XhoⅠ双酶切后,电泳图片显示得到5 369 bp的pET-28a 载体片段和375 bp 的目的条带。结果表明pET28a-L7/L12原核表达载体已成功构建。图3
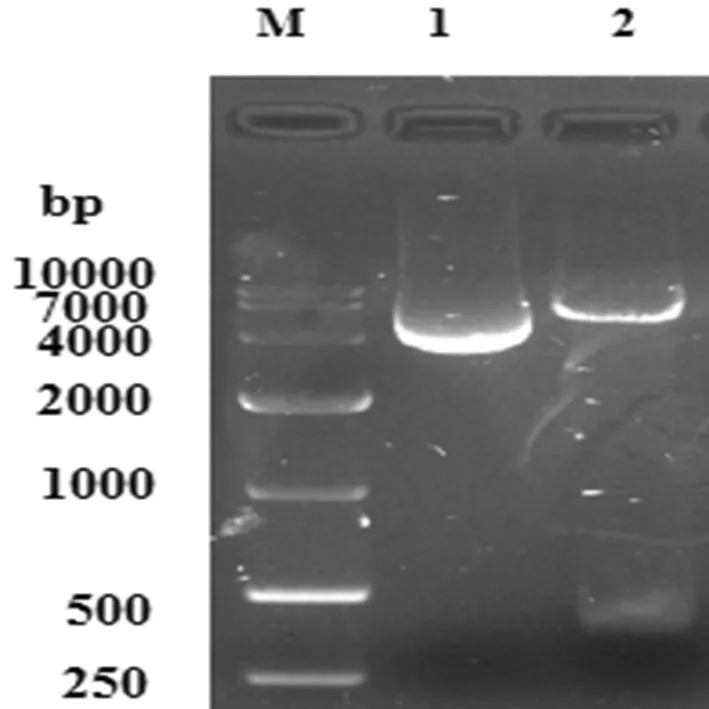
1:阴性对照;2:质粒pET-28a-L7/L12双酶切;M:DNA marker DL10 000
Lane 1: the double digested plasmid of pET-28a-L7/L12 ; Lane 2: negative control;Lane M: DNA marker DL10,000
图3 pET-28a-L7/L12双酶切鉴定
Fig.3 The double digestion identification of pET-28a-L7/L12
2.5 重组蛋白L7/L12的诱导表达
将鉴定正确的pET-28a-L7/L12的重组质粒转化至 BL21(DE3)感受态细胞中,筛选阳性重组菌后,IPTG诱导表达,SDS-PAGE结果表明目的蛋白位于大约19 ku处,与预计大小一致,且在8 h时表达量最高。图4
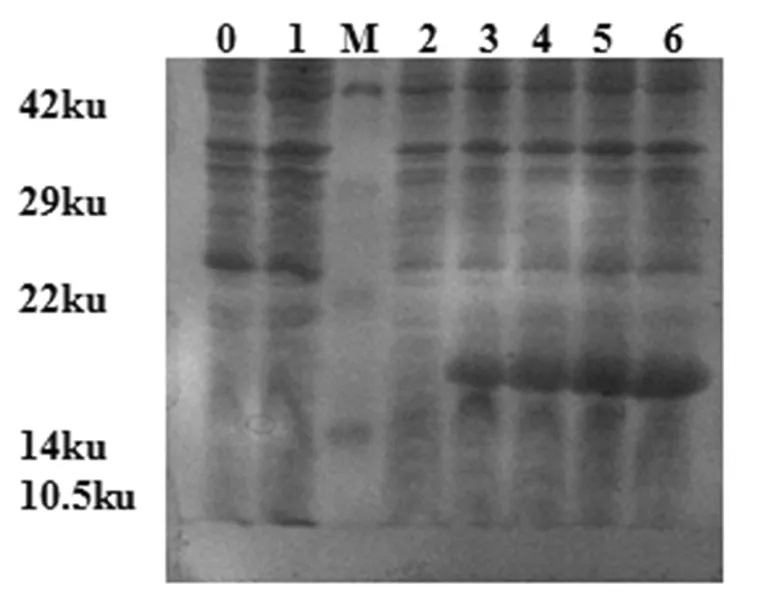
0: BL21(DE3)空菌诱导表达;1:转化pET-28a质粒的BL21诱导表达;M:蛋白Marker;2-6:转化pET-28a-L7/L12 质粒的BL21诱导表达0、2、4、6和8 h 0:induce expression BL21(DE3);1:induce expression BL21 transformed with pET-28a plasmid;M: Protein Marker; 2-6:induce expression BL21 transformed with pET-28a-L7/L12 plasmid for 0 h,2 h,4 h,6 h,8 h
图4 表达产物的SDS-PAGE分析Fig4 The SDS-PAGE of pET-28a-L7/L12
2.6 重组蛋白L7/L12的纯化
诱导8 h后的菌使用裂解液裂解后,取上清和沉淀验证,SDS-PAGE结果表明,融合蛋白L7/L12在上清中存在(图5a)。通过AKTA蛋白纯化系统纯化后的蛋白条带清晰,杂带较少,说明纯化效果较好(图5b)。图5
2.7 重组蛋白L7/L12的反应原性检测
将纯化后的重组蛋白L7/L12转至NC膜,采用羊布鲁菌阳性血清作为一抗,HRP标记的兔抗羊抗体为二抗进行免疫印迹分析。Western Blot结果显示在19 ku的位置上有一条明显的特异性反应条带,表明融合蛋白能被抗布鲁氏菌的绵羊血清所识别,且目的蛋白具有良好的反应原性,与理论分析相符合。图6
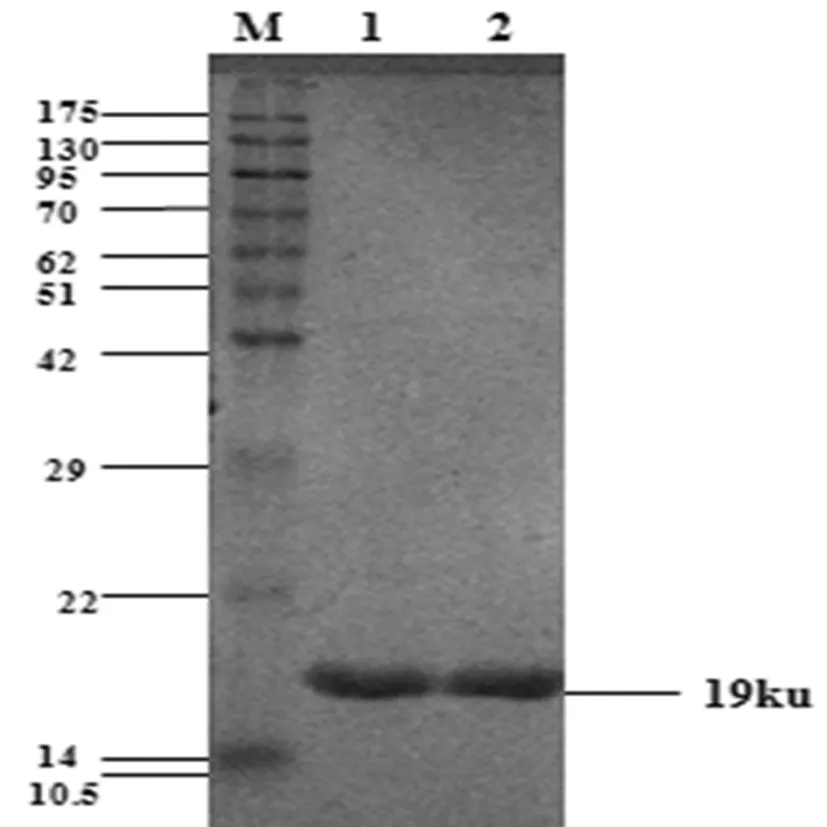
1-2:纯化后的 L7/L12蛋白;M:蛋白MarkerSDS-PAGE analysis the effect of purified L7/L12 fusion protein 1-2:the purified L7/L12 protein ;M:Protein Marker
图5 SDS-PAGE 电泳检测L7/L12融合蛋白纯化效果
Fig.5 SDS-PAGE analysis the effect of purified L7/L12 fusion protein

1-3:纯化的His-L7/L12 融合蛋白;M:蛋白Marker
1-3: the purified His- L7/L12 fusion protein ;M: Protein Marker
图6 融合蛋白His-L7/L12 Western Blot分析
Fig.6 The Western Blot analysis of fusion protein His-L7/L12
2.8 目的蛋白的生物信息学
通过TMHMM Server v.2.0在线软件分析得出,目的蛋白无跨膜螺旋结构(图7)。SignalP 4.1 Server 对该蛋白氨基酸序列分析显示,该蛋白有信号肽(图8)。利用 SOPMA 在线软件分析该蛋白的二级结构,结果显示,85个氨基酸参与形成α-螺旋,占68.55%。延伸链占8.87%,有13个氨基酸参与形成β-折叠,占10.48%,无规卷曲结构占12.10%(图9)。通过 Phyre2 在线服务器构建出并优化目的蛋白的三维结构(图10)。利用 PDBsum Generate在线评估(图11)。从Ramachandran 图中可以看出,在 121个氨基酸残基中,有98个处于核心允许区,占 92.5% ,6 个处于额外允许区,占5.7% ,1个处于最大允许区,占 0.9% ,不可信区域为1,占 0.9%。这说明该模型具有一定的可信度。图7~11
图7 TMHMM Server v.2.0 预测L7/L12蛋白跨膜结构域
Fig.7 The prediction of transmembrane domain of L7/L12 protein by TMHMM Server v.2.0
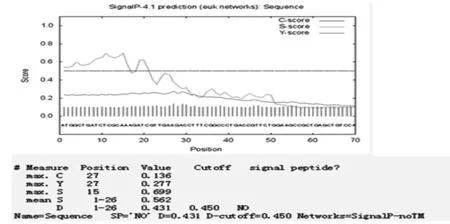
图8 Signal P 4.1 Server 预测L7/L12蛋白信号肽
Fig.8 The prediction of signal peptide of L7/L12 protein by Signal P 4.1 Server
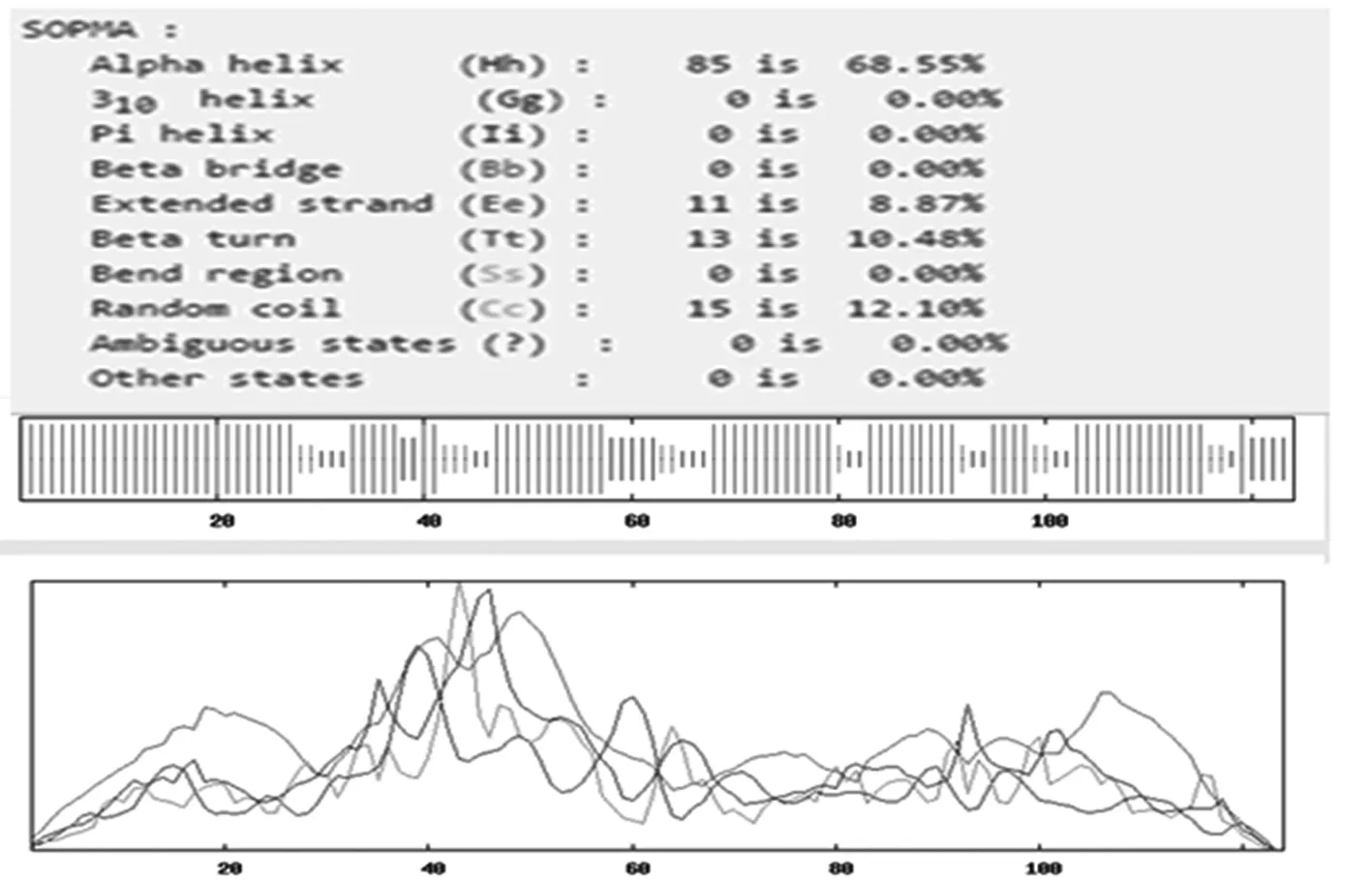
图9 SOPMA 软件推测的L7/L12蛋白二级结构
Fig.9 The prediction of secondary structure of L7/L12 protein by SOPMA Server
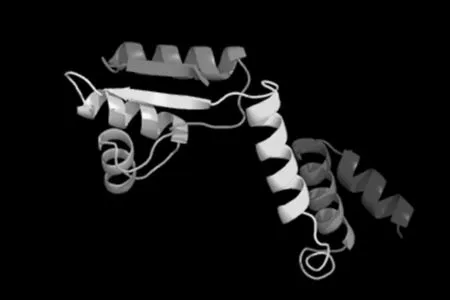
图10 Phyre2 在线服务器预测 L7/L12 蛋白三级结构的构建
Fig.10 The construction of tertiary structure of L7/L12 protein by Phyre2
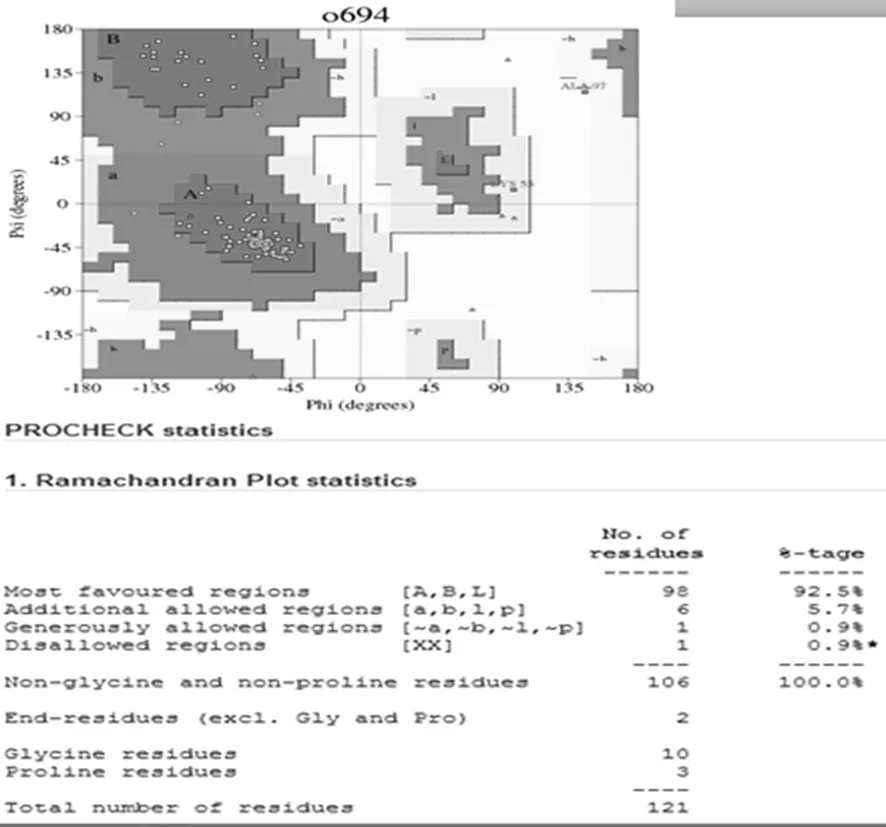
图11 拉氏图
Fig.11 The Ramachandran plot
3 讨 论
布鲁氏菌病是世界上具有严重危害性的人畜共患的传染病之一,几乎世界各地都有分布。从20世纪50年代中期,我国就开始了有组织有计划地对人畜布病调查及防治[13]。20世纪80年代中后期,布鲁氏菌病在世界部分地区有回升趋向,尤其在亚洲更为明显[14]。90年代以来,布病疫情呈持续愈演愈烈的态势,在我国西部、东北及华北省区疫情尤为严重。进入2000年以后,布病疫情强势走高,每年报导的发病人数逐年上升,由总共报导的37种传染病的第17位到2006年已上升至第10位,这种状况在所有法定报告传染病中是极其罕见的,进一步说明了当前布病疫情的严重性,研究及防治的迫切性[15]。
L7/L12核糖体蛋白是布鲁氏菌重要的免疫性抗原之一,结构保守,是良好的疫苗候选抗原蛋白[16]。另外,L7/L12蛋白在布鲁氏菌逃逸机体免疫应答后所引起的Ⅳ型超敏反应中也扮有重要角色[17]。除了引起细胞免疫反应外,L7/L12也可以引起体液免疫应答[18]。Tabynov 等[19,20]将L7/L12 蛋白与流感病毒载体结合包裹成类病毒颗粒作为疫苗抗原,免疫豚鼠和小鼠后发现该抗原可作为疫苗预防B.abortus544株所引起的动物感染。Luo等[21]研究表明L7/L12作为布鲁氏菌疫苗抗原的机制之一是天然的L7/L12蛋白内含有T淋巴细胞的表位,从而能够刺激机体产生Th1类细胞免疫应答,分泌IFN-γ刺激巨噬细胞活化,从而清除藏匿在巨噬细胞中的布鲁氏菌。因此,研究由此构建新疆地区分离株的L7/L12蛋白表达,对于进一步研制新疆地区的亚单位疫苗具有现实意义。
试验成功分离到新疆羊种生物3型布鲁氏菌并成功构建L7/L12蛋白重组表达载体。表达的重组蛋白能与布鲁氏菌阳性血清反应,说明表达的L7/L12在大肠杆菌中得到了正确折叠,其免疫学活性没有受到影响。免疫印迹实验证明了L7/L12蛋白具有良好的反应原性。
试验运用生物信息学相关知识分析,结果表明该基因所表达的蛋白并没有跨膜结构,说明该蛋白可能不参与细胞内外信号的转导。该蛋白没有信号肽,说明该蛋白属于非分泌性蛋白,不能被布鲁氏菌分泌到细胞外发挥作用。其二级结构主要以α-螺旋为主,和绝大多数蛋白的二级结构一样,都是通过骨架上的羰基和酰胺基团之间形成的氢键维持该二级结构的稳定。利用生物信息学软件Phyre2 等构建了出了L7/L12蛋白的三维模型,这有利于蛋白结构、功能的可视化分析。经分析发现,与其同源性的模型具有免疫调控功能,间接验证了该蛋白可能具有免疫调控的功能。布鲁氏菌的免疫逃避是一个复杂的过程,其分子机制尚不完全清楚。试验通过构建布鲁氏菌L7/L12基因的原核表达载体并对其反应原性进行鉴定以及生物信息学分析,为进一步探究布鲁氏菌疫苗研究提供了一些参考。同时,该蛋白作为新疆该地区羊种布鲁氏菌的疫苗候选分子具有一定的参考价值。
4 结 论
实验以羊流产胎儿为病料,经过划线培养、改良萋-尼染色法染色观察其形态,对疑似菌进行omp25PCR鉴定,初步判断出分离的菌中有布鲁氏菌,命名为015。经中国疾病预防控制中心传染病预防控制所对布鲁氏菌通过一系列的生化鉴定,最终确定了该菌为羊种布鲁氏菌生物3型,这表明新疆该羊场存在羊种布鲁氏菌3型的感染。L7/L12蛋白参与布鲁氏菌的蛋白质合成以及发挥保护性抗原的作用,为此通过原核表达的方式大量表达出L7/L12蛋白,并使用Western Blot方法检测出该表达蛋白有良好的反应原性。生物学软件对该蛋白进行了一些常规的预测,为了解该蛋白性质提供参考。
References)
[1] Pappas, G., Papadimitriou, P., Akritidis, N., Christou, L., & Tsianos, E. V. (2006). The new global map of human brucellosis.LancetInfectiousDiseases, 6(2):91-99.
[2] Ficht, T. A. (2003). Intracellular survival of brucella: defining the link with persistence.VeterinaryMicrobiology, 92(3):213-223.
[3] Godfroid, J., Cloeckaert, A., Liautard, J. P., Kohler, S., Fretin, D., & Walravens, K., et al. (2005). From the discovery of the malta fever's agent to the discovery of a marine mammal reservoir, brucellosis has continuously been a re-emerging zoonosis.VeterinaryResearch, 36(3):313-326.
[4] Pappas, G., Memish, Z., Earhart, K., Pappas, G., Sadek, R., & Hsueh, P. R. (2010). The changing brucella ecology: novel reservoirs, new threats.InternationalJournalofAntimicrobialAgents, 36 Suppl 1(5):8-11.
[5] 任德坤, 常青, 师茂林,等. 新疆布鲁氏菌病疫情现状与防治对策[J] . 疾病预防控制通报, 2008, 23(5):36-37.
REN De-kun, CHANG Qing, SHI Mao-lin, et al. (2008). Epidemic Sitation and Its Control of Brucellosis in Xinjiang[J] .Diseasepreventionandcontrolcommunications, 23(5):36-37.
[6] 闫晶华, 李金平, 米吉提,等. 新疆动物布鲁氏菌病现状分析[J] . 新疆畜牧业, 2011,(10):60.
YAN Jing-hua, LI Jin-ping, MI Jiti, et al. (2011). Present Situation Analysis of animal brucellosis[J] .XinjiangAnimalHusbandry, (10):60.
[7] Godinic-Mikulcic, V., Jaric, J., Greber, B. J., Franke, V., Hodnik, V., & Anderluh, G., et al. (2014). Archaeal aminoacyl-trna synthetases interact with the ribosome to recycle trnas.NucleicAcidsResearch, 42(8):5,191-5,201.
[8] Kurar, E., & Splitter, G. A. (1997). Nucleic acid vaccination of brucella abortus ribosomal l7/l12 gene elicits immune response.Vaccine, 15(17-18):1,851-1,857.
[9] Zhao, Z., Li, M., Luo, D., Xing, L., Wu, S., & Duan, Y., et al. (2009). Protection of mice from brucella infection by immunization with attenuated salmonella enterica serovar typhimurium expressing a l7/l12 and bls fusion antigen of brucella.Vaccine, 27(38):5,214-5,219.
[10] 曹涤非. 流产布鲁氏菌 Omp25 与 L7/L12 促巨噬细胞凋亡的分子机制 [D]. 哈尔滨:东北农业大学博士论文, 2012.
CAO Di-fei. (2012).MolecularMechanismofAbortusofBrucellaOmp25andL7/L12InduceMacrophageApoptosis[D]. PhD Dissertation. Northeast Agricultural University, Harbin.(in Chinese)
[11] Oliveira, S. C., & Splitter, G. A. (1996). Immunization of mice with recombinant l7/l12 ribosomal protein confers protection against brucella abortus infection.Vaccine, 14(10): 959-962.
[12] Mallick, A. I., Singha, H., Chaudhuri, P., Nadeem, A., Khan, S. A., & Dar, K. A., et al. (2007). Liposomised recombinant ribosomal l7/l12 protein protects balb / c, mice against brucella abortus, 544 infection.Vaccine, 25(18):3,692-3,704.
[13] 姜顺求.布病防治手册[K] .北京:人民卫生出版社,1986: 264- 268.
JIANG Shun-qiu. (1986).BrucellosisPreventionManual[K]. Beijing: People's Medical Publishing House: 264- 268. (in Chinese)
[14] 尚德秋.布鲁氏菌病再度肆虐及其原因[J] .中国地方病防治杂志, 2001, 16(1): 29- 34.
SHANG De-qiu. (2001). Brucellosis epidemic once again raging and its causes [J] .ChineseJournalofControlofEndemicDiseases, 16(1): 29- 34.(in Chinese)
[15] 崔步云.中国布鲁氏菌病疫情监测与控制[J] .疾病监测,2007, 22(10): 649.
CUI Bu-yun. (2007). China brucellosis epidemic monitoring and control [J].DiseeasSuvreillance, 22(10): 649.(in Chinese)
[16] Oliveira, S. C., & Splitter, G. A. (1996). Immunization of mice with recombinant l7/l12 ribosomal protein confers protection against brucella abortus infection.Vaccine, 14(10): 959-962.
[17] Mallick, A. I., Singha, H., Chaudhuri, P., Nadeem, A., Khan, S. A., & Dar, K. A., et al. (2007). Liposomised recombinant ribosomal l7/l12 protein protects balb / c, mice against brucella abortus, 544 infection.Vaccine, 25(18):3,692-3,704.
[18] Al, D. S., Nckler, K., Scholz, H. C., Tomaso, H., Bogumil, R., & Neubauer, H. (2006). Immunoproteomic characterization of brucella abortus 1119-3 preparations used for the serodiagnosis of brucella infections.JournalofImmunologicalMethods, 309(1-2):34-47.
[19] Tabynov, K., Kydyrbayev, Z., Ryskeldinova, S., Yespembetov, B., Zinina, N., & Assanzhanova, N., et al. (2014). Novel influenza virus vectors expressing brucella l7/l12 or omp16 proteins in cattle induced a strong t-cell immune response, as well as high protectiveness against b. abortus infection.Vaccine, 32(18): 2,034-2,041.
[20] Tabynov, K., Sansyzbay, A., Kydyrbayev, Z., Yespembetov, B., Ryskeldinova, S., & Zinina, N., et al. (2014). Influenza viral vectors expressing the brucella omp16 or l7/l12 proteins as vaccines against b. abortus infection.VirologyJournal, 11(1): 69.
[21] Deyan Luo, Bing Ni, Peng Li, Wei Shi, Songle Zhang, Yue Han, Liwei Mao, Yangdong He, Yuzhang Wu, Xiliang Wang. (2006). Protective immunity elicited by a divalent dna vaccine encoding both the l7/l12 and omp16 genes of brucella abortus in balb/c mice.Infection&Immunity,74(5):2,734-2,741.
Supported by: General Programs of the National Natural Science Foundation of China"Study on the molecular regulation of TceSR and TcfSR in the pathogenesis of Brucella" (31572491).
CHEN Chuang-fu(1962-), male, professor, doctoral supervisor, mainly engaged in the study of pathogenic microorganisms pathogenic mechanism
Identification of Isolate Strain of Brucella Melitensis in Xingjiang and Prokaryotic Expression and Bioinformatics Analysis of Its L7/L12 Protein
LIU Sheng1, JIANG Ya-li2, FU Qiang3, SHI Hui-jun3, LI Shuang1, MENG Lu-ping1, GUO Fei4, ZHANG Hui1, CHEN Chuang-fu1
(1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,ShiheziXinjiang832000,China; 2.CollegeofLifeTechnology,ShiheziUniversity,ShiheziXinjiang832000,China; 3.CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi830052,China; 4.SchoolofMedicine,ShiheziUniversity,ShiheziXinjiang832000,China)
【Objective】 To isolate and identify Xinjiang Brucella melitensis, this project focuses on prokaryotic expression of the L7/L12 protein of the bacteria,detection of its reactionogenicity and and partial biological analysis. 【Method】Isolation and identification of Brucella melitensis by using bacterial streak culture, morphological observation, biochemical test and PCR detection. Using conventional and molecular biological methods to express and purify the L7/L12 protein of this Brucella melitensis. Expression and purification isolate strain L7/L12 protein by using the conventional molecular biological methods, and analysis of the fusion protein reactionogenicity by Western Blot . Using bioinformatics software to analyze some functions of this protein. 【Result】After identification, the strain was identified as Brucella melitensis. After enzyme digestion and sequencing, the expression vector pET-28a-L7/L12 was correctly constructed. SDS-PAGE tests showed that the purified L7/L12 protein was a single band. The fusion protein had good reactionogenicity by Western Blot detection. Bioinformatics analysis showed the protein had no trans-membrane domain and no signal peptide.Its secondary structure was mainlyα-helix.And the three-dimensional structure of the protein was constructed by Phyre2 Server. 【Conclusion】The isolated strain was identified successfully and L7/L12 fusion protein of this isolate strain was expressed and purified. Blot Western test proved that the protein had a good reactionogenicity, which laid the foundation for the protein follow-up research of the subunit vaccine.
Brucellamelitensis;L7/L12; protein purification; reactionogenicity;biological analysis
10.6048/j.issn.1001-4330.2017.03.022
2016-11-24
国家自然科学基金面上项目“TceSR和TcfSR在布鲁氏菌致病过程中的分子调控机制研究”(31572491)
刘升(1992-),女,安徽宿州人,硕士研究生,研究方向为分子病毒学,(E-mail)1341753096@qq.com
陈创夫(1962-),男,广东潮州人,教授,博士生导师,研究方向为病原微生物致病机理,(E-mail)ccf-xb@163.com
S852.1;S188
A
1001-4330(2017)03-0564-10

