活性黄KE-4RN的厌氧脱色研究
付学港,卜久贺,郑 伟,武军杰,王新海,*
(1.河南大学 化学化工学院,河南省工业冷却水循环利用工程技术中心,河南 开封 475004; 2.河南大学 河南省高校环境与健康工程技术研究中心,河南 开封 475004; 3.河南省爱可沃德生态科技有限公司,河南 开封 475004)
活性黄KE-4RN的厌氧脱色研究
付学港1,卜久贺2,3,郑 伟3,武军杰3,王新海1,3*
(1.河南大学 化学化工学院,河南省工业冷却水循环利用工程技术中心,河南 开封 475004; 2.河南大学 河南省高校环境与健康工程技术研究中心,河南 开封 475004; 3.河南省爱可沃德生态科技有限公司,河南 开封 475004)
考察了活性黄KE-4RN在中温(35 ℃)条件下的厌氧脱色情况,从脱色率、VFAs(挥发性脂肪酸)、CODCr(化学需氧量)去除率、污泥吸附、产气量和生物气组分等方面分析了其脱色的形式和程度,并对其厌氧脱色的机理作了初步探讨. 结果表明,活性黄KE-4RN不易被完全矿化,其脱色主要是污泥吸附和厌氧生物初级降解的共同作用,且脱色率随染料的浓度增大而减小. 浓度≤80 mg·L-1(以碳计)的活性黄KE-4RN经2 w降解,脱色率可以达到94%,CODCr去除率在90%以上.
厌氧;生物降解;活性黄KE-4RN;脱色;吸附
活性染料(Reactive Dyes)在印染、化工等行业有着广泛的应用,其中活性黄KE-4RN(Reactive Yellow KE-4RN)属于偶氮类活性染料的一种[1-2]. 由于在实际生产使用过程中利用率不高,偶氮类染料约有一半左右会随废水等排入周围环境[3-4],又因其较难自然降解,会造成水体污染、威胁人和动植物生存、生态系统平衡被破坏等后果[5]. 研究表明,偶氮染料虽难以被好氧微生物分解消化,却能被厌氧微生物有效降解,且在厌氧降解的工程应用方面已经取得了部分进展[6-10].
参照有关偶氮类染料厌氧条件下降解效果研究的基础上,参照ISO13641(2003)国际标准及ECETOC(1988)技术报告[11-12],设计了在中温厌氧环境下活性黄KE-4RN染料的降解与脱色效果实验,考察了其可降解性,并从脱色率、CODCr、VFAs、生物气产量和污泥吸附能力等方面对其厌氧降解可行性进行综合分析,初步探讨了其厌氧脱色的机理,并研究了其在厌氧环境中的主要脱色形式,为活性黄KE-4RN印染废水的生化降解工程化研究提供一定的参考.
1 实验部分
1.1 仪器及试剂
由日本岛津紫外-可见分光光度计(UV-1750型)完成对活性黄KE-4RN分子的光谱扫描及吸光度测定,由上海荆和气相色谱仪(GC-9310型)分析测定VFAs及产生物气组分,由青岛科迪博COD微波消解仪(KDB-III型)完成CODCr消解及测定,由江苏晶玻电热恒温培养箱(DNP-9272型)提供活性污泥培养条件,由湖南沪康台式低速多管架自动平衡离心机(TDZ5-WS)完成离心操作.
活性黄KE-4RN材料由泰兴锦鸡染料有限公司提供,其分子结构如图1所示;实验中所用无机营养盐成分及其浓度详见表1,纯度均为分析纯;实验用水均为蒸馏水.
1.2 实验方法
实验中厌氧污泥由开封市浦华紫光水业提供,原泥悬浮固体颗粒物SS为22.5 g/L,挥发性悬浮固体颗粒物VSS为16.2 g/L,pH为7.3,活性黄KE-4RN分子中碳的质量分数为41.3%. 实验各组染料浓度(以碳计)如下表2所示.
实验流程如下图2所示. 先对污泥进行清洗和离心,避光预培养至不产气,再次清洗后稀释污泥并按表1所示加入无机盐. 配制染料溶液时,取出一定量的污泥按下表2所示装入血清瓶(规格120 mL),调节pH范围为6.5~7.5,配制后向瓶内通氮气约0.5 min,用铝箔及橡皮塞密封,最后通入氮气以排空瓶内空气,其中吸附实验溶液配制完成后于121 ℃条件下灭活0.5 h. 培养箱内设置35℃避光培养,每天摇动培养瓶3次,每次3至5 min,保证染料与污泥充分接触[11-12].
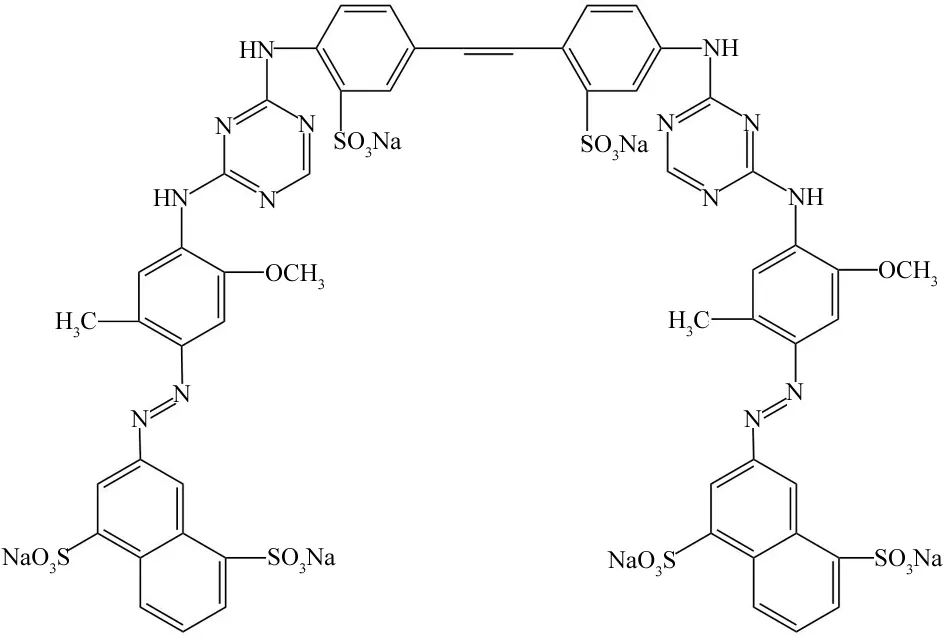
图1 活性黄KE-4RN的分子结构Fig.1 Chemical structure of reactive yellow KE-4RN
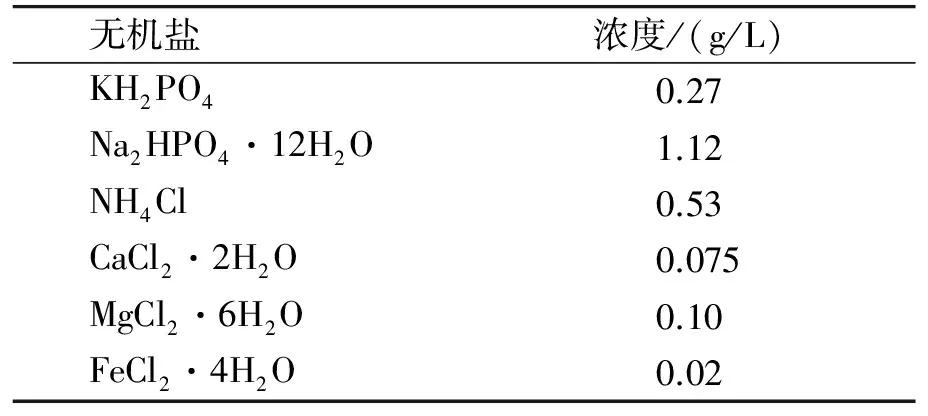
无机盐浓度/(g/L)KH2PO40.27Na2HPO4·12H2O1.12NH4Cl0.53CaCl2·2H2O0.075MgCl2·6H2O0.10FeCl2·4H2O0.02
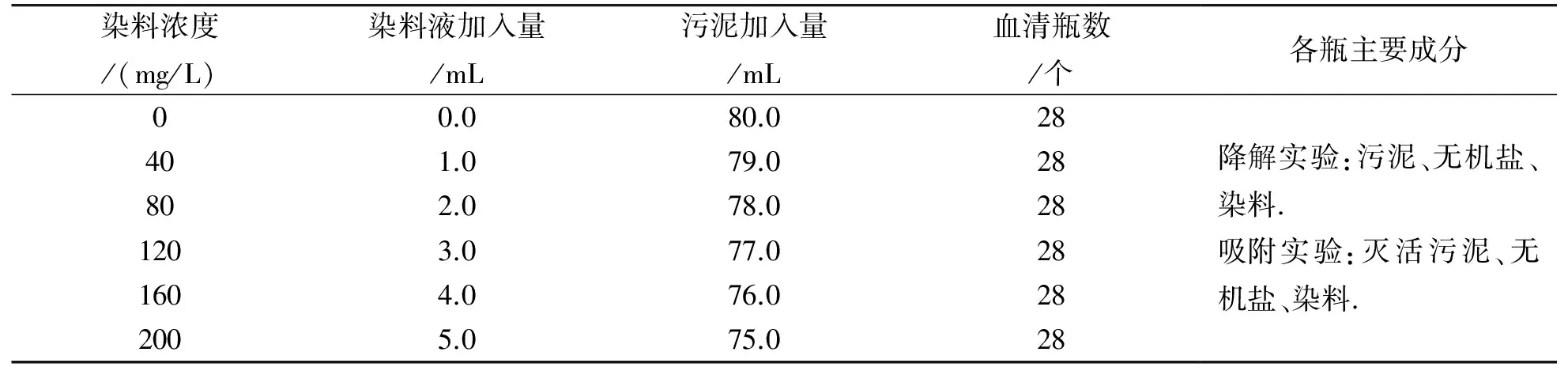
表2 实验设计
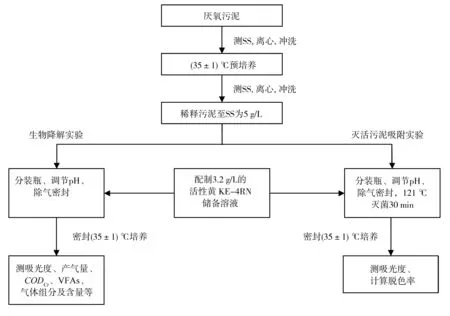
图2 实验流程图Fig.2 Flow chart of experiments
1.3 分析方法
对活性黄KE-4RN溶液进行光谱扫描与吸光度测定以计算实验脱色率. 首先在300~700 nm之间扫描光谱,找出活性黄KE-4RN的最大吸收波长λmax,在最大吸收波长λmax处测定吸光度A. 脱色率计算公式(1)如下:
(1)
式中:A0—降解前溶液在λmax处的吸光度值;At—降解后溶液在λmax处的吸光度值.
使用气相色谱法测定VFAs和产生物气组分,由伍豪色谱工作站提供分析. 其中测定VFAs时,色谱仪采用安捷伦毛细管柱、氢火焰离子检测器以及高纯氮气载气,进样量为6.0×10-4mL;测定产生物气组分时,色谱仪采用不锈钢填充柱、热导检测器及高纯氩气载气,进样量为0.40 mL.
CODCr测定采用微波消解-重铬酸钾法.CODCr去除率计算公式如下:
(2)
式中:CODCr,0—降解前溶液的CODCr值,mg/L;CODCr,t—降解后溶液的CODCr值,mg/L.
使用带刻度的玻璃注射器测定生物气产量. 净生物气产量用下式计算:
(3)
式中:Vg—净生物气产量,mL;V—降解实验生物气产量,mL;V0—空白实验生物气产量,mL.
2 结果与讨论
2.1 KE-4RN最大吸收波长
按照以上实验步骤得到计算脱色率的光谱和吸光度. 活性黄KE-4RN的光谱扫描结果如下图3所示,其最大吸收波长λmax为368 nm.
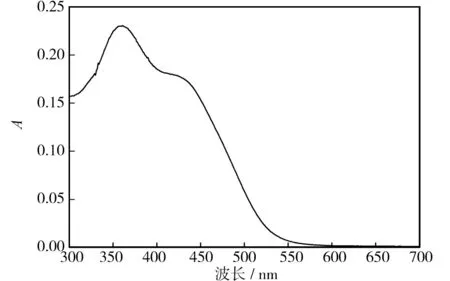
图3 活性黄KE-4RN的光谱图Fig.3 Wavelength scanning of reactive yellow KE-4RN
2.2 脱色率与处理时间的关系
不同浓度的活性黄KE-4RN溶液的脱色效果随时间变化情况如下图4所示. 可以看出,脱色率与溶液浓度呈负相关,在实验开始后第12 d,浓度为40 mg/L的活性黄KE-4RN溶液取得最好的脱色效果,脱色率达到94%.
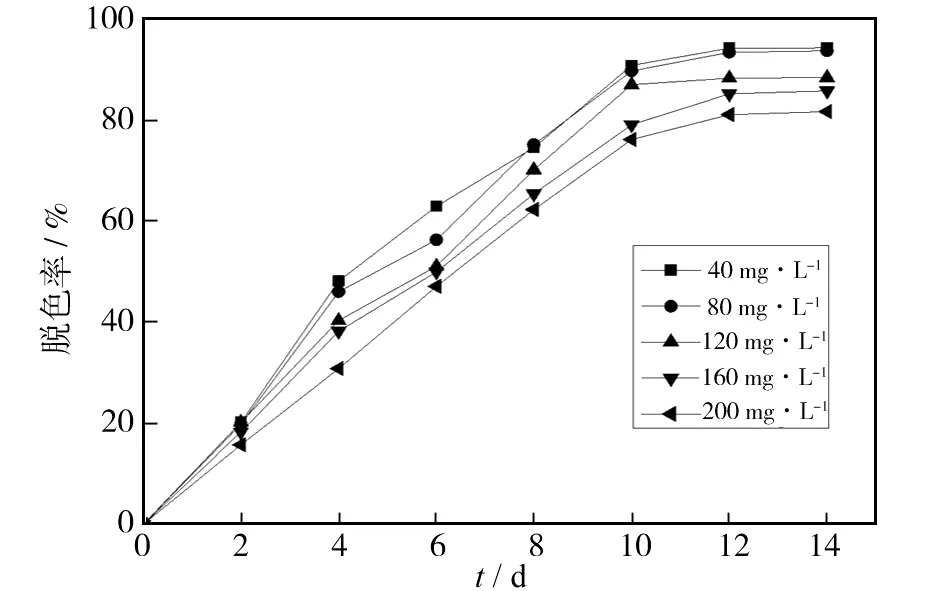
图4 不同浓度活性黄KE-4RN的脱色率Fig.4 Decolorization rate of reactive yellow KE-4RN with different dye concentration
厌氧生物的降解过程牵涉到一系列连续且复杂的生化反应,在有机物的降解过程中有多种具有催化作用的细胞内、外酶的参与. 偶氮类染料的降解也是多种细胞酶参与下完成,如存在于细胞内的偶氮还原酶(还原化合物内偶氮键)和存在于细胞外的转移酶(将化合物从细胞外转移至细胞内)等[13-14]. 偶氮类染料的偶氮键等显色基团在以上多种生物酶的复合作用下断裂,从而实现降解及脱色,大致机理如下图5所示[15-17]. 基于以上理论,活性黄KE-4RN同样在各种酶的作用下得到电子发生偶氮键断裂而降解脱色.
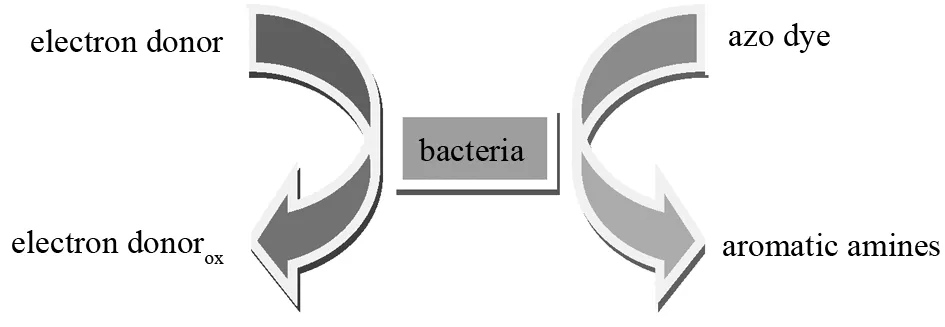
图5 偶氮染料降解的可能机理Fig.5 Plausible mechanism of azo dye degradation
2.3 染料浓度对CODCr去除率的影响
在实验条件下处理2 w后,不同浓度的活性黄KE-4RN溶液的CODCr去除率如表3所示. 可以看出随染料浓度的增大,各组的CODCr去除率逐渐减小. 再结合上文的脱色率结果和下文的VFAs浓度实验,表明活性黄KE-4RN会首先吸附于活性污泥上,在污泥中厌氧微生物的作用下降解,其中部分染料的主要降解过程为初级降解.

表3 活性黄KE-4RN降解实验的CODCr去除率
2.4 VFAs分布
反应进行2 w后,不同浓度的活性黄KE-4RN溶液的VFAs产生情况如图6所示. 结果显示VFAs积累较少. 结合下文的生物气实验结果分析得出,活性黄KE-4RN降解时产生的VFAs基本被产甲烷菌等微生物吸收消耗,并没有明显的累积,但是随着溶液浓度的增加,VFAs值也逐步增加.
厌氧发酵过程中产生过量的VFAs会对染料的降解造成一定的负面影响,如VFAs浓度较高时会阻碍活性染料的甲烷化. 这是由于VFAs可以改变厌氧微生物生长所需的酸碱平衡环境,高浓度VFAs将导致微生物环境的pH下降,从而抑制部分厌氧微生物如产甲烷菌的活性,降低厌氧降解过程中的产气量及其脱色率.
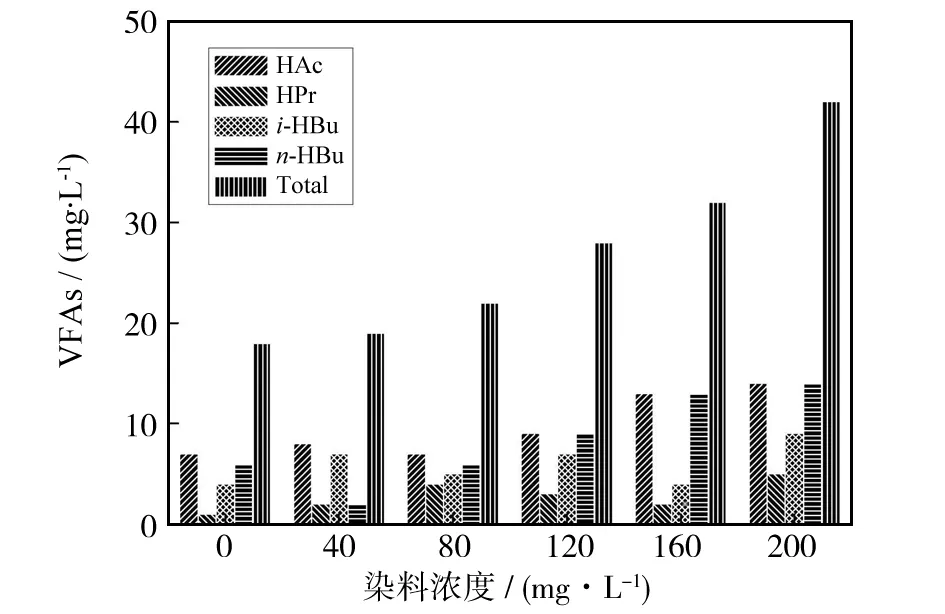
图6 降解实验的VFAs值Fig.6 Concentration of VFAs in degradation experiment
2.5 生物气产量及气体组分
生物气产量及其气体组分是衡量厌氧微生物活性的重要指标之一,净生物气产量可大致反映出降解化合物的矿化程度[12]. 为检测活性黄KE-4RN降解实验中厌氧微生物的活性,在实验开始后的第2 d和实验结束的第14 d对产生物气累积量进行了测定,如图7所示. 从图7中可以看出,不同浓度的活性黄KE-4RN溶液在第2 d的净产气量均为正值,表明前两天每个培养瓶内均有少量净生物气累积. 再结合下文的脱色实验,失活污泥依然具有吸附作用并导致脱色率下降,表明活性黄KE-4RN在厌氧发酵的初期阶段同时存在3种不同的脱色方式,即初级降解、吸附作用和完全矿化. 随着实验的继续进行,生物气产量随反应时间增加有明显变化. 第14 d的测量结果表明,培养瓶中净产气量值与活性黄KE-4RN浓度成反比. 结合上文VFAs分布图(图6)中VFAs值与活性黄KE-4RN浓度成正相关关系,说明在厌氧降解过程中低浓度的活性黄KE-4RN可以被矿化. 至于高浓度染料培养瓶在实验第2 d的净生物气值为正值,可能是由于高浓度染料对内生生物气产生的抑制作用具有一定的滞后性,从而在实验前几天表现出净生物气积累. 同时结合下文失活污泥的实验数据可知在厌氧降解过程中高浓度活性黄KE-4RN染料主要存在初级降解和污泥吸附两种脱色形式.
同时,生物气组分分析结果表明(如图8所示),生物气组分中CO2含量与活性黄KE-4RN浓度成正相关,在染料浓度为200 mg/L时达到最大值约89%;CH4含量与活性黄KE-4RN浓度成负相关,在染料浓度为200 mg/L时达到最小值约16%;H2含量未明显测出. 结合上文中的实验数据,说明在厌氧降解过程中,活性黄KE-4RN染料浓度较高时明显降低产甲烷菌活性,浓度较低时(≤80 mg/L)染料会发生部分矿化.
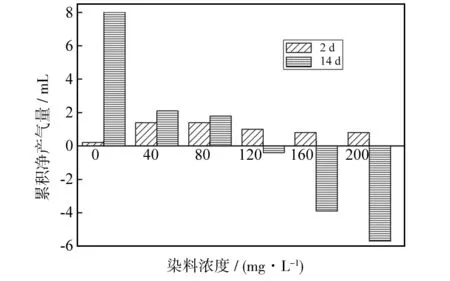
图7 降解实验累计净产气量Fig.7 Net gas production in degradation experiment
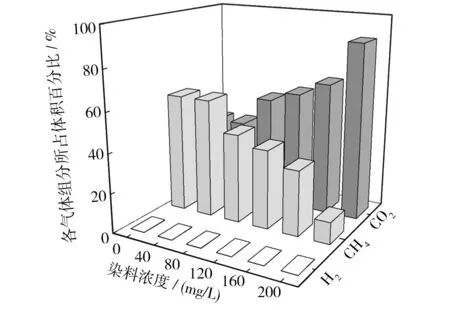
图8 各气体组分所占比例Fig.8 Percentage of gas composition
同时发现,在降解过程中活性黄KE-4RN溶液颜色由黄变蓝,最终变成淡蓝色. 说明活性黄KE-4RN分子中原有显色基团有可能被破坏,并产生了另一种有色中间体[18],也表明有部分活性黄KE-4RN染料未完全降解.
2.6 失活污泥对活性黄KE-4RN的吸附试验
由于污泥本身具有吸附能力,对活性黄KE-4RN起到了一定的吸附脱色作用. 为探明其对活性黄KE-4RN染料的脱色效果,设计了利用失活污泥进行活性黄KE-4RN溶液的脱色实验,结果如图9所示. 可以看出,该实验中脱色率与染料浓度成负相关. 综合活性污泥的脱色率实验分析得出:在厌氧消化过程中,活性黄KE-4RN的脱色除了由于少量矿化外,还同时存在厌氧降解与吸附两种脱色作用,且两者的协同脱色效果远比单一作用下的脱色效果明显.
同时分析灭活污泥和活性污泥的脱色率数据可知,在厌氧环境下,低浓度活性黄KE-4RN的脱色作用效果为:吸附>初级降解≫最终矿化;而高浓度活性黄KE-4RN溶液中降解作用脱色占比重上升,即:初级降解>吸附≫最终矿化.
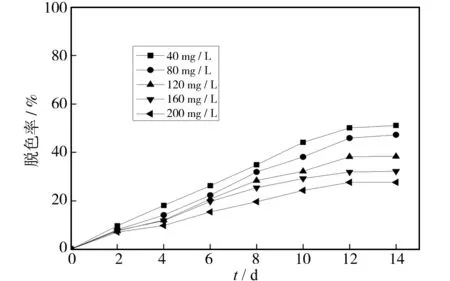
图9 活性黄KE-4RN吸附脱色率Fig.9 Adsorption decolorization rate of reactive yellow KE-4RN
3 结论
综合以上实验结果,得出以下结论:
1) 活性黄KE-4RN在低浓度(≤80 mg/L)时可发生部分矿化;但随着浓度的提高,其最终降解的难度增加,其脱色效果主要由活性污泥吸附和厌氧微生物初级降解协同作用完成.
2) 活性黄KE-4RN降解的脱色贡献率排序如下:低浓度溶液中,吸附>初级降解≫最终矿化;高浓度溶液中,初级降解>吸附≫最终矿化.
3) 溶液颜色的明显变化和最大吸收波长蓝移,表明可能有新的有色中间体产生.
[1] COUTO S R. Dye removal by immobilized fungi [J]. Biotechnology Advances, 2009, 27(3): 227-235.
[2] MAAS R, CHAUDHAR S. Adsorption and biological de-colourization of azo dye Reactive Red 2 in semicontinuous anaerobic reactors [J]. Process Biochemistry, 2005, 40(2): 699-705.
[3] O′NEILL C, HAWKES F R, HAWKES D L, et al. Color in textile effluents sources, measurement, discharge consents and simulation [J]. Journal of Chemical Technology and Biotechnology, 1999, 74(11): 1009-1018.
[4] SELVAM K, SWAMINATHAN K, CHAE K S. Decolourization of azo dyes and a dye industry effluent by a white rot fungus Thelephora sp [J]. Bioresource Technology, 2003, 88(2): 115-119.
[5] 王新海, 王天广, 马同森, 等. 中高温条件下活性红KE-3B厌氧脱色特性和机理初探[J]. 环境科学学报, 2012, 32(11): 2748-2754.
WANG X H, WANG T K, MA T S, et al. Characteristics and mechanism of anaerobic decolorization of reactive red KE-3B under mesophilic and thermophilic conditions [J]. Acta Scientiae Circumstantiae, 2012, 32(11): 2748-2754.
[6] GANESH R, BOARDMAN G D, MCIHELSEN D. Fate of azo dyes in sludges [J]. Water Research, 1994, 28(6): 1367-1376.
[7] BRAS R, FERRA I A, PINHEIRO H M, et al. Batch tests for assessing decolorization of azo dyes by methanogenic and mixed cultures [J]. Journal of Biotechnology, 2001, 89(2): 155-162.
[8] BROMLEY-CHALLENOR K C A, KNAPP J S, ZHANG Z, et al. Decolorization of an azo dye by unacclimated activated sludge under anaerobic conditions [J]. Water Research, 2004, 34(18): 4410-4418.
[9] CHANG J S, CHOU C, LIN P J, et al. Kinetic characteristics of bacterial azo-dye decolorization by Pseudomonas luteola [J]. Water Research, 2001, 35(12): 2841-2850.
[10] SELVAM K, SWAMINATHAN K, CHAE K S. Decolourization of azo dyes and a dye industry effluent by a white rot fungus Thelephora sp [J]. Bioresource Technology, 2003, 88(2): 115-119.
[11] Water quality-Determination of inhibition of gas production of anaerobic bacteria: ISO 13641-1,2: 2003 [S]. Switzerland: International Organization for Standardization.
[12] Evaluation of anaerobic biodegradation,Technical Report No.28 [R]. ISSN-0773-8072-28. Brussels: European Centre for Ecotoxicology and Toxicology of Chemicals,1988: 1-42.
[13] KASPAR H F, WUHRMANN K. Kinetic parameters and relative turnover of some important catabolic reactions in digesting sludge [J]. Appied and Environmental Micro-biology, 1978, 36(1): 1-7.
[14] RUSS R, RAU J, STOLZ A. The function of cytoplasmic flavin reductases in the reduction of azo dyes by bacteria [J]. Appied and Environmental Microbiology, 2000, 66(4): 1429-1434.
[15] KNACKMUSS H J. Basic knowledge and perspectives of bioelimination of xenobiotic compounds [J]. Journal of Biotechnology, 1996, 51(3): 287-295.
[16] PANDEY A, SINGH P, IYENGAR L. Bacterial decolorization and degradation of azo dyes [J]. International Biodeterioration & Biodegradation, 2007, 59(2): 73-84.
[17] FIELD J A, STAMS A J M, KATO M, et al. Enhanced biodegradation of aromatic pollutants in cocultures of anaerobic and aerobic bacterial consortia [J]. Antonie van Leeuwenhoek International Journal of General and Molecular Microbiology, 1995, 67(1): 47-77.
[18] 孙振世, 陈英旭, 柯强, 等. TiO2/膨润土纳米复合光催化剂降解偶氮染料的研究[J]. 环境科学学报, 2003, 23(1): 129-133.
SUN Z S, CHEN Y X, KE Q, et al. Photocatalytic degradation of azo dye by TiO2/bentonite nanocomposite [J]. Acta Scientiae Circumstantiae, 2003, 23(1): 129-133.
[责任编辑:吴文鹏]
Study on anaerobic decolorization of reactive yellow KE-4RN
FU Xuegang1, BU Jiuhe2,3, ZHENG Wei3, WU Junjie3, WANG Xinhai1,3*
(1.HenanEngineeringResearchCenterofIndustrialCirculatingWaterTreatment,CollegeofChemistryandChemicalEngineering,HenanUniversity,Kaifeng475004,Henan,China; 2.EngineeringTechnologyResearchCenterofEnvironment&Health,HenanUniversity,Kaifeng475004,Henan,China; 3.HenanProvinceIcoworldEcologicalSciTechCo.,Ltd,Kaifeng475004,Henan,China)
Based on an anaerobic batch test system under 35 ℃, the effects of volatile fatty acids (VFAs) and sludge adsorption on decolorization of reactive yellow KE-4RN were studied in details. The form and extent of anaerobic decolorization were detected by gas production amount and composition, and the degradation mechanism of reactive yellow KE-4RN reduction was also discussed. The results indicated that the reactive yellow KE-4RN was difficult to be anaerobic biodegraded into CO2and CH4completely. The decolorization should be joint action of sludge adsorption and anaerobic primary biodegradation and the rate of decolorization was inversely proportional to dye concentration. Under the conditions of dye concentration ≤ 80 mg·L-1(calculated by C) and biodegradation for 14 d, the decolorization rate could attain 94% and the removal rate ofCODCrcould be over 90%.
anaerobic; biodegradation; reactive yellow KE-4RN; decolorization; adsorption
2016-07-20.
河南省教育厅科学技术研究重点项目(13A610047), 教育部留学回国人员科研启动基金(2013210).
付学港(1991-), 男, 硕士生, 研究方向为环境科学.*
, E-mail:xinhaiwang@126.com.
X52
A
1008-1011(2017)02-0224-06