偶氮次甲基亚胺作为合成子在有机合成中的应用研究进展
袁贝贝,李雅宁,郭娇美,王琪琳,卜站伟
(阻燃与功能材料河南省工程实验室,河南大学 化学化工学院,河南 开封 475004)
偶氮次甲基亚胺作为合成子在有机合成中的应用研究进展
袁贝贝,李雅宁,郭娇美,王琪琳*,卜站伟*
(阻燃与功能材料河南省工程实验室,河南大学 化学化工学院,河南 开封 475004)
偶氮次甲基亚胺是构筑吡唑酮稠环骨架非常重要的合成子,在有机合成中得到了广泛的应用. 由于其具有合成简单、价格低廉等优点,近年来,对于偶氮次甲基亚胺参与的反应引起了广大化学家的关注. 本文对近几年来偶氮次甲基亚胺作为合成子在有机合成中的应用按照反应类型进行了总结,详细阐述了其在[3+2]、[3+3]、[3+4]和Mannich反应中的应用,以期为开发新反应及结构新型的含有吡唑酮骨架的合成子提供理论依据.
偶氮次甲基亚胺;稠环;合成子;环加成
吡唑酮杂环是一类非常重要的结构片段,在食物、纺织品、摄影、化妆品工业具有重要的应用[1];同时它们还是很多药物的活性骨架,表现出非常重要的生理活性(图1)[2]. 如化合物1被用作消炎药,另外,由于其结构与β-内酰胺类似,它们还被用做新的抗生素;化合物2常被用作除草剂和杀虫剂;化合物3可以用于治疗老年痴呆症;而化合物4自从19世纪80年代便被广泛研究,它们是青霉素和头孢菌素类抗生素的类似物. 鉴于含有吡唑酮骨架的重要性,因此合成该类化合物具有十分重要的意义.
偶氮次甲基亚胺是合成含有吡唑酮骨架化合物非常重要的合成子,自1968年DORN等[3]将其作为1,3-偶极子用于环加成反应以来,引起了广大化学家的研究兴趣. 从结构来看,首先它是一个很好的1,3-偶极子,可以与烯烃或炔烃发生1,3-偶极环加成反应;其次它还是一个两性离子,具有“亲核-亲电”的双重特性,因此可以和具有“亲电-亲核”特性的化合物发生环加成反应;此外,由于亚胺离子的存在,它还可以与亲核试剂发生Mannich反应(图2). 本文作者将围绕偶氮次甲基亚胺的这些结构特点,综述这几年来其在[3+2]、[3+3]、[3+4]和Mannich反应中的应用,以期为开发新的反应及结构新型的含有吡唑酮骨架的合成子提供理论依据.
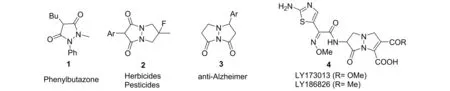
图1 几种含有吡唑酮骨架的具有重要生理活性的药物Fig.1 Some biologically interesting pharmaceuticals containing pyrazolone motifs
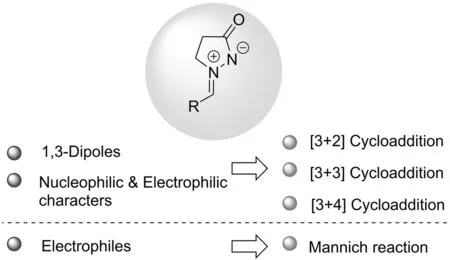
图2 偶氮次甲基亚胺的结构特点及其在有机合成中的应用Fig.2 Structural features of azomethine imines and their application in organic synthesis
1 偶氮次甲基亚胺在[3+2]环加成反应中的研究进展
由于偶氮次甲基亚胺是一类很好的1,3-偶极子,同时也是一类两性离子,所以能和烯烃或炔烃、Michael受体、“亲电-亲核”试剂发生[3+2]环加成反应,接下来将按照这个分类综述这几年来偶氮次甲基亚胺在[3+2]环加成反应中的应用.
1.1 偶氮次甲基亚胺与烯烃或炔烃发生的[3+2]环加成反应
2003年,FU等[4]报道了手性铜催化的偶氮次甲基亚胺与炔烃参与的[3+2]环加成反应(图3). 该反应的底物范围比较广,对芳炔和烷基取代的炔烃都能得到比较好的结果,同时炔烃的电子性能对反应也影响不大. 随后,作者又将该催化体系用于C3-取代的偶氮次甲基亚胺的不对称拆分中(图4),同样也得到了非常好的拆分效果[5].
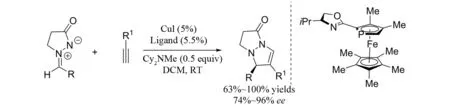
图3 手性铜催化的偶氮次甲基亚胺与炔烃参与的[3+2]环加成反应Fig.3 Chiral copper catalyzed [3+2] cycloaddition of azomethine imines with alkynes
2009年,KELLER等[6]报道了负载型铜盐催化的偶氮次甲基亚胺与缺电子端炔的[3+2]环加成反应(图5). 将铜盐负载在硅藻土上,可以非常高效地催化该反应顺利进行,同时催化剂易于分离,并且可以循环使用6次不降低催化活性. 在该反应中,底物范围仅仅局限于缺电子的端炔,而对于富电子的端炔或者非端炔,反应无法进行. 2011年,YOSHIMURA等[7]也报道了负载型铜催化的偶氮次甲基亚胺与缺电子端炔的[3+2]环加成反应,他们将氢氧化铜负载在Al2O3上,该催化剂的催化活性也非常高,仅仅需要0.15%的铜就能顺利的完成反应.
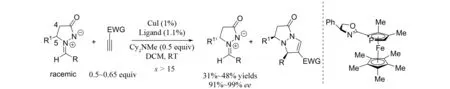
图4 手性铜催化的偶氮次甲基亚胺的手性拆分
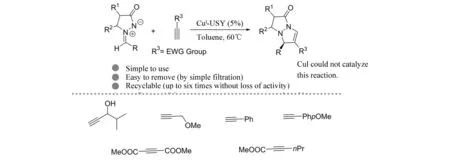
图5 负载型铜催化剂催化的[3+2]环加成反应
2012年,IMAIZUMI等[8]实现了手性铜催化的偶氮次甲基亚胺与端炔的不对称[3+2]环加成反应(图6),并且以不错的结果得到手性双环噁唑酮. 在该反应过程中,作者认为,端炔首先和铜形成炔铜,随后炔铜作为亲核试剂与偶氮次甲基亚胺发生1,2-加成,最后发生分子内环化得到目标产物.
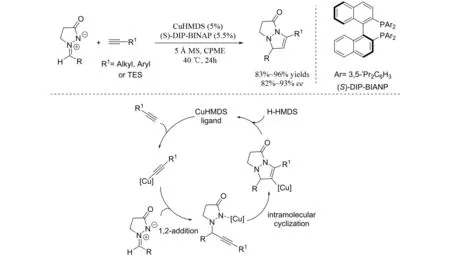
图6 铜催化的偶氮次甲基亚胺与端炔的不对称[3+2]环加成反应Fig.6 Cu- Catalyzed asymmetric [3+2] cycloaddition of azomethine imines with terminal alkynes
2013年,ARAI等[9]报道了铜催化的偶氮次甲基亚胺与丙炔酸酯的不对称[3+2]环加成反应(图7). 在该反应中,作者使用该课题组自己发展的双噁唑吡啶手性配体,可以达到很好的立体控制的目的,以72%~99%的收率以及80%~95%的对映选择性得到双环吡唑酮.
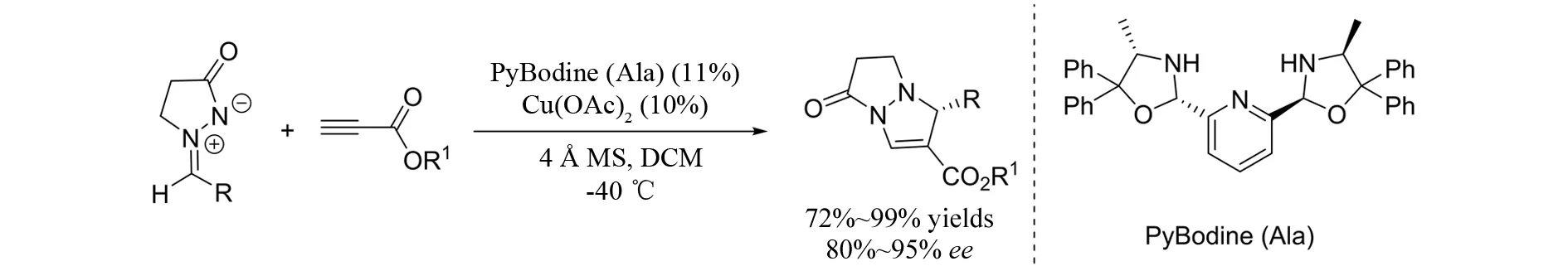
图7 偶氮次甲基亚胺与丙炔酸酯参与的不对称[3+2]环加成反应Fig.7 Bis(oxazolidine)pyridine-metal catalyzed asymmetric [3+2] cycloaddition of azomethine imines with propiolates
2015年,EFREMOVA等[10]报道了偶氮次甲基亚胺与N-乙烯基吡咯参与的[3+2]环加成反应(图8). 在微波的协助下,以高达85%的收率得到吡咯取代双环吡唑啉酮.
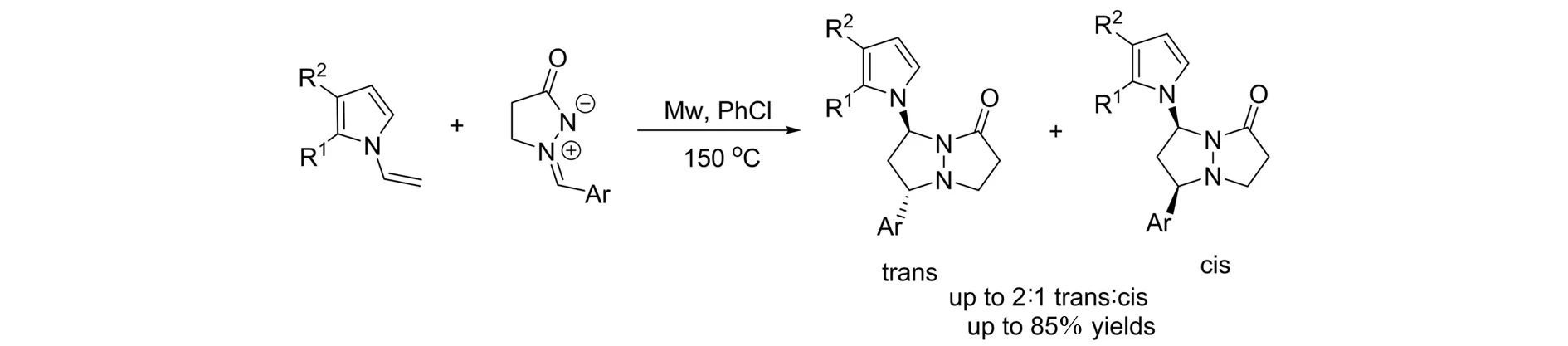
图8 微波诱导的[3+2]环加成反应Fig.8 Microwave-promoted [3+2] cycloaddition
2015年,LI等[11]报道了4-乙酰氧基联烯酸酯与偶氮次甲基亚胺参与的[3+2]环加成反应(图9). 该反应无需催化剂,在甲苯中于50 ℃下搅拌12 h即得到目标产物. 作者认为该反应可能先通过[3+2]环加成,随后失去一分子醋酸进行的.
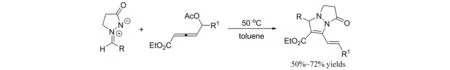
图9 4-乙酰氧基联烯酸酯与偶氮次甲基亚胺参与的[3+2]环加成反应Fig.9 [3+2] cycloaddition of 4-acetoxy allenoates with azomethine imines
1.2 偶氮次甲基亚胺与Michael受体发生的[3+2]环加成反应
2006年,CHEN等[12]报道了偶氮次甲基亚胺与α,β-不饱和醛参与的不对称[3+2]环加成反应(图10). 在脯氨醇类催化剂的催化作用下,得到具有三个连续手性中心的双环吡唑酮类化合物,通过对一系列反应条件的筛选,作者最终得到exo构型为主的目标产物. 随后,作者将α,β-不饱和醛底物体系扩展至反应活性相对较低同时立体控制较难的α,β-不饱和酮(图11)[13]. 在金鸡纳碱衍生的伯胺类催化剂的作用下,偶氮次甲基亚胺与环状烯酮发生反应,以高达99%的收率、95%的对映选择性得到多元稠环吡唑酮化合物.
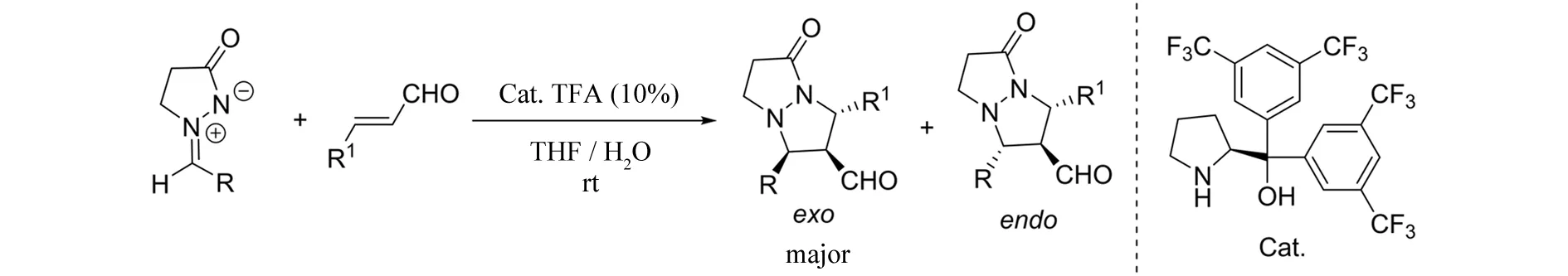
图10 脯氨醇催化的α,β-不饱和醛参与的[3+2]环加成反应Fig.10 Prolinol-catalyzed [3+2] cycloaddition of α,β-unsaturated aldehydes with azomethine imines
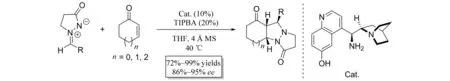
图11 偶氮次甲基亚胺与环状烯酮参与的不对称[3+2]环加成反应Fig.11 Asymmetric [3+2] cycloaddition of azomethine imines with cyclic enones
2008年,SIBI等[14]报道了手性铜催化的偶氮次甲基亚胺与α,β-不饱和酰肼参与的不对称[3+2]环加成反应(图12). 当α,β-不饱和酰肼的β-位没有取代基时,反应普适性较好,以高达90%的收率、96∶4的非对映选择性以及98%的对映选择性得到具有exo-构型的双环多取代四氢咪唑并吡唑酮类化合物(eq (1)). 然而,当β-位有甲基取代基时,反应活性大大降低,需要使用当量的催化剂才能得到中等的收率和对映选择性 (eq (2)).
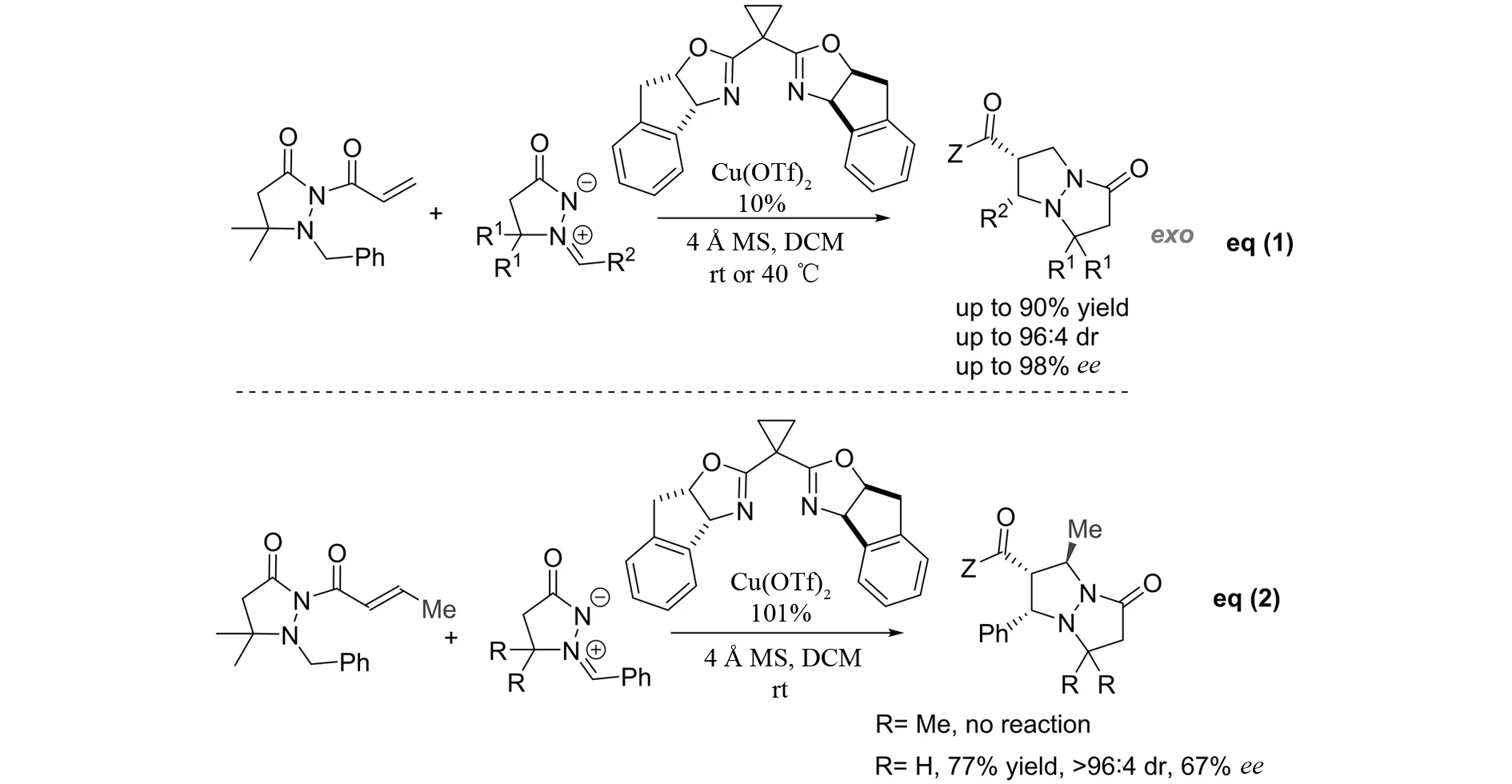
图12 偶氮次甲基亚胺与α,β-不饱和酰肼参与的不对称[3+2]环加成反应Fig.12 Asymmetric [3+2] cycloaddition of azomethine imines with 2-acryloyl-3-pyrazolidinone
2010年,OGAWA等[15]报道了无催化剂条件下偶氮次甲基亚胺与α-三氟甲基取代丙烯酸酯的[3+2]环加成反应(图13),并且以非常高的收率(82%~97%)得到具有双环骨架的吡唑酮类化合物. 遗憾的是,该反应的立体选择性不太好,最高得到3∶1的非对映选择性.
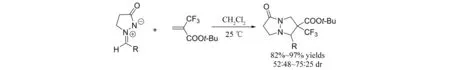
图13 偶氮次甲基亚胺与α-三氟甲基取代丙烯酸酯参与的[3+2]环加成反应Fig.13 [3+2] cycloaddition of azomethine imines with α-trifluoromethylacrylates
2011年,XIN等[16]报道了偶氮次甲基亚胺与β-三氟乙酰基乙烯基醚参与的[3+2]环加成/消除串联反应(图14). 以DMSO为反应溶剂,无需任何催化剂,在室温条件下,以44%~89%的收率得到三氟乙酰基取代的双环吡唑啉酮.
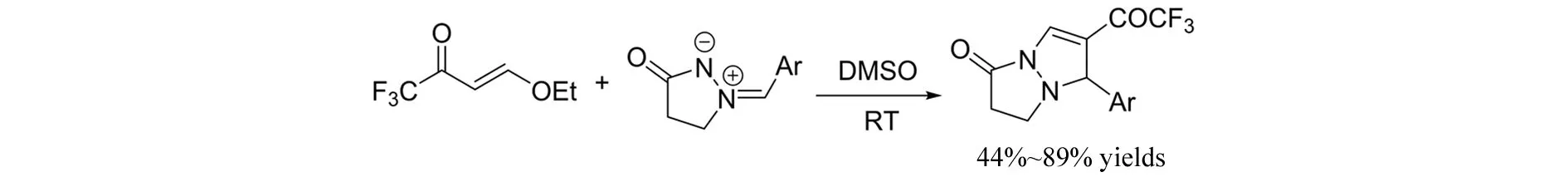
图14 偶氮次甲基亚胺与β-三氟乙酰基乙烯基醚参与的[3+2]环加成/消除串联反应Fig.14 [3+2] cycloaddition/elimination cascade of 3-oxo-1,2-pyrazolidinium ylides and β-trifluoroacetyl vinyl ethyl ether
2013年,HONG等[17]报道了双手性磷酸催化的偶氮次甲基亚胺与靛红衍生的烯烃参与的不对称[3+2]环加成反应(图15),并且以68%~93%的收率、6∶1~20∶1的非对映选择性以及91%~99%的对映选择性得到具有螺环氧化吲哚骨架的双环吡唑酮. 与传统的单手性磷酸相比,双手性磷酸具有更强的刚性骨架,同时是很好的双氢键给体,可以起到更好的立体控制的作用.
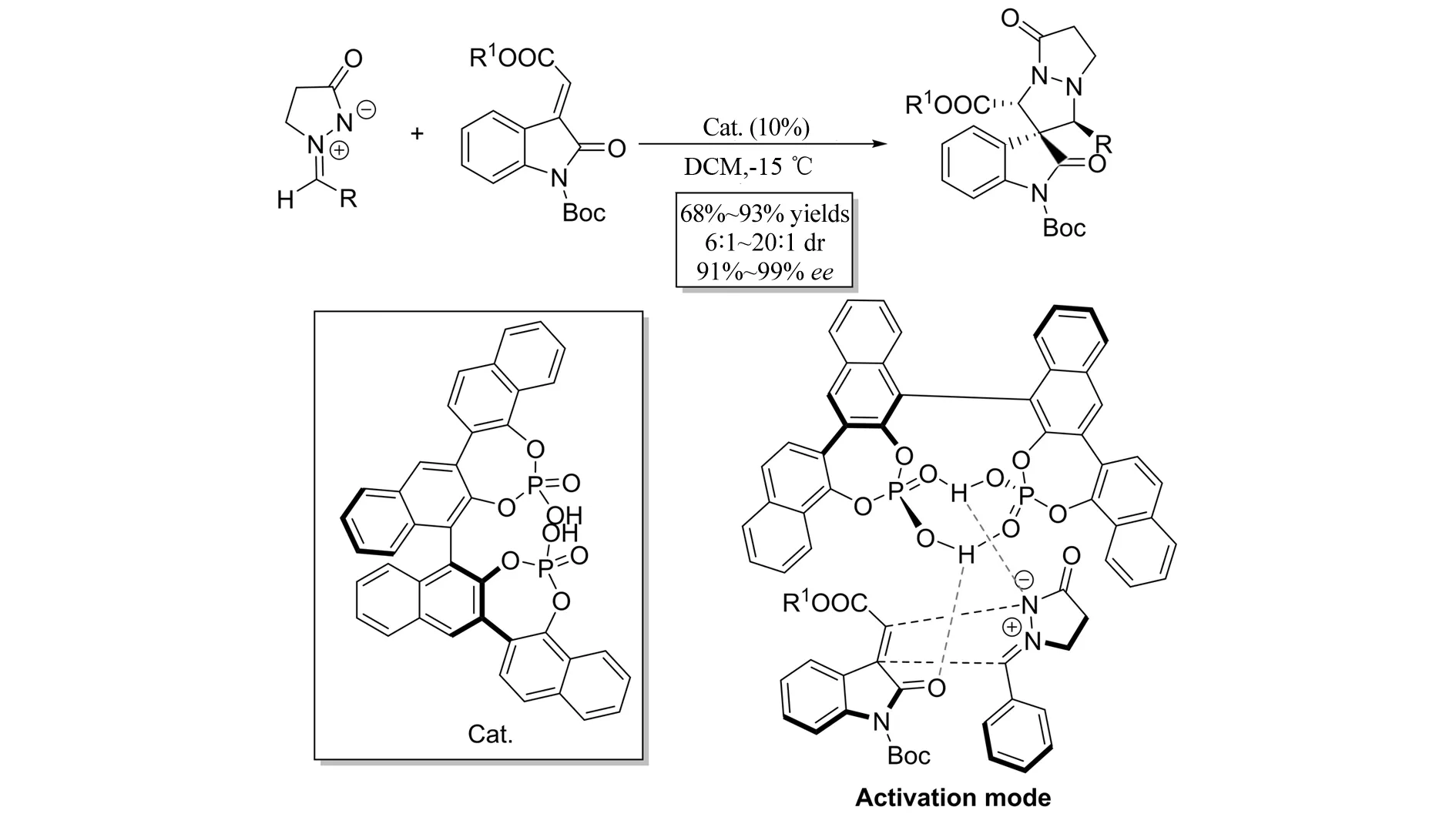
图15 偶氮次甲基亚胺与靛红衍生的烯烃参与的不对称[3+2]环加成反应Fig.15 Asymmetric [3+2] cycloaddition of methyleneindolinones and azomethine imines
同年,LI等[18]报道了醛与丙二酸酯衍生的α,β-不饱和羰基化合物与偶氮次甲基亚胺参与的不对称[3+2]环加成反应(图16). 在手性镍配合物的催化下,以较高的收率(65%~88%)及较好的对映选择性(62%~97%)得到具有反式结构的手性双环吡唑酮. 值得说明的是,手性配体仅仅起到了调控对映选择性的目的,而对非对映选择性无影响,该反应在不添加手性配体的情况下也仅仅得到反式结构的产物.
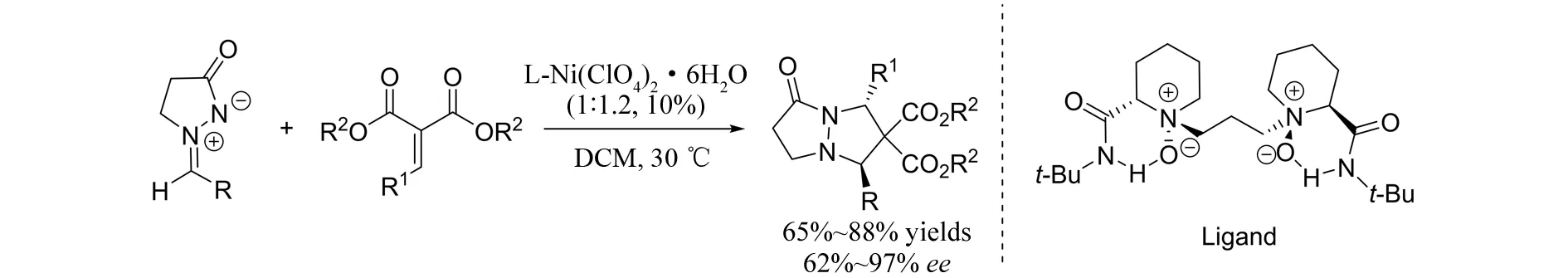
图16 镍催化的偶氮次甲基亚胺与α,β-不饱和羰基化合物参与的不对称[3+2]环加成反应Fig.16 Nickel-catalyzed asymmetric [3+2] cycloaddition of azomethine imines with alkylidene malonates
2014年,LI等[19]报道了偶氮次甲基亚胺与(Z)-α,β-不饱和砜参与的[3+2]环加成反应(图17). 在甲基二苯基膦的催化下,以高达93%的收率得到具有三个连续手性中心的双环吡唑酮. 遗憾的是,得到的双环吡唑酮是几个非对映异构体的混合物,该混合物无法通过柱色谱或液相色谱分开. 此外,作者还尝试了偶氮次甲基亚胺与(E)-α,β-不饱和砜的[3+2]环加成反应,并且以77%的收率得到加成产物. 有意思的是,该产物与(Z)-α,β-不饱和砜参与的[3+2]环加成产物结构相同,说明缺电子烯烃的构型对该反应活性和立体选择性没有影响. 随后,作者提出了该反应可能的反应机理(图18). 首先,膦作为亲核试剂对缺电子烯烃亲核进攻形成两性离子中间体A,随后A与偶氮次甲基亚胺发生加成反应生成B,最后B发生分子内的亲核取代反应,释放出催化剂,完成催化循环.
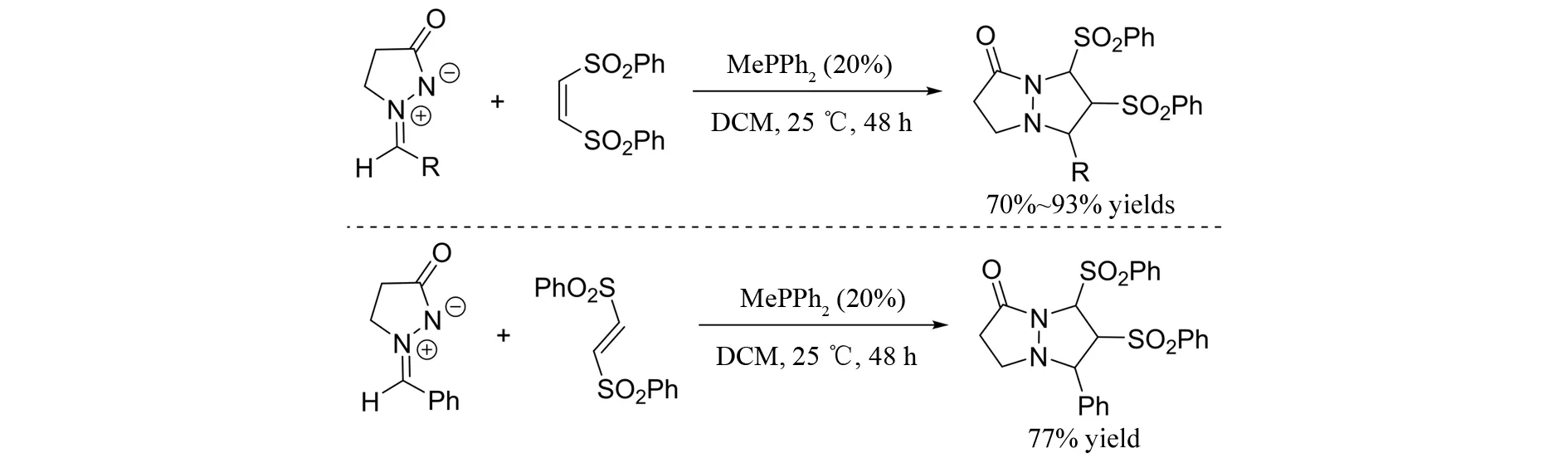
图17 膦催化的偶氮次甲基亚胺与缺电子烯烃参与的[3+2]环加成反应Fig.17 Phosphine-catalyzed [3+2] cycloaddition of azomethine imines with electron-deficient alkenes
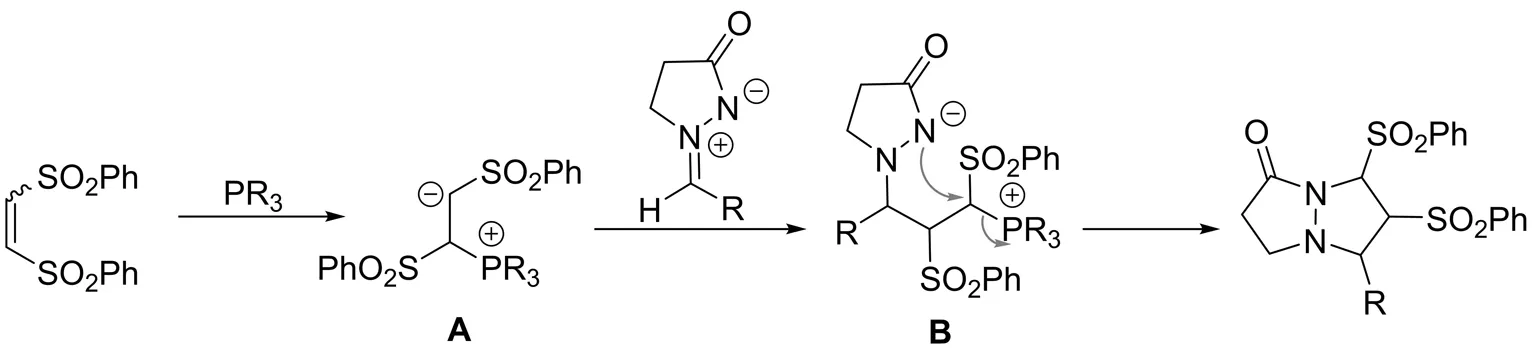
图18 反应进行可能的机理Fig.18 Plausible reaction mechanism
1.3 偶氮次甲基亚胺与“亲电-亲核”试剂发生的[3+2]环加成反应
2014年,PAIR研究小组报道了米氏酸与偶氮次甲基亚胺参与的不对称[3+2]环加成反应(图19)[20]. 在金鸡纳碱类催化剂的催化下,以高达89%的收率和92%的对映选择性得到具有不对称结构双吡唑酮产物. 有意思的是,该产物还可以采用米氏酸、吡唑酮与醛为起始原料发生Knoevenagel/Michael/Cyclization串联反应,通过一锅煮的方法来得到.
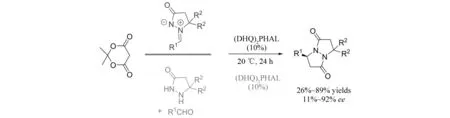
图19 有机小分子催化的米氏酸与偶氮次甲基亚胺参与的不对称环加成反应Fig.19 Organocatalytic asymmetric cycloaddition of Meldrum’s acid and cyclic azomethine imines
同年,LIU等[21]报道了无催化剂条件下偶氮次甲基亚胺与吖内酯发生的[3+2]环加成反应(图20). 在该反应中,吖内酯C2作为亲核试剂对偶氮次甲基亚胺的C=N双键亲核加成,随后发生分子内的胺酯交换反应,得到氨基取代的双吡唑酮产物.
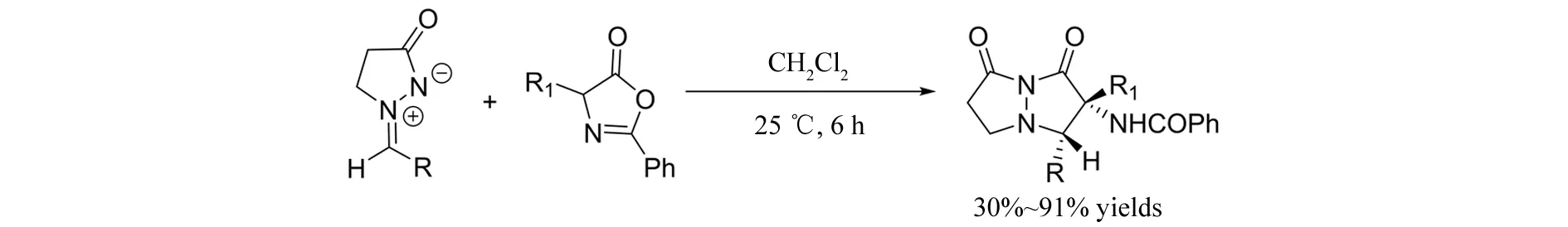
图20 偶氮次甲基亚胺与吖内酯发生的[3+2]环加成反应Fig.20 [3+2] cycloaddition of azomethine imines with azlactones
最近,MONDAL小组报道了酰氯和偶氮次甲基亚胺参与的不对称[3+2]环加成(图21)[22]. 在金鸡纳碱(DHQ)2PHAL的催化作用下,以高达99%的收率、27∶1的dr以及>96%的对映选择性得到双环手性吡唑啉酮. 另外,可以通过调控催化剂,得到目标产物的对映异构体. 在该反应中,作者认为,酰氯在碱的作用下生成烯酮,随后在金鸡纳碱的作用下,烯酮与偶氮次甲基亚胺发生[3+2]环加成反应,最终得到目标产物.
2 偶氮次甲基亚胺在[3+3]环加成反应中的研究进展
2006年,SHINTANI等[23]报道了钯催化的偶氮次甲基亚胺与烯丙基硅烷参与的[3+3]环加成反应(图22). 该反应的普适性比较好,无论是芳基还是烷基取代的偶氮次甲基亚胺均得到不错的反应结果. 但是该反应对空间位阻比较敏感,当R为叔丁基时,仅仅得到20%的收率.
2007年,CHAN等[24]报道了肉桂醛与偶氮次甲基亚胺参与的[3+3]环加成反应(图23). 在氮杂卡宾的催化下,以51%~93%的收率得到稠环吡唑酮衍生物,而目标产物是一类重要的合成子,可以进行下一步转化.
2009年,QIAN等[25]报道了无催化剂条件下异氰、丁炔二酸酯与偶氮次甲基亚胺参与的三组分串联反应(图24). 首先,异氰与丁炔二羧酸酯发生Michael加成形成两性离子中间体A,随后A与吡唑酮发生Michael/Pinner串联反应,得到多官能化的四氢哒嗪并吡唑酮. 该反应仅仅对丁炔二酸酯有效,而对丙炔酸酯和苯丙炔酸酯并不适用.
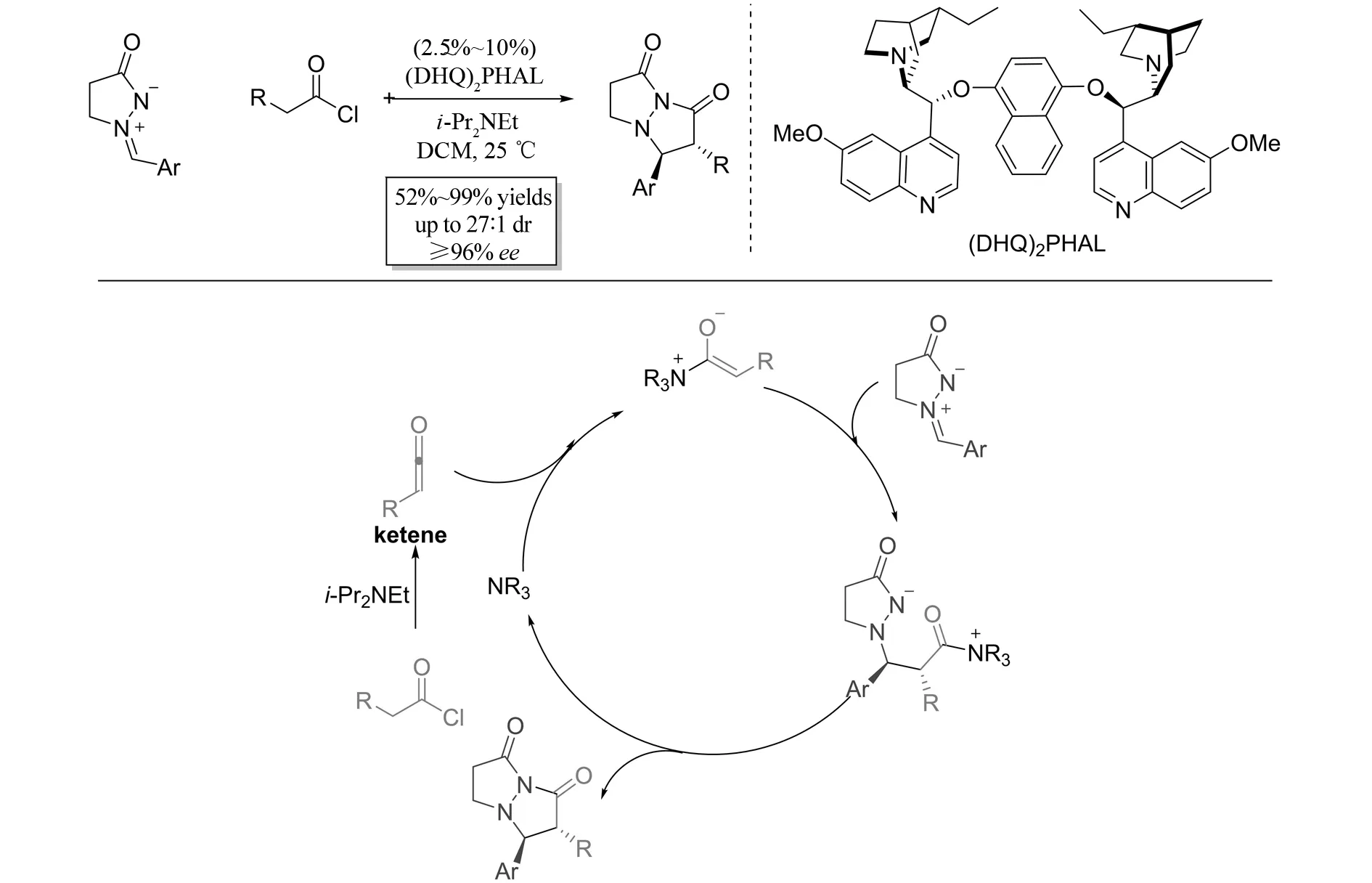
图21 Cinchona alkaloid催化的烯酮和偶氮次甲基亚胺参与的不对称[3+2]环加成反应Fig.21 Cinchona alkaloid-catalyzed asymmetric [3+2] cycloaddition of ketenes azomethine imines
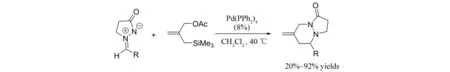
图22 偶氮次甲基亚胺与烯丙基硅烷发生的[3+3]环加成反应Fig.22 [3+3] Cycloaddition of trimethylenemethane with azomethine imines
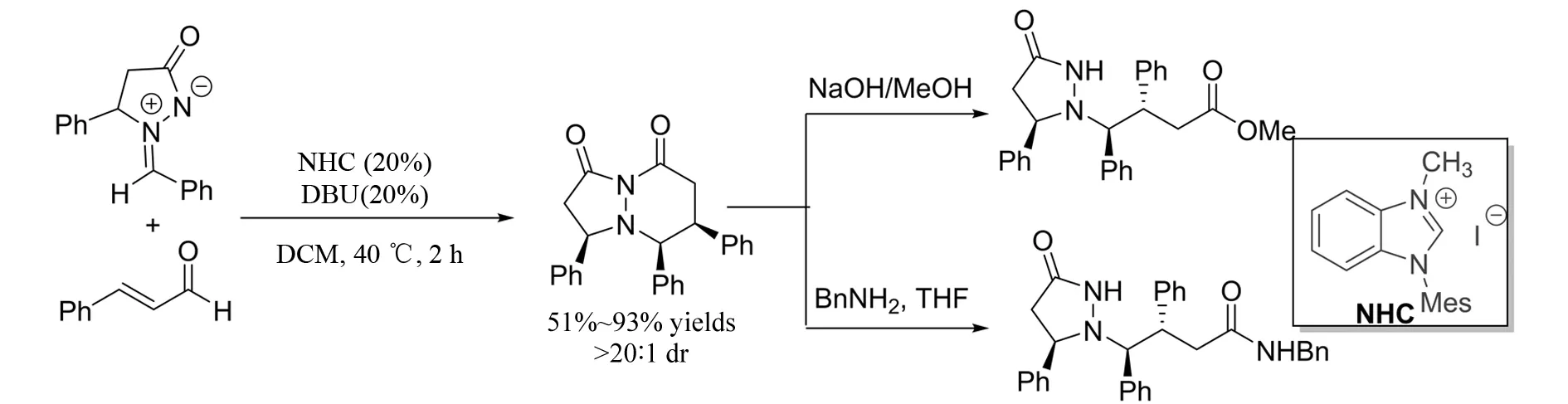
图23 氮杂卡宾催化的偶氮次甲基亚胺与肉桂醛的[3+3]环加成反应Fig.23 NHC-catalyzed [3+3] cycloaddition of azomethine imines with enals
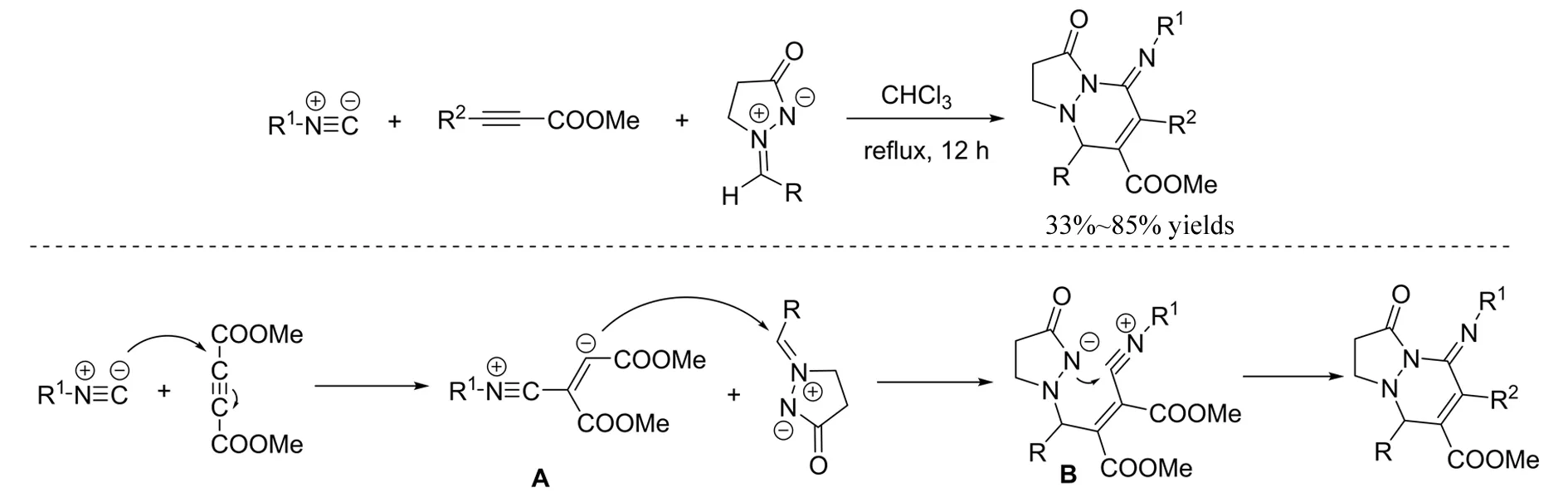
图24 偶氮次甲基亚胺参与的三组分反应Fig.24 Three-component reaction of azomethine imines
2013年,TONG等[26]报道了偶氮次甲基亚胺与亚胺叶立德参与的不对称[3+3]环加成反应(图25). 该反应的核心问题是如何有效的避免两种叶立德二聚,同时反应的区域选择性和立体选择性也是需要考虑的问题. 通过对一系列配体的筛选,作者发现具有噁唑啉骨架的手性膦配体可以起到很好的立体控制作用,最终以高达94%的收率和98%的对映选择性得到具有1,2,4-三嗪骨架的手性吡唑酮. 该反应体系的底物普适性非常好,对烷基取代的偶氮次甲基亚胺也能表现很好的催化活性.
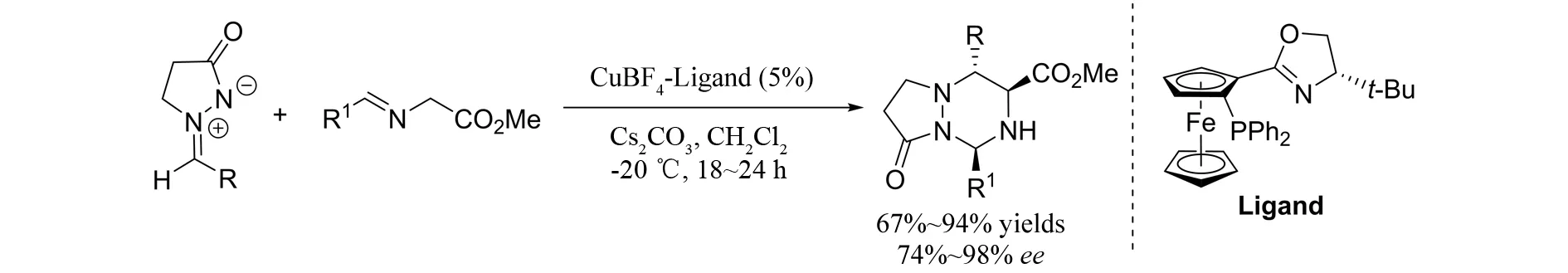
图25 偶氮次甲基亚胺与亚胺叶立德参与的不对称[3+3]环加成反应Fig.25 Asymmetric [3+3] cycloaddition of azomethine imines and imino ester ylides
2013年,FANG等[27]实现了DABCO催化的偶氮次甲基亚胺与2,5-二羟基-1,4-二噻烷参与的[3+3]环加成反应(图26). 在DABCO的作用下,硫作为亲核试剂进攻偶氮次甲基亚胺的C=N键,促进第一步Mannich反应的进行,随后氮负离子与醛羰基发生亲核加成反应,从而完成催化循环,形成目标产物.
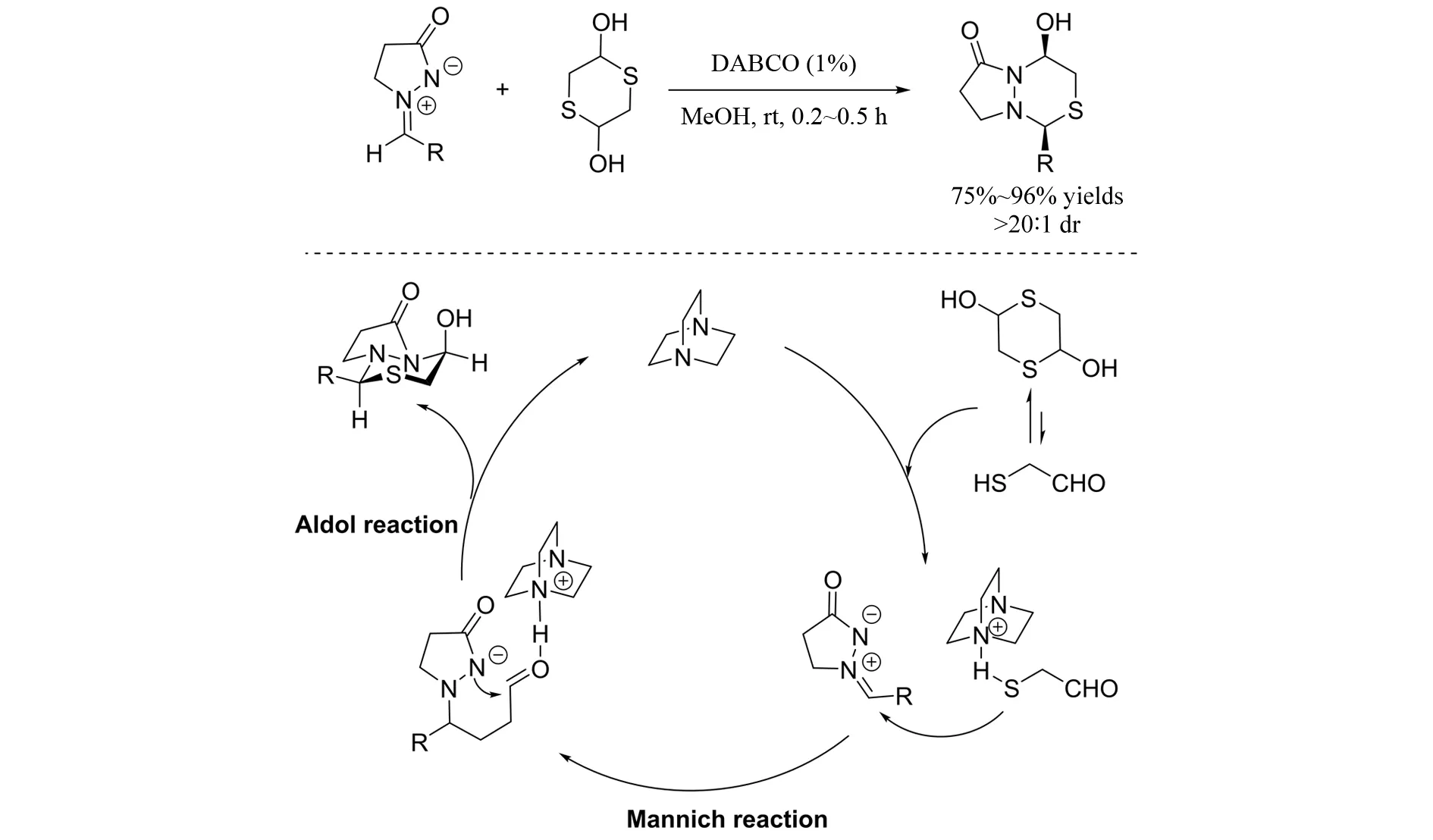
图26 偶氮次甲基亚胺与2,5-二羟基-1,4-二噻烷参与的[3+3]环加成反应Fig.26 [3+3]-Cycloaddition of azomethine imines with 1,4-dithiane-2,5-diol
2013年, QIAN等[28]报道了偶氮次甲基亚胺与烯醇重氮羧酸酯参与的[3+3]环加成反应,在醋酸铑的催化下,高立体选择性的得到具有稠环四氢哒嗪骨架的吡唑酮(图27). 在该反应中,醋酸铑首先和重氮化合物反应生成金属卡宾,随后与偶氮次甲基亚胺发生加成、环化串联反应,释放出催化剂,最终得到目标产物. 有意思的是,当采用三氯化金作催化剂时,得到的是[3+2]环加成产物.
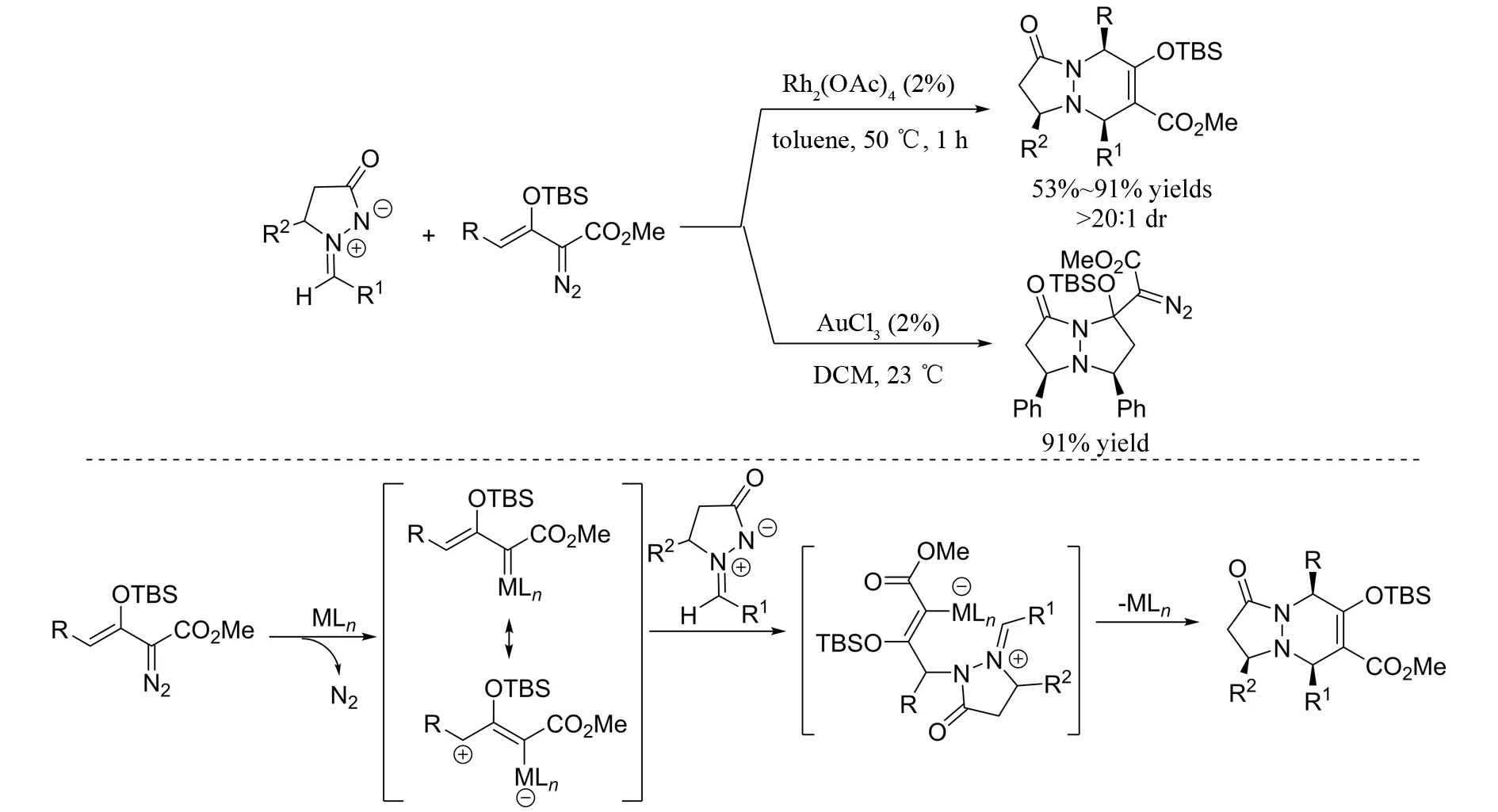
图27 偶氮次甲基亚胺与烯醇重氮羧酸酯参与的[3+3]环加成反应Fig.27 [3+3] cycloaddition of enoldiazoacetates with azomethine imines
2013年,ZHU等[29]实现了碱催化的3-异氰硫酸酯取代氧化吲哚与偶氮次甲基亚胺参与的[3+3]环加成反应(图28). 在氯仿溶剂中,以75%~94%的收率得到具有脲骨架的稠环吡唑酮螺环氧化吲哚. 有意思的是,通过改变溶剂,将氯仿换为氯仿和甲醇的混合溶剂时,非常高效地得到了吡唑酮的开环产物. 而在氯仿体系中得到的产物还可在碘化钐的作用下转化为开环产物,为开环产物的合成提供了新的途径.
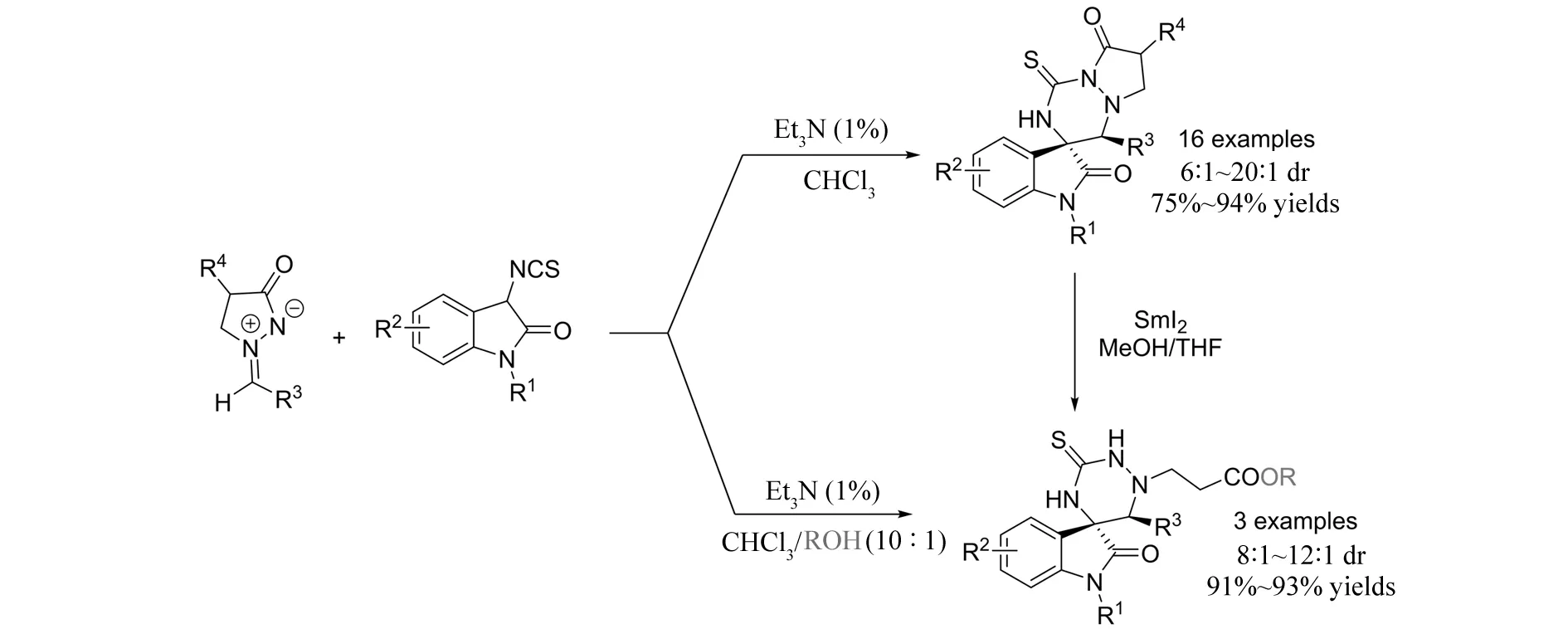
图28 3-异氰硫酸酯取代氧化吲哚与偶氮次甲基亚胺参与的[3+3]环加成反应Fig.28 [3+3] Annulation of 3-isothiocyanatooxindoles with azomethine imines
2014年,DU等[30]实现了碘化亚铜和DBU共催化的异氰与偶氮次甲基亚胺参与的[3+3]环加成反应(图29),以40%~93%的收率得到四氢哒嗪并吡唑酮类化合物,该化合物是很多天然产物的活性骨架,具有重要的生理活性[31]. 该反应进行的机理可能为:在CuI和DBU的作用下,异氰失去一个质子形成中间体A,然后A与偶氮次甲基亚胺发生加成反应生成中间体B,中间体B再经过分子内环化、质子化,最终得到目标产物.
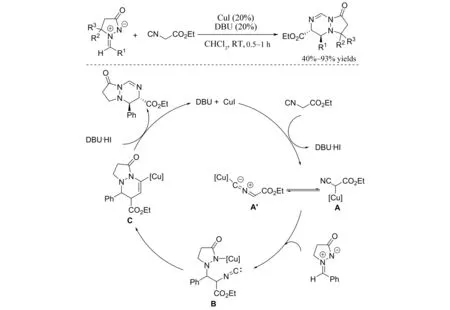
图29 偶氮次甲基亚胺与异氰参与的[3+3]环加成反应Fig.29 [3+3] Cycloaddition of azomethine imines with isocyanides
3 偶氮次甲基亚胺在[3+4]环加成反应中的研究进展
吡唑酮并七元环也是一类非常重要的活性骨架,它们可以被用做杀虫剂、杀螨剂、除草剂和乙酰辅酶羧化酶的抑制剂[32],因此发展高效的合成该类化合物的方法具有十分重要的理论价值和现实意义. 2014年,WANG等[33]报道了卡宾催化的β-甲基取代肉桂醛与偶氮次甲基亚胺参与的不对称[4+3]环加成反应(图30). 在手性卡宾的作用下,该反应不但能够顺利的进行,同时还起到动力学拆分的效果.
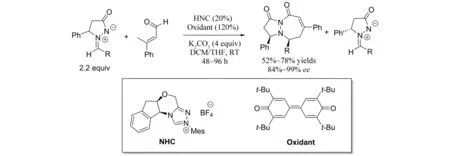
图30 氮杂卡宾催化的偶氮次甲基亚胺的[4+3]环加成反应和动力学拆分Fig.30 NHC-Catalyzed [4+3] cycloaddition and kinetic resolution of azomethine imines
4 偶氮次甲基亚胺在Mannich反应中的研究进展
偶氮次甲基亚胺由于C=N不饱和双键的存在,所以它也是一类很好的亲电试剂,可以发生Mannich反应. 2010年,SHINTANI等[34]报道了偶氮次甲基亚胺的不对称芳基化反应(图31). 在铑-手性二烯配合物的催化作用下,非常高效地得到双芳基取代的手性吡唑酮.
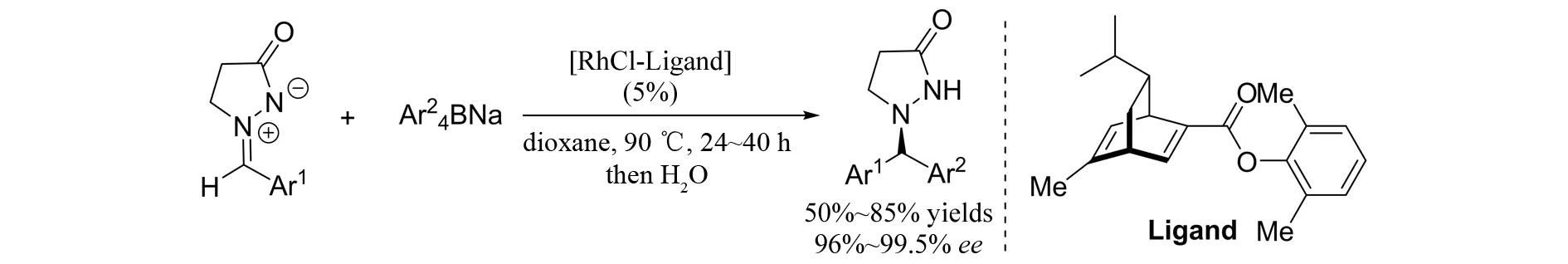
图31 偶氮次甲基亚胺的不对称芳基化反应Fig.31 Asymmetric arylation of azomethine imines
2014年,KONG等[35]报道了偶氮次甲基亚胺与二芳基磷氧、亚磷酸二甲酯参与的加成反应(图32). 在奎宁衍生的方酰胺催化剂的作用下,以非常好的结果得到氢膦酰化产物. 由于磷原子的引入致使该产物在药物化学领域具有潜在的应用价值.
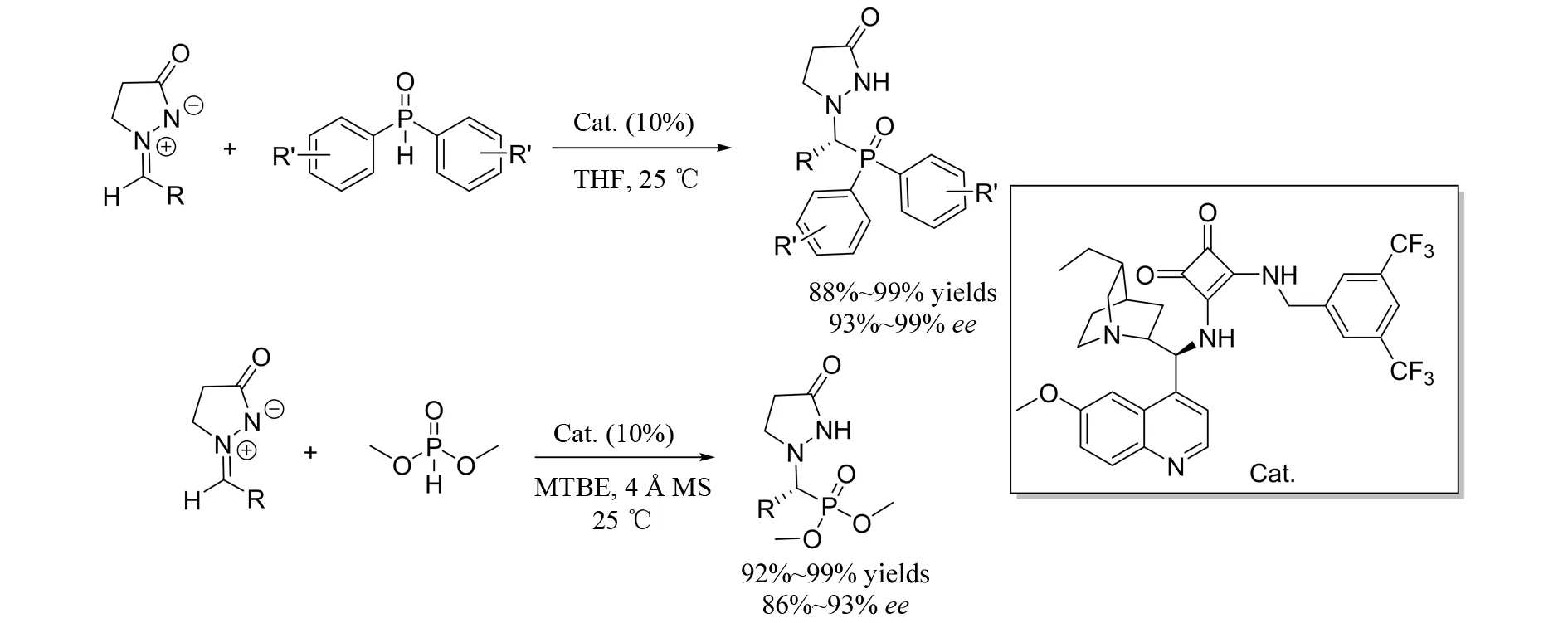
图32 偶氮次甲基亚胺参与的不对称氢膦酰化反应Fig.32 Asymmetric phosphination and hydrophosphonylation of azomethine imines
5 结论
综上所述,偶氮次甲基亚胺已成为构建吡唑酮稠环骨架的非常重要的合成子,由于其具有制备简单、易于储存、廉价易得等优点,近年来已经成为一个研究热点,由此涌现出大量高效的合成新反应. 但是在反应类型反面还不够全面,大多集中在[3+2]和[3+3]反应,而对于其参与的[3+4]和Mannich反应却研究较少. 另外,目前研究的偶氮次甲基亚胺多由吡唑酮与醛衍生而来,而对于吡唑酮与酮衍生的叶立德还未涉及,因此开发含有吡唑酮骨架的其他类型的叶立德也是需要进一步研究的问题.
[1] VARVOUNIS G, FIAMEGOS Y, PILIDIS G. Pyrazol-3-ones part 1: synthesis and applications [J]. Advances in Heterocyclic Chemistry, 2001, 80: 73-156.
[2] (a) JUNGHEIM L N, SIGMUND S K, FISHER J W. Bicyclic pyrazolidinones, a new class of antibacterial agent based on theβ-lactam model [J]. Tetrahedron Letters, 1987, 28(3): 285-288; (b) JUNGHEIM L N, SIGMUND S K. 1,3-Dipolar cycloaddition reactions of pyrazolidinium ylides with acetylenes. Synthesis of a new class of antibacterial agents [J]. The Journal of Organic Chemistry, 1987, 52(18): 4007-4013; (c) TERNANSKY R J, DRAHEIM S E, PIKE A J, et al. Structure-activity relationship within a series of pyrazolidinone antibacterial agents. 2. Effect of side-chain modification on in vitro activity and pharmacokinetic parameters [J]. Journal of Medicinal Chemistry, 1993, 36(22): 3224-3229; (d) KOSOWER E M, RADKOWSKY A E, FAIRLAMB A H, et al. Bimane cyclic esters, possible stereologues of trypa-nothione as antitrypanosomal agents [J]. European Journal of Medicinal Chemistry, 1995, 30(9): 659-671; (e) HANESSIAN S, MCNAUGHTON-SMITH G, LOMBART H G, et al. Design and synthesis of conformationally constrained amino acids as versatile scaffolds and peptide mimetics [J]. Tetrahedron, 1997, 53(38): 12789-12854.
[3] (a) DORN H, OTTO A. Stable azomethinimine und 1-substituierte 3-hydroxy-pyrazole durch dehydrierung 1-substituierter pyrazolidone-(3) [J]. Tetrahedron, 1968, 24(23): 6809-6811; (b) DORN H, OTTO A. Syntheses by means of 1-alkylidene- and 1-(arylalkylidene)-3-pyrazolidonee N,N-betaines, a new type of stable azomethine imine [J]. Angewandte Chemie International Edition, 1968, 7(3): 214-215.
[4] SHINTANI R, FU G C. A new copper-catalyzed [3+2] cycloaddition: enantioselective coupling of terminal alkynes with azomethine imines to generate five-membered nitrogen heterocycles [J]. Journal of the American Chemical Society, 2003, 125(36): 10778-10779.
[6] KELLER M, SIDO A S S, PALE P, et al. Copper(I) zeolites as heterogeneous and ligand-free catalysts: [3+2] cycloaddition of azomethine imines [J]. Chemistry-A European Journal, 2009, 15(12): 2810-2817.
[7] YOSHIMURA K, OISHI T, YAMAGUCHI K, et al. An efficient, ligand-free, heterogeneous supported copper hydroxide catalyst for the synthesis of N,N-bicyclic pyrazolidinone derivatives [J]. Chemistry-A European Journal, 2011, 17(14): 3827-3831.
[8] IMAIZUMI T, YAMASHITA Y, KOBAYASHI S. Group 11 metal amide-catalyzed asymmetric cycloaddition reactions of azomethine imines with terminal alkynes [J]. Journal of the American Chemical Society, 2012, 134(49): 20049-20052.
[9] ARAI T, OGINO Y, SATO T. Development of a tailor-made bis(oxazolidine)pyridine-metal catalyst for the [3+2] cycloaddition of azomethine imines with propiolates [J]. Chemical Communications, 2013, 49(71): 7776-7778.
[10] EFREMOVA M M, MOLCHANOV A P, STEPAKOV A V, et al. A highly efficient [3+2] cycloaddition of nitrile oxides and azomethine imines to N-vinylpyrroles [J]. Tetrahedron, 2015, 71(14): 2071-2078.
[11] LI F L, CHEN J F, HOU Y D, et al. 1,3-Dipolar cycloadditions of 4-acetoxy allenoates: access to 2,3-dihydropyrazoles, 2,3-dihydroisoxazoles and indolizines [J]. Organic Letters, 2015, 17(21): 5376-5379.
[12] CHEN W, YUAN X H, LI R, et al. Organocatalytic and stereoselective [3+2] cycloadditions of azomethine imines withα,β-unsaturated aldehydes [J]. Advanced Synthesis & Catalysis, 2006, 348(14): 1818-1822.
[13] CHEN W, DU W, DUAN Y Z, et al. Enantioselective 1,3-dipolar cycloaddition of cyclic enones catalyzed by multifunctional primary amines: beneficial effects of hydrogen bonding [J]. Angewandte Chemie International Edition, 2007, 46(40): 7667-7670.
[14] SIBI M P, RANE D, STANLEY L M, et al. Copper(II)-catalyzed exo and enantioselective cycloadditions of azomethine imines [J]. Organic Letters, 2008, 10(14): 2971-2974.
[15] OGAWA S, NISHIMINE T, TOKUNAGA E, et al. Expeditious synthesis of trifluoromethylated heterocycles: noncatalytic 1,3-dipolar cyclization of azomethine imines withα-trifluoromethylacrylates [J]. Synthesis, 2010(19): 3274-3281.
[16] XIN Y, ZHAO J W, GU J W, et al. Catalyst free 1,3-dipolar cycloaddition of 3-oxo-1,2-pyrazolidinium ylides toβ-trifluoroacetyl vinyl ethyl ether: Synthesis of 6-trifluoroacetyl substituted bicyclic pyrazolidinones [J]. Journal of Fluorine Chemistry, 2011, 132(6): 402-408.
[17] HONG L, KAI M, WU C Y, et al. Enantioselective 1,3-dipolar cycloaddition of methyleneindolinones and N,N′-cyclic azomethine imines [J]. Chemical Communications, 2013, 49(60): 6713-6715.
[18] LI J T, LIAN X J, LIU X H, et al. Nickel(II)-catalyzed enantioselective 1,3-dipolar cycloaddition of azomethine imines with alkylidene malonates [J]. Chemistry-A European Journal, 2013, 19(16): 5134-5140.
[19] LI Z, YU H, LIU H L, et al. Phosphine-catalyzed [3+2] cycloaddition reactions of azomethine imines with electron-deficient alkenes: a facile access to dinitrogen-fused heterocycles [J]. Chemistry-A European Journal, 2014, 20(6): 1731-1736.
[20] PAIR E, BERINI C, NOEL R, et al. Organocatalysed multicomponent synthesis of pyrazolidinones: Meldrum’s acid approach [J]. Chemical Communications, 2014, 50(71): 10218-10221.
[21] LIU W J, XU Y, SUN X X, et al. Catalyst-free synthesis of N-(1,7-dioxotetrahydropyrazolo[1,2-a]pyrazol-2-yl)benzamide derivatives by 1,3-dipolar cycloaddition and rearrangement [J]. Synlett, 2014, 25(8): 1093-1096.
[22] MONDAL M, WHEELER K A, KERRIGAN N J. Alkaloid-catalyzed enantioselective [3+2] cycloaddition of ketenes and azomethine imines [J]. Organic Letters, 2016, 18(16): 4108-4111.
[23] SHINTANI R, HAYASHI T. Palladium-catalyzed [3+3] cycloaddition of trimethylenemethane with azomethine imines [J]. Journal of the American Chemical Society, 2006, 128(19): 6330-6331.
[24] CHAN A, SCHEIDT K A. Highly stereoselective formal [3+3] cycloaddition of enals and azomethine imines catalyzed by N-heterocyclic carbenes [J]. Journal of the American Chemical Society, 2007, 129(17): 5334-5335.
[25] QIAN B, FAN M J, XIE Y X, et al. A novel one-pot, three-component synthesis of 5-imino-2,3,5,8-tetrahydropyrazolo[1,2-a]pyridazin-1-one derivatives [J]. Synthesis, 2009(10): 1689-1693.
[26] TONG M C, CHEN X, TAO H Y, et al. Catalytic asymmetric 1,3-dipolar cycloaddition of two different ylides: facile access to chiral 1,2,4-triazinane frameworks [J]. Angewandte Chemie International Edition, 2013, 52(47): 12377-12380.
[27] FANG X, LI J, TAO H Y, et al. Highly diastereoselective DABCO-catalyzed [3+3]-cycloaddition of 1,4-dithiane-2,5-diol with azomethine imines [J]. Organic Letters, 2013, 15(21): 5554-5557.
[28] QIAN Y, ZAVALIJ P J, HU W H, et al. Bicyclic pyrazolidinone derivatives from diastereoselective catalytic [3+3]-cycloaddition reactions of enoldiazoacetates with azomethine imines [J]. Organic Letters, 2013, 15(7): 1564-1567.
[29] ZHU G M, SUN W S, WU C Y, et al. Base-catalyzed diastereoselective [3+3] annulations of 3-isothiocyanatooxindoles and azomethine imines [J]. Organic Letters, 2013, 15(19): 4988-4991.
[30] DU J, XU X X, LI Y F, et al. [3+3]-Cycloaddition reactions ofα-acidic isocyanides with 1,3-dipolar azomethine imines [J]. Organic Letters, 2014, 16(15): 4004-4007.
[31] (a) KELLY T R, ELLIOTT E L, LEBEDEV R, et al. Synthesis of the pyrazolo[4,3-e][1,2,4]triazine family of natural products: Nostocine A, Fluviol A, and Pseudoiodinine [J]. Journal of the American Chemical Society, 2006, 128(17): 5646-5647; (b) YE L, HADDADIN M J, LODEWYK M W, et al. Cyclopenta[b]pyrroles from triazines: synthetic and mechanistic studies [J]. Organic Letters, 2010, 12(1): 164-167; (c) EGOROV I N, TSEITLER T A, KOVALEV I S, et al. Chichibabin-type condensation of cyclic ketones with 3-R-1,2,4-triazin-5(H)-ones [J]. The Journal of Organic Chemistry, 2012, 77(14): 6007-6013; (d) BLAIR L M, SPERRY J. Natural products containing a nitrogen-nitrogen bond [J]. Journal of Natural Products, 2013, 76(4): 794-812.
[32] KAMATA M, YAMASHITA T, KINA A, et al. Symmetrical approach of spiro-pyrazolidinediones as acetyl-CoA carboxylase inhibitors [J]. Bioorganic & Medicinal Chemistry Letters, 2012, 22(14): 4769-4772.
[33] WANG M, HUANG Z J, XU J F, et al. N-Heterocyclic carbine-catalyzed [3+4] cycloaddition and kinetic resolution of azomethine imines [J]. Journal of the American Chemical Society, 2014, 136(4): 1214-1217.
[34] SHINTANI R, SOH Y T, HAYASHI T. Rhodium-catalyzed asymmetric arylation of azomethine imines [J]. Organic Letters, 2010, 12(18): 4106-4109.
[35] KONG L P, LI N K, ZHANG S Y, et al. Highly enantioselective phosphination and hydrophosphonylation of azomethine imines: using chiral squaramide as a hydrogen bonding organocatalyst [J]. Organic & Biomolecular Chemistry, 2014, 12(43): 8656-8670.
[责任编辑:张普玉]
Research progress on the application of azomethine imines as synthons in organic synthesis
YUAN Beibei, LI Yaning, GUO Jiaomei, WANG Qilin*, BU Zhanwei*
(HenanProvinceEngineeringLaboratoryofFlameRetardantandFunctionalMaterials,CollegeofChemistryandChemicalEngineering,HenanUniversity,Kaifeng475004,Henan,China)
Azomethine imines are a kind of important synthons for the construction of fused pyrazolones, which were extensively studied in organic synthesis. Due to the inherent advantages of easy availability and low cost, significant attention has been paid to their application as synthons in organic synthesis. This review summarizes the progress on the application of azomethine imines in [3+2], [3+3] and [3+4] cycloadditions as well as Mannich reactions. It would provide a reference for exploring new reactions and novel 1,3-dipoles containing pyrazolone motifs.
azomethine imines; fused cycle; synthon; cycloaddition
2016-10-08.
国家自然科学基金(U1504206).
袁贝贝(1995-), 女, 研究方向为有机合成,不对称催化.*
, E-mail:wangqilin@henu.edu.cn.
O621.3
A
1008-1011(2017)02-0135-15