提取缓冲液pH值对植物组织中SOD、POD和CAT酶活性的影响
龚屾,石英,韩毅强,高亚梅,郑殿峰,杜吉到
(黑龙江八一农垦大学农学院,大庆 163319)
提取缓冲液pH值对植物组织中SOD、POD和CAT酶活性的影响
龚屾,石英,韩毅强,高亚梅,郑殿峰,杜吉到
(黑龙江八一农垦大学农学院,大庆 163319)
植物组织中SOD、POD和CAT活性测定对于研究植物抗逆性极其重要。为了简化实验,利用比色法研究了四种作物在正常水分条件下和干旱胁迫下,不同pH值提取缓冲液对SOD、POD和CAT酶活性的影响。结果表明,SOD不适合在低pH值(6.0)提取缓冲液下提取,POD不适合在pH 7.0的提取缓冲液下提取,CAT可以应用三种提取缓冲液中的任意一种,对酶活性均影响不大。综上所述,SOD、POD和CAT三种酶活均可以应用pH 7.8缓冲液提取,不会显著影响实验结果,提高测定效率。
抗氧化;酶活性;超氧化物歧化酶;过氧化物酶;过氧化氢酶
氧气是需氧生物所必须的物质,如果植物在生长过程中遭受到外界干旱、水淹、冷冻等环境胁迫,植物对光能的吸收效率会下降,体内CO2固定受阻,最终O2被作为电子受体形成O2-产生大量的活性氧(reactive oxygen species,ROS)[1]。活性氧过度积累对植物产生严重伤害,甚至死亡。超氧化物歧化酶(SOD)催化O2·-分解生成H2O2,胞内过氧化氢酶(CAT)和过氧化物酶(POD)能够清除H2O2,它们共同形成重要的植物活性氧清除系统[2-3]。SOD、CAT和POD在生物学抗性研究中成为一个非常关键性的指标,为了提高植物的活性氧清除系统,人们采用改变水肥[4-5]、施用激素[6]以及转基因[7]等技术来提高植物的抗逆性。酶活性的测量有化学滴定法、比色法、电化学法和放射化学测定法等多种方法[8-9]。SOD、CAT和POD均可以通过比色法测定,测定方法简便易行被研究人员广泛采用[10],三种酶在提取和测定时使用的缓冲溶液均可为磷酸缓冲溶液,仅pH值有差别。为了进一步简化方法、减小误差、减少工作量,实验设计了不同pH的提取缓冲液体系,以研究提取缓冲液pH对酶活性的影响。
1 材料与方法
1.1 供试材料
实验材料选取健康的大豆(嫩丰18)、水稻(垦鉴稻10)、小麦(垦大13)和玉米(郑单958)种子。使用10%的双氧水浸泡10 min,无菌水冲洗3次,播种于蛭石与土比例为3∶1的种植钵中,发芽15 d后,将各作物材料的1/2进行水分胁迫管理,另外1/2正常水分管理,处理10 d后,取长势一致,同一部位的叶片置于液氮中30 min,保存于-80℃冰箱备用。
1.2 酶活测定方法
SOD活性采用核黄素-NBT法测定[11],活性单位以抑制NBT光化还原50%所需酶量为1个酶活单位(u)。CAT活性采用紫外吸收法测定[12-13],以每min内A240减少0.1的酶量为一个酶活单位(u)。POD活性采用愈创木酚法测定[14],酶活性计算:以每分钟OD值变化(升高)0.1为1个酶活性单位(u)。
1.3 提取缓冲液和反应缓冲液的配方
实验对照组为SOD酶活测定使用的提取和反应缓冲液是50 mmol·L-1pH 7.8磷酸缓冲液[11],CAT酶活测定的提取和反应缓冲液使用的是50 mmol·L-1pH 7.0磷酸缓冲液[12-13],POD酶活测定的提取和反应缓冲液使用的是50 mmol·L-1pH 6.0磷酸缓冲液[11]。实验处理组为反应液不变,提取液采用不同pH的磷酸缓冲液,设计如表1。
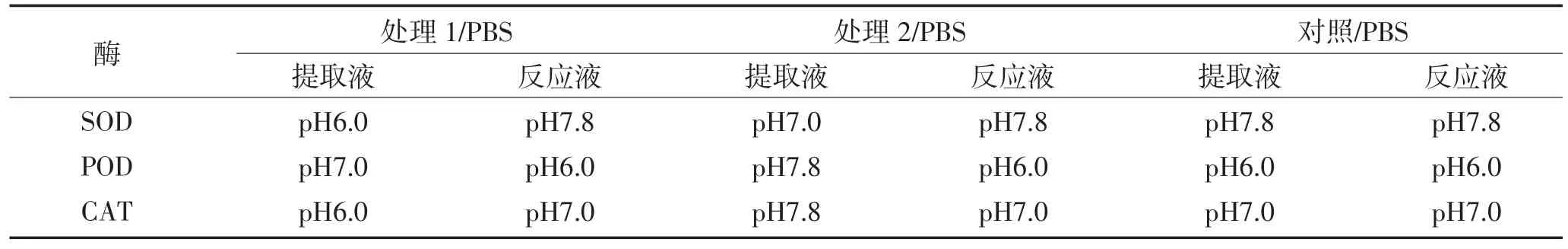
表1 实验设计方案Table 1 Design scheme of experiment
1.4 数据分析
用Microsoft Excel 2010软件录入数据和作图,采用SPSS19.0中Duncan检测进行差异显著性检验分析。
2 结果与分析
2.1 不同pH磷酸提取缓冲液对SOD活性的影响
利用不同pH磷酸提取缓冲液测定的SOD酶活性的结果见图2,在正常测定条件下(pH 7.8),干旱处理的大豆、水稻和玉米三种作物的SOD酶活性均显著高于正常水分处理,小麦没有显著变化。磷酸提取缓冲液为(pH 7.0)时,变化与对照相同。并且不论正常水分处理还是干旱处理,四种作物的SOD酶活性均与对照无显著差异。但是,当磷酸提取缓冲液为(pH 6.0)时水稻和玉米干旱处理和正常水分处理间的SOD酶活性变化不显著,小麦的出现显著差异,这些与对照(pH 7.8)不同。同时,小麦正常水分处理时磷酸提取缓冲液为(pH 6.0)测得的酶活显著低于正常测定条件下(pH 7.8)和pH 7.0处理;水稻的干旱条件下pH 6.0处理也显著低于其他两个处理。
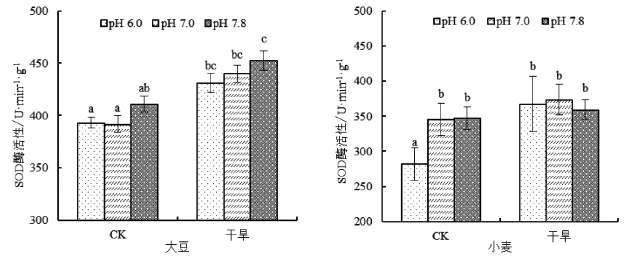
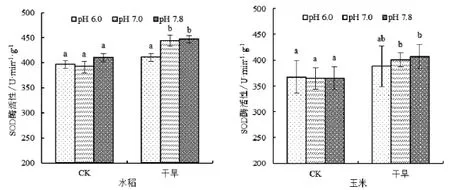
图1 不同提取液pH值对四种作物SOD酶活性的影响Fig.1 Effect of different pH of extraction buffer on enzyme activity of SOD of four crops
2.2 不同pH磷酸提取缓冲液对POD活性的影响
研究发现磷酸提取缓冲液pH值为7.0时,四种作物两种处理的POD酶活性都低于正常提取条件下(pH6.0)POD酶活性,其中大豆、小麦和水稻的POD酶活性显著低于正常提取条件下(pH6.0)。并且小麦中水分不同造成的差异也不相同。而当磷酸提取缓冲液pH值为7.8时,所有作物和的POD酶活性都与正常提取条件下(pH6.0)POD酶活性无显著变化,同时干旱胁迫形成的差异与正常提取条件下(pH6.0)形成的差异相同。干旱条件下,大豆POD酶活性差异最大,小麦其次,水稻和玉米无显著变化。
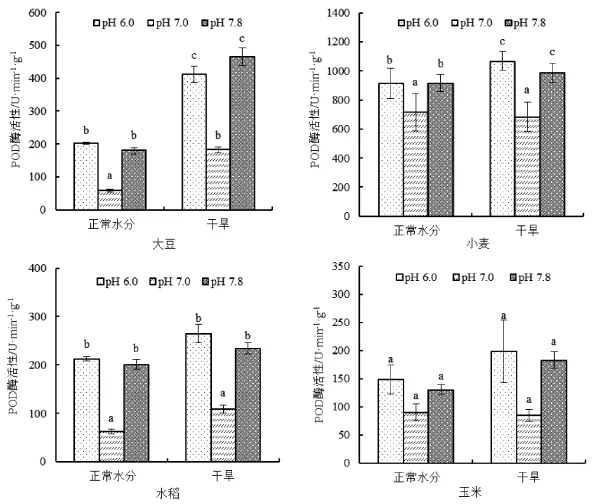
图2 不同提取液pH值对四种作物POD酶活性的影响Fig.2 Effect of different pH of extraction buffer on enzyme activity of POD of four crops
2.3 不同pH磷酸提取缓冲液对CAT活性的影响
研究发现磷酸提取缓冲液pH值对CAT活性的影响较小,同种作物和同样的水分条件下不同pH值提取缓冲液对CAT活性无显著影响,并且两种水分条件下的CAT活性差异变化均相同,见图3。干旱处理显著增加了水稻、小麦和玉米CAT活性,水稻影响最大,增加2倍左右,对大豆无显著影响。
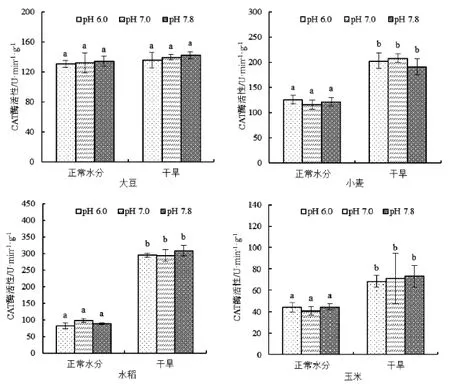
图3 不同提取液pH值对四种作物CAT酶活性的影响Fig.3 Effect of different pH of extraction buffer on enzyme activity of CAT of four crops
3 结论与讨论
在植物抗性研究中,准确快捷获得酶活力大小的方法是所有研究领域科学家希望获得的。植物样品在进行酶活性测定时都需要破碎细胞和提取,提取液中一些成分对酶活的测定也有影响,有人通过简单分离纯化的手段将影响物质去除以达到更好的测定效果[15]。汪俏梅等[16]在研究1-甲基环丙烯对青花菜衰老延缓作用时对三种抗氧化酶进行了联合测定,但并未给出相应的理论依据。实验结果表明,提取缓冲液pH值对CAT没有显著影响,低pH值影响一些植物SOD酶活性,而pH值为7.0时POD酶活性在大豆、小麦和水稻三种植物中均显著低于正常处理。究其原因,认为可能来自于两个方面,首先一些酶对低pH值耐受性较差,例如SOD[17];其次,酶在其等电点时溶解度最低,SOD的等电点PI 4.9,低pH值影响SOD的提取,POD的等电点PI 7.0,在等电点处提取酶的效率是最低的,提取液中酶的提取量直接影响的酶活性表征。SOD、POD、CAT作为ROS系统中的最主要的酶,是科研的重要指标。以往根据三种酶反应的最适pH设定相应的提取液的pH[14],三种酶液的提取都是分开的,这为三种酶活性的测定增加了工作量。对实验的结果进一步分析发现,三种酶在提取缓冲液pH 7.8时可以获得较高的酶活性,可以准确测量。这样可一次提取三种酶的提取液用于酶活测定,减少提取次数,简化实验。
作物干旱条件下,SOD将O2·-分解生成H2O2,而H2O2除本身对细胞有毒害外,还可在Fe2+、Mn2+等的参与下,通过Haber-Weiss反应生成毒害更强的·OH[18]。CAT直接催化H2O2分解为H2O和O2,而POD是一种以血红素为辅基的酶,通过催化H2O2与有机无机氢供体发生氧化还原反应,以消耗H2O2。它们在阻断自由基链式反应中还起着承上启下的作用。研究发现干旱条件下大豆中POD活性显著高于正常水分。而CAT活性没有显著改变,说明在大豆中POD在清除H2O2能力方面强于CAT。同样的干旱条件下水稻和玉米的CAT活性显著高于正常水分,而POD活性没有显著改变,说明在水稻和玉米中CAT在清除能力方面强于POD。他人在研究植物与微生物共生过程中活性氧网络时也发现了CAT和POD清除H2O2能力不同的情况[3]。小麦中POD和CAT活性均显著高于正常水分,表明这两种酶在清除H2O2均有作用,但小麦中POD活性远远高于其他三种作物,POD可能更加重要。
[1] Ort D R,Baker N R.A photoprotective role for O(2)as an alternative electron sink in photosynthesis[J].Curr Opin Plant Biol,2002(3):193-198.
[2] Quan L J,Zhang B,Shi W W,et al.Hydrogen peroxide in plants:a versatile molecule of the reactive oxygen species network[J].Journal of Integrative Plant Biology,2008,50(1):2-18.
[3] Nanda A K,Andrio E,Marino D,et al.Reactive oxygen species during plant-microorganism early interactions[J]. Journal of Integrative Plant Biology,2010,52(2):195-204.
[4] 张智猛,戴良香,宋文武,等.干旱处理对花生品种叶片保护酶活性和渗透物质含量的影响[J].作物学报,2013,39(1):133-141.
[5] 战秀梅,韩晓日,杨劲峰,等.不同施肥处理对玉米生育后期叶片保护酶活性及膜脂过氧化作用的影响[J].玉米科学,2007,15(1):123-127.
[6] 郑殿峰,赵黎明,冯乃杰.植物生长调节剂对大豆叶片内源激素含量及保护酶活性的影响[J].作物学报,2008,34(7):1233-1239.
[7] 成雨洁.转不同外源基因提高薯类作物抗逆能力的研究[D].杨凌:西北农林科技大学,2014.
[8] 王华芳,展海军.过氧化氢酶活性测定方法的研究进展[J].科技创新导报,2009(19):7-8.
[9] 王伟玲,王展,王晶英.植物过氧化物酶活性测定方法优化[J].实验室研究与探索,2010,29(4):21-23.
[10] 林植芳,刘楠.活性氧调控植物生长发育的研究进展[J].植物学报,2012,47(1):74-86.
[11] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2004.
[12] 李璇,王升,岳红,等.不同pH值和酶提取体系对丹参抗氧化酶活性的影响[J].中国现代中药,2011,13(12):46-49.
[13] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[14] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[15] Banowetz G M,Dierksen K P,Azevedo M D,Stout R.Microplate quantification of plant leaf superoxide dismutases[J].Anal Biochem,2004,332(2):314-320.
[16] 汪俏梅,郭得平,Kyikyi Win,等.1-甲基环丙烯延缓青花菜衰老的效应及机理[J].园艺学报,2004,31(2):205-209.
[17] Nagi M N,Albekairi A M,Alsawaf H A.Spectrophotometric assay for superoxide dismutase based on the nitroblue tetrazolium reduction by glucose-glucose oxidase[J].Biochem Mol Biol Int,1995,36(3):633-638.
[18] 宋道军,李红,余增亮.N~+离子注入对不同辐射敏感性微生物超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性的影响[J].生物物理学报,1998,14(2):325-330.
Effect of pH of Extraction Buffer on SOD,POD and CAT in the Plant Tissue
Gong Shen,Shi Ying,Han Yiqiang,Gao Yamei,Zheng Dianfeng,Du Jidao
(College of Agronomy,Heilongjiang Bayi Agriculture University,Daqing 163319)
Enzyme activity measurement of SOD,POD and CAT was important for study of plant stress-tolerance.To simplify the experiment,effect of different extraction buffer on enzyme activity measurement of SOD,POD and CAT was analyzed in four crops under normal condition and drought stress by photocolorimetric method.Results showed that the extraction of SOD was unsuitable in low pH (6.0)buffer,and the extraction of POD was unsuitable in pH 7.0 buffer,and the extraction of CAT could be carried out in three buffers,which had no effect on enzyme activity of CAT.Above all,pH 7.8 buffer could be applied for extraction of SOD,POD and CAT,and had no obvious effect on result of measurement,and it would improve efficiency of activity measurement of those enzymes.
Antioxidation;Enzyme activity;SOD;POD;CAT
Q4-33/S-3
A
1002-2090(2017)02-0008-05
10.3969/j.issn.1002-2090.2017.02.002
2016-03-26
国家自然科学基金项目(31271652);大庆市指导性科技计划项目(zd-2016-041)。
龚屾(1989-),男,黑龙江八一农垦大学农学院2013级硕士研究生。
郑殿峰,男,教授,E-mail:zdffnj@263.net。

