新型分散液液微萃取-GC/MS检测水中三唑类农残
李祖光,宋志宇,劳家正,聂 晶,叶静青,韦其真,倪 琳,邓丰涛(.浙江工业大学 化学工程学院,浙江 杭州 3004;.聚光科技(杭州)股份有限公司,浙江 杭州 3005)
新型分散液液微萃取-GC/MS检测水中三唑类农残
李祖光1,宋志宇1,劳家正1,聂 晶1,叶静青1,韦其真1,倪 琳1,邓丰涛2
(1.浙江工业大学 化学工程学院,浙江 杭州 310014;2.聚光科技(杭州)股份有限公司,浙江 杭州 310052)
建立了一种基于冒泡辅助的新型分散液液微萃取技术结合GC-MS用于测定水中的四种三唑类杀菌剂的分析测试方法.以低密度的甲苯作为萃取剂,替代了具有一定毒性的卤代烷烃萃取剂;通过磷酸二氢钠粉末和无水碳酸钠粉末在水溶液中反应产生CO2的方式进行破乳,取代传统的离心破乳.对影响萃取结果的影响因素进行了优化,在最优条件下,腈菌唑、戊唑醇、氟环唑和苯醚甲环唑的检出限分别为0.024,0.011,0.014,0.012 μg/L,富集倍数为866~1 226.加标回收率在86.7%~115.8%之间,RSD(n=7)在9.93 %~17.28 %之间.实验结果表明:冒泡辅助分散液液微萃取技术是一种简便、高效、相对绿色环保且具有现场分析潜力的样品前处理方法,已成功应用于自来水中三唑类杀菌剂残留的分析.
冒泡破乳;分散液液微萃取;三唑类农药;低密度萃取剂;气相色谱-质谱法
农药的使用在保障农作物丰产方面做出了重大贡献,但如果农药使用不当,则会对环境和农作物造成污染,影响食品和生态安全.随着人们生活水平的提高和对农药残留危害意识的增强,农药残留的分析日益成为社会关注的热点.三唑类农药是一类新型的杀菌剂,不仅具有杀菌的作用,还具有调节植物生长的作用,目前在蔬菜、水果等生产中得到广泛地应用[1];三唑类杀菌剂是抑制锈病、白粉病、胡麻叶斑病和灰心斑病的常用农药[2-3].随着三唑类农药越来越广泛的使用,在食物和水体中已经发现三唑类农药残留,三唑类农药对生态系统和人类健康的毒害作用也越来越受到关注[4-6].因此,迫切需要建立一种简便快速,高效和绿色环保的三唑类农药残留分析方法应用于食品安全和环境监测.目前,对三唑类杀菌剂的检测已经有了一些报导.例如固相萃取[7-9],固相微萃取[10-11]等.分散液-液微萃取是一种快速、简单的分析方法,它只需使用微量的有机萃取剂即能获取良好的萃取结果,并用于三唑类农药残留的分析,例如超声辅助乳化微萃取[12],均质液-液萃取[13],空气辅助液-液微萃取[14],硅烷化萃取容器-分散液液微萃取[15]等.
针对传统分散液-液相微萃取技术进行改进,建立了一种快速简便、环境友好的“冒泡辅助分散液-液微萃取”方法,结合GC-MS用于水中三唑类农残的分析检测.该方法使用粉末状的CO2源(无水Na2CO3)和质子源(NaH2PO4)混合后在水中反应生成极为微小和均匀的二氧化碳气泡,低密度的甲苯萃取剂能够附着在气泡上完成对三唑类农药目标物的萃取,从而达到从水体中萃取和富集三唑类农药的目的.
1 实验部分
1.1 仪器与试剂
GC 2000-Mars 6 100气相色谱-质谱联用仪(配有电子轰击离子源(EI)),聚光科技(杭州)股份有限公司;AL 204型电子分析天平,梅特勒-托利多仪器(上海)有限公司;SY-360型超声波清洗器,上海宁商超声仪器有限公司;自制分散液相微萃取玻璃装置.
腈菌唑(99.5%)、戊唑醇(98.5%)、氟环唑(99.5%)和苯醚甲环唑(98.5%)标准试剂购自Dr. Ehrenstorfer GmbH(德国,奥格斯堡).甲苯、正己烷、环己烷、乙腈、乙酸乙酯、甲醇和丙酮,均为分析纯,采购自杭州华东医药股份有限公司;无水碳酸钠、柠檬酸、磷酸二氢钠、碳酸氢钠和无水硫酸钠采购自上海试四赫维化工有限公司;超纯水,美国Millipore公司.
1.2 仪器工作条件
1.2.1 色谱条件
毛细管色谱柱:Rxi-5 MS石英毛细管柱(30 m×0.25 mm×0.25 μm);升温程序:起始温度为180 ℃,保持1 min,以5 ℃/min升至200 ℃,保持1 min,再以2 ℃/min升至220 ℃,最后以10 ℃/min升至290 ℃,保持6 min.高纯氦气(99.999%)为载气,流速为1.0 mL/min;进样口温度:280 ℃;不分流进样;进样量:1.0 μL;0.75 min后以20 mL/min进行载气吹扫.
1.2.2 质谱条件
电子轰击(EI)离子源;电子能量70 eV;离子阱温度180 ℃;歧管温度为50 ℃;传输线温度250 ℃;扫描速度为3 scans/s,溶剂延迟3 min.采用SIM模式扫描:1) 腈菌唑3~15.5 min:179m/z,152m/z;2) 戊唑醇15.5~18.43 min:125m/z,250m/z;3) 氟环唑:18.43~20 min:192m/z,138m/z;4) 苯醚甲环唑20~29.0 min:265m/z,323m/z.
1.3 样品前处理方法
1) 自来水样处理:取杭州市下城区自来水,经0.22 μm过滤器过滤后备用.
2) 萃取步骤:将55 μL甲苯和2.2 mL乙腈混合均匀后,加入20.0 mL水样后摇匀3 min成为奶白色的乳化溶液.准确称取2.640 g磨成粉末状的磷酸二氢钠和1.060 g无水碳酸钠,混匀,装入自制分散微萃取装置底部.然后,再将上述乳化溶液倒入该分散微萃取装置;随后反应立即开始,大量细小的二氧化碳气泡从水体中冒出并夹带着甲苯聚集在水的表面,随着反应的进行,溶液逐渐澄清;待反应结束完成后,向细长管处加入去离子水抬高液面,接着用微量进样针从窄颈取出上层甲苯有机层,转移至装有少量无水硫酸钠的0.5 mL PCR管中,除去有机相中含有的微量水分.最后,用另一支进样针抽取1 μL有机相注入GC-MS中进行检测分析.萃取过程如图1所示.
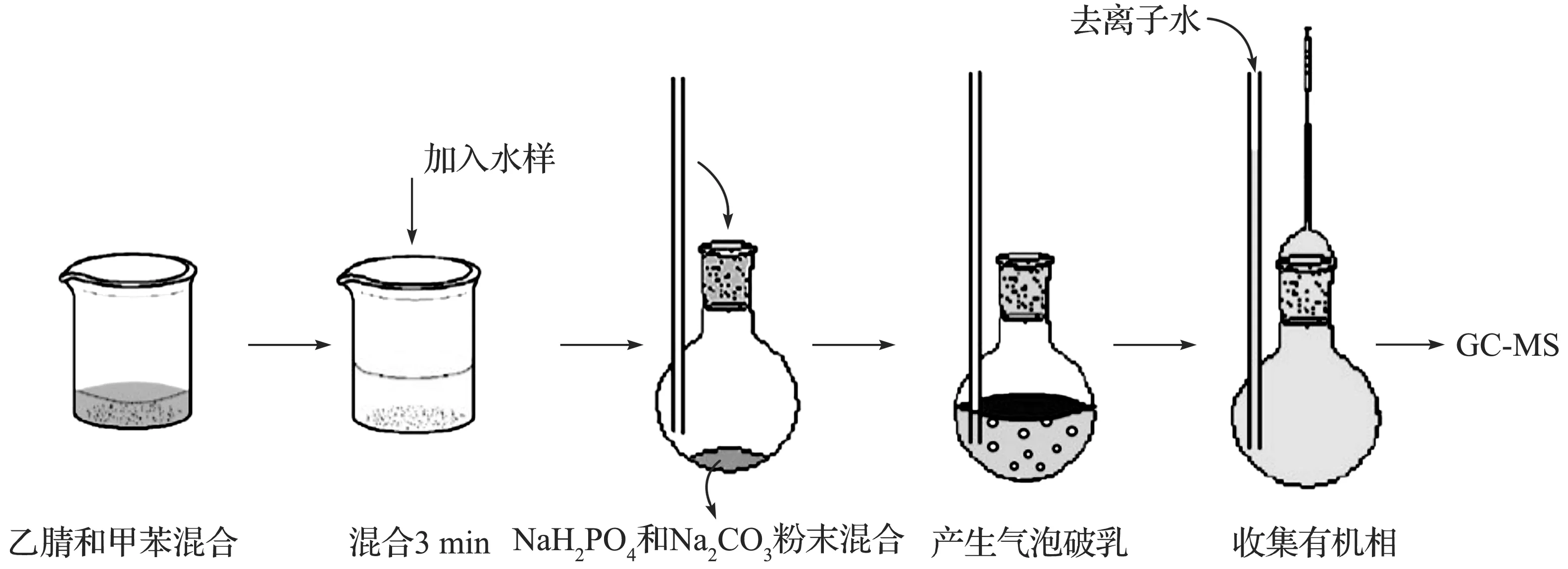
图1 EA-DLLME萃取流程图Fig.1 Schematic of triazoles extraction from tap water by EA-DLLME
2 结果与讨论
2.1 EA-DLLME实验条件优化
2.1.1 CO2源和质子源的选择
采用无水碳酸钠和碳酸氢钠作为CO2源,质子源采用柠檬酸和磷酸二氢钠,分别两两组合进行了四组优化实验,保持每次生成的CO2体积相同.结果表明:当柠檬酸作为质子源时,冒泡反应比磷酸二氢钠作为质子源时更剧烈,产生的气泡更大,但萃取效果却比磷酸二氢钠差;CO2源选用碳酸钠的萃取效果优于碳酸氢钠,所以最终选择无水碳酸钠作为CO2源和磷酸二氢钠作为质子源.
2.1.2 质子源与CO2源配比的优化
在质子源与CO2源粉末按摩尔比完全反应的基础之上,分别进行质子源粉末过量10%(酸性)、CO2源粉末过量10%(碱性)的优化实验.即:660.0 mg的NaH2PO4对应265.0 mg的Na2CO3,600.0 mg的NaH2PO4对应291.5 mg的Na2CO3,600.0 mg的NaH2PO4对应265.0 mg的Na2CO3的对照试验,平行实验两次,结果如图2所示.实验结果表明质子源粉末过量10%时萃取效率更佳.
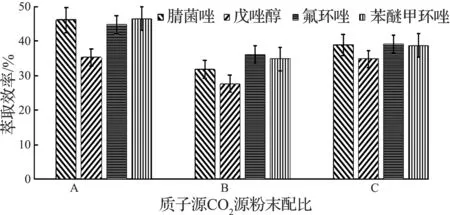
A—质子源过量10%;B—CO2源过量10%;C—化学计量比图2 质子源与CO2源配比的优化Fig.2 The radio of proton source and carbon dioxide
2.1.3 CO2的量(粉末加入量)的优化
为了考察CO2的生成量对萃取结果的影响,选择适量的粉末分别产生1,2,3,4,5 mol的CO2气体量,即无水硫酸钠的质量为265,530,795,1 060,1 325 mg,对应的磷酸二氢钠分别为660,1 320,1 980,2 640,3 300 mg,进行实验考察.结果如图3所示,CO2气体量在4 mol时萃取结果最优.当粉末的加入量越多,生成的CO2气体越多,有利于破乳,但是加入过多粉末时,会使得溶液的离子强度和粘度增加,而影响萃取效率.
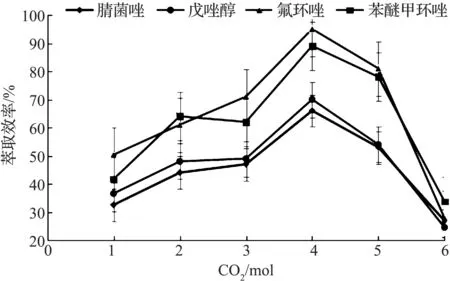
图3 CO2量的优化Fig.3 The optimization of the amount of carbon dioxide
2.1.4 萃取剂和分散剂的选择
萃取剂在分散液液微萃取过程中直接影响目标物的萃取效率.采用甲苯(ρ=0.87 g/mL)、环己烷(ρ=0.78 g/mL)、正己烷(ρ=0.66 g/mL)三种低密度溶剂作为萃取剂进行优化.其中,三种萃取剂在收集到相同体积上层(15±1) μL时所用体积分别为甲苯60 μL,正己烷70 μL,环己烷90 μL.综合考虑萃取剂的用量及萃取效率,选择甲苯作为后续实验的萃取剂.
分散剂的选择将直接影响“萃取剂/分散剂/水”三相乳浊液体系的形成,间接影响萃取的结果.考察了甲醇、丙酮和乙腈四种溶剂作为分散剂,在体积均为2 mL时分别进行实验,结果如图4所示.由图4可知:当采用乙腈为分散剂时,萃取效率最高.
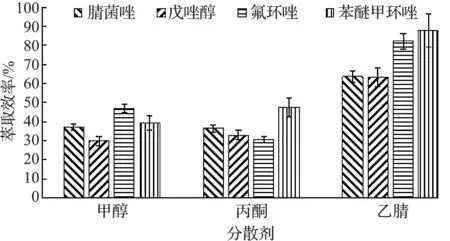
图4 分散剂的选择Fig.4 The selection of dispersant
2.1.5 萃取时间的优化
在EA-DLLME方法中,萃取时间是指水相溶液/萃取剂/分散剂三相体系从混合开始到冒泡反应破乳结束后所需要的时间.对萃取时间进行优化,以提高方法的效率.选择萃取时间分别为1,2,3,4,5 min,比较萃取效率受萃取时间的影响,结果见图5.由图5可知:在3 min前,三唑类农药的萃取率随着萃取时间增加而增加,这是因为这一阶段萃取时间过短,乳化作用不充分;当萃取时间大于3 min以后,萃取率下降,这是因为萃取时间过长会导致甲苯有机相的挥发损失.因此综合考虑,选择萃取时间为3 min.
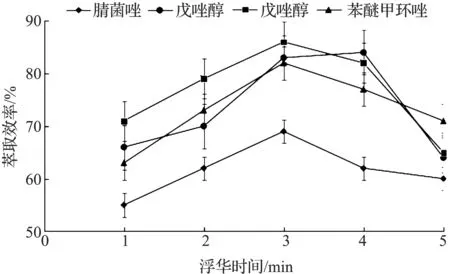
图5 乳化时间的优化Fig.5 The optimization of emulsification time
2.1.6 萃取剂和分散剂体积的选择
萃取剂的用量与萃取效率和富集倍数直接相关,适当减少萃取剂的用量,可获得更高的富集倍数,但同时需确保上层有机相有足够的体积以便于收集.考察了萃取剂甲苯体积分别为50,55,60,65 μL时对萃取结果的影响.当萃取剂体积为50 μL时,所得到的上层有机相的量过少,不方便收集;当甲苯体积大于55 μL时,富集倍数随着萃取剂体积的增加而下降.综合考虑,甲苯体积为55 μL时最优.
为选择最优的分散剂体积,设置五个不同水平(1.6,1.8,2.0,2.2,2.4 mL)进行实验.实验结果:2.2 mL时萃取效果最好,因此最后选择2.2 mL作为分散剂体积.
2.2 标准曲线与检出限
采用4种三唑类杀菌剂质量浓度为0.2,0.5,1.0,2.0,5.0,10.0,20.0,50.0,100.0 μg/L的加标自来水为研究对象,在已优化好的条件下进行测定分析,以三唑的峰面积的比值(y)对质量浓度(x)做线性回归方程,平行测定3次,得出线性回归方程和相关系数,分别以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)作为定性检出限(LODs)和定量检出限(LOQs),结果见表1.四种三唑类杀菌剂的线性范围为0.2~100 μg/L,相关系数为0.986 6~0.995 3,定性检出限和定量检出限分别为0.011~0.024,0.038~0.077 μg/L.为了测定该方法的相对标准偏差,本实验选取其中一组加标质量浓度为100 μg/L的加标自来水平行测定7次,得到的RSD%值为9.93%~17.28%,富集倍数为866~1 226.
2.3 回收实验
选用空白自来水为基质,加入不同质量浓度水平的三唑类杀菌剂标准溶液,加入质量浓度为0.2,10.0,100.0 μg/L,按优化后实验条件进行测定分析,平行测定5次,得到相应的回收率和精密度,结果见表2.
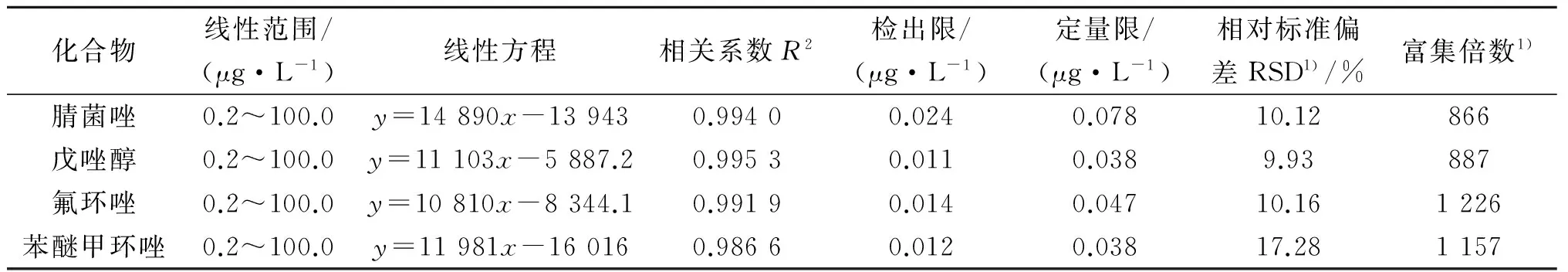
表1 四种三唑的线性范围、检出限、定量限和相对标准偏差Table 1 LODs, LOQs, liner range and RSDs of four triazoles
注:1) 以100 μg/L加标自来水计算得到(n=7).
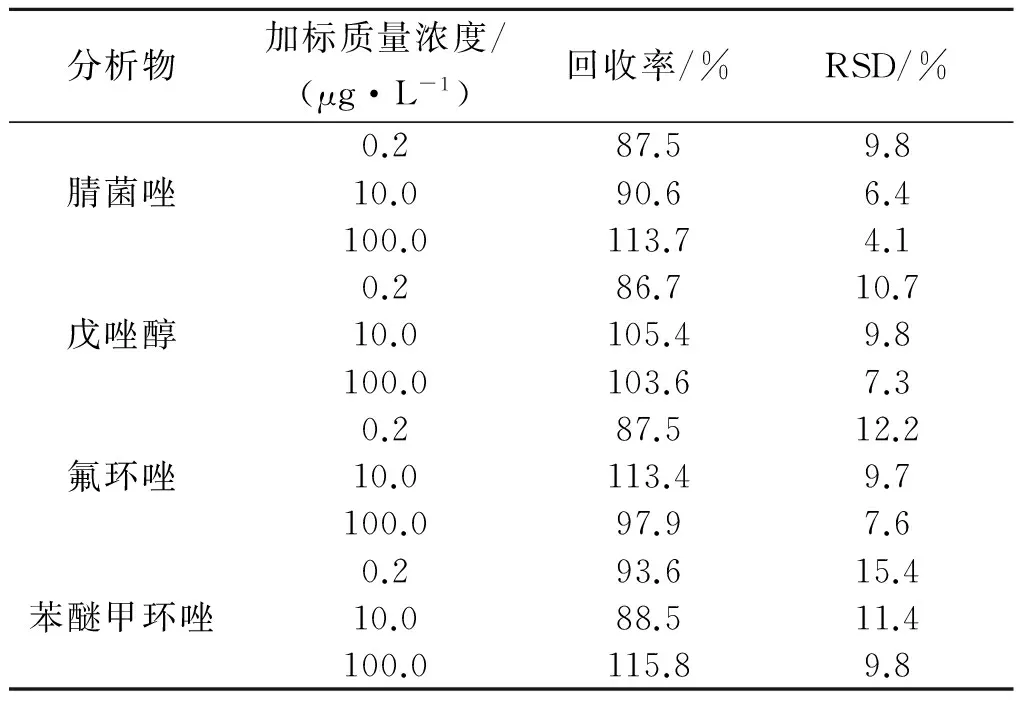
表2 回收率试验结果(n=5)Tab.2 Results of tests for recovery
2.4 真实样品分析
采用该方法检测自来水样品,以验证方法的实用性.在最优条件下,对自来水样品进行分析,自来水样品中没有测出这四种三唑类杀菌剂,自来水样品的总离子流色谱图(图6),自来水加标溶液(质量浓度10 μg/L)的总离子流色谱图(图7)以及加标溶液(10 μg/L)二次加标质量浓度10 μg/L后(即20 μg/L)的总离子流色谱图(图8).
图6 自来水空白样品的总离子流色谱图Fig.6 The TIC of the unspiked tap water sample
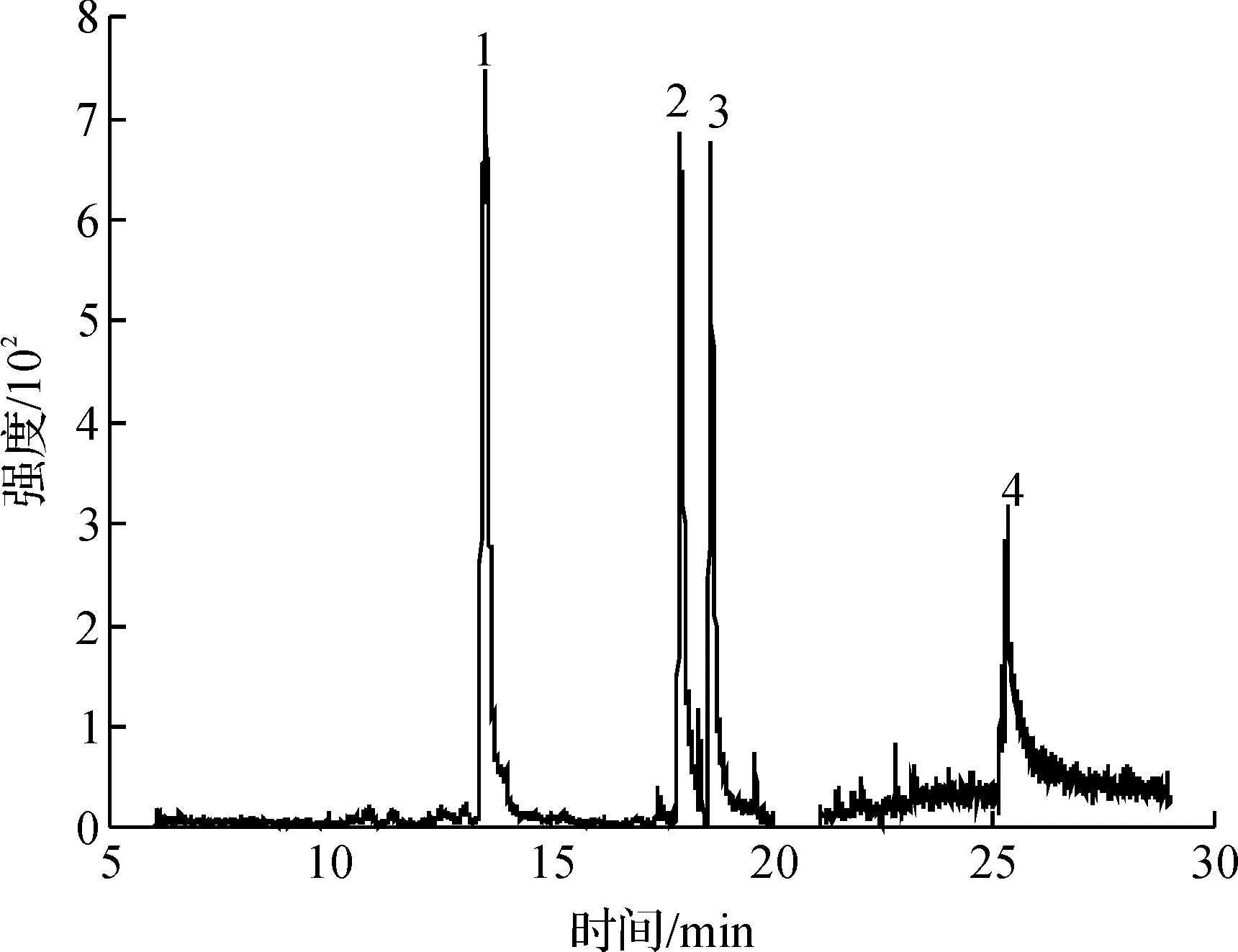
1—腈菌唑;2—戊唑醇;3—氟环唑;4—苯醚甲环唑图7 自来水加标溶液(10 μg/L)的总离子流色谱图Fig.7 The TIC of the spiked tap water sample with 10 μg/L of triazoles
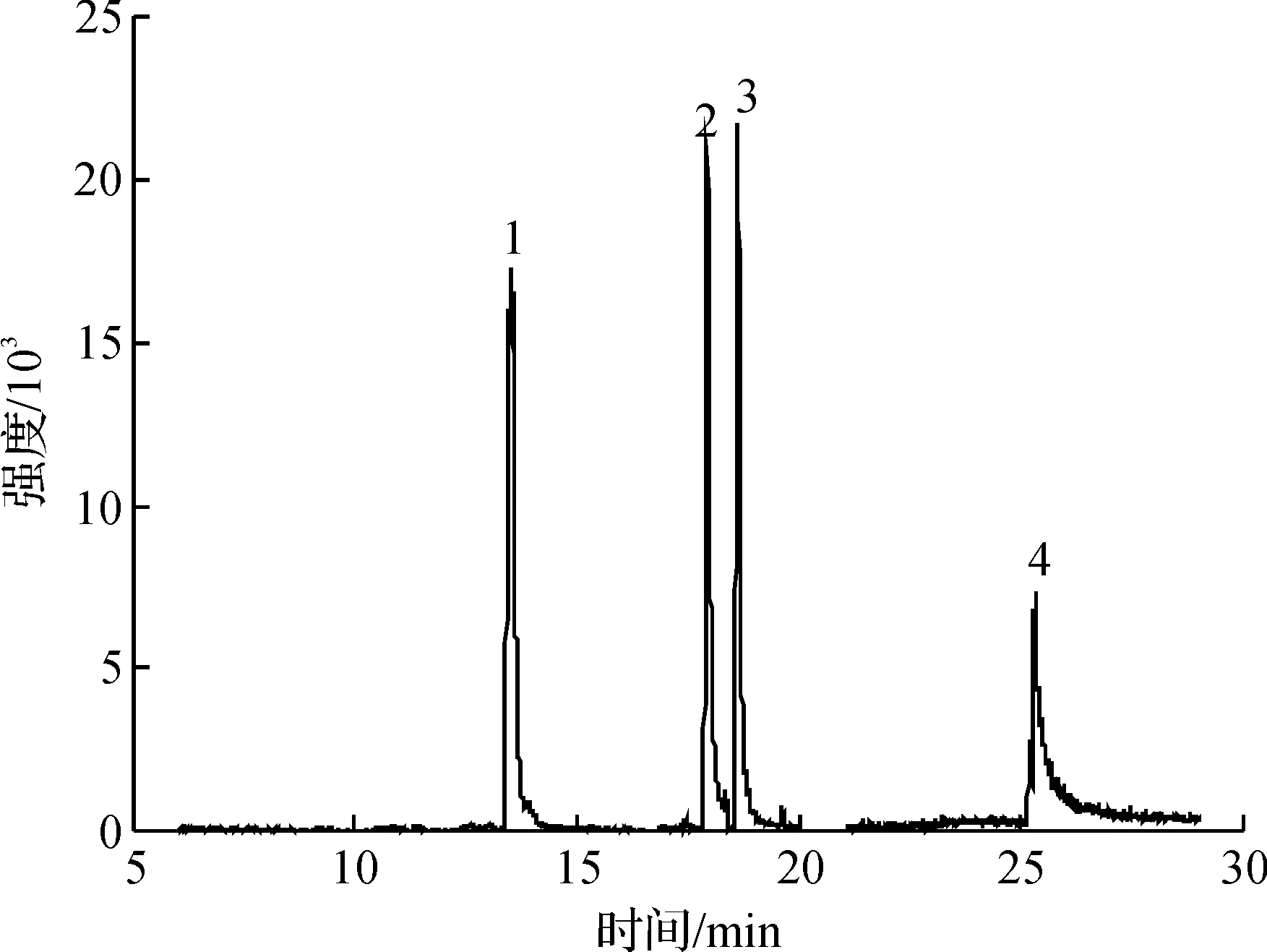
1—腈菌唑;2—戊唑醇;3—氟环唑;4—苯醚甲环唑图8 自来水加标溶液二次加标质量浓度的总离子流色谱图Fig.8 The TIC of the second spiked tap water sample with 20 μg/L of triazoles
3 结 论
提出了粉末冒泡破乳-分散液液微萃取的分析方法,并成功用于自来水中三唑类农药的测定.实验采用自制萃取装置,可重复利用,经济环保;使用密度小于水的甲苯为萃取剂代替传统分散液-液微萃取中高密度的卤代烷烃萃取剂,降低了对环境和人体的危害;在无需离心机、超声仪等试验设备的条件下对目标物进行富集.该方法具有重复性好,富集倍数高,检测限低,回收率和精密度良好,具有水样现场分析潜力等优点,已成功应用于自来水样的检测.
本文得到了浙江工业大学2016年校级大学生创新创业训练计划项目(2016101011124)的资助.
[1] 周子燕,李昌春,高同春,等.三唑类杀菌剂的研究进展[J].安徽农业科学,2008,36(27):11842-11844.
[2] 周炳,赵美蓉,黄海凤.4种农药对斑马鱼胚胎的毒理研究[J].
浙江工业大学学报,2008,36(2):136-140.
[3] 汪爱娟,戴德江,李阿根,等.茭白胡麻斑病药剂防治技术研究[J].中国植保导刊,2016,36(1):68-70.
[4] RIJK E P C D,HAFMANS W T M,ESCH E V V. Multifocal ductal cell hyperplasia in the submandibular salivary glands of wistar rats chronically treated with a novel steroidal compound[J].Journal of toxicologic pathology,2003,31(1):1-9.
[5] 冯硕立,徐明仙,高伟亮,等.超临界色谱拆分6种唑类手性农药[J].浙江工业大学学报,2011,39(4):424-428.
[6] NESNOW S,WARD W,MOORE Y,et al.Discrimination of tumorigenic triazole conazoles from phenobarbital by transcriptional analyses of mouse liver gene expression[J].Toxicological sciences,2009,110(1):68-83.
[7] 曹慧,林珍珍,陈小珍,等.固相萃取-气相色谱/三重四极杆质谱法同时分析蔬菜中的50种农药残留量[J].浙江工业大学学报,2012,40(3):280-283.
[8] BOLYGO E,ATREYA N C.Solid-phase extraction for multi-residue analysis of some triazole and pyrimidine pesticides in water[J].Fresenius iouranl analytical chemistry,1991,339(6):423-430.
[9] LI J,DONG F,XU J,et al.Enantioselective determination of triazole fungicide simeconazole in vegetables, fruits, and cereals using modified QuEChERS (quick, easy, cheap, effective, rugged and safe) coupled to gas chromatography/tandem mass spectrometry[J].Analtica chimica acta,2001,702(1):127-135.
[10] BODAGARAY A,GARCIA-ARRONA R,MILLAN E.Optimization of solid-phase microextraction procedure coupled to GC-ECD for triazole fungicides determination in juice samples food[J].Analytical methods,2011,4(3):293-299.
[11] BODAGARAY A,GARCIA-ARRONA R,MILLAN E.Development and application of a screening method for triazole fungicide determination in liquid and fruit samples using solid-phase microextraction and HPLC-DAD[J].Analytical methods,2013,5(10):2565-2571.
[12] BODAGARAY A,GARCIA-ARRONA R,MILLAN E.Determination of triazole fungicides in liquid samples using ultrasound-assisted emulsification microextraction with solidification of floating organic droplet followed by high-performance liquid chromatography[J].Food analytical methods,2014,7(6):1195-1203.
[13] FARAJZADEH M A,MOGADDAMA M R A,GHORBANPOURB H.Development of a new microextraction method based on elevated temperature dispersive liquid-liquid microextraction for determination of triazole pesticides residues in honey by gas chromatography-nitrogen phosphorus detection[J].Journal of chromatography A,2014,1347(15):8-16.
[14] FARAJZADEH M A,KHOSHMARAM L.Air-assisted liquid-liquid microextraction-gas chromatography-flame ionisation detection: a fast and simple method for the assessment of triazole pesticides residues in surface water, cucumber, tomato and grape juices samples[J].Food chemistry,2013,141(3):1881-1887.
[15] FARAJZADEH M A,BAHRAM M,JAFARY F,et al.Combination of Extraction by silylated vessel-dispersive liquid-liquid microextraction as a high-enrichment factor technique: Optimization and application in preconcentration of some triazole pesticides from aqueous samples followed by GC-FID determination[J].Chromatographia,2011,73:393-401.
(责任编辑:陈石平)
Determination of triazole pesticides combining effervescence-assisted dispersive liquid-liquid microextraction followed by gas chromatography-mass spectrometry
LI Zuguang1, SONG Zhiyu1, LAO Jiazhen1, NIE Jing1, YE Jingqing1, WEI Qizhen1, NI Lin1, DENG Fengtao2
(1.College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, China;2.Focused Photonics Inc., Hangzhou 310052, China)
A novel method of effervescence-assisted dispersive liquid-liquid microextraction(EA-DLLME)coupled with GC-MS was proposed for the determination of four triazoles in tap water. This method adopted toluene with low-density as extractant and the self-generating carbon dioxide which was produced by powder of sodium dihydrogen phosphate and anhydrous sodium carbonate as demulsification. Under the optimized conditions, the limits of detections ranged from 0.011 μg/L to 0.024 μg/L. Enrichment factors were between 866~1 226. Meanwhile the recoveries were at the range of 86.7%~115.8%, and RSDs were at the range of 9.93%~17.28%. The simple, efficient, and environmentally friendly method was successfully applied todetermine triazole in real waters.
effervescence-assisted; dispersive liquid-liquid microextraction; triazole pesticides;low-density extractant ;gas chromatography-mass spectrometry
2016-09-21
浙江省自然科学基金资助项目(LY16B050008);浙江省科技厅公益项目(2015C32006);国家重大科学仪器设备开发专项(2013YQ13042908)
李祖光(1971—),男,江西上饶人,教授,博士生导师,主要从事分析化学、应用化学和农药学等研究,E-mail: lzg@zjut.edu.cn.
O657.63
A
1006-4303(2017)02-0190-05

