基于GS1编码体系的唯一器械标识UDI编码及实施研究
基于GS1编码体系的唯一器械标识UDI编码及实施研究
【作 者】李海波,李庆岱河北省标准化研究院,石家庄市,050051
该文介绍了UDI的定义、组成及目前国际上先进国家UDI实施现状,重点对基于GS1标准的UDI编码体系进行分析研究。首先介绍了GS1编码体系,对比分析UDI与GS1编码体系的关系,然后举例说明基于GS1标准的UDI编码标识到规格型号、批次和单品的编码方法,并对UDI数据载体及载体间的优劣势进行比较,最后阐述了UDI的实施流程及效果。对引导医疗器械生产企业、经销商和医院正确使用UDI编码,推动国内医疗器械标准和法规的制定有一定的参考意义。
唯一器械标识;UDI;GS1编码;医疗器械;UDI数据载体
【 Writers 】LI Haibo, LI Qingdai
Hebei Institute of Standardization, Shijiazhuang, 050051
【 Abstract 】The paper introduced de fi nition, composition and implementing situation on UDI in developed countries. The coding system based on GS1 standard was researched. First, the paper introduced GS1 coding system and analyzed the connection of UDI and GS1 coding system. Next, it gave examples to illustrate the method to mark the type, batch and a single product. Besides, the superiority and inferiority of UDI data carrier were analyzed. Finally, the implementing procedure and effect of UDI coding were described. it has some signi fi cance to guide medical device manufacturers, distributors and hospitals to use UDI coding correctly, and it is also bene fi cial to work out regulation and standard.
0 引言
随着人们生活水平和对健康关注度的不断提高,对医疗器械的需求也越来越多,但是医疗事故常有发生,直接威胁到患者的生命安全,因此各国政府相继出台了一系列法律法规或指导文件对医疗器械的使用进行规范化管理。UDI,全称为Unique Device Identification,中文名翻译为“唯一器械标识”,根据全球医疗器械法规协调机构目前的定义:UDI是根据国际或等同转换的国家物品编码标准系统,采用数字或文字数字表示的代码[1]。这个代码在全球范围内用于特定的医疗器械领域,代码可以作为进入相关信息数据库的索引,以满足医疗器械信息化管理、追溯、问题产品召回等需要。
1 唯一器械标识UDI简介及实施现状
1.1 UDI组成
唯一器械标识(UDI)由器械标识(DI)单独组成,或者由器械标识(DI)与生产标识(PI)联合组成。
器械标识(DI)+生产标识(PI)=唯一器械标识(UDI)
在唯一器械标识(UDI)中,DI属于静态信息,它作为医疗器械进入相关数据库查询该器械基本信息的 “索引”,是医疗器械在整个供应链上的身份标识;PI属于动态信息,它可以包括医疗器械产品的生产日期、有效期、批号和序列号等动态附加信息,它与DI联合使用能够指向特定的医疗器械产品。根据UDI的组成及要实现的不同程度的追溯功能,既可以只使用DI实现医疗器械追溯,也可以联合使用DI与PI实现医疗器械追溯。
1.2 UDI数据库
UDI数据库向公众免费开放,从中可以检索到除患者信息外的医疗器械的DI及其他核心要素,生产商负责首次提交并更新数据库的DI和其他数据。通过UDI数据库可以将其它医疗器械的各级包装关联到一起。目前,国际医疗器械监管机构论坛(IMDRF,原名GHTF)要求编码静态信息数据库包含25项核心属性,美国、欧盟、日本根据自身需求及当地国家政策略有不同,如美国静态信息数据库包含13项核心属性,欧盟静态信息数据库包含21项核心属性[2]。
1.3 UDI实施现状
IMDRF在2011年完成了对UDI实施原则的协调,提出了《医疗器械UDI系统》指导性最终文件,推动UDI作为全球医疗器械上市后追溯的基本手段,通过自动识别与数据获取技术可对UDI中的制造商、器械类别、生产日期、有效期、批号等信息进行读取。在此基础上,各个国家和组织积极制定UDI政策法规,推动UDI在本国和本区域的规范管理与应用实施。欧洲医疗器械行业协会(Eucomed)制定了《基于风险管理的不同包装级别医疗器械UDI标识要求》,未来将逐步对所有医疗器械实施UDI[3]。日本从20世纪80年代就开始积极推广医药信息化,以GS1编码技术核心编制本国的UDI标准,所有相关的国家机构可以共享日本的研究成果,目前IMDRF UDI的实施要求对日本信息基础完全兼容[4]。美国食品药品监督管理局(Food and Drug Administration,简称FDA)2013年9月24日正式出台了建立UDI系统的最终法规,按照法规要求,医疗器械标签和包装中应标注UDI[5]。鉴于GS1编码体系在国际上的广泛应用,因此本文主要介绍基于GS1标准的UDI编码体系,对于其他编码标准的UDI编码不做介绍。
2 基于GS1标准的UDI编码体系
2.1 GS1编码体系
GS1是全球性、中立的非营利组织,致力于通过制定全球统一的产品标识和电子商务标准,实现供应链的高效运作与可视化。GS1拥有一套全球跨行业的产品、运输单元、资产、位置和服务的标识标准体系和信息交换标准体系,使产品在全世界都能够被扫描和识读,GS1的全球数据同步网络(GDSN)确保全球贸易伙伴都使用正确的产品信息[6]。编码体系是GS1系统的核心,包括流通领域中所有的产品和服务(包括贸易项目、物流单元、资产、位置和服务关系等)的标识代码及附加属性代码,附加属性代码不能脱离标识代码独立存在。GS1系统编码体系如图1所示。
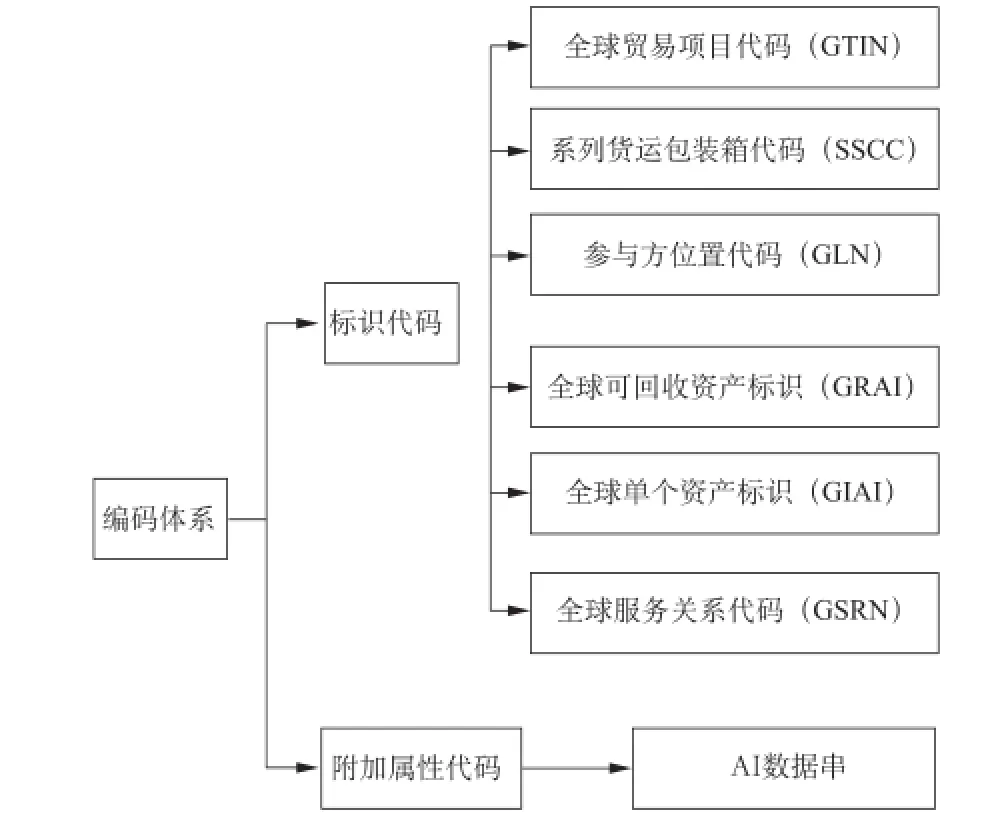
图1 GS1系统编码体系Fig.1 The GS1 coding system
其中,GTIN是为全球贸易项目提供唯一标识的代码,在编码体系中应用最为广泛。GTIN的编码结构可以对不同包装形态的商品进行唯一编码,确保其在相关应用领域的全球唯一,GTIN有4种不同的编码结构,包括EAN/UCC-14、EAN/UCC-13、UCC-12和EAN/UCC-8,4种不同编码结构如表1所示。
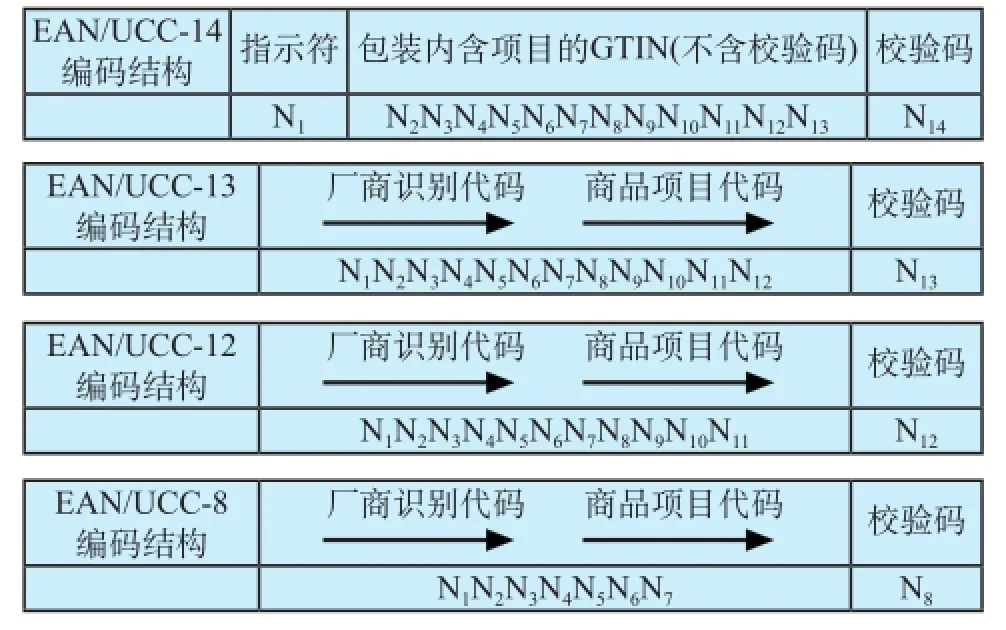
表1 GTIN的4种编码结构Tab.1 Four coding structure of GTIN
2.2 基于GS1编码体系的UDI编码
当UDI采用GS1标准进行编制时,DI采用全球贸易项目代码(GTIN)进行编制,PI采用应用标识符(AI)进行标识。在进行UDI编码时,根据实际需要对静态标识与动态标识进行组合使用可以满足追溯到规格型号、批号或单品的要求,GS1标准的编码结构,使得标识数据规范化,更具可读性。UDI与GS1编码关系对照如表2所示。
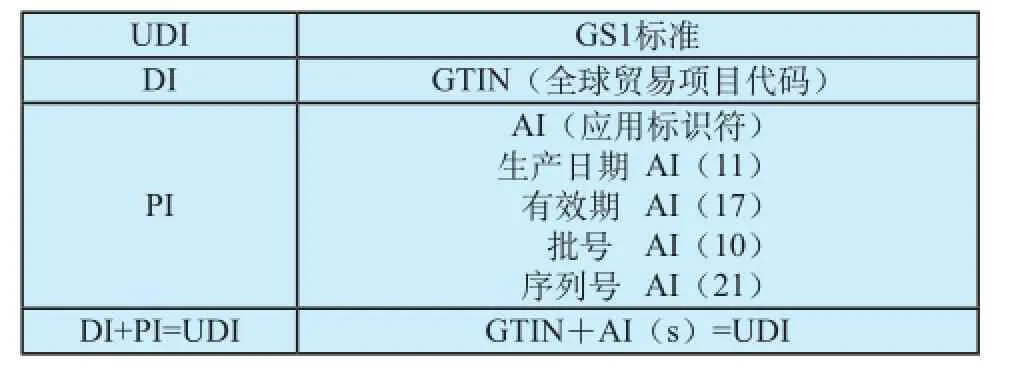
表2 UDI与GS1编码关系对照表Tab.2 The coding relationship table of UDI and GS1
图2为基于GS1标准使用一维条码进行UDI编码追溯到单品的结构分析图。其中,厂商识别代码由7~9位数字组成,由中国物品编码中心负责分配管理,商品项目代码由3~5位数字组成,由厂商识别代码所有人依据国家标准负责编制,校验码根据一定算法生成,用来校验前12数字的编码正确性,基于GS1标准的UDI编码具体结构分析如图2所示。

图2 基于GS1标准的UDI编码结构分析图Fig.2 The analysis chart of UDI coding structure based on GS1 standard
根据医疗器械使用风险和追溯要求的不同,UDI随之变化,基于GS1标准使用一维条码、二维条码或RFID电子标签可以根据实际情况标识到规格型号、有效期和批次或有效期和单品。例如使用UDI由DI表示的唯一编码“6901234000054”可以标识并追溯到某一规格型号的医疗器械;使用UDI由DI和PI联合表示的唯一编码“(01)26901234567896(17)130131(10)1234”可以标识并追溯到“6901234567896”的医疗器械规格型号及有效期和批次号;使用UDI由DI和PI联合表示的唯一编码“(01)06901234567896(17)130131(21)1302011475”可以标识并追溯到“6901234567896”的医疗器械规格型号及有效期和序列号。
2.3 基于GS1标准的UDI数据载体
UDI的数据载体有一维条码、二维条码和RFID电子标签,目前IMDRF及各国政府部门并没有强制要求使用某一种数据载体。UDI的数据载体应当位于标签、外包装或医疗器械本体上。对于需反复使用或需要处理后再使用的医疗器械通常需要直接产品标识(Direct Part Marking,简称DPM)。适用于DPM要求的二类和三类医疗器械产品一般需标识条码或可读文本信息,至少标注GTIN和批次或序列号,若没有批次或序列号可使用生产日期作为PI标识,其中,对于一类医疗器械PI不是必须包括在UDI中。当显示可读文本时,GTIN中的批次号、序列号的AI必须使用换括号标注。GS1推荐使用GS1 DataMatrix技术。 GS1 DataMatrix可应用于很小的设备或是手术器材上,如手术剪等。UDI的数据载体相互比较如表3所示。
3 UDI实施流程及实施效果
3.1 UDI实施流程
当唯一器械标识UDI在整个医疗系统供应链上开始实施后,无论是对医疗器械生产企业,物流公司,还是使用医疗器械的医院、患者都能带来极大的益处。医疗器械生产企业生产过程中为每个产品和包装级别分别创建UDI,并负责管理相关数据信息,医疗器械生产企业车间通过企业ERP(Enterprise Resource Planning)系统可快速获取相关医疗器械订单信息,生产出的医疗器械直接打印或贴标记录UDI相关信息(如批号、有效期等);物流公司在医疗器械验收、仓储、运输、配送等物流环节使用UDI信息对医疗器械进行管理,能够做到库存流转和质量控制,确保生产厂家及时收到订单信息,医疗器械及时送达患者医院;医院通过扫描UDI载体可以在物资管理信息系统中进行医疗器械的订货、配货、补货预警管理、快速查找医疗器械产品、快速追踪患者及其已使用的医疗器械等相关信息,医院病房通过扫描患者腕带,确认患者身份,将患者身份信息和医疗器械UDI信息进行绑定并上传至相关数据库。

表3 UDI数据载体比较表Tab.3 The comparison table of UDI data carrier
3.2 UDI实施效果
在医疗器械产品生产过程尽早实施UDI,能够确保在医疗器械生产过程中的自动化识别和可追溯性,利用UDI及相应的自动识别设备,能够快速地对医疗器械生产信息和产品信息进行检验,将采集到的UDI信息与其它信息进行对比,可以大大降低医疗器械产品生产过程中混批的可能;物流公司在运输、仓储、配送等过程中利用UDI进行管理,能够确保运输、仓储、配送等物流过程中的准确率;医院借助UDI实行精细化管理,使用较少的人员就能够做到医疗器械管理的高效率与高准确性,保证医疗器械供应链的共享和通畅。在医疗器械生产到最终使用的过程中将患者信息与医疗器械UDI建立一一对应关系,做到每个批次或单品都能信息可追溯,最终能达到提高医疗供应链效率,提升患者安全,改善医疗服务的目标。
4 结论
UDI是对医疗器械在其整个生命周期赋予的身份标识,是其在整个供应链体系中的唯一“身份证”。全球采用统一的、标准的UDI有利于提高供应链透明度和运作效率,降低运营成本,实现供应链中信息共享与交换;当出现问题医疗器械时,有利于问题医疗器械的快速召回,最终提高医疗服务质量,保障患者安全。在当前我国医疗器械管理制度有待完善,危及患者健康甚至生命的医疗事故时有发生的情况下,实施唯一器械标识UDI对我国医疗体制改革具有重要的意义。在这方面,美国已经走在世界前列,将UDI的实施上升为法规,借鉴美国等先进国家在UDI实施上的宝贵经验,制定符合当前我国国情的UDI实施标准或法律规范十分紧迫。不过必须看出,UDI的实施是一项长期的系统工程,关系到各方利益,在看似简单的贴标和数据管理背后,需要相关医疗器械生产企业、物流企业、医院等进行生产线改造、数据库建设、平台搭建、设备更新升级、人员培训等大量资源投入。因此,UDI的实施过程中应充分发挥政府相关部门的引导、监管作用,积极推进生产企业、医院等相关企事业单位采用UDI编码。
[1] 俞凯君. 医疗设备物流研究初探[J]. 中国医疗设备, 2013, 28(5): 56-59.
[2] 杨婉娟, 李军, 李静莉. 医疗器械唯一标识(UDI)国际进展[J].中国医疗器械杂志, 2014, 38(5): 353-356.
[3] 杜树海. 关于UDI的产品质量控制问题改善研究[D]. 南京: 南京大学, 2014.
[4] 梁晓婷, 池慧, 杨国忠. 欧洲、美国、日本医疗器械标准管理及对我国的启示[J]. 中国医疗器械信息, 2008, 14(8): 37-52.
[5] 刘清峰. 唯一医疗器械标识(UDI)及在美国实施情况[J].中国医疗器械信息, 2014, 20(4): 37-42.
[6] 王剑, 张楠, 张亚晶. GS1标准体系和HIBC编码标准及其应用[J].信息技术与标准化, 2009 (6): 54-57.
Research and Implement of Unique Device ldentif i cation UDl Based on GS1 Coding System
unique device identi fi cation, UDI, GS1 coding, medical device, UDI data carrier
F203
A
10.3969/j.issn.1671-7104.2017.02.015
1671-7104(2017)02-0133-04
2016-07-20
李海波,E-mail: wlihaibo@163.com

