七氟醚吸入麻醉和丙泊酚静脉麻醉对老年肺癌根治术患者血清VEGF、VCAM-1、MMP-2和MMP-9表达的影响
仲吉英,徐 枫,张 涛,黄 腾,黄振兴,杨承祥
(佛山市第一人民医院麻醉科, 佛山 528000)
肺癌是世界各国常见的呼吸道恶性肿瘤。手术切除是治疗肺癌的方法之一,但术后肿瘤的复发或转移仍然是肺癌患者死亡的主要原因[1]。不同的麻醉药物和麻醉方法对肿瘤细胞生长和侵袭能力的影响存在差异,并和肿瘤患者术后的转归密切相关[2,3]。七氟醚是目前临床常用的吸入麻醉药,广泛用于肺癌手术的麻醉。体外研究表明,七氟醚具有抑制肺癌细胞增殖和转移的效应[4,5]。丙泊酚作为一种常用静脉麻醉药已被证实对人肺癌A549细胞的侵袭力有抑制作用[6]。但两者对肺癌细胞在体转移能力的影响尚不明确。本研究拟比较七氟醚吸入麻醉和丙泊酚静脉麻醉对老年肺癌根治术患者血清血管内皮生长因子(vascular endothelial growth factor, VEGF)、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)和MMP-9表达的影响,为临床麻醉用药提供参考。
1 对象与方法
1.1 对象
选择佛山市第一人民医院收治的美国麻醉医师协会(American Society of Anesthesiologists, ASA)Ⅰ~Ⅱ级择期全麻下行肺癌根治术患者60例,随机分为七氟醚组(S组)和丙泊酚组(P组),每组30例。所选患者满足以下条件:年龄60~75岁,无高血压、糖尿病、心脏病史,无贫血(Hgb>12 g/L),无放化疗史,近1个月无麻醉镇痛药应用史。本研究经医院医学伦理委员会批准,所有患者或家属签署知情同意书。
1.2 方法
所有患者术前禁食8 h,禁饮4 h,均未术前用药。患者入室后常规面罩吸氧,氧流量为5 L/min,用Cicero EM型麻醉机(Drager公司,德国)监测血压(blood pressure,BP)、心率(heart rate,HR)、呼气末二氧化碳分压(end-tidal carbon dioxide partial pressure, PetCO2)、心电图(electrocardiogram,ECG) 和脉搏血氧饱和度(pulse oxygen saturation,SpO2),同时连接Narcotrend(NT)麻醉深度监护仪(SCHILLER公司,瑞士)。B超辅助局麻下行右侧颈内静脉穿刺,并连续监测中心静脉压(central venous pressure, CVP)。术中控制补液速度为 8~10 ml/(kg·h),晶/胶体液比例为1∶1,其中晶体液为乳酸林格液,胶体液为6%羟乙基淀粉液。麻醉诱导:静脉注射咪达唑仑0.1 mg/kg,依托咪酯0.25 mg/kg,舒芬太尼0.5 mg/kg,维库溴铵0.12 mg/kg,插入双腔支气管导管后行机械通气。S组患者吸入七氟醚(批号:9301,丸石制药株式会社,日本)维持麻醉,患者七氟醚呼气末浓度维持在1.7%~3.4%(1~2 MAC);P组术中不吸七氟醚,静脉泵注丙泊酚(批号:LW216,阿斯利康,意大利)3~6 mg/(kg·h)。两组患者术中均静脉泵注瑞芬太尼0.15~0.3 μg/(kg·min),氧流量为2 L/min。术中维持平均动脉压(mean arterial pressure,MAP)上下波动不超过基础值±30%,CVP 6~12 cmH2O,PetCO235~45 mmHg,NT值为40~50。术毕送患者到麻醉后恢复室(post anesthesia care unit, PACU)观察,监测BP、HR、PetCO2、ECG、SpO2。 所有手术由同一组外科医师完成,所有患者麻醉由同一位有经验的麻醉医师完成。
分别于麻醉诱导前即刻(T0)、手术开始后1 h(T1)、手术开始后2 h(T2)、手术结束后1 h(T3)、手术结束后2 h(T4)抽取静脉血2 ml(不含抗凝剂),离心分离血清并装于离心管中,编号密封放置于-20℃冰箱中保存待查。采用酶联免疫吸附法检测两组患者血清VEGF、VCAM-1、MMP-2和MMP-9表达。VEGF、VCAM-1、MMP-2和MMP-9试剂盒购自上海酶研生物科技有限公司,实验操作严格按试剂盒说明书进行。
1.3 统计学处理

2 结 果
2.1 两组患者基本资料
两组患者年龄、性别、体质量、ASA分级、术中输液量、出血量、麻醉时间、术后病理分型及术中瑞芬太尼用量比较,差异无统计学意义(P>0.05;表1)。
2.2两组患者血清VEGF、VCAM-1、MMP-2和MMP-9水平
与T0时比较,S组T1~T4时血清VEGF和VCAM-1表达明显降低(P<0.05),T2~T4时MMP-2和MMP-9表达明显降低(P<0.05);P组T1~T4 时血清VEGF、VCAM-1、MMP-2和MMP-9表达无明显差异(P>0.05)。与P组比较,S组T2~T4时血清VEGF、VCAM-1、MMP-2和MMP-9表达明显降低(P<0.05;表2)。
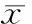
表2 两组患者不同时点血清VEGF、VCAM-1、MMP-2和MMP-9水平的比较
VEGF: vascular endothelial growth factor; VCAM: vascular cell adhesion molecule; MMP: matrix metalloproteinase. T0: just before induction of anesthesia; T1: 1 h after surgery beginning; T2: 2 h after sugery beginning; T3: 1 h after the end of surgery; T4: 2 h after the end of surgery. Compared with T0,*P<0.05; compared with propofol group,#P<0.05

表1 两组患者一般情况和术中各项指标比较
ASA: American Society of Anesthesiologists
3 讨 论
研究证实,麻醉药物对肿瘤患者术后的长期生存和转归有一定影响。应用具有抑制肿瘤细胞生长和侵袭性的麻醉药物,可减少肿瘤细胞在手术期间的播散,减少肿瘤复发或转移的概率[7]。临床上常用吸入麻醉药浓度为1~2 MAC,因此,本研究选择1~2 MAC的七氟醚维持麻醉。大量研究证实, 肿瘤的发生、发展和转移依赖于肿瘤血管形成。肿瘤血管的形成受多种因子调控,VEGF具有促进体内新生血管的生成、促进血管内皮细胞增殖、增加血管的通透性、维持血管的形态及完整性的作用,是目前发现的最重要的促进肿瘤血管形成的因子[8]。VCAM-1(CD106)属免疫球蛋白超家族, 具有免疫球蛋白相似的分子结构, 是VLA4的配体,内皮细胞受损后, VCAM-1的表达增强。这些分子作用于微血管内皮细胞或白细胞,或者介导它们之间的相互作用, 从而导致内皮及组织损伤和微循环障碍。目前发现,VCAM-1 参与了炎症调节反应、细胞和组织分化发育过程、免疫应答反应、淋巴细胞归巢和再循环以及肿瘤形成、扩散转移等过程[9]。MMP-2和MMP-9是MMP家族中两个重要成员,属于Zn2+和Ca2+依赖的内源性蛋白水解酶类,能降解细胞外基质和基底膜主要结构蛋白为Ⅳ型胶原[10]。MMP-2和MMP-9在肿瘤细胞浸润和转移中起着较为关键的作用,其表达水平高低与肺癌患者预后密切相关[11,12]。肿瘤细胞转移过程中,先分泌MMP-2和MMP-9降解Ⅳ型胶原,通过破坏基底膜和基膜构成的屏障而发生转移。
本研究发现,与术前相比,术中各时点丙泊酚组患者血清VEGF、VCAM-1、MMP-2和MMP-9的表达无明显差异,这与王宇娜等[13]研究结果相同。但是,加大丙泊酚剂量是否可以抑制由手术刺激引起的肺内弥漫性炎症细胞浸润、肺血循环障碍、肺毛细血管通透性增加等一系列变化导致的上述各因子生成的增加,尚不可知,有待进一步研究。以往尤华等[14]研究结果显示,丙泊酚比七氟醚更显著降低肺癌切除术患者血清MMP-9的表达,这与本研究结果不同,可能与本研究麻醉维持所用丙泊酚剂量较小有关。与T0时比较,S组T2~T4时MMP-2和MMP-9表达降低(P<0.05),这与傅蕊等[15]研究结果相同。七氟醚组患者研究期间血清VEGF、VCAM-1、MMP-2和MMP-9的表达明显低于丙泊酚组,这可能与七氟醚在体内代谢途径有关。七氟醚在体代谢率为5%,主要被细胞色素P450 2E1代谢,代谢产物对细胞功能有一定干扰[16]。由此推测,在体代谢率较高的七氟醚麻醉后,血清中含有较高的七氟醚代谢产物,对肺癌细胞分泌VEGF、VCAM-1、MMP-2和MMP-9有一定影响,但具体机制还有待进一步探讨。七氟醚吸入麻醉引起的上述各因子的变化可能会对肺癌患者术后复发及转归起到进一步改善作用,这仍有待进一步探讨。
综上所述,与丙泊酚静脉麻醉相比,七氟醚吸入麻醉能抑制老年肺癌根治术患者血清VEGF、VCAM-1、MMP-2和MMP-9的表达。
【参考文献】
[1] Shoji F, Morodomi Y, Akamine T,etal. Predictive impact for postoperative recurrence using the preoperative prognostic nutritional index in pathological stage Ⅰ non-small cell lung cancer[J]. Lung Cancer, 2016, 98:15-21. DOI: 10.1016/j.lungcan.2016.05.010.
[2] Weng M, Chen W, Hou W,etal. The effect of neuraxial anesthesia on cancer recurrence and survival after cancer surgery: an updated meta-analysis[J]. Oncotarget, 2016, 7(12): 15262-15273. DOI: 10.18632/oncotarget.7683.
[3] Jang D, Lim CS, Shin YS,etal. A comparison of regional and general anesthesia effects on 5-year survival and cancer recurrence after transurethral resection of the bladder tumor: a retrospective analysis[J]. BMC Anesthesiol, 2016, 16: 16. DOI: 10.1186/s12871-016-0181-6.
[4] Liang H, Gu M, Yang C,etal. Sevoflurane inhibits invasion and migration of lung cancer cells through inactivating p38 MAPK signaling pathway[J]. J Anesth, 2012, 26(3): 381-392. DOI: 10.1007/s00540-011-1317-y.
[5] Liang H, Wang HB, Liu HZ,etal. The effects of combined treatment with sevoflurane and cisplatin on growth and invasion of human lung adenocarcinoma cell line A549[J]. Biomed Pharmacother, 2013, 67(6): 503-509. DOI: 10. 1016/ j. biopha.2013.03.005.
[6] 叶惠瑾, 白建杰, 郭培培, 等. 丙泊酚下调水通道蛋白3和金属基质蛋白酶-9表达抑制人肺癌A549细胞的侵袭力[J]. 南方医科大学学报, 2016, 36(9): 1286-1290.
Ye HJ, Bai JJ, Guo PP,etal. Propofol suppresses invasion of human lung cancer A549 cells by down-regulating aquaporin-3 and matrix metalloproteinase-9[J]. J South Med Univ, 2016, 36(9): 1286-1290.
[7] Bharati SJ, Chowdhury T, Bergese SD,etal. Anesthetics impact on cancer recurrence: what do we know[J]? Cancer Res Ther, 2016, 12(2): 464-468. DOI: 10.4103/0973-1482.148670.
[8] Takahashi Y, Kitadai Y, Bucana CD,etal. Expression of vascular endothelial growth factor and its receptor, KDR, correlates with vascularity, metastasis, and proliferation of human colon cancer[J]. Cancer Res, 1995, 55(18): 3964-3968.
[9] 夏 亮, 田 臻. 血管细胞黏附分子 1与肿瘤关系的研究进展[J].医学综述, 2016, 22(7): 1277-1281. DOI:10.3969/j.issn.1673-4130.2011.18.018.
Xia L,Tian Z. The study advances of relations between VCAM-1 and tumors[J]. Med Recapitulate, 2016, 22(7): 1277-1281. DOI: 10. 3969/ j. issn. 1673-4130.2011.18.018.
[10] Gupta GP, Massague J.Cancer metastasis: building a framework[J]. Cell, 2006, 127(4): 679-695. DOI: 10.1016/j.cell.2006.11.001.
[11] Butkiewicz D, Krzes'niak M, Drosik A,etal. The VEGFR2, COX-2 and MMP-2 polymorphisms are associated with clinical outcome of patients with inoperable non-small cell lung cancer[J]. Int J Cancer, 2015, 137(10): 2332-2342. DOI: 10.1002/ijc.29605.
[12] Nie FQ, Zhu Q, Xu TP,etal. Long non-coding RNA MVIH indicates a poor prognosis for non-small cell lung cancer and promotes cell proliferation and invasion[J]. Tumour Biol, 2014, 35(8): 7587-7594. DOI: 10.1007/s13277-014-2009-7.
[13] 王宇娜, 曾凡荣, 刘海萍, 等. 七氟醚和丙泊酚气管内全麻对肺泡内ICAM-1 及VEGF表达的影响[J]. 黑龙江医药科学,2015, 38(3): 59-60. DOI: 10.3969/j.issn.1008-0104.2015.03.029.
Wang YN, Zeng FR, Liu HP,etal. The effects of sevoflurane and propofol on alveolar ICAM-1 and VEGF expression in endotracheal anesthesia[J]. Heilongjiang Med Sci, 2015, 38(3): 59-60. DOI:10.3969/ j.issn. 1008-0104.2015.03.029.
[14] 尤 华, 谢灿果. 丙泊酚对肺癌切除术患者围术期炎性反应及肺功能的影响[J]. 实用医院临床杂志, 2015, 12(4): 78-80. DOI: 10. 3969/ j.issn.1672-6170.2015.04.029.
You H, Xie CH. Effects of propofol on perioperative inflammatory response and lung function of patients with lung cancer[J]. Pract J Clin Med, 2015,12(4): 78-80. DOI:10.3969/j.issn.1672-6170.2015.04.029.
[15] 傅 蕊, 周国强, 巩晓洁, 等. 异氟醚和七氟醚对肺癌根治术患者血清E-selectin、ICAM-1、MMP-2、MMP-9表达的影响[J].临床麻醉学杂志, 2015, 31(3): 250-252.
Fu R, Zhou GQ, Gong XJ,etal. The effects of isoflurane or sevoflurane on the expressions of E-selectin, ICAM-1, MMP-2 and MMP-9 in patients undergoing radical surgery for lung cancer[J]. J Clin Anesthesiol, 2015, 31(3): 250-252.
[16] Campagna JA, Miller KW, Forman SA. Mechanisms of actions of inhaled anesthetics[J]. N Engl J Med, 2003, 348(21): 2110-2124. DOI: 10.1056/ NEJMra021261.

