间充质干细胞条件培养基对糖尿病肾病大鼠肾脏的保护作用
李 颖,华 岩,于 翔
(山海关人民医院内分泌科,秦皇岛 066200)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的一种严重并发症。在长期高血糖、高血脂和高血压的刺激下,肾小球微循环系统的微循环滤过压会异常增高,这导致DN发生和不断发展[1]。间充质干细胞(mesenchymal stem cells,MSCs)可以通过旁分泌途径分泌细胞因子、生长因子及神经营养因子等生物活性物质,具有抗凋亡、损伤修复、促再生和调节炎症反应等多种综合性作用[2]。有研究表明干细胞条件培养基具有促血管生成和调节神经功能的作用[3]。我们利用MSCs主要通过旁分泌的特点来提取和制作MSCs条件培养基,以研究其对DN的治疗和修复作用; 同时结合Alzet微量渗透泵可长效缓慢进行释放的特点,对DN大鼠模型进行治疗,观察其对DN大鼠的保护作用。
1 材料与方法
1.1 药物和试剂
SD大鼠骨髓MSCs 和MSCs专用培养基采购自赛业生物科技有限公司(美国),达尔伯克改良伊格尔(Dulbecco’s modified eagle medium,DMEM)培养基和胰酶采购自HyClone公司,链脲佐菌素(streptozocin,STZ)购自Sigma公司。2ML2微量渗透泵购自美国ALZET公司。
1.2 MSCs条件培养基的制备
SD大鼠骨髓MSCs用MSCs专用培养基进行培养,约2 d更换1次细胞培养液传代,第3代MSCs在细胞培养融合度达到约90%时弃掉原培养基,更换为DMEM无血清培养基。在孵箱内培养24 h后收集上清液即为MSCs条件培养基。吸取上层条件培养基2 ml于Alzet微量渗透泵中即为MSCs条件培养基Alzet微量渗透泵。
1.3 分组和方法
30只清洁级SD 雄性大鼠[北京维通利华实验动物技术有限公司],体质量(200±10)g,随机分为3组:正常组,DN模型组和MSCs条件培养基组,每组10只。正常组给予普通饲料喂养;DN模型组大鼠每天给予高脂高糖饲料(在普通饲料的基础上加上10%蔗糖、5%奶粉、20%猪油);MSCs条件培养基组是对造模成功的DN大鼠植入Alzet微量渗透泵。
DN模型大鼠高脂高糖饲料喂养8周后,腹腔一次性注射STZ(35 mg/kg),配制方法:将STZ溶解于新鲜配制的0.1 mol/L的枸橼酸缓冲液中,溶液浓度为1%,pH值维持在4.2。1周后检测相关指标,将非禁食血糖≥16.7 mmol/L和尿蛋白≥30 mg/24 h 作为判断2型DN大鼠模型是否成功的标准[4]。
Alzet微量渗透泵植入方法:2%戊巴比妥钠腹腔注射麻醉大鼠,取大鼠仰卧位,去毛备皮,聚维硐碘(碘伏)消毒,在腹部做1个1.5 cm深的纵切口,植入内置MSCs条件培养基的Alzet微量渗透泵,逐层缝合,术中严格无菌操作。
1.4 检测指标
处死大鼠前行眶静脉采血,全自动生化分析仪检测血糖、甘油三酯、尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)等生化指标,电化学发光分析仪检测血清胰岛素水平。处死大鼠前用代谢笼收集大鼠24 h尿液,全自动生化分析仪检测24 h尿蛋白。处死大鼠后取一部分肾组织用10%甲醛溶液固定,经脱水、包埋,切片,制作2 μm 厚度的石蜡切片行过碘酸雪夫氏(periodic acid-Schiff,PAS)染色,观察大鼠肾脏病理形态变化情况,然后对肾脏组织形态学进行定量分析,同时计算平均肾小球系膜截面积和平均肾小球体积。再取一部分肾脏组织于-80℃冰箱中保存,用于做Western印迹检测。
1.5 Western印迹检测
取适量大鼠肾组织,经裂解液对组织进行处理,考马斯亮蓝法测蛋白浓度,然后等浓度加入上样缓冲液,100℃沸水变性5 min。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、转膜、封闭、一抗孵育过夜及二抗孵育,通过化学发光及图像分析,测定nephrin蛋白的表达情况。
1.6 统计学处理

2 结 果
2.1 各组大鼠检测指标的比较
与正常组大鼠相比,DN模型组的血糖、血清胰岛素、甘油三酯、24 h尿蛋白、血肌酐和血尿素氮均显著增高,差异具有统计学意义(P<0.05)。与DN模型组大鼠相比,MSCs条件培养基组的血糖、血清胰岛素、24 h尿蛋白、血肌酐和血尿素氮均显著降低,差异具有统计学意义(P<0.05;表1)。
2.2 各组大鼠病理结果
正常组大鼠肾小球、肾小管及肾间质无明显改变;DN模型组大鼠可见肾小球体积增大,系膜细胞增生,系膜基质增多,肾小管上皮细胞可有水肿;MSCs条件培养基组大鼠肾损害较DN模型组有所减轻(图1)。在显微镜下进行肾小球系膜截面积与肾小球体积定量分析,结果发现与正常组大鼠相比,DN模型组的肾小球系膜截面积与肾小球体积均显著增加(P<0.05);而与DN模型组相比,MSCs条件培养基组大鼠的肾小球系膜截面积与肾小球体积均显著减小(P<0.05;表2)。
2.3 Western印迹结果
与正常组大鼠相比,MSCs条件培养基组大鼠nephrin蛋白的表达情况显著降低(P<0.05),但与DN模型组相比显著增加(P<0.05;图2)。
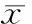
表1 各组大鼠检测指标的比较
DN: diabetic nephropathy; MSCs: mesenchymal stem cells; Scr: serum creatinine; BUN: blood urea nitrogen. Compared with normal control group,*P<0.05; compared with DN group,#P<0.05

图1 各组大鼠病理变化

Index NormalcontrolgroupDNgroupMSCsgroupGlomerularmesangialarea(μm2×103)4.49±0.187.49±0.30*5.23±0.25#Glomerularvolume(μm3×105)5.52±0.138.06±0.25*6.89±0.18#
DN: diabetic nephropathy; MSCs: mesenchymal stem cells. Compared with normal control group,*P<0.05; compared with DN group,#P<0.05

图2 各组大鼠nephrin蛋白表达情况
3 讨 论
近年来,干细胞治疗糖尿病的相关研究引起了人们的注意,MSCs可以通过旁分泌等方式分泌各种生长因子及细胞因子,通过调控免疫的途径来实现对损伤的修复治疗[5]。然而直接应用MSCs(如通过注射移植)的方式也存在一些问题,如大鼠尾静脉注射后归巢率低、病理环境下使用时增加感染等问题[6]。我们利用MSCs通过旁分泌机制实现治疗损伤的特性,制备MSCs条件培养基,以观察其对于DN的治疗作用。MSCs不仅通过旁分泌分泌细胞因子,而且其条件培养基中的因子可以趋化性的到达损伤部位,使损伤部位细胞增殖、凋亡减轻,这些都是MSCs条件培养基治疗作用的一些特点[7,8]。
MSCs条件培养基治疗损伤有许多优点,但如何能长期稳定释放连续治疗DN是目前存在的问题。如果一次性腹腔注射,随着吸收及时效的延长会影响治疗作用的发挥。我们利用微量渗透泵长效缓慢释放的特点,通过无菌手术植入实验动物皮下或腹腔内,从而使药物持续稳定地释放[9]。本研究采用Alzet 2ML2型微量渗透泵,可装入2 ml的条件培养基,并且以恒定速度(5μl/h)向外输出,持续时间长达2周。该途径给药能够起到持续、恒定、稳定的作用,减少药物浓度波动对实验的影响[10,11]。
本研究结果表明MSCs条件培养基缓慢释放的确能降低DN大鼠的血糖及胰岛素释放水平,降低血肌酐和血尿素氮,同时减少24 h尿蛋白量,进而改善肾功能,然而甘油三酯的变化不太明显,可能是由于实验时间等因素的影响。病理结果也显示MSCs条件培养基治疗后能降低系膜截面积和肾小球体积,提示MSCs条件培养基能够减轻系膜增生和系膜基质聚集[12,13]。
Western印迹监测结果显示,与正常组大鼠相比,MSCs条件培养基组大鼠nephrin蛋白的表达情况显著降低(P<0.05),但与DN模型组相比显著增加(P<0.05),表明MSCs条件培养基能减轻一些nephrin的损伤,这一结果与24 h尿蛋白定量的结果也比较符合。以上结果进一步证明MSCs条件培养基缓慢释放对DN有治疗修复作用。
综上所述,MSCs条件培养基对DN损伤具有治疗作用,可避免移植细胞带来的不良反应;Alzet微量渗透泵持续缓慢释放的特性为MSCs在DN的应用方面提供了新的思路。
【参考文献】
[1] Ruilope LM, Agarwal R, Chan JC,etal. Rationale, design, and baseline characteristics of ARTS-DN: a randomized study to assess the safety and efficacy of finerenone in patients with type 2 diabetes mellitus and a clinical diagnosis of diabetic nephropathy[J]. Am J Nephrol, 2014, 40(6): 572-581. DOI: 10.1159/000371497.
[2] Gnecchi M, Danieli P, Malpasso G,etal. Paracrine mechanisms of mesenchymal stem cells in tissue repair[J]. Methods Mol Biol, 2016, 1416: 123-146. DOI: 10.1007/978-1-4939-3584-0_7.
[3] Guo J, Cheng C, Chen CS,etal. Overexpression of fibulin-5 attenuates ischemia/reperfusion injury after middle cerebral artery occlusion in rats[J]. Mol Neurobiol, 2016, 53(5): 3154-3167. DOI: 10.1007/s12035-015-9222-2.
[4] Ma ST, Liu DL, Deng JJ,etal. Effect of arctiin on glomerular filtration barrier damage in STZ-induced diabetic nephropathy rats[J]. Phytother Res, 2013, 27(10): 1474-1480. DOI: 10.1002/ptr.4884.
[5] Lim JY, Park MJ, Im KI,etal. Combination cell therapy using mesenchymal stem cells and regulatory T-cells provides a synergistic immunomodulatory effect associated with reciprocal regulation of TH1/TH2 and th17/treg cells in a murine acute graft-versus-host disease model[J]. Cell Transplant, 2014, 23(6): 703-714. DOI: 10.3727/096368913X664577.
[6] Cantinieaux D, Quertainmont R, Blacher S,etal. Conditioned medium from bone marrow-derived mesenchymal stem cells improves recovery after spinal cord injury in rats: an original strategy to avoid cell transplantation[J]. PLoS One, 2013, 8(8): e69515. DOI: 10.1371/journal.pone.0069515.
[7] Akyurekli C, Le Y, Richardson RB,etal. A systematic review of preclinical studies on the therapeutic potential of mesenchymal stromal cell-derived microvesicles[J]. Stem Cell Rev, 2015, 11(1): 150-160. DOI: 10.1007/s12015-014-9545-9.
[8] Ju GQ, Cheng J, Zhong L,etal. Microvesicles derived from human umbilical cord mesenchymal stem cells facilitate tubular epithelial cell dedifferentiation and growthviahepatocyte growth factor induction[J]. PLoS One, 2015, 10(3): e0121534. DOI: 10.1371/journal.pone.0121534.
[9] Wedel J, Weij M, Oosten AS,etal. Simultaneous subcutaneous implantation of two osmotic minipumps connected to a jugular vein catheter in the rat[J]. Lab Anim, 2014, 48(4): 338-341. DOI: 10.1177/0023677214543089.
[10] Jankun J. Challenging delivery of VLHL NS plasminogen activator inhibitor-1 by osmotic pumps in diabetic mouse: a case report[J]. Exp Ther Med, 2012, 4(4): 661-664. DOI: 10.3892/etm.2012.639.
[11] Ewan EE, Hagg T. Intrathecal acetyl-L-carnitine protects tissue and improves function after a mild contusive spinal cord injury in rats[J]. J Neurotrauma, 2016, 33(3): 269-277. DOI: 10.1089/neu.2015.4030.
[12] Griffin TP, Martin WP, Islam N,etal. The promise of mesenchymal stem cell therapy for diabetic kidney disease[J]. Curr Diab Rep, 2016, 16(5): 42. DOI: 10.1007/s11892-016-0734-6.
[13] Lv S, Liu G, Sun A,etal. Mesenchymal stem cells ameliorate diabetic glomerular fibrosisinvivoandinvitroby inhibiting TGF-β signallingviasecretion of bone morphogenetic protein 7[J]. Diab Vasc Dis Res, 2014, 11(4): 251-261. DOI: 10.1177/1479164114531300.

