采用柱后抑制器技术降低流动相中三氟乙酸对质谱信号抑制作用的研究
张婷婷,刘绿叶,张艳海,金 燕
(赛默飞世尔科技(中国)有限公司,上海 201206)
采用柱后抑制器技术降低流动相中三氟乙酸对质谱信号抑制作用的研究
张婷婷,刘绿叶,张艳海,金 燕
(赛默飞世尔科技(中国)有限公司,上海 201206)
研究柱后抑制器(CSRS)技术有效降低流动相中三氟乙酸(TFA)对质谱信号的抑制. 采用双三元液相系统,左泵以反相模式分离细胞色素C酶解肽段(流动相含0.1 %TFA,流速0.25 mL/min),柱后选择CSRS作为抑制器.同时右泵提供碳酸氢铵(浓度为0.05 mol/L,流速1.00 mL/min)作为再生液. 碳酸氢铵和三氟乙酸在抑制器CSRS中通过阴离子交换膜进行离子交换,降低流动相中TFA离子抑制效应,提高肽段在质谱上的响应(S/N提高1~16倍). 采用柱后抑制器技术对硫酸依替米星主成分及杂质进行定性分析(0.2 mol/L TFA),流动相经过抑制器后由强酸性变成中性,实现样品在LC和MS之间无缝连接分析.
抑制器;高效液相色谱;质谱;三氟乙酸;多肽;硫酸依替米星
在反相色谱法分离多肽和蛋白质的试验中,三氟乙酸 (TFA) 是最常用的离子对试剂,流动相中的三氟乙酸通过与疏水键合相和残留的极性表面以多种模式相互作用,能够改善峰形、克服峰展宽和拖尾的问题[1-3]. 但由于含有三氟乙酸的流动相对化合物离子化会产生较强的抑制作用,一定程度上降低了液质联用技术的灵敏度和分析可靠性[4].
目前常用的方法是降低流动相中TFA浓度, 达到降低电离抑制作用的目的. 但是TFA属于强酸,极易电离,一般在流动相中的含量为0.1 %. 如果继续降低其含量会造成色谱分析质量的降低. 而如果用甲酸代替TFA, 虽然能够提高电离效率,增加目标物的响应值[5-6],但是对于多肽等生物样品的色谱峰形分离度的改善效果不及TFA,会造成色谱分离柱效降低,达不到理想的分离效果[7-8].
有文献针对该问题采用TFA-Fix的方法[9],即在色谱柱后加入丙酸. 丙酸的沸点高于TFA,在ESI过程中,TFA先挥发,丙酸和分子离子形成的离子对稳定性较差,倾向于形成丙酸根和准分子离子 ,降低TFA的离子抑制效应,提高样品在质谱中的灵敏度而不用改变LC的条件和分离效果,但是提高倍数有限(2-5倍)[10].
基于TFA在流动相中强电离的性质,采用双三元液相色谱系统[11-13]和柱后抑制器(CSRS)技术[14],将两个泵分别作为流动相的输液泵和柱后再生液的传输泵,通过抑制器将流动相中的TFA和碳酸氢铵进行离子交换,显著降低流动相中TFA的含量,从而降低对质谱ESI离子化产生的抑制作用,实现与质谱的兼容. 其抑制原理:柱后抑制器技术利用了CSRS阴离子交换膜的原理,将再生液中的HCO3-与流动相中的TFA-进行离子交换,从根本上降低流动相中TFA-的浓度,而HCO3-与流动相中H+结合生成水和二氧化碳(如图1所示). 经过pH计验证,流动相流经抑制器CSRS后pH值由酸性迅速升至中性,达到降低流动相中TFA含量的目的.

图1 柱后抑制器CSRS的抑制原理图Fig.1 Schematic diagram of CSRS
1 试验部分
1.1 仪器与试剂
Dionex Ultimate 3000系统(美国,赛默飞世尔科技);双三元液相色谱泵:DGP-3600SD、自动进样器:WPS-3000TSL、柱温箱:TCC-3000SD、检测器:Thermo TSQ Vantage、色谱软件:Chromeleon Chromatography Data System 7.2和Xcalibur;色谱柱:Acclaim C18,2.1 mm×150 mm,3 μm(P/N 059130,S/N 002486);Sartorius BS21S型电子天平(德国,赛多利斯公司),所有用水均为纯水机(美国,赛默飞世尔科技)产生的纯水(电阻率18.2 MΩ·cm). 乙腈,HPLC级(批号为131445,赛默飞世尔科技(中国)有限公司);三氟乙酸,HPLC级(批号7A01K090,安谱分析仪器有限公司);碳酸氢铵,分析纯AR(批号20120327,国药集团化学试剂有限公司);细胞色素C的酶解片段(P/N 161089,赛默飞世尔科技(中国)有限公司);硫酸依替米星氯化钠注射液,批准文号:国药准字H20051632,宁波天衡药业股份有限公司.
1.2 试验方法
1.2.1 色谱条件及仪器装置图
色谱条件:以Acclaim C18为色谱柱;温度:35 ℃;右泵:A通道为95%超纯水/5%乙腈/0.1% TFA,B通道为5%超纯水/95%乙腈/0.1% TFA;流速为0.25 mL/min;左泵:0.05 mol/L NH4HCO3, 流速1 mL/min;抑制器: CSRS Ultra II, 2 mm,化学抑制模式;TSQ Vantage质谱检测器参数:离子化方式:ESI,正模式;电压: 3 000 V;毛细管温度: 350.0 ℃;喷雾温度:400.0 ℃;鞘气压力:4 MPa;离子吹扫压力:0 MPa;辅助气压力: 12 MPa;扫描范围: 200~1 200 m/z;质谱扫描参数:扫描时间 0.286 s. 仪器连接如图2所示.

图2 柱后抑制器技术的HPLC-MS/MS系统结构图Fig.2 Configuration of HPLC-MS/MS with CSRS
1.2.2 对照品溶液和供试品溶液制备
细胞色素C酶解肽段的溶液配制:将1.6 nmol的固体样品溶解于200 μL右泵的流动相A溶液中,得到8 pmol/L的待测样品溶液,具体样品分子结构及分子量如表1所列.
硫酸依替米星溶液配制:每100 ml超纯水中含100 mg依替米星与0.9 g氯化钠,用0.45 μm滤膜过滤后直接进样分析.
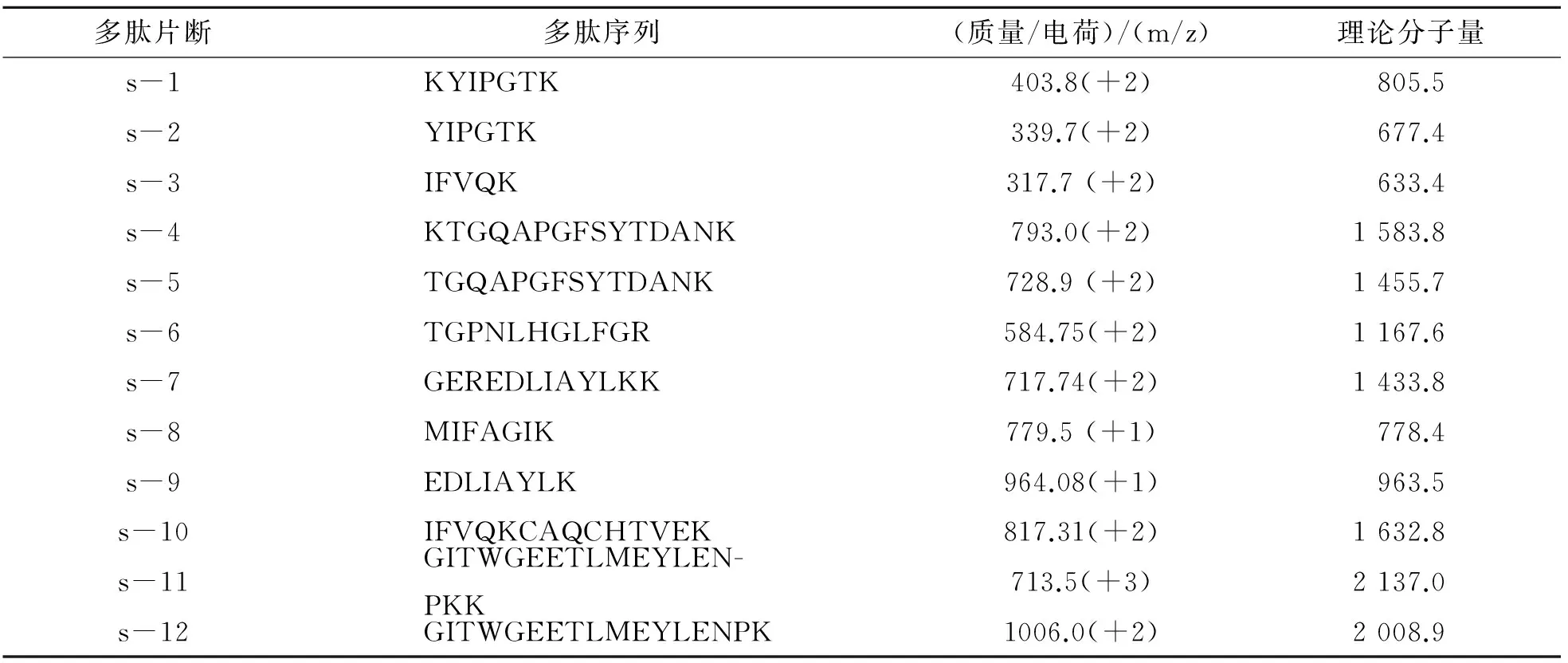
表1 细胞色素C酶解多肽片断的信息Table 1 Information of Cytochrome C digest
2 结果与讨论
2.1 抑制器技术对对灵敏度的影响
比较直接进MS/MS和经过抑制器后再进MS/MS的多肽样品灵敏度,由表2可知,经过抑制器抑制后大部分多肽的响应值显著提高,最高的可达到16倍.
其中部分多肽样品S-10和S12抑制前后的灵敏度反而降低(表2),可能原因:(1)与多肽本身结构有关,因为基于阴离子交换膜原理,可能有些多肽为离子态被交换到再生液中而降低其响应值;(2)梯度条件中乙腈含量越来越高,而CSRS的离子交换膜对有机试剂的耐受性不好,因此会影响高浓度乙腈条件下出峰的多肽样品灵敏度.

表2 柱后抑制器技术对多肽质谱灵敏度影响Table 2 Effect of CSRS on MS/MS sensitivity
2.2 抑制器中再生液NH4HCO3浓度对灵敏度的影响
比较柱后抑制器CSRS中再生液浓度对多肽样品灵敏度的影响,当NH4HCO3浓度为0.05 mol/L时,多肽在质谱上的灵敏度比0.1 mol/L和0.025 mol/L的NH4HCO3更高,如表3所列. 由表3可见,在此浓度条件下,HCO3-能够最大程度地将TFA-交换到再生液中,从而更好降低TFA对质谱的影响.

表3 再生液NH4HCO3浓度对多肽质谱灵敏度影响Table 3 Effect of NH4HCO3 on MS/MS sensitivity
*:提高比例为该再生液浓度条件下,质谱峰的信噪比(S/N)与无再生液条件下质谱峰的信噪比(S/N)的比值.
2.3 抑制器中再生液流速对灵敏度的影响
比较了柱后抑制器的再生液流速对灵敏度的影响. 在0.5~3.0 mL/min 流速范围内,随着流速的增加,灵敏度先增加后降低,所以一般推荐1 mL/min 作为最佳再生液的流速(图3). 根据CSRS抑制器的工作原理,随着流速的增加,再生液在单位时间内提供的HCO3-离子数量增加,通过CSRS的阴离子交换膜与分析流动相中TFA-离子进行充分的离子交换,使更多的TFA-离子交换到再生液流路中,显著降低TFA对多肽样品的抑制作用. 因此在流速0.5~1.0 mL/min 流速范围内,随着流速的增加,多肽样品的灵敏度显著增加,当再生液流速为1.0 mL/min时,达到最佳离子交换值. 继续增加再生液流速,多肽样品的灵敏度反而降低,可能是流速太快,导致HCO3-和TFA-离子不能得到充分交换,从而影响多肽样品的灵敏度.
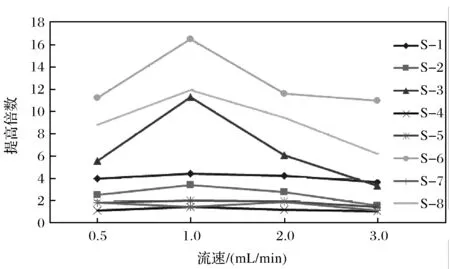
图3 柱后抑制器CSRS中再生液流速对多肽的MS灵敏度影响Fig.3 Effect of flow rate of NH4HCO3 on MS/MS sensitivity
2.4 实际应用案例
氨基糖苷类抗生素(硫酸依替米星)的LC-MSMS快速分析:参考2015版药典的方法对硫酸依替米星中的主成分和杂质进行分离分析. 由于流动相中TFA含量约为1 %(0.2 mol/L),浓度非常高,如果直接进质谱对化合物进行定性分析非常困难. 高含量的TFA完全抑制了硫酸依替米星中各化合物在ESI上的电离,灵敏度非常低,如图4(a)所示. 因此考虑采用柱后加抑制器CSRS的方法,通过加入合适浓度和流速的再生液(0. 1 mol/L的NH4HCO3),置换流动相中的TFA,显著降低流动相中TFA的抑制作用. 按照图1进行系统连接,通过双三元液相色谱系统实现质谱前端快速直接除去TFA的目的,TSQ可便捷高效地对硫酸依替米星主成分及杂质进行定性分析,如图4(b)所示,对应的色谱和质谱结果如表4所列,与文献的报道一致[15-16].
比较通过CSRS抑制前后硫酸依替米星的LC/MSMS试验结果,认为柱后阳离子抑制器(CSRS)能够快速高效实现LC与MS/MS的在线连接,大大提高了液质联用的工作效率.
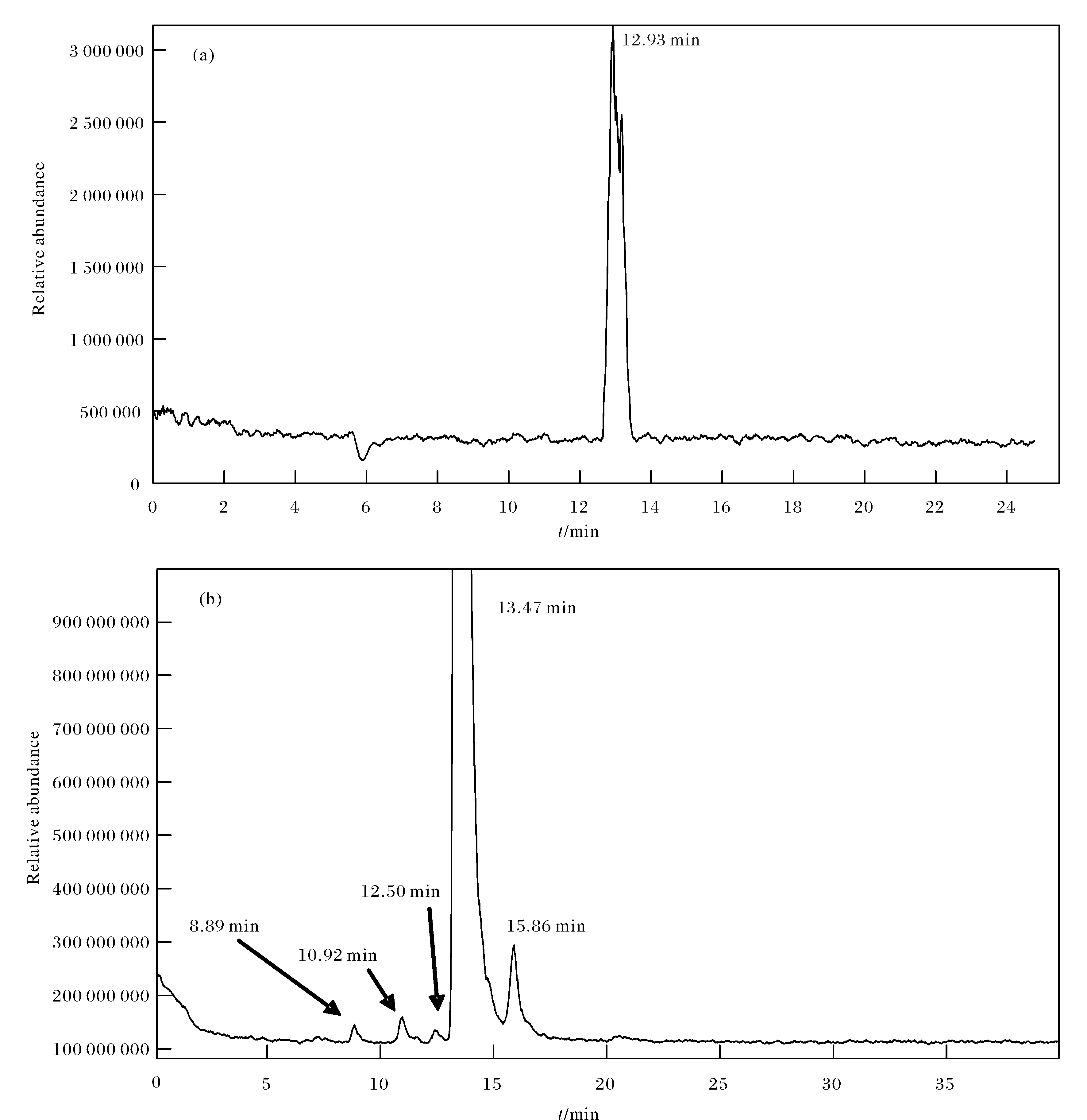
图4 硫酸依替米星直接进TSQ/经过CSRS抑制后进TSQ谱图Fig.4 Mass chromatograms of etimicin sulfate with and without CSRS(a)Without CSRS,(b)With CSRS
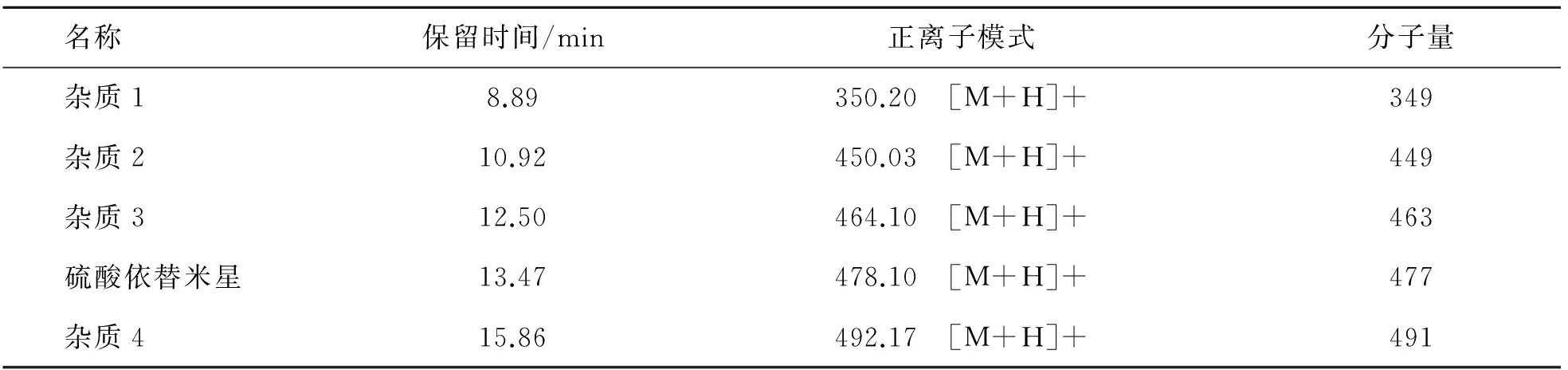
名称保留时间/min正离子模式分子量杂质18.89350.20 [M+H]+349杂质210.92450.03 [M+H]+449杂质312.50464.10 [M+H]+463硫酸依替米星13.47478.10 [M+H]+477杂质415.86492.17 [M+H]+491
3 结论
采用柱后NH4HCO3再生液通过CSRS阳离子抑制器,在不改变分析流动相TFA含量的条件下,待测样品直接进ESI离子源的质谱仪进行定性分析,充分利用双泵的功能,同时进行样品分析和柱后再生液添加,通过CSRS阴离子交换膜降低流动相中TFA的含量,从而大大提高多肽样品在质谱上的灵敏度.
以中国2015版药典中的药品硫酸依替米星分析为例,高效便捷实现液相和质谱的在线连接,显著提高硫酸依替米星主成分及杂质定性分析结果的可靠性.
[1] Matthew E, Goodwin L. Bioanalytical approaches to analyzing peptides and proteins by LC-MS/MS [J]. Bioanalysis, 2011, 12(3):1379-1397.
[2] Giuseppe P, Oceania D, Filomena T, et al. Evaluation of mobile phase, ion pairing, and temperature influence on an HILIC-MS/MS method for L-arginine and its dimethylated derivatives detection[J].Journal of Separation Science,2008,31(13):2424-2429.
[3] Thomas M, Annesley. Ion suppression in mass spectrometry[J].Clinical Chemistry, 2003, 49(7):1041-1044.
[4] Thomas M. Methanol-associated matrix effects in electrospray ionization tandem mass spectrometry [J]. Clinical Chemistry, 2007, 53(10): 1827-1834.
[5] Asish B C, Scott J B. Use of an integrated MS - multiplexed MS/MS data acquisition strategy for high-coverage peptide mapping studies [J]. Rapid Communications in Mass Spectrometry, 2007, 21(5): 730-744.
[6] Ackermann B L, Berna M J. Coupling immunoaffinity techniques with MS for quantitative analysis of low-abundance protein biomarkers[J]. Expert Review of Proteomics, 2014, 4(2): 175-186.
[7] Stao Y, Nagata M, Tetsuka K, et al. Optimized methods for targeted peptide-based quantification of human uridine 5′-diphosphate-glucuronosyl transferases in biological specimens using liquid chromatography-tandem mass spectrometry[J]. Drug Metabolism & Disposition, 2014, 42(5): 885-889.
[8] Junichi K, Sumio O, Ryo I, et al. Quantitative atlas of membrane transporter proteins: development and application of a highly sensitive simultaneous LC/MS/MS method combined with novel in-silico peptide selection criteria[J]. Pharmaceutiacal Research, 2008, 25(6):1469-1483.
[9] Ang L, Joseph T, Chad E W. Investigation of an on-line two-dimensional chromatographic approach for peptide analysis in plasma by LC-MS-MS [J]. Journal of Chromatography B, 2009, 877(20-21): 1873-1881.
[10] Wilson Z S, Wang N D. Simple means to alleviate sensitivity loss by trifluoroacetic acid (TFA) mobile phases in the hydrophilic interaction chromatography-electrospray tandem mass spectrometric (HILIC-ESI/MS/MS) bioanalysis of basic compounds [J]. Journal of Chromatography B, 2005, 825(55):186-192.
[11] Cheng X L, Guo L P, Li Z Q, et al. A HPLC method for simultaneous determination of 5-aminoimidazole- 4-carboxamide riboside and its active metabolite 5-aminoimidazole-4-carboxamide ribotide in tumor-bearing nude mice plasma and its application to pharmacokinetics study [J]. Journal of Chromatography B, 2013, 915-916: 64-70.
[12] Zeng M F, Zhang J, Yang Y F, et al. An automated dual-gradient liquid chromatography-MS/MS method for the simultaneous determination of ferulic acid, ligustrazine andligustilide in rat plasma and its application to a pharmacokinetic study[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014,88(32):354-363.
[13] 黄超群,刘绿叶,吕春华,等. 柱后补偿-液相色谱-电喷雾式检测器测定饮料中的三氯蔗糖[J] .分析化学,2014,42(12):1869-1870.
[14] Paul R H, Peter E J, Matthew J S. Developments in suppressor technology for inorganic ion analysis by ion chromatography using conductivity detection [J]. Journal of Chromatography B, 2003, 1000(1-2):725-742.
[15] Yuan Y Z, Zhang M, Qian W, et al. Determination of methacycline and its related substances in the bulk material of methacycline hydrochloride and its preparations by HPLC[J]. Journal of Pharmaceutical and Biomedical Aanlysis, 2012, 70(5): 212-213.
[16] 吴宇宁,赵卫,朱晓玥,等. 硫酸依替米星含量测定及有关物质反相高效液相色谱-脉冲安培电化学法的建立[J] . 中国药学杂志,2015,50(20):1797-1806.
Enhancement of Sensitivity for Bioanalysis by Liquid Chromatography-Electrospray Mass Spectrometry with Trifluoroacetic Acid in Mobile Phase Using a Suppressor
ZHANG Ting-ting, LIU Lv-ye, ZHANG Yan-hai, JIN Yan
(ShanghaiApplicationLab,ThermofisherScientific,Shanghai201206,China)
A method is described to improve the sensitivity of biological samples in LC-MS which contains trifluoroacetic acid(TFA) in the mobile phase by adding a suppressor (CSRS Ultra II) after the column. The method is developed on dual-gradient liquid chromatographic(DGLC) systems. And one peptide sample hydrolyzed by cytochrome C was analyzed on the left pump by the reversed phase model where the mobile phase contained 0.1 % TFA and the flow rate was 0.25 mL/min. 0.05 mol/L ammonium bicarbonate solution was delivered by the right pump with a flow rate of 1.00 mL/min. The two mobile phases converged in the post-column suppressor after which the concentration of TFA was reduced. As a result, the signal of peptide analyzed by MS improved about 1-fold to 16-fold. Using this method, the qualitative analysis of impurities in etimicin sulfate drug was perfectly achieved without any additional operations between LC and MS.
suppressor;HPLC;MS;TFA;peptides;etimicin sulfate
分析测试新成果(018~023)
2017-01-06;
2017-02-20.
张婷婷(1982 -),硕士,主要研究方向为高效液相色谱系统在生物制药领域的应用,Tel:13818636877,E-mail:tingting.zhang@thermofisher.com.
O657.3
B
1006-3757(2017)01-0018-06
10.16495/j.1006-3757.2017.01.004

