超高效液相色谱-串联质谱法测定食品中4种罂粟壳生物碱
颜晓丽
(佛山市质量计量监督检测中心, 广东 佛山 528200)
超高效液相色谱-串联质谱法测定食品中4种罂粟壳生物碱
颜晓丽
(佛山市质量计量监督检测中心, 广东 佛山 528200)
建立了超高效液相色谱-串联质谱法(UPLC-MS/MS)测定食品中可卡因、可待因、吗啡、盐酸罂粟碱的检测方法. 样品经氨化甲醇提取,采用 Capcell Pak C18(250 mm×2.0 mm,MGII 5 μm) 色谱柱,以色谱纯乙腈为流动相A,以20 mmol/L 乙酸铵和0.1%甲酸缓冲液为流动相B,进行梯度洗脱. 在优选条件下,可待因、吗啡方法线性范围为5.0~50.0 μg/L,可卡因、盐酸罂粟碱的方法线性范围为1.0~20.0 μg/L,相关系数均大于0.999,方法检出限在0.1~0.8 μg/kg之间,平均回收率为76.0%~111.2%,相对标准偏差RSD低于10%.
超高液相色谱-串联质谱;可卡因;可待因;吗啡;盐酸罂粟碱
罂粟属罂粟科植物,是制取鸦片的主要原料,同时其提取物也是多种镇静剂的原料,其果实中含有吗啡、可卡因、可待因、盐酸罂粟碱等20多种生物碱. 国际条约关于麻醉品和精神药物管理指导原则中规定吗啡、可待因、罂粟碱、可卡因4种生物碱禁止用于食品,国家卫计委、公安部、国家药品监督管理局相关法规规定严禁在食品中添加罂粟壳(籽). 通过检测吗啡、可卡因、可待因、盐酸罂粟碱可实现对食品中罂粟壳非法添加情况的监测.
目前,吗啡、可卡因、可待因、盐酸罂粟碱的检测方法主要有薄层色谱法[1]、气相色谱法[2]、高效液相色谱法[3-4]、极谱法[5]、免疫测定法[6]、气相色谱-质谱法[7-9]等. 其中气相色谱方法和气相色谱-质谱法不适用于难挥发、强极性和易热解化合物的检测,且样品需要衍生化处理,操作繁琐. 酶联免疫吸附试验(ELISA)方法存在交叉反应,特异性较差. HPLC法的灵敏度较低. 液相色谱-串联四极杆质谱联用仪具有较好的灵敏度和特异性,随着科学仪器的不断发展,近年来有不少使用液相串联质谱检测生物碱的报道[9-12]. 但是运用超高效液相色谱-串联质谱法同时检测食品中罂粟碱、吗啡、可待因和可卡因的报道较少,同时这些检测方法使用直接进标准溶液,得到的峰面积响应值对标准溶液浓度作图,得到标准曲线计算样品目标物浓度,这种方法无法排除待检物基质和前处理溶剂提取效率对于待测物实测浓度的影响. 本研究采用超高效液相色谱-串联质谱法(UPLC-MS/MS),通过空白样品加标,建立标准曲线的方法,建立快速准确测定食品中盐酸罂粟碱、吗啡、可卡因和可待因的方法. 该方法的灵敏度高,可靠性较强,结果令人满意.
1 试验部分
1.1 仪器与试剂
Agilent1290II-6470 Triple Quad 超高效液相-串联三重四极杆质谱联用仪(美国Agilent公司),Cenece@ TDZ5-WS离心机(湖南赛特湘仪离心机仪器有限公司),Vortex kylin-bell@5旋涡混合仪(美国),国华SHA-C恒温振荡器.
乙腈、甲醇和正己烷均为色谱纯(Merck, Darmstadt, Germany); 乙酸铵、甲酸为色谱纯(恩科化学有限公司). 试验用水均来自Milli-Q纯水系统(法国Millipore公司). 可待因、可卡因、吗啡、盐酸罂粟碱标准品由中国药品生物制品检定所提供. 调味油、调味酱、火锅料样品来源于超市、生产厂家等市场定期监督抽查样本,共计15例.
1.2 标准贮备液的配制
准确称取4种生物碱标准品各10.0 mg于4个10 mL容量瓶中, 用少量甲醇溶解后, 并用甲醇定容至刻度,做为标准贮备液(1.0 mg/mL).
1.3 色谱条件
色谱柱:Capcell Pak C18(250 mm×2.0 mm,MGII 5 μm),柱温:30 ℃,流速:0.2 μL/min;以色谱纯乙腈为流动相A,以20 mmol/L乙酸铵和0.1%甲酸缓冲液为流动相B,按照表1进行梯度洗脱.
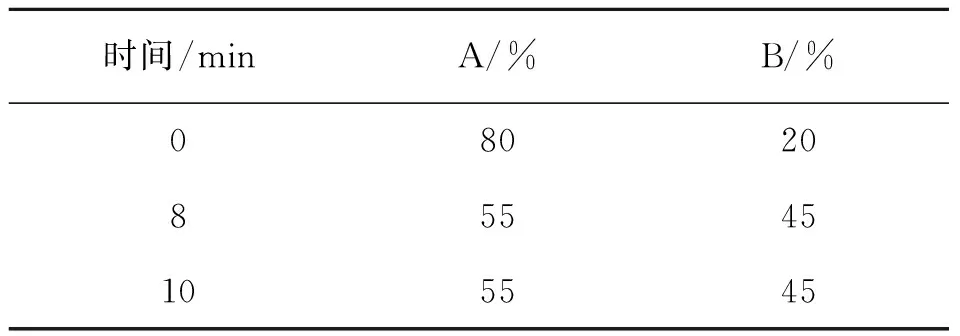
表1 梯度洗脱程序Table 1 Gradient elution parameter
离子源:电喷雾电离-正离子模式(AJS ESI+);检测方式:动态多反应模式检测(DMRM);喷嘴电压:500 V;毛细管电压:3 500 V; 干燥气温度:300 ℃;干燥气流速:5 L/min;鞘气温度:250 ℃;鞘气流速:11 L/min. 经过对毛细管出口去簇电压(DP)、碰撞池能量(CE)等质谱参数的优化,最终确定可待因、可卡因、吗啡、盐酸罂粟碱质谱条件,如表2所列.
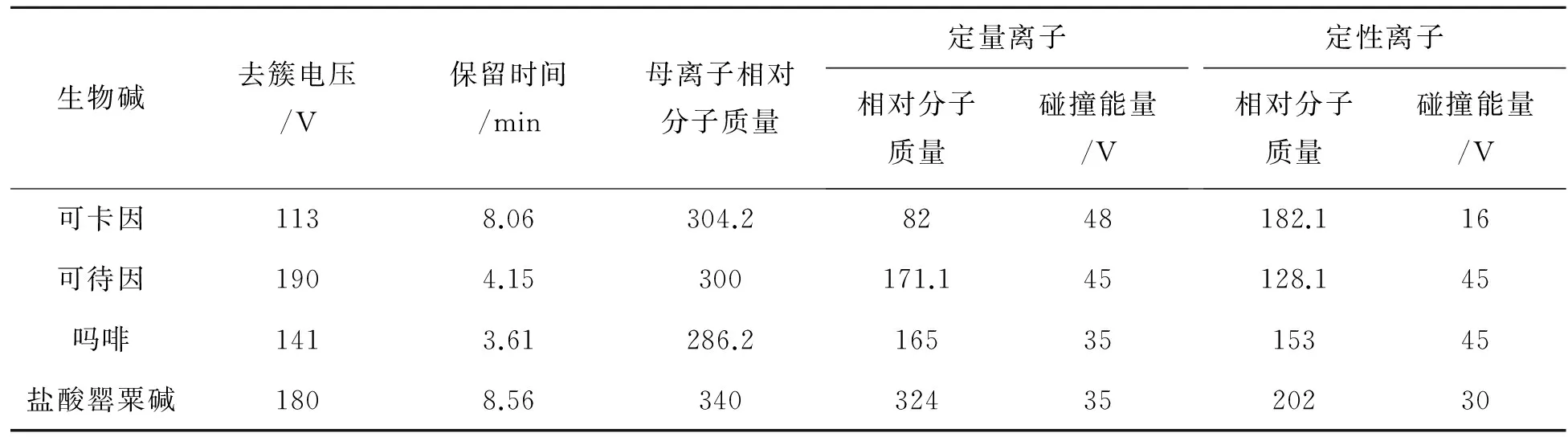
表2 可待因、可卡因、吗啡、盐酸罂粟碱的优化MRM参数Table 2 Optimized MRM parameters for cocaine, codeine, morphine and papaverine hydrochloride
1.4 样品处理
油状调味油和调味酱,可以直接取样进行前处理. 含有颗粒的调味酱混合均匀后取样. 半固体和固态火锅料样品,研磨粉碎后均匀取样.
前处理步骤为,称取1.00 g均匀样品于25 mL离心管中,加入5 mL 5%氨化甲醇,涡旋3 min后,振荡提取20 min,于离心机2 500 r/min离心5 min,移取有机相层至另一离心管中,用5 mL 5%氨化甲醇再次按照上述步骤提取残渣,合并有机相,然后用甲醇饱和的正己烷去除有机相中油脂,除去正己烷层,有机相在60 ℃挥干,用甲醇定容至500 μL, 过0.22 μm聚四氟乙烯滤膜,待UPLC-MS/MS测定.
调味油、调味酱和火锅汤料经上述方法前处理后,上机检测各生物碱,其响应值低于方法检出限时,该样品可以作为空白基质,用于标准曲线的配置. 具体步骤为:称取1.00 g混合均匀的调味酱空白基质样品,添加不同量的标准物质,按上述前处理步骤,根据检测需要得到一系列不同浓度的基质提取液,用于标准曲线的绘制.
2 结果与讨论
2.1 色谱条件优化
2.1.1 色谱柱的选择
在流动相A和B的体积比为50∶50和多反应监控(MRM)模式下,考查了使用Allure PFP Propyl (100 mm×2.1 mm×5 μm),Capcell Pak C18(250 mm×2.0 mm,MGⅡ 5 μm),PC HILIC (100 mm×2.0 mm×5 μm) 和Ultra IBD柱(50 mm×2.1 mm×5 μm) 4种色谱柱对可待因、可卡因、吗啡、盐酸罂粟碱进行分离. 结果表明,Capcell Pak C18(250 mm×2.0 mm,MGⅡ 5 μm) 对于这4种生物碱的分离效果和峰形最好. 究其原因,Capcell Pak C18柱子的填料为硅聚合物覆盖的连接C18基团的硅胶球,具有合适的极性和疏水分离性,可耐受的pH范围较广(2~10),适合碱性较强的化合物的分离,因此后续的优化均采用该色谱柱.
2.1.2 流动相的优化
为了达到最好的分离效果同时兼顾检测效率,在多反应监控(MRM)模式下分别考查了流动相A和B的体积比在20∶80、30∶70、50∶50、80∶20下,4种生物碱的混合标准样品(10 μg/L)的分离情况,最终得出如表1所列的梯度洗脱程序. 4种生物碱的MRM色谱图如图1所示.
2.1.3 标准工作曲线及检出限
如果采用外标法,直接使用标准溶液浓度对响应峰面积作图,得出标准曲线,计算目标物浓度,则无法排除基质和溶剂提取效率的影响,得出的回收率低于50%. 因此,为了扣除基质干扰,提高定量的准确性,选择了基质空白加不同浓度标准溶液,经前处理步骤后上机,得出相应的峰面积响应值,绘制标准曲线,外标法定量. 以空白加标后,前处理上机前,可待因、吗啡的加标质量浓度分别为5.0、10.0、20.0、50.0 μg/L,作为X轴,上述加标试验实际得到的峰面积响应值作为Y轴,作图得到标准曲线. 同样的方法得到可卡因、盐酸罂粟碱的标准曲线,所选用的质量浓度为1.0、2.0、5.0、10.0、20.0 μg/L. 得到如表3中的各个生物碱的线性回归方程,用于计算实际样品中待测物的浓度.
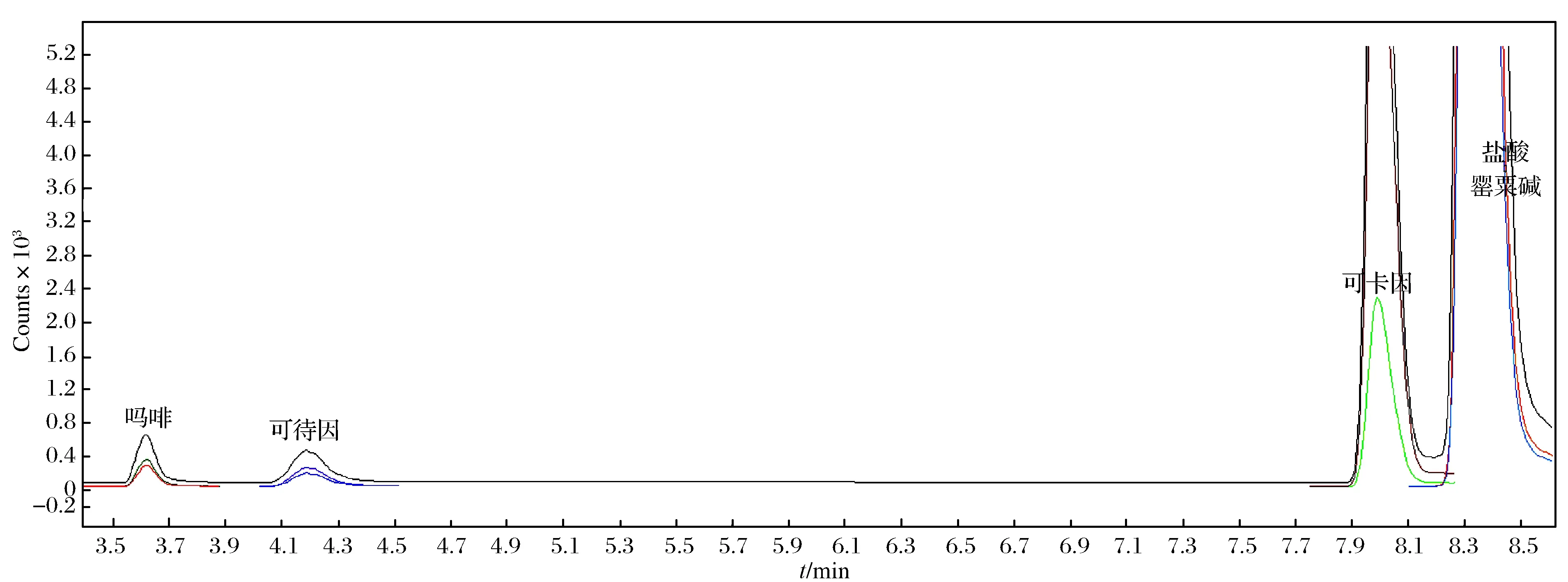
图1 4种生物碱的MRM色谱图Fig.1 MRM extracting spectra of 4 alkaloids
各生物碱最低浓度的添加量通过信噪比S/N = 3时,对应的目标物含量确定仪器检出限IDL,即0.1或0.5 ng,经前处理后,上机测定后得出峰面积响应值,重复进样7次, 按照美国EPA(美国环保局)确定的检出限定义(MDL=t(n-1,1-α=0.99)×S)计算方法检出限,结果如表3所列.
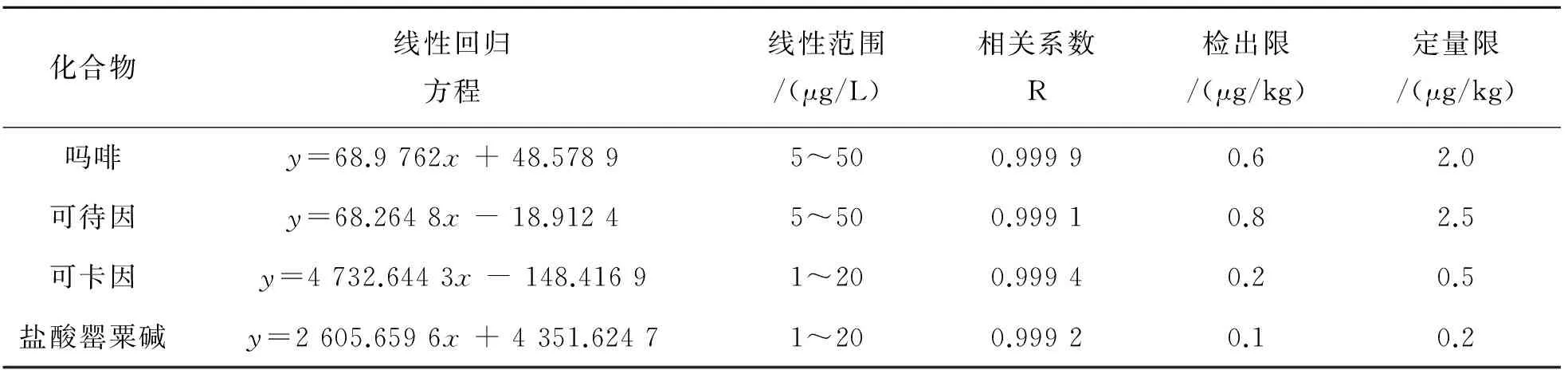
表3 4种生物碱的线性范围、相关系数、方法检出限和方法定量限Table 3 Linear range, relative coefficient, method detection limit (MDL) and method quantification limit (MQL) of 4 alkaloids
2.1.4 回收率与精密度
向混合均匀的调味酱空白样品中分别加入低、中、高水平的吗啡、 可待因、盐酸罂粟碱、可卡因标准品,经前处理后使得上机前质量浓度分别为低(5 μg/L)、中(8 μg/L)、高(10 μg/L)进行加标回收试验.由于该方法中盐酸罂粟碱、可卡因具有较好响应值,额外考查了这两个物质在经前处理后、上机前质量浓度分别为0.5和1 μg/L的加标回收试验. 每个添加水平重复测定6次,结果如表4所列. 由表4可见,该方法的平均回收率为76.0%~111.2%,RSD为0.7%~9.8 %,表明该方法的精密度和准确度良好,可以满足食品中4种生物碱的痕量分析要求. 典型的加标回收试验MRM模式测定图谱如图2所示.
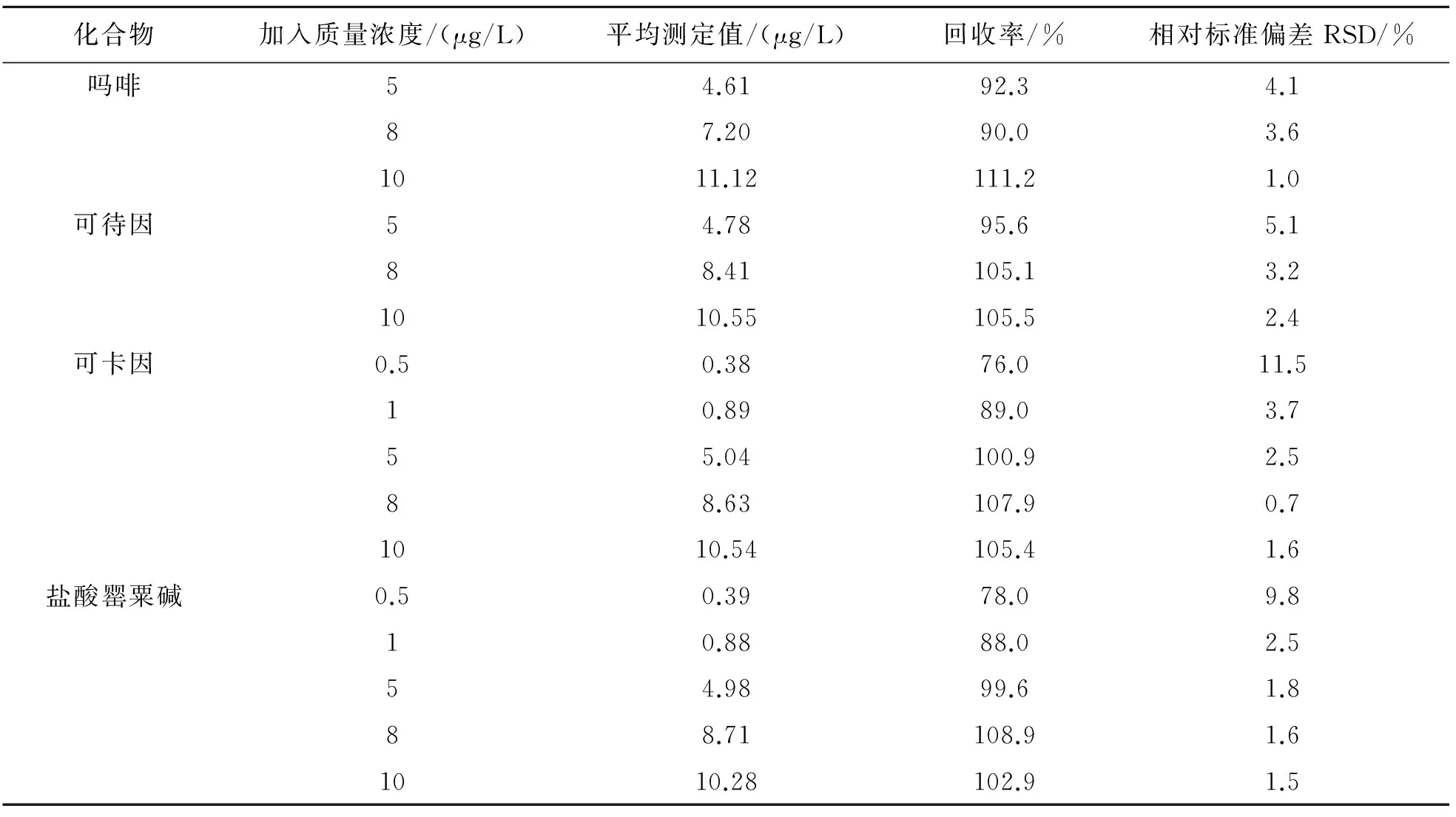
表4 4种生物碱的回收率与精密度测定结果(n=6)Table 4 Determination results for recovery and precision of 4 alkaloids (n=6)
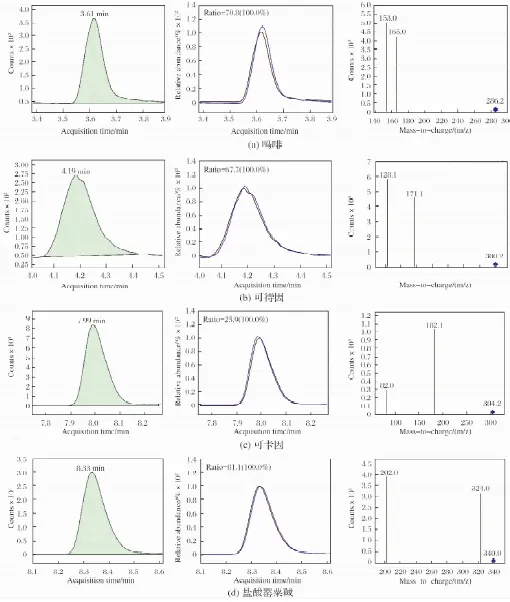
图2 4种生物碱5 μg/L加标回收实验的MRM图谱Fig.2 MRM spectra of recovery experiments under 5 μg/L as spiking concentration for 4 alkaloids
2.1.5 样品测定
样品中4种生物碱计算公式如下:
其中,Co为曲线计算出的生物碱浓度,V为上机前稀释体积,m为样品称量质量.
随机抽取了调味油、调味酱、火锅料样品共15批进行检验,结果如表5所列. 由表5可见,8批次样品中不同程度地检出吗啡、可待因、盐酸罂粟碱、可卡因,表明食品调味料中存在添加罂粟壳的问题. 麻辣粉(序号12)样品检测的MRM色谱图如图3所示.
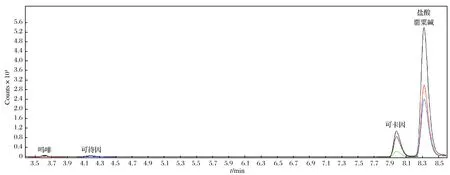
图3 麻辣粉(序号12)样品检测的MRM色谱图Fig.3 MRM spectra for spicy powder (entry 12)
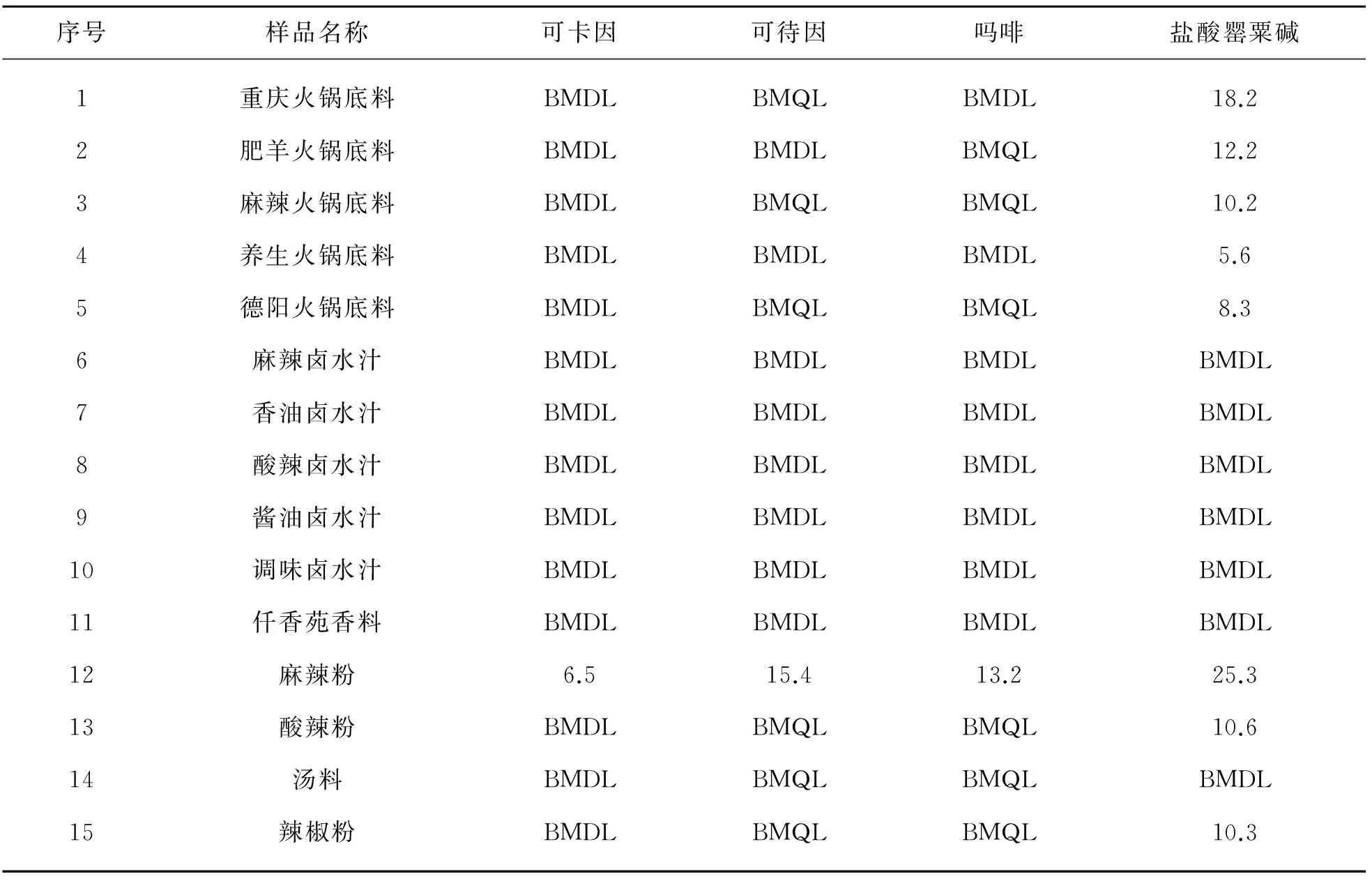
*:BMDL表示低于方法检出限,BMQL表示低于方法检定量限.
3 结论
本研究建立了超高效液相色谱-串联质谱测定食品中吗啡、可待因、盐酸罂粟碱、可卡因等4种罂粟壳生物碱的方法. 该方法检出限在0.1~0.8 μg/L之间,定量限在0.2~2.5 μg/L之间,平均回收率为76.0%~111.2 %,RSD为0.7%~9.8 %. 方法简便快速,精确度、准确度和灵敏度均较高,可满足食品中4种罂粟壳生物碱成分同时定量检测的要求,将为食品安全监管提供强有力的技术支持.
[1] 徐平声,马虹英,雷鹏,等. 薄层色谱法对6种常见麻醉药品的定性定量分析[J]. 中国药学杂志,2003,38(8):619-620.
[2] 季申,王柯.GC法测定中药罂粟壳中吗啡、可待因和罂粟碱的含量[J]. 中草药,1998,29(8):526-528.
[3] 戴维杰,钮伟民.高效液相色谱法检测掺罂粟壳食品中的罂粟碱[J]. 中国卫生检验杂志,2003,13(5):607-608.
[4] 张靖.食品中罂粟碱、吗啡、可待因含量的液相色谱检测法研究[J]. 中国卫生检验杂志,2007,17(1):607-608.
[5] 陶锐.火锅汤料中吗啡的示波极谱测定[J]. 中国卫生检验杂志,1994,4(3):140.
[6] 钮伟民,毛云中,戴维杰.ELISA检测罂粟碱方法学研究[J]. 中国卫生检验杂志,2003,13(5):575-577.
[7] 高玲,杨元,蒲斌.气相色谱-质谱法测定火锅汤料中吗啡[J]. 中国卫生检验杂志,2001,11(1):41-43.
[8] 陈家华. 气相色谱法测定可可类食品中生物碱[J]. 食品科学,1991,12(5):40-43.
[9] 马要兵,张峻松,宋春满,等. GC/MS-SIM测定烟草中的生物碱[J]. 分析试验室, 2010(S1):350-353.
[10] 顾万江,周春艳,唐晓琴,等. 固相萃取-超高效液相色谱-串联质谱法同时测定食品中5种生物碱[J]. 中国卫生检验杂志,2014,24(17):2481-2484.
[11] 王柯,郑荣,简龙海,等. 火锅调料中5种生物碱成分的液相色谱-串联质谱测定法[J]. 中国卫生检验杂志,2011,21(2):363-365.
[12] 秦军燕,陈文,夏寅强,等. HPLC-MS法测定食品中生物碱的研究[J]. 食品工业科技,2012,33(16):73-75.
声明
本刊许可中国学术期刊(光盘版)等数字化传播的声明
本刊已许可中国学术期刊(光盘版)、超星全文"域出版"期刊、《中文科技期刊数据库》、《中国终身教育学术研究数据库》和《万方数据-数字化期刊群》在其系列数据库产品中以数字化方式复制、汇编、发行、信息网络传播本刊全文. 该社著作权使用费与本刊稿酬一并支付. 作者向本刊提交文章发表的行为即视为同意我社上述声明.
《分析测试技术与仪器》编辑部
Simultaneous Determination of Four Opium Poppy Husk Alkaloids in Residues of Foods Using Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
YAN Xiao-li
(FoshanSupervisonTestingCenterofQualityandMetrology,Foshan, 528200,Guangdong,China)
A method of ultra performance liquid chromatography coupled with tandem mass spectrometry(UPLC-MS/MS) was developed for the simultaneous determination of four opium poppy husk alkaloids(i. e., cocaine, codeine, morphine and papaverine hydrochloride) in the residues of foods. The samples were extracted by methanol (containing 5 % ammonia acetate) followed by analyzed on a UPLC-MS/MS system (AJS ESI positive mode) equipped with a Capcell Pak C18(250 mm×2.0 mm,MGII 5 μm) column with the mobile phase of acetonitrile and aqueous solution of ammonium acetate (20 mmol/L) containing formic acid (0.1 %) as the additive. Under optimized conditions, the linear range for codeine and morphine were 5.0~50.0 μg/L, and those for cocaine and papaverine were 1.0~20.0 μg/L, with relative coefficients above 0.999. The limits of detection for the method was in the range of 0.1~0.8 μg/kg, and average spiking recovery was in the range of 76.0%~111.2 % with RSDs below 10%. Key words:UPLC-MS/MS;cocaine; codeine; morphine; papaverine hydrochloride
分析测试新成果(011~017)
2017-01-15;
2017-03-02.
颜晓丽(1980-),女,硕士研究生,质量工程师,主要从事食品分析,E-mail:junouchem@163.com.
O657.32
B
1006-3757(2017)01-0011-07
10.16495/j.1006-3757.2017.01.003

