玉屏风散及过敏煎合止嗽散对PM2.5致Th17/Treg失衡诱发肺损伤大鼠的影响
张晓雅,冯淬灵,孟玉凤,杜建超,岑锦裳,魏永杰
1.北京中医药大学东直门医院,北京 100700;2.沧州市中心医院,河北 沧州 061014;3.北京大学人民医院,北京 100044;4.国药集团广东环球制药有限公司,广东 广州 528303;5.中国环境科学研究院环境基准和风险评估国家重点实验室,北京 100012
玉屏风散及过敏煎合止嗽散对PM2.5致Th17/Treg失衡诱发肺损伤大鼠的影响
张晓雅1,2,冯淬灵3,孟玉凤1,杜建超1,岑锦裳4,魏永杰5
1.北京中医药大学东直门医院,北京 100700;2.沧州市中心医院,河北 沧州 061014;3.北京大学人民医院,北京 100044;4.国药集团广东环球制药有限公司,广东 广州 528303;5.中国环境科学研究院环境基准和风险评估国家重点实验室,北京 100012
目的 观察PM2.5致辅助性T细胞17(TH17)与调节性T细胞(Treg)失衡诱发的大鼠肺损伤及不同中药治法的干预作用。方法将SPF级雄性Wistar大鼠随机分为正常组、模型组、中药1组和中药2组。采用气道滴注方法建立PM2.5致肺损伤模型,模型组和正常组予生理盐水灌胃,中药1组和及中药2组分别予玉屏风散及过敏煎合止嗽散灌胃。ELISA检测各组肺泡灌洗液(BALF)及血清白细胞介素(IL)-17、IL-10、IL-8、中性粒细胞弹性蛋白酶(NE)、黏蛋白(MUC)5AC含量;免疫组化检测肺组织Foxp3、IL-17的表达。结果与正常组比较,模型组血清和BALF IL-8、IL-17、NE、MUCAC含量显著升高,IL-10含量明显降低(P<0.05,P<0.01),肺组织IL-17蛋白表达明显增加、Foxp3蛋白表达明显降低(P<0.01);与模型组比较,中药1组及中药2组血清和BALF IL-8、IL-17、NE含量明显降低,BALF IL-10明显升高,中药2组血清IL-10明显升高(P<0.05),肺组织IL-17蛋白表达明显降低、Foxp3蛋白表达明显增加(P<0.01),病理学变化明显改善。结论PM2.5可通过引起Th17/Treg失衡诱发肺损伤,玉屏风散及过敏煎合止嗽散均可明显改善PM2.5致大鼠肺组织病理损害,并可改善PM2.5导致的TH17/Treg失衡。
玉屏风散;过敏煎合止嗽散;PM2.5;肺损伤;辅助性T细胞17;调节性T细胞;大鼠
近年来,空气污染加重,雾霾频现。细颗粒物(paticulate matter,PM)是雾霾的主要成分。PM2.5有粒径小、面积大、活性强,易附带有毒、有害物质,且在大气中的停留时间长、输送距离远等特点。PM2.5的这些特性决定其表面可以吸附更多有害物质,并且可以自如避开呼吸系统的天然屏障如鼻毛、支气管纤毛等而进入细小支气管及肺组织内,对人体造成更大的损伤。本研究运用过敏煎合止嗽散及玉屏风散干预PM2.5致大鼠肺损伤模型。前者可祛风固卫、宣肺止咳,后者偏于益气固表、防邪外侵。初步探讨2种不同治法的干预作用及机制。
1 实验材料
1.1 动物
清洁级雄性Wistar大鼠24只,鼠龄6~8周,体质量(200±20)g,北京维通利华实验动物技术有限公司,合格证号11400700124029。饲养于20~25 ℃、12 h光照清洁的动物房,自由饮水,进食标准饲料。
1.2 药物及制备
玉屏风散由黄芪、白术、防风组成,国药集团广东环球制药有限公司加工成浸膏剂,用去离子水配制成0.8 g/mL;过敏煎合止嗽散由银柴胡10 g、防风10 g、乌梅 6 g、五味子10 g、陈皮10 g、桔梗10 g、炙紫菀10 g、制百部10 g、荆芥10 g、白前10 g、生甘草4 g组成,购自北京中医药大学东直门医院中药房,北京康仁堂药业有限公司制成颗粒,用去离子水配制成0.172 g/mL药液。
1.3 主要试剂与仪器
PM2.5石英纤维膜由中国环境科学院提供,采集机器为TH-16A型大气颗粒物智能采样仪,采集时间为2015年1月-3月,采集地点为中国环境科学院北段大楼楼顶。每张膜约含PM2.5量120 mg,共6张膜,制成PM2.5悬液。大鼠白细胞介素(IL)-8酶联免疫试剂盒(E02I0056,Blue Gene),IL-10酶联免疫试剂盒(CSB-E04595r,武汉华美),IL-17酶联免疫试剂盒(CSB-E07451r,武汉华美),黏蛋白/黏液素5AC(MUC5AC)酶联免疫试剂盒(CSB-E16223r,武汉华美),中性粒细胞弹性蛋白酶(NE)酶联免疫试剂盒(CSB-E08847r,武汉华美),兔抗IL-17多克隆抗体(ab79056,Abcam),鼠抗Foxp3单克隆抗体(sc-130666,Santa Cruz)。精密天平(BSA223S-CW,上海人和科学仪器有限公司),超声震荡器(JP-C100,广州市吉普超声波电子设备有限公司),低温冷冻干燥机(LGJ-10 普通型,北京松源华兴科技发展有限公司)标准规格酶标仪(Multiskan MK3,Thermo Scientific),电热恒温培养箱(SKP-02.600,黄石市恒丰医疗器械有限公司),离心机(3K18,Sigma公司),摄像装置(Moticcam 2306,麦克奥迪实业集团公司),成像软件系统(Motic Images Advanced 3.2,麦克奥迪实业集团公司)。
2 实验方法
2.1 造模及给药
大鼠适应性饲养7 d后随机分为正常组、模型组、中药1组和中药2组,每组6只。正常组正常饲养,不做干预;模型组实验第 1日开始第 1次气道滴注PM2.5悬液染毒,染毒浓度为8 mg/kg,滴注方法参照文献[1],后每隔2 d染毒1次,共10次,最后1次染毒48 h后处死大鼠,给予生理盐水灌胃;中药组PM2.5染毒同模型组,中药1组予玉屏风散灌胃,中药 2组予过敏煎合止嗽散灌胃。给药体积均为10 mL/kg,每日1次,连续30 d。
2.2 一般观察
分别于实验第1、10、20、30日观察大鼠活动度、呼吸及胸廓起伏、体质量等。
2.3 肺组织形态观察
大鼠10%戊巴比妥(0.3 mL/kg)腹腔注射麻醉,开胸取右侧肺组织,用4%、pH 7.4多聚甲醛缓冲液固定48 h,乙醇石蜡包埋,切片(厚度5 μm),供HE染色及免疫组化测定使用。
2.4 肺泡灌洗液和血清相关指标测定
麻醉大鼠剪开腹部皮肤及皮下组织,暴露腹主动脉,抽血8 mL,4 ℃、1000 r/min离心10 min,取上清液,置于-20 ℃冰箱保存。剪开颈部、胸部皮肤,暴露气管及肺脏,剥离气管及左侧肺脏、心脏及胸腺,找到气管分支,结扎右主支气管,经气管注入无菌生理盐水4 mL至左主支气管和左肺,再慢慢回抽,回抽液大约2~3 mL,反复3次,于4 ℃、1000 r/min离心10 min,取上清液,置于-20 ℃低温冰箱保存。ELISA检测大鼠肺泡灌洗液(BALF)和血清IL-8、IL-10、IL-17、NE和MUC5AC含量;免疫组化法检测大鼠肺组织 IL-17、Foxp3蛋白表达。取大鼠右下肺切片,每张切片加50 μL生物素标记一抗(1∶100),37 ℃孵育40 min,0.01 mmol/L PBS浸泡5 min×3次,滴加二抗,37 ℃孵育20 min,0.01 mmol/L PBS浸泡5 min×3次,每张切片加100 μL新配制的DAB工作液,镜下观察随时终止反应,自来水浸泡5 min,苏木素复染3~10 min,自来水浸泡5 min,晾干,中性树胶封固。应用Image Pro Plus6.0图像处理软件进行图像数据处理,计算每张切片的平均光密度(IOD)值。
3 统计学方法
采用SAS8.0统计软件进行分析。实验数据以—x±s表示,多组间比较采用方差分析,非正态分布采用非参数检验。组间比较,若服从正态分布则采用两独立样本t检验,若不服从正态分布则采用秩和检验。P<0.05表示差异有统计学意义。
4 结果
4.1 一般情况
正常组大鼠毛发光泽度好,饮食正常,呼吸运动正常,体质量缓慢增长;模型组大鼠毛发光泽度较正常组差,呼吸运动基本正常,时有躁动,体质量增长较缓慢;中药1组和中药2组大鼠毛发光泽度与模型组相差不大,呼吸基本正常,体质量缓慢增长,平时较安静。结果见表1。
4.2 中药对模型大鼠病理形态的影响
正常组大鼠支气管和肺组织周围有极少量炎性细胞浸润,肺泡结构完整,分布均匀,肺毛细血管管壁结构完整。模型组大鼠肺组织支气管、血管及肺泡间隔内中性粒细胞、嗜酸性粒细胞、淋巴细胞等多种炎性细胞浸润;小支气管管壁增厚,可见少量杯状细胞增生,管腔内伴有少量出血及渗出;肺泡间隔明显增厚,部分肺泡间隔断裂,肺泡腔增大,肺泡结构消失;肺毛细血管管壁增厚明显。中药组大鼠支气管、肺泡间隔及肺毛细血管周围炎性浸润情况明显改善,支气管黏膜损伤改善,肺泡间隔增生缓解,肺毛细血管壁增厚减轻,结构较完整。结果见图1。
表1 各组大鼠体质量比较(g)

表1 各组大鼠体质量比较(g)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别 第1日 第1 0日 第2 0日 第3 0日正常组 1 9 6 . 5 0 ± 9 . 0 1 2 1 5 . 8 3 ± 6 . 5 5 2 3 7 . 5 0 ± 4 . 5 1 2 6 0 . 0 0 ± 4 . 2 4模型组 1 9 5 . 0 0 ± 1 1 . 5 9 2 0 7 . 0 0 ± 1 1 . 7 8 2 3 2 . 0 0 ± 2 . 1 9# 2 4 4 . 5 0 ± 3 . 5 1##中药1组 1 9 0 . 6 7 ± 7 . 4 7 2 0 9 . 3 0 ± 1 1 . 1 1 2 3 2 . 3 3 ± 2 . 5 0# 2 5 1 . 3 3 ± 4 . 8 4##*中药2组 1 9 1 . 1 7 ± 8 . 8 9 2 0 9 . 1 7 ± 8 . 8 7 2 3 3 . 8 3 ± 3 . 6 0 2 5 3 . 3 3 ± 4 . 9 3#**
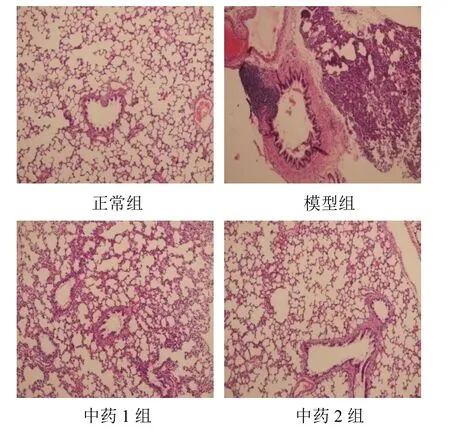
图1 各组大鼠肺组织病理形态(HE染色,×100)
4.3 中药对模型大鼠血清和肺泡灌洗液中相关指标含量的影响
与正常组比较,模型组血清和及 BALF IL-8、IL-17、NE、MUC5AC含量明显升高,IL-10含量明显降低(P<0.05,P<0.01);与模型组比较,中药组血清和BALF IL-8、IL-17、NE含量明显降低(P<0.05),中药1组BALF和中药2组血清和BALF IL-10明显升高(P<0.05)。结果见表2、表3。
表2 各组大鼠血清IL-8、IL-10、IL-17、NE、MUCAC含量比较(pg/mL)
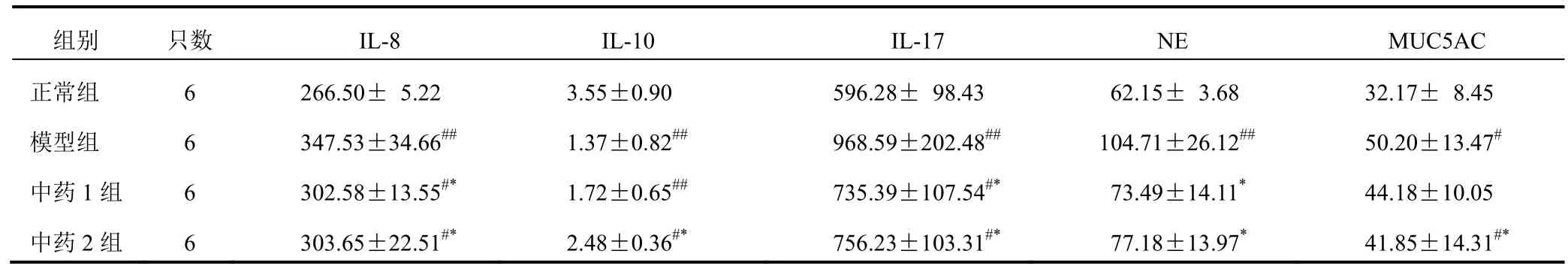
表2 各组大鼠血清IL-8、IL-10、IL-17、NE、MUCAC含量比较(pg/mL)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05
组别 只数 IL-8 IL-10 IL-17 NE MUC5AC正常组 6 266.50± 5.22 3.55±0.90 596.28± 98.43 62.15± 3.68 32.17± 8.45模型组 6 347.53±34.66## 1.37±0.82## 968.59±202.48## 104.71±26.12## 50.20±13.47#中药1组 6 302.58±13.55#* 1.72±0.65## 735.39±107.54#* 73.49±14.11* 44.18±10.05中药2组 6 303.65±22.51#* 2.48±0.36#* 756.23±103.31#* 77.18±13.97* 41.85±14.31#*
表3 各组大鼠BALF IL-8、IL-10、IL-17、NE、MUCAC含量比较(pg/mL)

表3 各组大鼠BALF IL-8、IL-10、IL-17、NE、MUCAC含量比较(pg/mL)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05
组别 只数 IL-8 IL-10 IL-17 NE MUC5AC正常组 6 174.02±12.31 33.40±3.59 236.89±70.74 30.63± 5.79 196.70±29.59模型组 6 223.83±19.50## 21.80±2.56## 432.68±68.39## 48.75± 6.85## 302.82±62.29##中药1组 6 195.94±12.33*# 44.34±5.58*# 330.11±81.86* 35.71±12.34* 246.23±78.38中药2组 6 197.06±16.43*# 39.27±5.34*# 331.03±51.84*# 38.34± 5.10*# 261.67±38.30
4.4 中药对模型大鼠肺组织白细胞介素-17、Foxp3蛋白表达的影响
模型组较正常组IL-17蛋白表达明显升高、Foxp3蛋白表达明显降低(P<0.01);中药1组和中药2组肺组织较模型组IL-17蛋白表达明显降低、Foxp3蛋白表达明显升高(P<0.01)。结果见表4、图2和图3。
表4 各组大鼠肺组织IL-17及Foxp3蛋白表达比较(IOD值)

表4 各组大鼠肺组织IL-17及Foxp3蛋白表达比较(IOD值)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01
组别 只数 IL-17 Foxp3正常组 6 27 749.29±22 195.10 54 615.66±16 752.80模型组 6 122 222.49±44 957.33## 37 958.31±19 448.39##中药1组 6 80 619.77±28 450.66##**67 083.46±75 299.05**中药2组 6 92 318.87±33 342.45##**50 769.94±23 395.94**
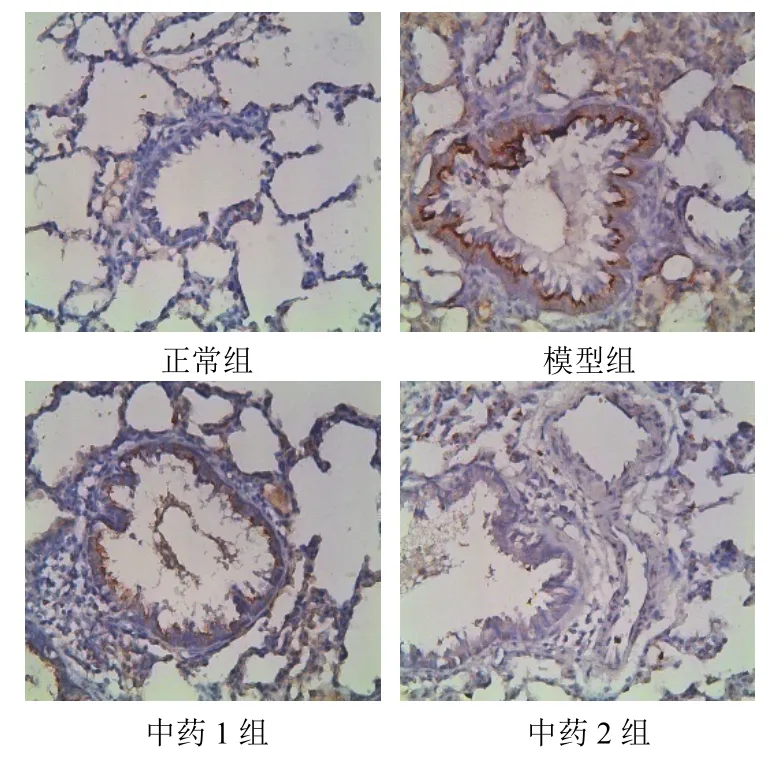
图2 各组大鼠肺组织IL-17蛋白表达(免疫组化染色,×200)
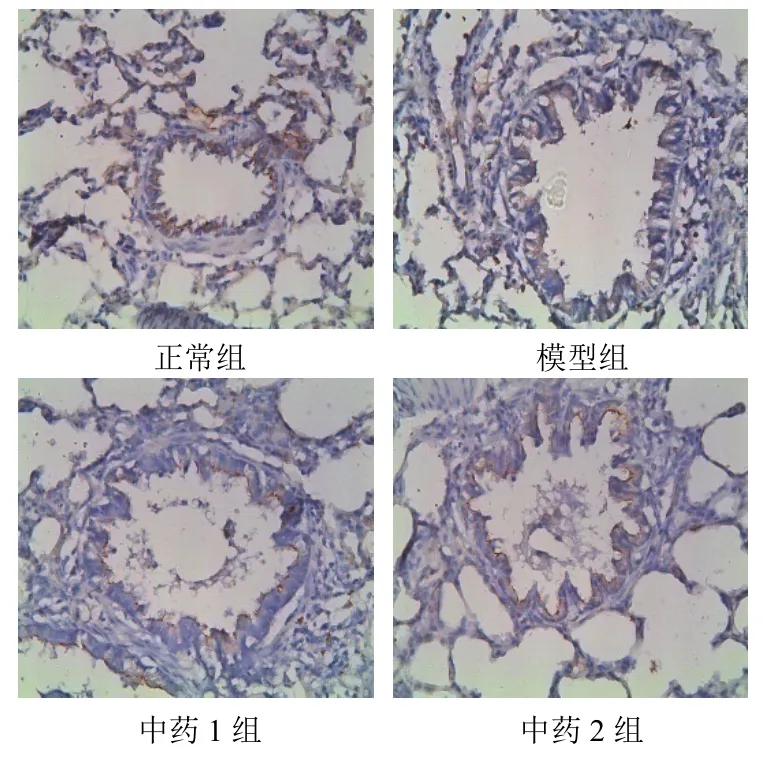
图3 各组大鼠肺组织Foxp3蛋白表达(免疫组化染色,×200)
5 讨论
PM2.5指空气动力学直径≤2.5 μm的颗粒物,是雾霾的重要组成部分。近年流行病学研究显示,大气中 PM2.5浓度升高与呼吸系统疾病的病死率关系密切[2-7]。
TH17/Treg免疫平衡是机体除TH1/TH2之外的又一重要的免疫机制,其免疫失衡与气道炎症、气道黏液高分泌及气道重构均密切相关。PM2.5可导致TH17/Treg失衡。有研究表明,PM2.5引起小鼠BALF IL-17显著升高,IL-10显著降低,肺组织 RORγt mRNA表达升高,Foxp3 mRNA表达降低[8],从而直接参与了TH17/Treg免疫失衡。PM2.5还可通过多种途径诱发TH17/Treg免疫失衡。有研究表明,PM2.5可使小鼠IL-6及转化生长因子-β升高[9]。PM2.5可明显抑制人胚肺细胞 IL-2的生成[10],这一结果在大鼠动物实验中也得到证实[11]。TGF-β和 IL-6可通过诱导大量的RORγt表达进而启动RORγt信号转导通路,从而促进Th17细胞的分化。TGF-β和IL-6还可诱导RORa的表达,此过程依赖于 STAT3。过高表达的RORa可通过诱导IL-17和IL-17F来促进Th17细胞的分化,而RORa缺陷时则可导致体内外IL-17 明显减少。RORγt和RORa两者共存可协同促进Th17细胞的表达。Laurence A等[12]研究发现,IL-2可以通过STAT5抑制RORγt活性抑制Th17细胞的分化。
玉屏风散由黄芪、白术及防风组成。黄芪味甘性温,归肺、脾经,益气固表;白术味甘、苦,性温,归肺、脾经,可益气健脾止汗;防风味辛、甘,性温,归膀胱、肝、脾经,可解表祛风。本方配伍严谨,补中寓疏,散中寓补,具有固表而不留邪、祛邪而不伤正的特点。临床和实验研究显示,本方对呼吸系统损伤有很好的干预作用[13-16]。
过敏煎(祝谌予方)由银柴胡、防风、乌梅、五味子组成。银柴胡味甘性微寒,归肝、胃经,可清热凉血;乌梅味酸、涩性平,归肝、脾、肺、大肠经,五味子味酸甘性温,归肺,心、肾经,两药配合,敛肺益气生津;防风味辛甘性温,归膀胱、肝、脾经,功能抗过敏。本方组方严谨,寒热共济,有收有散。止嗽散源于清代程国彭所著《医学心悟》,方由桔梗、荆芥、紫菀、百部、白前、甘草、陈皮组成。方中紫菀、百部为君,其性温而不热,润而不寒,皆可止咳化痰,新久咳嗽都能使用;桔梗味苦辛,善于开宣肺气,白前味辛甘,长于降气化痰,两者协同,一宣一降,以复肺气之宣降,为臣药;荆芥、陈皮为佐药,荆芥辛而微温,疏风解表利咽,以除在表之余邪,陈皮理气化痰;甘草缓急和中,调和诸药之升降收散,合桔梗、荆芥又有利咽止咳之功,是佐使之用。本方具有温而不燥、润而不腻、散寒不助热、解表不伤正的特点,故对新久咳嗽、咳痰不爽者,加减运用得宜,均可获效。过敏煎合止嗽散加强了祛风理肺之力,止嗽散合过敏煎则熄风理肺之力更强。两方合用,疏风解表宣肺,理气化痰止咳,治疗咳嗽属风邪犯肺,疗效明显。临床和实验研究均显示,两方对多种肺系疾病均有较好的治疗作用[17-20]。
本实验结果显示,PM2.5可导致大鼠 Th17/Treg失衡,引发肺组织损伤,玉屏风散及过敏煎合止嗽散均可改善PM2.5致大鼠肺组织病理损害;降低PM2.5导致的血清及BALF中IL-8、IL-17、NE含量,升高IL-10含量。同时可降低肺组织IL-17的蛋白表达,上调Foxp3的蛋白表达,进而对PM2.5致肺损伤起到保护作用。
结合玉屏风散及过敏煎合止嗽散方义,前者可能偏于调节机体免疫功能、提高机体免疫力,后者抗炎、抗过敏作用更明显。玉屏风散更适合预防性给药,后续研究将在本实验研究结果的基础上,分时段给药,分时段取材,选取针对免疫应答及炎症反应的效应指标,进一步比较研究两者改善PM2.5致肺损伤的具体机制、作用靶点及最佳干预时机。
[1] 冯淬灵,张前,刘治坤,等.芪蛭益肺颗粒对COPD模型大鼠肺组织TGF-β1表达的影响[J].北京中医药大学学报,2013,36(4):238-241.
[2] HUANG W, TAN J, KAN H, et al. Visbility, air quality and dalilymoratality in shanghai, China[J]. Sci Total Environ,2009, 407(10):3295.
[3] 殷文军,彭晓武,宋世震,等.广州市空气污染与城区居民心脑血管疾病死亡的时间序列分析[J].环境与健康杂志,2012,29(6):521-525.
[4] 孙永昌.解读 PM2.5相关的几个关键词[N].中国医学论坛报, 2012-03-05(006).
[5] 黄文珊,胡衡生,刘航,等.南宁市大气污染与呼吸系统疾病的关系[J].环境与健康杂志,2004,21(6):384-386.
[6] 牟喆,彭丽,杨丹丹,等.上海市天气和污染对儿童哮喘就诊人次的影响[J].中国卫生统计,2014,31(5):827-829.
[7] 马依拉•尔肯,晓开提•依不拉音,吴文华.乌鲁木齐市大气污染与儿童哮喘住院人数的相关性[J].新疆医科大学学报,2014,37(10):1382-1384.
[8] 李莉珊,马琼锦,杨凌.鱼油对 PM2.5所致心血管炎性和氧化损伤拮抗作用[J].卫生研究,2014,43(3):387-392.
[9] 杨凌.大气细颗粒物急性、亚慢性染毒对小鼠肺损伤及其免疫机制的研究[D].上海:复旦大学,2014.
[10] 杨宇轩,闫思琪,衣颖杰,等.西安市采暖季与非采暖季 PM2.5染毒的人胚肺细胞基因差异表达研究[J].西安交通大学学报:医学版,2015, 36(6):836-839.
[11] 乔果果,张志红,董洁,等.交通相关的 PM2.5亚急性染毒对大鼠肺泡灌洗液和血清细胞因子水平的影响[J].毒理学杂志,2011,25(4):275-277.
[12] LAURENCE A. Interleukin-1 signaling via STAT5 COSTRAINS Thelper 17 cell generation[J]. Immunity,2007,26:371-381.
[13] 王静,徐希胜,张莹,等.加味玉屏风散对慢性阻塞性肺疾病急性加重期患者肺功能和细胞因子的影响[J].山西医药杂志,2010,39(7):591-594.
[14] 张瑜,张忠德,张溪.玉屏风散对咳嗽变异型哮喘缓解期患者免疫功能的影响[J].广州中医药大学学报,2009,26(6):517-519.
[15] 吴海桂,陈必达.玉屏风散联合布地奈德对COPD患者免疫功能及炎症因子水平的影响[J].现代中西医结合杂志,2016,25(2):164-166.
[16] 李承德,周文宾,孙艳,等.黄芪多糖对哮喘大鼠 Th17/Treg细胞因子及肺部炎症的影响[J].中国药理学通报,2013,29(9):1275-1278.
[17] 于磊,谢吟灵,朱敬秀.过敏煎治疗变异性哮喘 90例临床观察[J].黑龙江中医药,2010,39(5):8-9.
[18] 杨洁.过敏煎加味治疗咳嗽变异性哮喘 64例临床观察[J].中国医药导报,2011,8(2):94-95.
[19] 李彦军,龚盟,马淑然,等.过敏煎对SD小鼠血中IgE变化影响的实验研究[J].辽宁中医杂志,2010,37(1):177-178.
[20] 顾惠英.止嗽散治疗慢性咳嗽随机平行对照研究[J].实用中医内科杂志,2013,37(5):39-40.
Effects of Yupingfeng Powder and Guomin Decoction Combined with Zhisou Powder on Lung Injury Rats Caused by Imbalance of Th17/Treg Induced by PM2.5
ZHANG Xiao-ya1,2, FENG Cui-ling3, MENG Yu-feng1, DU Jian-chao1, CEN Jin-shang4, WEI Yong-jie5(1. Dongzhimen Hospital Attached to Beijing University of Chinese Medicine, Beijing 100700, China; 2. Cangzhou Central Hospital, Cangzhou 061014, China; 3. People’s Hospital of Peking University, Beijing 100044, China; 4. Sinopharm Group Guangdong Medi-World Pharmaceutical Co, Guangzhou 528303, China; 5. State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China)
ObjectiveTo observe the lung injury of rats caused by PM2.5 induced imbalance of TH17/Treg immune system and the intervention effect of two different TCM treatments.MethodsWistar male rats were randomly divided into normal group, model group, TCM-treated group1 and TCM-treated group 2. PM2.5-induced lung injury model was established by airway instillation. Model group was given normal saline for gavage. TCM-treated group 1 and 2 were given Yupingfeng Powder and Guomin Decoction combined with Zhisou Powder for gavage. The pathological changes of bronchial and lung tissues, the contents of IL-8, IL-10, IL-17, NE, and MUC5AC in serum and BALF were compared, and the expressions of Foxp3 and IL-17 in lung tissue of each group were analyzed.Results Compared with normal group, the contents of IL-8, IL-17, NE and MUC5AC in serum and BALF of model group increased significantly, while IL-10 decreased significantly (P<0.05, P<0.01); the expression of IL-17 increased significantly and the expression of Foxp3 decreased significantly in lung tissue (P<0.01). Compared withmodel group, the contents of IL-8, IL-17, and NE decreased in TCM-treated group 1 and 2, while the content of BALF IL-10 increased significantly (P<0.05). The content of IL-10 in serum increased significantly in TCM-treated group 2 (P<0.05); the protein expression of IL-17 of lung issue decreased significantly, and the protein expression of Foxp3 increased significantly (P<0.01). The pathological changes were improved significantly.ConclusionPM2.5 can induce lung injury caused by the imbalance of TH17/Treg. Both two treatments can significantly improve the lung injury induced by PM2.5 and the imbalance of TH17/Tregs immune system.
Yupingfeng Powder; Guomin Decoction combined with Zhisou Powder; PM2.5; lung injury; TH17; Treg; rats
R285.5
A
1005-5304(2017)04-0045-05
2016-08-22)
(
2016-10-11;编辑:华强)
北京中医药大学自主课题(2015-JYB-XS161)
冯淬灵,E-mail:fengcuiling@sina.com
10.3969/j.issn.1005-5304.2017.04.012

