p16/Ki67双染在宫颈病变检出中的作用
葛雪飞 张睿怡 游 珂 郭艳利 李子健 耿 力
北京大学第三医院(100083)
目前宫颈癌发病率占中国女性生殖系统恶性肿瘤第一位,每年宫颈癌新发病例约10万[1-2]。宫颈癌是妇科最常见的恶性肿瘤之一,可通过早期筛查发现早期宫颈癌和宫颈病变,实现早期诊断、早期治疗。目前宫颈癌筛查方案多样,但均有不同的局限性。细胞学由最初的传统宫颈涂片进展到现今的液基细胞学制片技术,其细胞涂片质量明显提高,但仍有假阴性的问题存在,并且其需要细胞病理学家的诊断,使细胞学的进展受到制约[3]。大量研究表明高危型人乳头瘤病毒(HR-HPV)持续感染与宫颈癌的发生密切相关,尤其是宫颈癌标本中可检测出高危型HPV,此后HR-HPV检测成为筛查手段之一。2015年美国妇产科医师学会的宫颈癌筛查过渡期指南中明确指出HR-HPV筛查的灵敏度高于细胞学,但特异度不满意。p16/Ki67双染是一种近年新出现的宫颈病变检出手段。若同一细胞中检测到 p16和Ki67共表达,可作为细胞周期失调的标志物,强烈提示高级别病变[4-5]。本文对92位妇女进行p16/Ki67双染检测,计算灵敏度、特异度等指标,并按年龄与HR-HPV感染与否再次分组,分析双染在≥30岁妇女、HR-HPV(+)妇女中的诊断价值。
1 资料与方法
1.1 临床资料
收集2017年1-5月在北京大学第三医院妇科门诊进行机会性筛查的105位妇女,最终获得92例完整样本。妇女年龄21~65岁,其中≥30岁妇女有78例,每位妇女均行液基细胞学检测(TCT)、HR-HPV检测、p16/Ki67双染检测,并对HR-HPV(+)的非典型鳞状细胞(ASC-US)、HPV16或HPV18型阳性、细胞学异常等行阴道镜检查和活检组织病理学检查,其中细胞学异常包括ASC-US、非典型鳞状细胞-不除外宫颈高度上皮内病变(ASC-H)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)、非典型腺细胞(AGC)。
1.2 实验方法
p16/Ki67双染采用CINtec PLUS细胞学试剂盒(罗氏公司,德国)检测。处理子宫颈细胞后立即进行BD SurePath样本制备,经过95%酒精固定、染色、洗洁精清洗、封固等过程,最终镜下观察并拍照记录。
1.3 结果判断
1.3.1 p16/Ki67双染结果判读细胞质染色棕色(p16)、细胞核染色红色(Ki-67),若在同一个焦距下观察到特定的红染细胞核和棕染细胞质,则判读为阳性细胞。
1.3.2细胞学、HR-HPV、组织病理学结果判读细胞学结果ASC-US及以上病变记为异常;14型(16、18、31、33、35、39、45、51、52、56、58、59、66、68)HR-HPV结果只要有一项为阳性则记为阳性,结果均阴性记为阴性。
1.4 统计学方法
统计学分析采用SPSS 20.0和Medcalc14.0软件进行分析,计算p16/Ki67双染检测检出CIN2及以上病变的灵敏度、特异度、阳性似然比、阴性似然比、ROC曲线下面积(AUC)等指标,所有检验结果以双侧P<0.05为差异有统计学意义。
2 结果
2.1 不同方法检测检出CIN2及以上病变效力比较
p16/Ki67双染检出CIN2及以上病变的灵敏度与TCT、HR-HPV检测相比差异无统计学意义(P=1.000;P=0.424);检出特异度与TCT、HR-HPV检测相比均提高(P=0.001;P=0.001),AUC指数与HR-HPV、TCT相比有差异(P=0.001;P<0.001);p16/Ki67双染的阳性似然比较TCT、HR-HPV检测升高,阴性似然比降低(表1)。
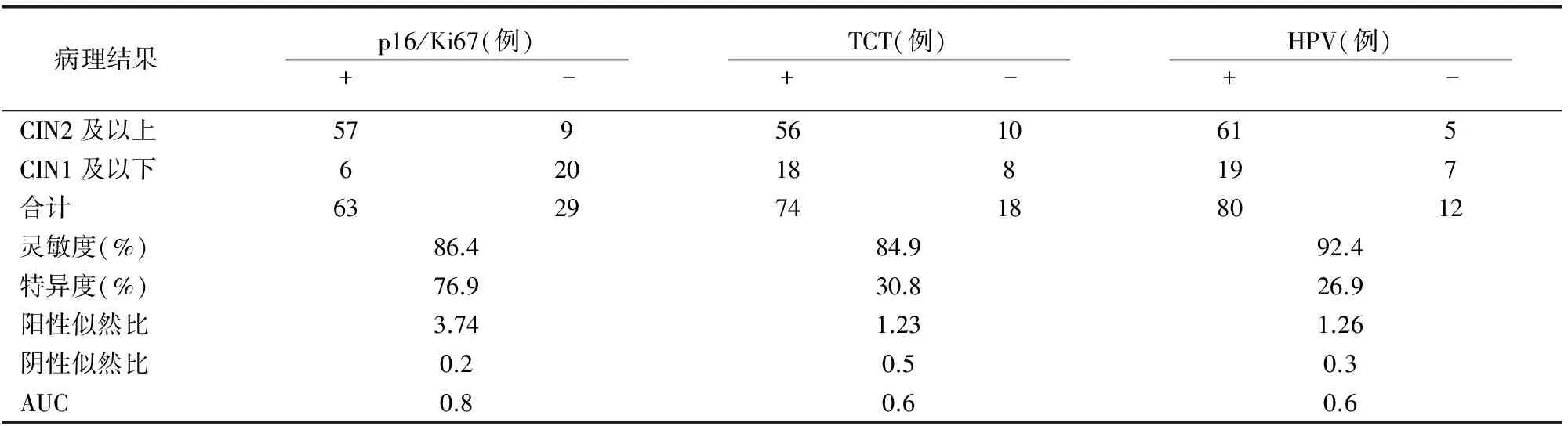
表1 3种方法检测检出CIN2及以上宫颈病变的灵敏度、特异度比较
2.2 不同方法在≥30岁妇女中检出CIN2及以上病变效力的比较
92例妇女中≥30岁78例,≥30岁妇女p16/Ki67双染检出CIN2及以上病变的灵敏度与TCT、HR-HPV检测相比无差异(P=0.581;P=1.000);检出特异度与TCT、HR-HPV检测相比提高(P=0.001;P=0.001);AUC指数与HR-HPV、TCT检测相比有差异(P<0.0011;P<0.0001);阳性似然比较TCT、HR-HPV(1.20;1.23)检测提高2倍以上,阴性似然比降低。在<30组妇女(14例)中p16/Ki67双染、TCT、HR-HPV检测的灵敏度、特异度、阳性似然比和AUC指标无差异。见表2。

表2 3种方法在不同年龄组妇女检测检出宫颈病变的灵敏度、特异度比较
2.3 p16/Ki67双染、TCT检测在HR-HPV感染妇女中检出CIN2及以上病变效力的比较
根据是否感染HR-HPV分组,HR-HPV(+)妇女80例,HR-HPV(-)妇女12例。HR-HPV(+)组中p16/Ki67双染与TCT检出CIN2及以上病变的灵敏度无差异(P=1.000),p16/Ki67双染的特异度较TCT增高(P=0.016);p16/Ki67双染的AUC优于TCT检测(P=0.006)(表3)。
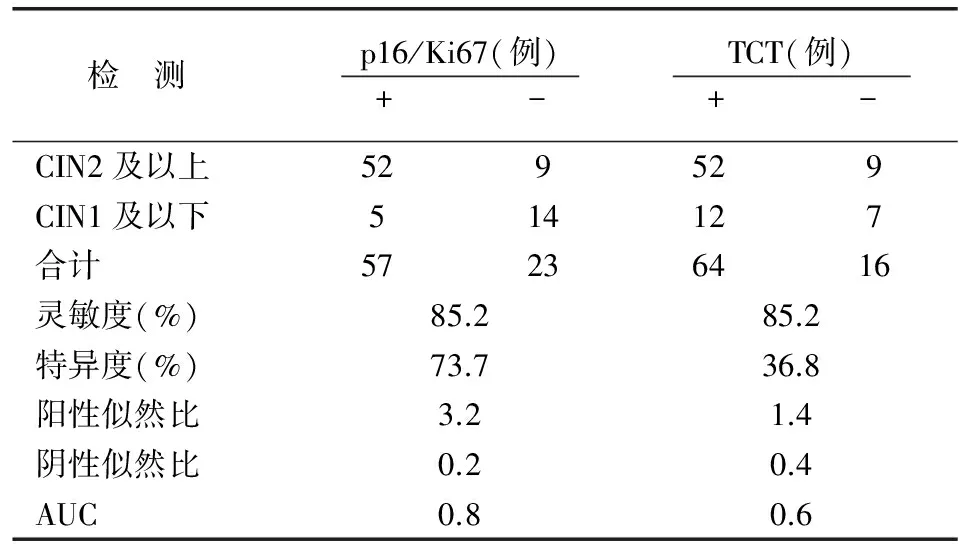
表3 HR-HPV(+)两种方法检测宫颈病变的灵敏度、特异度比较
HR-HPV(-)组中p16/Ki67双染和TCT检出CIN2及以上病变的灵敏度、特异度(P=1.000,P=0.063)无差异;p16/Ki67双染的AUC优于TCT检测(P=0.007)(表4)。最后分析≥30岁妇女中HR-HPV(+)时p16/Ki67双染、TCT检出CIN2及以上病变的灵敏度无差异(P=0.774),p16/Ki67双染的特异度较TCT增高(P=0.016);p16/Ki67双染的AUC指标优于TCT检测(P=0.002)(表5)。由表3和表5可知,HR-HPV(+)妇女和≥30岁HR-HPV(+)妇女中,p16/Ki67双染检出CIN2及以上病变的特异度较TCT增高。
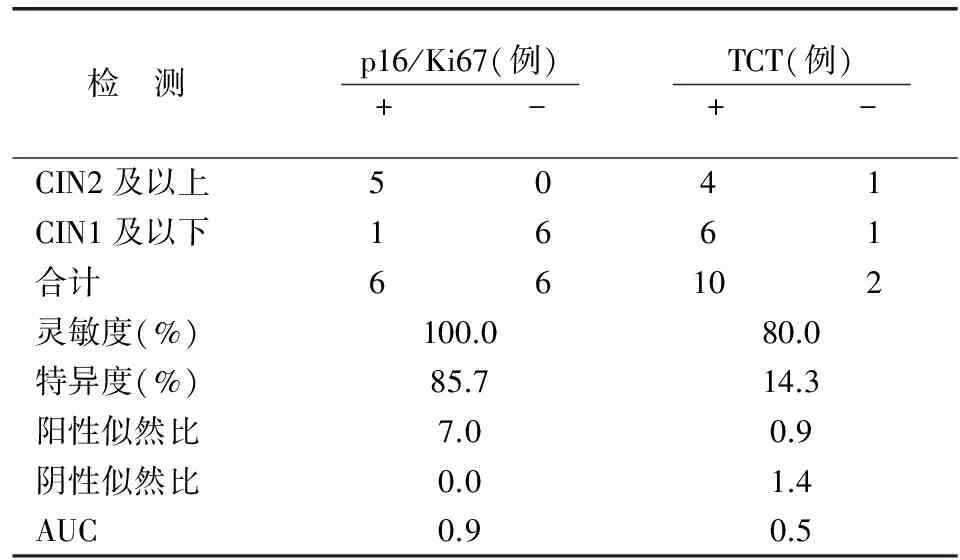
表4 HR-HPV(-)妇女两种方法检测宫颈病变的灵敏度、特异度比较
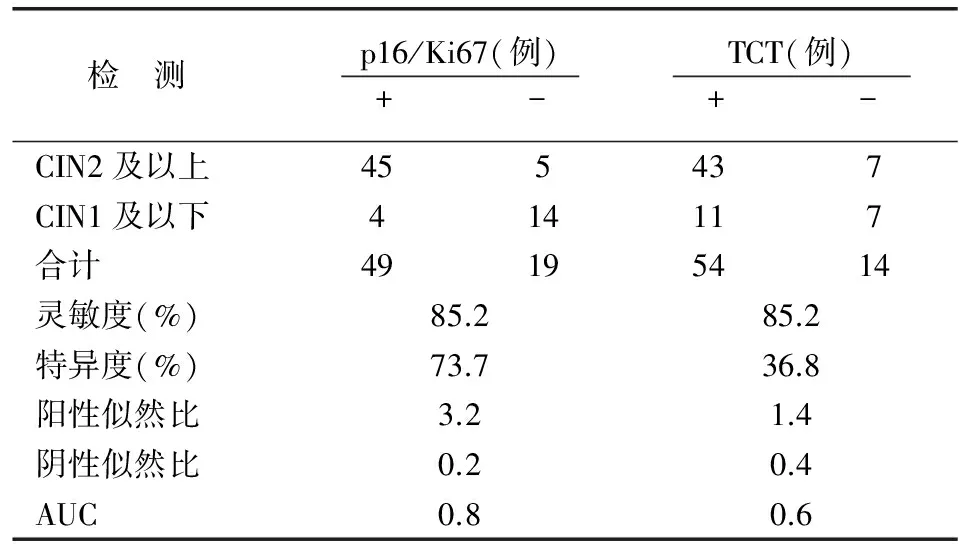
表5 HR-HPV(+)≥30岁妇女两种方法检测宫颈病变的灵敏度、特异度比较
3 讨论
本次研究首先对92例样本进行p16/Ki67双染、TCT、HR-HPV检测比较,发现双染与后两者检出宫颈病变的灵敏度相似,而特异度较其他两种方法明显提高,AUC、阳性似然比增高,阴性似然比降低。阳性似然比反映筛查实验真阳性与假阳性的比值,比值越大,试验结果阳性时为真阳性的概率越大。而阴性似然比越小,试验结果阴性时为真阴性的可能性越大。AUC为ROC曲线下面积,数值越大说明筛查实验的灵敏度、特异度越高。因此本研究表明p16/Ki67双染在宫颈癌筛查中有更高的应用价值,而且该结论同样适用于≥30岁妇女。在Ordi等[6]的研究中同样发现≥30岁妇女组p16/Ki67双染检出CIN1及以上病变的灵敏度特异度较高,在<30岁妇女组中检出病变的特异度是二代杂交捕获法(HC2)检测的2倍。由此推测p16/Ki67双染可能在<30岁妇女中有更高的应用价值。而本研究并没有相似的结论,可能与检出病变的级别不同和<30岁妇女样本例数少有关。
1977年ZurHausen发现宫颈癌发生的一个重要原因是HPV感染,研究表明由于HR-HPV的E7癌蛋白介导的视网膜母细胞瘤蛋白(pRb)失活,p16蛋白强烈过表达[7]。由于E7是HPV相关性癌前病变和癌变中维持恶性表型的必要因素,因此p16过表达与HR-HPV的致癌活性直接相关,并被认为是HPV感染转化的标记物[8]。Ki67是一种细胞增殖相关蛋白,只可在增殖细胞的细胞核中检出[4]。Ki67在细胞增殖的所有阶段都可检出,但G0期的静止或静息细胞不表达。在正常生理条件下同一细胞内同时表达增殖标记物Ki67和 p16应当彼此相互排斥,因此细胞内同时表达Ki67和 p16可作为细胞周期调控失常的一个指标[5,9]。
对HR-HPV(+)妇女进行p16/Ki67双染与TCT检测,两种检测手段检出CIN2及以上病变的灵敏度相同、特异度较TCT提高了1倍;阳性似然比较TCT明显升高,阴性似然比较TCT降低,AUC指数比TCT提高,表明p16/Ki67双染降低了漏诊率;以上数据均表明p16/Ki67双染与TCT相比在HR-HPV(+)妇女中对宫颈病变的检出价值更高。与Ebisch[10]等研究结果中p16/Ki67双染与TCT检测有相似的灵敏度,特异度有差异。Wentzensen等[11]发现,与HR-HPV阳性妇女分诊的细胞学相比,p16/Ki67双染的特异度增加,灵敏度保持不变。Luttmer等[12]也证实p16/Ki67双染检测是HR-HPV(+)妇女的分流方法,对检出CIN3及以上病变的灵敏度、特异度增加。然而在其他的研究中却有不同的研究结果[13-14],p16/Ki67双染与TCT相比,在HR-HPV(+)妇女中检出CIN3及以上病变的灵敏度增加10%以上且有统计学差异、然而特异度无差异。这两组研究结果分别代表KPNC和ATHENA两项研究。在KPNC研究中细胞学诊断采取的是计算机辅助筛选的液基薄片,然后由了解患者HPV状态的细胞病理专家进行审查,而且最初分类阴性的HR-HPV(+)病例会被重新筛检。然而在ATHENA研究中细胞病理专家并不了解患者的HPV感染情况,这可能导致KPNC研究中的灵敏度较ATHENA研究高。一项研究[15]选择了ATHENA研究中的一部分数据,在告知患者HPV感染情况下,细胞学和双染对检查CIN3及以上病变的敏感性分别提高了8.3%和23%,间接证实了上述推论。
由于p16/Ki67双染在HR-HPV(+)和≥30岁两种不同分组中均存在灵敏度与TCT检测相似,而特异度明显提高的特点。为了明确在≥30岁的HR-HPV(+)妇女中p16/Ki67双染的应用价值,我们将68名符合条件的妇女再次进行分析,发现双染的灵敏度与TCT相似,特异度提高。
本次研究不仅对HR-HPV(+)妇女进行分析研究外,还首次比较了p16/Ki67双染与TCT检测在HR-HPV(-)妇女中检出CIN2及以上病变的灵敏度、特异度等指标。HR-HPV(-)组中p16/Ki67双染、TCT检出CIN2及以上病变的灵敏度无差异、而特异度提高;阳性似然比也提高;两者AUC值有统计学差异。从而表明在HR-HPV(-)妇女中进行p16/Ki67双染有较高的诊断价值,由于本次HR-HPV(-)妇女仅有12例,入组病例少,需要扩大样本量做更深入的研究。
[1]陈万青,郑荣寿,张思维,等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤,2017,26(1):1-7.
[2]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA: A Cancer Journal for Clinicians,2016,66(2):115-132.
[3]王轶英,王悦,乔友林,等. 中国宫颈癌筛查未来之路——细胞学初筛的弃或守[J]. 中国实用妇科与产科杂志,2017,33(03):324-326.
[4]Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown[J]. J Cell Physiol,2000,182(3):311-322.
[5]Wentzensen N, Doeberitz M. Biomarkers in Cervical Cancer Screening[J]. Disease Markers,2007,23(4):315-330.
[6]Ordi J, Sagasta A, Munmany M, et al. Usefulness of p16/Ki67 immunostaining in the triage of women referred to colposcopy[J]. Cancer Cytopathol,2014,122(3):227-235.
[7]Walboomers JM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J]. J Pathol,1999,189(1):12-19.
[8]Sano T, Oyama T, Kashiwabara K, et al. Expression Status of p16 Protein Is Associated with Human Papillomavirus Oncogenic Potential in Cervical and Genital Lesions[J]. American Journal of Pathology,1998,153(6):1741-1749.
[9]Klaes R, Friedrich T, Spitkovsky D, et al. Overexpression of p16INK4A as a specific marker for dysplastic and neoplastic epithelial cells of the cervix uteri[J]. Int J Cancer,2001,92(2):276-284.
[10]Ebisch RM, van der Horst J, Hermsen M, et al. Evaluation of p16/Ki-67 dual-stained cytology as triage test for high-risk human papillomavirus-positive women[J]. Mod Pathol,2017,30(7):1021-1031.
[11]Wentzensen N, Fetterman B, Castle PE, et al. p16/Ki-67 Dual Stain Cytology for Detection of Cervical Precancer in HPV-Positive Women[J]. J Natl Cancer Inst, 2015,107(12):257.
[12]Luttmer R, Dijkstra MG, Snijders P, et al. p16/Ki-67 dual-stained cytology for detecting cervical (pre)cancer in a HPV-positive gynecologic outpatient population[J]. Modern Pathology,2016,29(8):870-878.
[13]Wright TC, Behrens CM, Ranger-Moore J, et al. Triaging HPV-positive women with p16/Ki-67 dual-stained cytology: Results from a sub-study nested into the ATHENA trial[J]. Gynecologic Oncology,2017,144(1):51-56.
[14]Gustinucci D, Rossi PG, Cesarini E, et al. Use of Cytology, E6/E7 mRNA, and p16 INK4a-Ki-67 to Define the Management of Human Papillomavirus (HPV)-Positive Women in Cervical Cancer Screening[J]. AJCP,2015,145(1):35-45.
[15]Wright TC, Stoler MH, Aslam S, et al. Knowledge of Patients’ Human Papillomavirus Status at the Time of Cytologic Review Significantly Affects the Performance of Cervical Cytology in the ATHENA Study[J].AJCP,2016,146(3):391-398.

