外源氨基酸的添加对恢复或预防丝状真菌退化的研究
马元伟, 王 荣, 高 强, 刘敏祥, 鲍大鹏, 汪 滢
(1. 上海海洋大学 食品学院 上海 201306; 2. 上海市农业科学院 食用菌研究所, 上海 201403;3. 中国科学院 上海生命科学研究院 植物生理生态研究所, 上海 200032)
外源氨基酸的添加对恢复或预防丝状真菌退化的研究
马元伟1, 王 荣2, 高 强3, 刘敏祥2, 鲍大鹏2, 汪 滢2
(1. 上海海洋大学 食品学院 上海 201306; 2. 上海市农业科学院 食用菌研究所, 上海 201403;3. 中国科学院 上海生命科学研究院 植物生理生态研究所, 上海 200032)
丝状真菌退化是一种很普遍的现象,表现为产孢能力下降或丧失、毒力下降及次级代谢产物合成能力下降等。退化严重影响了许多丝状真菌的经济性状。现有的丝状真菌复壮方法过于费时费力,通过氨基酸的添加,实现简单经济的恢复或防止丝状真菌的退化。
丝状真菌; 退化; 氨基酸; 复壮
丝状真菌在人工培养基上经多次继代后常常会发生毒力降低和形态改变。形态上可以观察到菌落颜色、生长形式发生变化即出现角变区域,更重要的是产孢能力的下降甚至丧失。人们经常称这种现象为表型退化(phenotypic degeneration)、表型不稳定(phenotypic instability)、表型恶化(phenotypic deterioration)、双重表型(dual phenomenon)、突变(saltation)和衰变(attenuation)[1-6]。频繁发生的菌种退化很早就成为经济真菌生产应用所面临的重要问题,尤其是许多重要的经济真菌,如食用菌和虫生真菌退化使生产蒙受巨大损失,也为菌种保藏工作带来很大的困难。然而,人们至今对于真菌退化的原因还知之甚少,也有很多关于真菌退化机制的报道,比如转座子随机插入,真菌双链RNA病毒的入侵或者染色体的缺失等等,但是这些原因都不能很好地回答一些问题,比如真菌退化的频率远远超过这些事件发生的概率,而且不同菌株退化频率也不尽相同[7]。
子囊菌绿僵菌(Metarhiziumrobertsii,下简称绿僵菌)作为虫生真菌,其寄主范围可达50科,200余种昆虫。绿僵菌具有典型的真菌侵染过程:分生孢子附着于昆虫体表,孢子萌发并分化形成附着胞,借助各种降解酶的联合作用而穿透昆虫体壁,体内形成虫菌体而快速繁殖,由于营养剥夺及分泌毒素等作用而杀死害虫[8];蛹虫草(Cordycepsmilitaris)为药用真菌,具有多种药用功效,主要依靠其产生大量的次生代谢活性物质:虫草素、多糖、虫草酸等,它可以代替冬虫夏草入药。目前国内外对虫草属真菌的开发利用研究比较多[9],但是这两种重要的真菌,在实验室连续继代培养的过程中,都存在菌株易退化的问题。
氨基酸是构成生物体蛋白质并同生命活动有关的最基本的物质,是在生物体内构成蛋白质分子的基本单位,与生物的生命活动有着密切的关系,是生物体内不可缺少的营养成分之一。本研究以绿僵菌和蛹虫草为实验材料,拟通过外源添加氨基酸的方式,找到简单有效防止丝状真菌退化、或延缓其退化的方法。
1 材料和方法
1.1 材料
1.1.1 供试菌株
罗伯茨绿僵菌M.robertsiiARSEF 2575,蛹虫草C.militaris01由中科院上海植物生理生态研究所王成树实验室提供。
1.1.2 培养基与试剂
改良的MM培养基:NaNO36 g/L, KCl 0.52 g/L, MgSO4·7H2O 0.52 g/L, KH2PO40.25 g/L, Glucose 10 g/L, CH3COONa·3H2O 8.2 g/L。PDA(BD Diagnostic Systems, Maryland, USA)、 Peptone购自生工,各种氨基酸:天冬氨酸(Aspartic acid),组氨酸(Histidine),苏氨酸(Threonine),丝氨酸(Serine),谷氨酸(Glutamic),脯氨酸(Proline),甘氨酸(Glycine),丙氨酸(Alanine),半胱氨酸(Cysteine),缬氨酸(Valine),蛋氨酸(Methionine),异亮氨酸(Isoleucine),亮氨酸(Leucine),酪氨酸(Tyrosine),苯基丙氨酸(Phenylalanine),赖氨酸(Lysine),精氨酸(Arginine)及色氨酸(Tryptophan)均购自上海生工生物有限公司。
1.2 实验方法
1.2.1 退化菌株的获得
MM平板上接种正常的罗伯茨绿僵菌M.robertsiiARSEF 2575,菌株接30个平板。继代培养时,每个随机选择3块正常的平板,每个平板转接10个样本,共3×10 个样本,持续接种3代,每代生长30 d,观察、转接获得的稳定的角变菌株。正常的蛹虫草C.militaris菌株,PDA培养基上连续传代,25℃恒温培养箱培养,每组10个平板,每次3组,一代生长10 d,连续传代10次。所有菌株25℃恒温培养箱培养。
1.2.2 NBT染色实验
150 r/min振荡培养3 d的菌丝中加入过氧化氢(终浓度20 mmol/L)继续培养24 h后,收集菌丝并用PBS缓冲液冲洗两次,随后取适量菌丝浸没于0.3 mmol/L nitro blue tetrazolium (NBT)中室温孵育20 min,加入30%的甘油终止反应,置于光学显微镜下观察菌丝细胞内活性氧的含量。
1.2.3 绿僵菌退化菌株复壮
将持续传代获得的退化绿僵菌菌株,转接到MM添加不同氨基酸的平板上培养,氨基酸浓度的选择参见文献[10]观察产孢恢复及色素变化。
1.2.4 蛹虫草防止退化实验
防止蛹虫草退化实验,正常的蛹虫草菌株,转接到添加1.5%的组氨酸(Histidine)和0.64%的赖氨酸(Lysine)培养基PDA上,25℃恒温培养箱培养,每组10个平板,每次3组,一代生长10 d,连续传代10次。和没有添加氨基酸的菌落做对比。
1.2.5 菌株产孢量统计
在PDA培养基上生长的菌株,25℃培养10 d后测量其菌落直径,并用4 mL 0.05 % Tween 20洗脱菌株的分生孢子,吸取10 μL孢子液滴加在血球计数板上,在光学显微镜下计数。产孢量=孢子数/菌丝面积。每组实验独立重复3次。
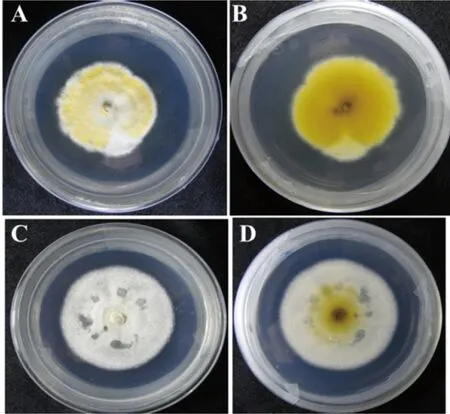
图1 绿僵菌的角变菌株(A和B)和角变菌落转移到MM培养基上的不产孢菌落形态(C和D)
2 结果与分析
2.1 绿僵菌退化菌株的获得
许多丝状真菌在人工培养基上长期生长或者经历多次继带培养之后会发生菌落的退化现象,气生菌丝过度生长伴随着产孢量的减少。退化绿僵菌在营养缺乏的培养基上经历3代的转接培养,就会发生平均约26.7%的角变现象。角变区(图1-A、B)所示,颜色发白。将菌落的角变区打孔,转接到MM平板上继续培养10 d后观察,菌株完全失去颜色,没有分生孢子产生,并出现类似自溶的表型(图1-C、D)。
为了检验菌丝细胞内含有活性氧的情况,我们参考Lara-Ortiz等[11]所描述的NBT法对菌丝样品内ROS进行定性测定。结果显示,角变菌丝经NBT还原后呈现出深染的蓝紫色,这说明菌株清除活性氧的能力大大降低(图2)。
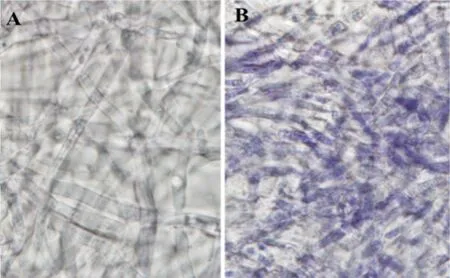
图2 NBT (nitro blue tetrazolium) 还原实验反映细胞内源氧化胁迫程度
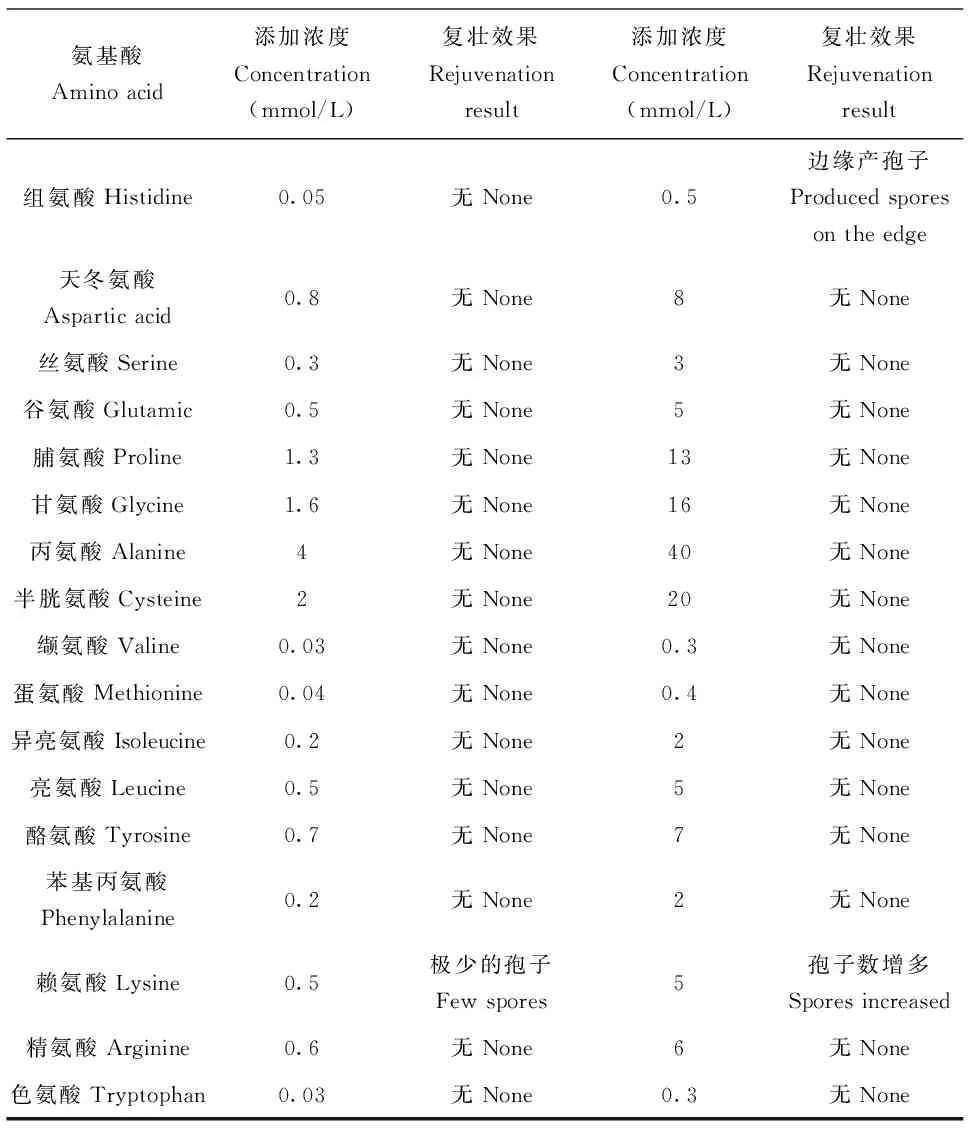
氨基酸Aminoacid添加浓度Concentration(mmol/L)复壮效果Rejuvenationresult添加浓度Concentration(mmol/L)复壮效果Rejuvenationresult组氨酸Histidine0.05无None0.5边缘产孢子Producedsporesontheedge天冬氨酸Asparticacid0.8无None8无None丝氨酸Serine0.3无None3无None谷氨酸Glutamic0.5无None5无None脯氨酸Proline1.3无None13无None甘氨酸Glycine1.6无None16无None丙氨酸Alanine4无None40无None半胱氨酸Cysteine2无None20无None缬氨酸Valine0.03无None0.3无None蛋氨酸Methionine0.04无None0.4无None异亮氨酸Isoleucine0.2无None2无None亮氨酸Leucine0.5无None5无None酪氨酸Tyrosine0.7无None7无None苯基丙氨酸Phenylalanine0.2无None2无None赖氨酸Lysine0.5极少的孢子Fewspores5孢子数增多Sporesincreased精氨酸Arginine0.6无None6无None色氨酸Tryptophan0.03无None0.3无None
2.2 绿僵菌退化菌株的复壮
将退化菌株转接到添加不同氨基酸MM平板上生长10~14 d,观察退化角变菌株的复壮,以不添加氨基酸的MM平板做对照。添加成分如表1。
观察发现,退化菌株在添加了1倍氨基酸时,只有赖氨酸出现极少的孢子,在氨基酸量扩大到10倍后,同样是组氨酸和赖氨酸添加出现孢子,但孢子数量有增加(数据未显示)。其后,结合试验结果,我们在MM培养基里同时添加1.5%的组氨酸(Histidine)和0.64%的赖氨酸(Lysine),退化菌株的产孢及色素明显恢复(图3)。
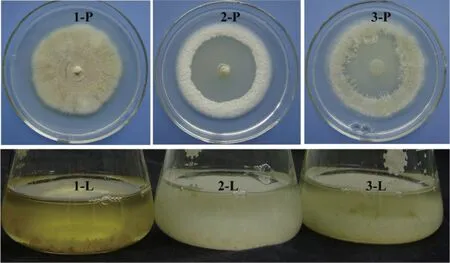
图3 氨基酸的添加和退化菌株的恢复
1:正常菌株;2:角变子;3:恢复菌株; P:平板培养,L:液体培养
2.3 蛹虫草菌株防止退化实验
正常的蛹虫草(C.militaris)菌株,PDA培养基上连续传代,25℃恒温培养箱培养,每组10个平板,每次3组,一代生长10 d,连续传代10次,几乎所有的菌株第10代出现明显的产孢减少,菌丝色素退化的现象;正常的蛹虫草(C.militaris)菌株,转接到添加1.5%的组氨酸(Histidine)和0.64%的赖氨酸(Lysine)培养基PDA上,25℃恒温培养箱培养,每组10个平板,每次3组,一代生长10天,连续传代10 d,产孢减少的量明显降低,菌丝色素退化现象也明显降低(图4)。
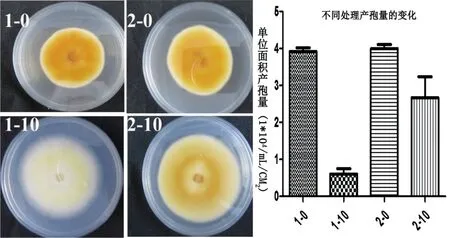
图4 传代的蛹虫草添加氨基酸预防退化
1-0,2-0正常菌株;1-10转接10次没有添加氨基酸;2-10转接10次添加氨基酸
3 讨论
丝状真菌退化的原因多种多样,外界环境的改变、菌株基因的突变等等,其退化的分子机理也有研究。李琳等[9]通过比较转录组学发现绿僵菌中一些参与胁迫响应和衰老相关的基因在退化菌株中显著上调,推测退化菌株表现为老化现象。发现活性氧(ROS)引起的线粒体损伤是导致菌株退化的机制之一。其后Li等[3]以模式真菌——构巢曲霉为对象,开展了正常菌株与退化菌株的线粒体蛋白质组比较分析,结合不同生化试验证明真菌退化表现为细胞凋亡的特征,包括线粒体呼吸能力提高、细胞色素c释放、钙离子浓度升高及凋亡诱导因子的高表达等,但退化菌株同时上调表达抗逆蛋白、抗凋亡因子及提高DNA修复能力等,因而短期内没有表现出细胞死亡现象。
氨基酸在生物体抗衰老方面发挥重要作用。早在2002年,Memmott的研究就发现,在炭疽菌(Colletotrichumtrifolii)生长的过程中添加脯氨酸,就能持续的激活菌体内的小G蛋白Ras的表达,进而完全逆转菌株反常的菌丝形态以及产孢[12]。其后,该实验室的Chen[13]在PNAS上发文,发现脯氨酸可以抑制ROS的产生,并且脯氨酸可以保护Ras突变细胞免受各种外界的胁迫。Eisler等[10]在酵母中的研究发现,基础氨基酸(赖氨酸或者组氨酸)的饥饿会诱导酵母产生细胞凋亡和细胞内的氧化压力。
目前关于丝状真菌复壮的方法有很多。组织分离:将退化的丝状真菌出菇(如蘑菇类或蛹虫草),选择子实体外观健壮的,在无菌条件下重新进行组织分离;菌丝纯化与尖端菌丝分离:挑取健壮的菌丝尖端部分,进行培养,以期获得复壮的菌株;有性孢子分离筛选:选择形态好,生长好的子实体,采用孢子收集器收集有性孢子,进行多孢或单孢分离培养;获得的单核菌丝还要与可亲和的单核菌丝杂交后形成双核菌丝,再进行出菇实验,才能确定获得复壮的菌株;添加抗生素,对菌株进行复壮[14-15]。
从以上方法中,我们可以看出都是在菌株退化后,再利用不同的方法,重新选择。前3种方法都费时耗力,而且不能保证得到复壮的菌株;最后一种方法,虽然简单,但要添加各种不同的抗生素,而现在抗生素的使用已经得到严格的控制,因此也不能很好地推广和应用。本研究旨在寻找简单、经济的延缓或预防丝状真菌退化的方法,在丝状真菌持续传代或菌种保藏过程中添加一定浓度的组氨酸和赖氨酸,能很好地延缓或恢复菌株退化。本研究已经申请发明专利(201510979555.X)。
[1]BUTT T M, GOETTEL M. Bioassays of entomopathogenic fungi.[A]//In: NAVON A and ASCHER K R S, Eds., Bioassays of Entomopathogenic Microbes and Nematodes[M]. CAB International, Wallingford, UK, 2000:141-195.
[2]KAWAKAMI K. On the change of characteristics of the silkworm muscardines through successive cultures[J]. Bulletin Sericultural Experiment Station, 1960, 16(1): 83-99.
[3]LI L, HU X, XIA Y L, et al. Linkage of oxidative stress and mitochondrial dysfunctions to spontaneous culture degeneration inAsperaillusnidulans[J]. Molecular & Cellular Proteomics, 2014, 13(2): 449-461.
[4]NAGAICH B B.Verticilliumspecies pathogenic on aphids[J]. Indian Pathol, 1973, 26(1): 163-165.
[5]IBRAHIM L, BUTT T M, JENKINSON P. Effect of artificial culture media on germination, growth, virulence and surface properties of the entomopathogenic hyphomyceteMetarhiziumanisopliae[J]. Mycological Research, 2002, 106(6): 705-715.
[6]RYAN M J, BRIDGE P D, SMITH D, et al. Phenotypic degeneration occurs during sector formation inMetarhiziumanisopliae[J]. Journal of General and Applied Microbiology, 2002, 93(1): 163-168.
[7]李 琳. 丝状真菌退化机制的研究[D]. 上海: 中国科学院上海生命科学研究院, 2012: 70-74.
[8]CLARKSON J M, CHARNLEY A K. New insights into the mechanisms of fungal pathogenesis in insects[J]. Trends Microbiol, 1996, 4(5): 197-203.
[9]XIONG C H, XIA Y L, ZHENG P, et al. Increasing oxidative stress tolerance and subculturing stability ofCordycepsmilitarisby overexpressing of a glutathione peroxidase gene[J]. Applied Microbiology and Biotechnology, 2013, 97(5): 2009-2015.
[10]EISLER H, FRÖHLICH K U. HEIDENREICH E. Starvation for an essential amino acid induces apoptosis and oxidative stress in yeast[J]. Experimental Cell Research, 2004, 300(2): 345-353.
[12]MEMMOTT S D, HA Y S, DICKMAN M B. Proline reverse the abnormal phenotypes ofColletotrichumtrifoliiassociated with expression of endogenous constitutively active Ras[J]. Applied and Environmental Microbiology, 2002, 68(4): 1647-1651.
[13]CHEN C, DICHMAN M B. Proline suppresses apoptosis in the fungal pathogenColletotrichumtrifolii[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(9): 3459-3464.
[14]毛 宁,柯 轶. 蛹虫草菌株的复壮方法:中国, CN201110005899.2 [P]. 2011-6-15.
[15]陶 军,胡亚鹏. 一种解决液体菌种营养液体菌性变异退化的方法:中国,CN201210593981.6 [P]. 2013-4-3.
Rejuvenation and preventing degradation of filamentous fungi by adding exogenous amino acids
MA Yuan-wei1, WANG Rong2, GAO Qiang3, LIU Min-xiang2, BAO Da-peng2, WANG Ying2
(1. College of Food Science, Shanghai Ocean University, Shanghai 201306; 2. Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences, Shanghai 201403; 3. National Key Laboratory of Plant Molecular Genetics, Institute of Plant Physiology and Ecology, Shanghai Institutes for Biological Sciences, Shanghai 200032, China)
Culture degeneration of filamentous fungi frequently occurs, i.e. the reduction or complete loss of the abilities of sporulation, virulence and pigments and secondary metabolite biosynthesis, leading to great losses of fungal economic values. Existing rejuvenation method is for filamentous fungi too time-consuming, so in this study through the added amino acids, we implement a simple economic recovery or prevent the degradation of filamentous fungi.
filamentous fungi; degeneration; amino acid; rejuvenation
2016-05-18;
2016-06-03
上海市农委青年成长计划(2015,1-10)
马元伟,硕士,主要从事食用菌分子育种研究,E-mail:mayuanwei2010@163.com
汪 滢,助理研究员,从事食用菌遗传工程研究,E-mail: wyhrx@126.com
Q935; TQ920.6
B
2095-1736(2017)02-0108-04
doi∶10.3969/j.issn.2095-1736.2017.02.108

