筋骨草和茯苓配伍合用抑制乳腺癌细胞侵袭转移作用及初步机制研究
王晶晶,彭 博,贺 蓉,徐启华,韩靖雅,李建荣
(1.辽宁师范大学生命科学学院,辽宁 大连 116000 ;2.中国中医科学院中药研究所,北京 100700)
筋骨草和茯苓配伍合用抑制乳腺癌细胞侵袭转移作用及初步机制研究
王晶晶1,彭 博2,贺 蓉2,徐启华2,韩靖雅2,李建荣2
(1.辽宁师范大学生命科学学院,辽宁 大连 116000 ;2.中国中医科学院中药研究所,北京 100700)
目的 研究筋骨草和茯苓联合用药对高转移性乳腺癌MDA-MB-231(三阴型乳腺癌)和SK-BR-3(HER-2过表达乳腺癌)细胞侵袭转移的作用及分子机制。方法 以筋骨草有效部位——总环烯醚萜类化合物和茯苓有效部位——三萜类化合物为研究对象。采用细胞黏附实验、细胞划痕和Transwell 侵袭实验检测细胞黏附、运动和侵袭能力。Western blot 法检测上皮-间质转化(epithelial-mesenchymal transitions,EMT)相关蛋白和MAPK通路蛋白表达。结果 筋骨草和茯苓合用对MDA-MB-231和SK-BR-3细胞的黏附、迁移和侵袭能力有明显的抑制作用,配伍比例为10 ∶1时具有较好的协同效应。两药合用还可逆转乳腺癌细胞EMT,主要表现在上皮性标志物β-catenin、E-cadherin、ZO-1表达增加,间质性标志物Vimentin表达降低。进一步研究发现,两药合用明显降低p-ERK1/2、p-JNK和p-p38的蛋白表达。结论 筋骨草和茯苓合用能有效地抑制高转移性乳腺癌MDA-MB-231 和SK-BR-3细胞的侵袭和转移,作用机制可能与其调控MAPK通路,逆转肿瘤细胞EMT有关。
乳腺癌;茯苓;筋骨草;肿瘤转移;MAPK通路;侵袭
乳腺癌在中医学中被称为“乳岩”、“乳石痈”等,其发病率和死亡率位居女性恶性肿瘤之首[1],目前临床上有30~40%的乳腺癌复发并导致肺、骨、肝等远处转移[2]。因此,防治和控制乳腺癌转移和复发具有积极重要的临床意义。
“筋骨草-茯苓”药对是根据中医临床经验,针对乳腺癌转移和复发的关键核心病机是“热毒内蕴,痰毒流注”的观点[3],以清热解毒、利湿化痰法组方用于预防和治疗乳腺癌及其转移的中药复方。筋骨草是代表“清热解毒”治则的中药,性寒,味苦,归肺经,具有清热解毒、凉血消肿的功效;郁仁存《中医肿瘤学》中记载其常用于治疗乳腺癌、乳腺炎和肺癌[3]。茯苓是代表“利湿化痰”治则使用频率最高的一味中药[4],性甘、淡、平,归心、肺、脾、肾经,具有利水渗湿的功效。临床实践证明,两者配伍应用能预防和延缓乳腺癌转移复发,降低术后复发率,提高患者的生存率和生存质量[3]。文献报道及本课题组前期体内外实验均证实,筋骨草和茯苓均有明显的抑制肿瘤生长的作用,药效物质基础分别为筋骨草总环烯醚萜类化合物(iridoids inAjugadecumbens,HBG)和茯苓三萜类化合物(triterpenes inPoriacocos,FL)[5-7];两药合用明显抑制小鼠乳腺癌4T1的侵袭和转移。但是目前对于两药合用抑制乳腺癌转移是否具有协同效应,作用特点及其机制尚不明确。
因此,本实验通过研究HBG、 FL单用和联合用药对高转移性乳腺癌MDA-MB-231和SK-BR-3细胞侵袭转移能力的影响,旨在探讨两药合用抗乳腺癌转移的作用特点及其分子机制,为其潜在临床应用于乳腺癌治疗提供实验依据。
1 材料与方法
1.1 受试药品 筋骨草总环烯醚萜提取物(HBG),由本所制剂室提供,筋骨草全草水提取物经大孔树脂精制,减压干燥后得筋骨草总环烯醚萜类提取物,以乙酰哈巴苷计,总环烯醚萜质量分数为61.57%。茯苓三萜类提取物(FL),茯苓药材经乙醇回流提取后得三萜类提取物,测定三萜类化合物质量分数为>50%。
1.2 细胞培养 人乳腺癌 MDA-MB-231和SK-BR-3 购自北京协和细胞资源中心,使用含10% FBS,0.1 U·L-1青霉素和100 mg·L-1链霉素的RPMI 1640培养基, 置于37℃、5% CO2的细胞培养箱中培养,0.25%胰酶消化传代。
1.3 主要试剂和仪器 RPMI 1640培养基、胎牛血清(FBS)和0.25%胰酶购自Gibco公司;人工基质胶 matrigel购自BD公司;细胞全蛋白提取试剂盒(K0202)购自南京凯基生物公司;BCA蛋白浓度试剂盒(QG219579)、ECL 高灵敏度化学发光试剂盒(NL181598)购自Thermo公司; Transwell小室购自 Corning公司;二甲基亚砜(2255C398)购自Amersco公司。本研究一抗:ERK1/2、p-JNK、ZO-1、Vimentin、β-catenin购自CST公司;p-ERK1/2、p-p38MAPK购自中杉金桥;JNK、E-cadherin购自碧云天;二抗:山羊抗小鼠IgG/辣根酶标记、山羊抗兔IgG/辣根酶标记购自中杉金桥。 台式高速离心机 (5415R) 购自Eppendorf 公司,CO2培养箱 (HERAcell 150i)购自Thermo公司;显微镜(IX71) 购自Olympus公司,IncuCyteTMZOOM长时程动态活细胞成像系统购自Essen Bioscience公司,多功能酶标仪(Thermo Varioskan Flash)购自Thermo公司。
1.4 FL和HBG贮存液的配制 称取100 mg FL或HBG药物粉末,加入1 mL DMSO 溶解,即配成100 g·L-1的母液,4℃保存待用。实验过程中按需要进行稀释。
1.5 MTT法检测细胞毒性 以每孔1×104个将人乳腺癌 MDA-MB-231、SK-BR-3细胞接种到96孔板中。待细胞贴壁后,加入不同浓度FL(终浓度分别为 2.5~20 mg·L-1),不同浓度HBG(终浓度分别为5~200 mg·L-1),不同浓度两药合用(HBG和FL配比分别为1 ∶1,5 ∶1和10 ∶1),置于培养箱中培养48 h。每孔加MTT溶液至终浓度为0.5 g·L-1,继续孵育4 h,终止培养,小心弃去上清液,每孔加DMSO 200 μL,震荡10 min,使紫色结晶物充分溶解。酶标仪测570/650 nm处的吸光度(OD),细胞增殖抑制率/%=(1-OD给药/OD对照)×100%。
1.6 细胞黏附实验 将matrigel胶按1 ∶30稀释后包被96孔板,4 ℃过夜,PBS洗板3次。加入1% BSA室温封闭2 h,PBS 洗板3次待用。以不同浓度FL(终浓度分别为2.5~20 mg·L-1),不同浓度HBG(终浓度分别为25~200 mg·L-1),不同浓度两药合用(HBG和FL配比比例分别为5 ∶1和10 ∶1)处理细胞。收集受试药品处理24 h的乳腺癌细胞,制备单细胞悬液,以每孔5×104个细胞接种于matrigel包被的96孔板,37 ℃、5% CO2培养箱中孵育30 min,PBS洗去未黏附的细胞,甲醇固定后0.1%结晶紫染色5 min,水冲洗2~3遍,干燥照相后,每孔加入10%乙酸100 μL振荡5~10 min,592 nm处测定OD值,计算细胞黏附抑制率/%=(1-OD给药/OD对照)×100%。
1.7 划痕实验 对数生长期细胞按每孔5×104个细胞接种于96孔板,孵育24 h后,划痕,PBS洗去掉落的细胞,更换无血清培养基,按“2.6”的给药方法加入不同浓度的受试药物。以IncuCyte ZOOM 2013B软件动态观测划痕愈合情况,以相对划痕密度作为评价指标(Relative Wound Density, RWD)。
1.8 细胞侵袭力实验 matrigel胶1 ∶8稀释后包被8 μm Transwell小室,37 ℃孵育2 h成胶。将对数生长期MDA-MB-231和SK-BR-3细胞用无血清培养基制备成单细胞悬液,按每孔5×104个细胞/100 μL接种于Transwell上室,同时加入不同浓度的HBG、FL及两药合用(HBG和FL配比为10 ∶1),下室加含10% FBS的培养基600 μL,培养24 h~48 h。用棉签擦去上室细胞,穿膜细胞以5%戊二醛固定后0.1%结晶紫染色10 min,显微镜拍照。染色细胞用10%醋酸溶解,592 nm处测定OD值,计算细胞侵袭率/%=OD给药/OD正常×100%。
1.9 Western blot分析 收集细胞,加入细胞裂解液400 μL冰上充分裂解15 min。14 000 r·min-1,4 ℃离心15 min,收集上清液,采用BCA法测定蛋白浓度。取20 μg蛋白样品进行SDS聚丙烯酰胺凝胶电泳,4 ℃、350 mA湿转15 min,5% BSA室温封闭1 h。分别用一抗(1 ∶1 000) 4 ℃孵育过夜;洗膜后,HRP标记二抗(1 ∶2 000)室温孵育1 h, ECL Western blot 化学发光试剂盒显色检测,以Actin、GAPDH为内参。
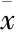
1.11 相互作用结果判定 细胞增殖、黏附和迁移实验采用中效法以Compusyn软件计算HBG和FL两药合用的联合用药指数(combination index,CI)。根据Soriano等[8]的判断方法,0.9≤CI≤1.1为相加作用,0.8≤CI<0.9为低度协同作用,0.6≤CI<0.8为中度协同作用,0.4≤CI<0.6为高度协同作用,0.2≤CI<0.4为强协同作用。细胞侵袭实验采用金氏Q值法计算合用效应,按照以下公式:Q=EA+B/(EA+EB-EA×EB),其中EA+B代表两药合用的实际效应值, EA代表A药单用时的效应, EB代表B药单用时的效应。以Q<0.85为拮抗,0.85≤Q≤1.15为相加,Q>1.15为协同。
2 结果
2.1 HBG、FL及其合用对人乳腺癌细胞增殖的影响 采用MTT法对HBG和FL单用及合用对人乳腺癌细胞MDA-MB-231和SK-BR-3的细胞毒性作用进行研究。结果显示,HBG、FL单用及其合用对乳腺癌细胞均显示不同程度的抑制细胞增殖的作用。参考药物的IC50,选择FL和HBG的浓度范围为1/10 IC50-2 IC50,通过Compusyn软件计算两药在不同浓度配比下作用于两种乳腺癌细胞的联合用药指数(combination index,CI),结果显示,在Fa值为0.5时,HBG和FL按1 ∶1、5 ∶1和10 ∶1不同配比,抑制两种乳腺癌MDA-MB-231和SK-BR-3细胞增殖作用的CI值分别为1.25/0.98(1 ∶1)、0.85/0.91(5 ∶1)、0.58/0.48(10 ∶1)。根据Soriano等的判断方法,两药按5 ∶1配比合用达到低度协同作用;按10 ∶1配比合用达到高度协同作用。后续实验根据以上结果选择HBG单用的药物浓度为25~200 mg·L-1;由于FL本身溶解性差,在浓度大于25 mg·L-1时表现为非特异性细胞毒性作用, FL单用的药物浓度为2.5~20 mg·L-1;两药按5 ∶1配比合用的剂量为30~120 mg·L-1,按10 ∶1配比合用的剂量为27.5~220 mg·L-1,在此浓度下药物对乳腺癌细胞增殖基本无影响。
2.2 HBG、FL及其合用对人乳腺癌细胞黏附能力的影响 为明确HBG、FL及其合用是否对人乳腺癌细胞的黏附能力有抑制作用,采用细胞黏附实验测定不同浓度HBG、FL单用及其合用对乳腺癌MDA-MB-231及SK-BR-3细胞的黏附能力的影响。结果显示(Fig 1),HBG、FL单用及其合用能明显抑制两种乳腺癌细胞的黏附能力,且作用呈现剂量依赖性关系。在本实验选择的给药剂量下,黏附实验中的效应局限在50%以内,在此条件下根据中效法计算两药联合用药指数CI值。在Fa值为0.4时, HBG和FL按5 ∶1和10 ∶1不同配比,抑制两种乳腺癌MDA-MB-231和SK-BR-3细胞黏附作用的CI值分别为0.87/0.86(5 ∶1)和0.2/0.71(10 ∶1)。根据Soriano等的判断方法,两药按5 ∶1配比合用达到相加作用;按10 ∶1配比合用在两种细胞中分别达到强协同作用和中协同作用。

Fig 1 Effects of HBG, FL and their combination on breast cancer cell adhesion
MDA-MB-231 and SK-BR-3 cells were pretreated with different concentrations of HBG, FL and the combination for 24 h. 5×104cells/well were seeded on matrigel-precoated wells and incubated at 37 ℃ for 30 min. After washing, adherent cells were fixed with methanol and stained with 0.1% crystal violet(magnification ×100). The stain was eluted by 10% acetic acid, and the absorbance at 592 nm was measured.*P<0.05,**P<0.01vsHBG or FL only treated group.

Fig 2 Effects of HBG, FL and their combination on breast cancer cell migration using scratch motility assay
5×104cells were seeded into 96-well plate. After 24 h, a wound was scratched into confluent monolayer and cells were treated with various concentrations of HBG, FL and the combination in serum-free medium for 24 h. The relative wound density(RWD) was measured by Incucyte ZOOM.
两者按10 ∶1固定比值配比,当Fa值0.2~0.5时,对于MDA-MB-231细胞,CI值<1;且随剂量的增加,效应随之增加,CI值为0.87~0.2,表现出从低协同作用变为强协同作用的趋势。对于SK-BR-3细胞,对应的CI值<1; 且随剂量的增加,效应随之增加,CI值为0.2~0.86,表现出从强协同作用变为低协同作用的趋势。
2.3 HBG、FL及其合用对人乳腺癌细胞迁移能力的影响 通过对人乳腺癌MDA-MB-231细胞进行划痕实验可观察到,对照组细胞在24 h后几乎完全愈合,而经HBG、FL及其合用处理过的乳腺癌MDA-MB-231细胞迁移能力明显受到抑制(Fig 2)。通过Compusyn软件计算两药在不同浓度配比下的CI值,在Fa值为0.5时, HBG和FL按5 ∶1和10∶1不同配比,抑制两种乳腺癌MDA-MB-231细胞迁移作用的CI值分别为0.56(5 ∶1)和0.28(10 ∶1)。根据Soriano等的判断方法,两药按5 ∶1配比合用达到高度协同作用;按10 ∶1配比合用达到强协同作用。
2.4 HBG、FL及其合用对人乳腺癌细胞侵袭能力的影响 采用Transwell小室法对HBG、FL单用及合用对乳腺癌细胞侵袭能力进行研究。根据细胞黏附和迁移能力的实验结果,细胞侵袭实验中两药按10 ∶1配比合用。结果显示(Fig 3),HBG、FL单用及合用24~48 h后能明显抑制乳腺癌MDA-MB-231和SK-BR3细胞侵袭能力,且作用呈现剂量依赖性关系。与同等剂量的HBG和FL单用相比,两药合用抑制肿瘤细胞侵袭的能力明显增强(P<0.05)。Q值评价结果显示,合用剂量为110 mg·L-1时,MDA-MB-231细胞和SK-BR-3细胞的Q值分别为1.26和1.83,可见HBG和FL合用对抑制乳腺癌细胞侵袭能力上所呈现的主要是协同作用。
2.5 HBG、FL及其合用对人乳腺癌细胞上皮-间质转化(epithelial-mesenchymal transitions,EMT)相关蛋白表达的影响 EMT在肿瘤转移中起重要作用,因此我们采用Western blot法检测药物对乳腺癌MDA-MB-231和SK-BR-3细胞EMT关键蛋白表达的影响。结果发现(Fig 4),对于MDA-MB-231细胞,HBG、FL单用和合用均能不同程度的增加上皮性标志物ZO-1、β-catenin和E-cadherin的表达,降低间质性标志物Vimentin的表达,且作用呈现一定的剂量依赖性关系(不包括E-cadherin);对于SK-BR-3细胞,两药合用能增加ZO-1、E-cadherin表达,降低Vimentin的表达。提示HBG和FL合用通过增加上皮性标志蛋白表达,降低间质性标志蛋白的表达,逆转EMT作用,从而发挥抑制乳腺癌细胞转移的作用,且两药合用具有协同作用。
2.6 HBG、FL及其合用对人乳腺癌细胞中MAPK通路相关蛋白表达的影响 为了探究药物抗乳腺癌转移的作用机制,我们进一步测定HBG和FL单用及合用对MAPK通路相关蛋白表达的影响。结果发现(见Fig 5),对于三阴型乳腺癌MDA-MB-231细胞,100 mg·L-1和200 mg·L-1HBG单用能明显降低p-ERK1/2蛋白表达水平,但是对于p-p38MAPK和p-JNK表达未见明显影响;10 mg·L-1和20 mg·L-1FL单用能明显降低p-ERK1/2和p-p38的蛋白表达水平,对p-JNK表达未见明显影响;两药合用能明显抑制p-ERK1/2和p-p38的蛋白表达,且有协同作用,对p-JNK表达未见明显影响。对于HER2过表达型乳腺癌SK-BR-3细胞,HBG单用、FL单用以及两药合用均能不同程度的降低p-ERK1/2、p-p38和p-JNK的蛋白表达水平;同HBG或FL单用相比,两药合用后抑制MAPK通路相应蛋白表达的作用有明显的协同效应。

Fig 3 Effects of HBG, FL and their combination on breast cancer cell invasion
5×104cells in 0.1 mL serum-free conditional medium containing different concentrations of HBG, FL and the combination were seeded on the upper compartment of the matrigel-precoated chamber, 0.6 mL of medium with 10% FBS was added to the lower compartment. After incubation for 24~48 h, the cells on the lower surface of the filter were fixed in 5% glutaraldehyde and stained with 0.1% crystal violet(magnification×100). The dye was eluted with 10% acetic acid, the absorbance was measured at 592 nm.*P<0.05vsnon-drug treated control group;#P<0.05vsHBG/FL combination treated group.

Fig 4 Effects of HBG, FL and their combination on expressions of EMT markers in breast cancer cells by Western blot
MDA-MB-231 and SK-BR-3 cells were pretreated with different concentrations of HBG, FL and the combination for 24 h~48 h. Total proteins were extracted and used for Western blot. 50μg protein/ well was loaded. Primary antibodies(vimentin, ZO-1,β-catenin and E-cadherin)(1 ∶1 000) were incubated 4℃ overnight. HRP labeling secondary antibodies(1 ∶2 000) were incubated for 1 h at room temperature. actin was used as a loading control.

Fig 5 Effects of HBG, FL and their combination on expressions of MAPK markers in breast cancer cells by Western blot
MDA-MB-231 and SK-BR-3 cells were pretreated with different concentrations of HBG, FL and the combination for 24 h~48 h. Total proteins were extracted and used for Western blot. 50 μg protein/ well was loaded. Primary antibodies(p-ERK,p-ERK1/2;p-JNK,JNK;p-p38,p38)(1 ∶1 000) were incubated 4℃ overnight. HRP labeling secondary antibodies(1 ∶2 000) were incubated for 1 h at room temperature. GAPDH was used as a loading control.
3 讨论
本研究根据乳腺癌中医治疗“清热解毒,祛水利湿”的治则配伍组成“筋骨草-茯苓”组方。茯苓三萜是茯苓抗肿瘤作用的主要有效成分之一,对包括皮肤癌、肺癌、卵巢癌、直肠癌、膀胱癌、胰腺癌[6-7]、乳腺癌[9]和白血病[10]等多种肿瘤具有明显的抑制作用。其作用机制可能与抑制DNA、RNA和蛋白质合成[10];阻滞细胞周期[7];通过线粒体和内质网应激诱导肿瘤细胞凋亡[11-12];抑制NF-κB 信号通路,从而降低基质金属蛋白酶的水平,抑制肿瘤转移[9,13]有关。另外,长期的临床应用和体内外实验研究均证明筋骨草对肝癌、肺癌、皮肤癌和乳腺癌有抗肿瘤作用[14-17],我们前期研究发现环烯醚萜类化合物是其发挥抗乳腺癌及其转移作用的主要有效成分,作用机制主要是调节MMPs-TIMPs平衡,抑制乳腺癌4T1细胞肺转移[5]。本研究结果也证实HBG和FL单用能不同程度的抑制乳腺癌MDA-MB-231和SK-BR-3细胞的黏附、运动和侵袭能力(Fig 1~3),且作用呈现剂量依赖性。HBG和FL按固定比例(1 ∶1、5 ∶1和10 ∶1)配伍合用对乳腺癌细胞增殖和转移能力有明显的抑制作用,且作用明显强于HBG或FL单用(P<0.05) ;并且通过中效法和金氏Q值法对合并用药效果进行分析评价,两药按5 ∶1和10 ∶1比例配比合用抑制乳腺癌细胞黏附、运动和侵袭的作用表现为相加或协同效应,其中按10 ∶1配比合用显示为高度协同作用。基于以上结果,我们进一步对两药按10 ∶1配伍比例合用抑制肿瘤转移的作用机制进行研究。
肿瘤细胞的上皮-间质转化(EMT)是乳腺癌转移的主要原因,EMT是具有极性的细胞获得自由移动于细胞基质间的能力,从而使得肿瘤细胞获得更强的移动和侵袭能力,穿过细胞外基质及血管基底膜进入循环系统。此过程以上皮表型缺失和间质表型获得为主要特征[18]。本研究发现,HBG、FL单用及其合用有明显的逆转EMT的作用,主要表现在上皮性标志物ZO-1、β-catenin和E-cadherin表达增加,间质性标志物Vimentin表达降低。同HBG和FL单用相比,两药合用(10 ∶1)具有协同逆转EMT的作用(Fig 4)。在本实验中,通过Western blot法在SK-BR-3细胞中未检测出β-catenin蛋白表达,与文献报道结果相似[19-20],可能与此细胞中β-catenin的mRNA和蛋白表达非常低[21]有关。
丝裂原活化蛋白激酶(MAPK) 通路是介导细胞外刺激到细胞内反应的重要信号转导系统,在细胞内主要有3种激酶亚型:ERK1/2、JNK以及p38,参与肿瘤细胞的生长、增殖、凋亡、运动、黏附、EMT以及细胞外基质降解等过程,在肿瘤的发生、侵袭和转移中其重要的作用[22]。有研究报道,包括肺癌、卵巢癌、皮肤癌等的多种恶性肿瘤中均存在MAPK信号通路的异常表达[23-24],其中ERK1/2和JNK被认为可作为乳腺癌复发转移的独立危险因素[25]。因此本实验对两药合用对MAPK信号通路的影响进行分析,从而确定药物抑制乳腺癌细胞侵袭和转移的作用机制。结果发现,HBG和FL单用及合用对p-ERK1/2、p-p38和p-JNK的表达均有不同程度的抑制作用,并且两药合用具有协同效应。提示,两药合用通过抑制MAPK信号通路的过度激活发挥协同抑制乳腺癌细胞黏附、运动和侵袭能力的作用。此外,Fig 5结果也显示,在两种乳腺癌细胞中,HBG对p-p38表达未见明显抑制作用,但是相同剂量下HBG与FL配伍合用后能明显抑制p38 MAPK通路的过度激活,以上结果也体现了两药配伍合用的作用优势。
本实验还发现,对于三阴型乳腺癌MDA-MB-231细胞,HBG和FL单用及合用对p-JNK表达未见明显影响;但相同给药剂量下,对于HER-2过表达型乳腺癌SK-BR-3细胞,HBG和FL单用及合用能明显抑制p-JNK表达。由此推测,HBG和FL合用对两种不同分子亚型乳腺癌细胞MAPK通路的差异作用可能与两种细胞的HER-2的差异表达有关,但是HER-2在介导两药合用抑制乳腺癌转移中的作用及其与MAPK通路的相互关系尚需要进一步深入研究。
结合药物对MAPK信号通路和EMT相关靶蛋白的影响,我们发现HBG和FL单用以及合用对ERK/p38 MAPK信号通路靶蛋白(p-ERK1/2和p-p38)的表达和对EMT相关标志物(Vimentin、ZO-1、β-catenin和E-cadherin)的蛋白表达的影响趋势和程度一致;此外,虽然两药合用对不同乳腺癌细胞均有明显逆转EMT,抑制细胞黏附、运动和侵袭的能力,但是在SK-BR-3细胞中明显抑制p-JNK表达,在MDA-MB-231细胞中未见对p-JNK有明显影响,推测HBG和FL两药合用逆转EMT的作用可能与ERK/MAPK途径和p38/MAPK途径密切相关,但是对于MAPK通路3种亚型激酶在两药合用逆转EMT中的作用需要进一步深入研究。
综上所述,筋骨草总环烯醚萜和茯苓三萜两药合用可能通过抑制MAPK信号通路的激活,从而逆转肿瘤细胞EMT,进而抑制乳腺癌细胞的黏附、运动和侵袭能力,最终发挥抑制肿瘤生长和转移的作用;并且同筋骨草总环烯醚萜和茯苓三萜单用相比,两药合用具有协同效应。本研究提示筋骨草和茯苓合用在预防和治疗乳腺癌转移中的有效性,为“茯苓-筋骨草”药对在乳腺癌治疗中的应用及潜在候选药物的发现提供一定的实验依据。
(致谢:本研究是在中国中医科学院中药研究所完成,在此衷心感谢实验室彭博、贺蓉老师对课题设计、实验操作和文章修改给予的支持和帮助。)
[1] Torre L A,Bray F,Siegel R L,et al. Global cancer statistics,2012[J].CACancerJClin,2015,65(2):87-108.
[2] Eroles P,Bosch A,Perez-Fidalgo JA,et al. Molecular biology in breast cancer:intrinsic subtypes and signaling pathways[J].CancerTreatRev,2012,38:698-707.
[3] 郁仁存.中医肿瘤学[M]. //北京:科学出版社,1983.
[3] Yu R C.TraditionalChinesemedicine(TCM)oncology[M].//Beijing:Science press,1983.
[4] 卢雯平, 姜翠红.古方治疗乳腺癌的用药规律[J]. 中国实验方剂学杂志,2010,16:133-4.
[4] Ru W P,Jiang C H. Ancient medication rules for the treatment of breast cancer[J].ChinJExpeFormulChinMed,2010,16:133-4.
[5] 彭 博,贺 蓉,徐启华,等.筋骨草提取物抑制乳腺癌转移与MMPs和TIMPs表达的关系研究[J].中国中医药杂志,2011,36(24):3511-4.
[5] Peng B,He R,Xu Q H,et al.Correlation between antimetastatic action of Ajuga decumbens and expression of MMPs and TIMPs[J].ZhongguoZhongYaoZaZhi,2011,36(24):3511-4.
[6] Ríos J L. Chemical constituents and pharmacological properties of Poria cocos [J].PlantaMed,2011,77(7):681-91.
[7] Jiang W G,Sanders A J,Katoh M,et al. Tissue invasion and metastasis: Molecular, biological and clinical perspectives[J].SeminCancerBiol,2015,35:S244-75.
[8] Soriano A F, Helfrich B, Chan D C,et al. Synergistic effects of new chemopreventive agents and conventional cytotoxic agents against human lung cancer cell lines[J].CancerRes, 1999,59(24):6178-84.
[9] Ling H,Zhang Y,Ng K Y,et al.Pachymic acid impairs breast cancer cell invasion by suppressing nuclear factor-κB-dependent matrix metalloproteinase-9 expression[J].BreastCancerResTreat,2011,126(3):609-20.
[10]许 津,吕 丁,钟启平,等.茯苓素对小鼠L1210细胞的抑制作用[J],中国医学科学院学报,1988,10(1):45-9.
[10]Xu J,Lyu D,Zhong Q P,et al. Poria cocos inhibiting effect on L1210 cell of mice[J].JChinAcadMedSci,1988,10(1):45-9.
[11]Kikuchi T,Uchiyama E,Ukiya M,et al.Cytotoxic and apoptosis-inducing activities of triterpene acids from Poria cocos[J].JNatProd,2011,74(2):137-44.
[12]Ma J,Liu J,Lu C,et al.Pachymic acid induces apoptosis via activating ROS-dependent JNK and ER stress pathways in lung cancer cells[J].CancerCellInt,2015,15:78.
[13]Cheng S,Eliaz I,Lin J,et al. Triterpenes from Poria cocos suppress growth and invasiveness of pancreatic cancer cells through the downregulation of MMP-7[J].IntJOncol,2013,42:1869-74.
[14]Takasaki M,Tokuda H,Nishino H,et al.Cancer chemopreventive agents(antitumor-promoters) from Ajuga decumbens[J].JNatProd,1999,62(7):972-5.
[15]Konoshima T,Takasaki M,Tokuda H,et al.Cancer chemopreventiveactivity of an iridoid glycoside,8-acetylharpagide,from Ajuga decumbens[J].CancerLett,2000,157(1):87-92.
[16]李 东,姜 淼.中药白毛夏枯草水提液体外抗肿瘤研究[J].吉林中医药,2009,29(5):434.
[16]Li D,Jiang M. Anti-tumor research of Traditional Chinese medicine(TCM),Ajuga decumbens with watering extraction[J].JJilinTraditChinMed,2009,29(5):434.
[17]曾茂贵,贾 铷,吴符火.筋骨草对小鼠S180肉瘤的抑瘤试验[J].福建中医学院学报,2003,13(2):30.
[17]Zeng M G,Jia R,Wu F H. Tumor suppression test of Ajuga decumbens for S180 sarcoma in mice[J].JFujianCollTraditChinMed,2003,13(2):30.
[18]Yilmaz M,Christofori G.EMT,the cytoskeleton, and cancer cell invasion[J].CancerMetastasisRev,2009,28(1-2):15-33.
[19]Schickling B M,England S K,Aykin-Burns N,et al. BKCa channel inhibitor modulates the tumorigenic ability of hormone-independent breast cancer cells via the Wnt pathway[J].OncolRep,2015,33:533-8.
[20]He B,You L,Uematsu K,et al. A monoclonal antibody against Wnt-1 induces apoptosis in human cancer cells[J].Neoplasia,2004,6:7-14.
[21]Pishvaian M J,Feltes C M,Thompson P,et al. Cadherin-11 is expressed in invasive breast cancer cell lines[J].CancerRes,1999,59(4):947-52.
[22]Dhillon A S,Hagan S,Rath O,et al.MAP kinase signalling pathways in cancer[J].Oncogene,2007,26:3279-90.
[23]Kim E K,Choi E J. Compromised MAPK signaling in human diseases: an update[J].ArchToxicol,2015,89: 867-82.
[24]刘 虹,马 艳,邵荣光. 磷酸化蛋白EBP50通过降低ERK1/2活性抑制乳腺癌细胞MCF-7增殖能力[J]. 中国药理学通报,2015,31(1):55-9.
[24]Liu H, Ma Y, Shao R G. Phosphoprotein EBP50 suppresses proliferation of breast cancer by inhibiting activity of ERK1/2 in MCF-7 cell line [J].ChinPharmacolBull, 2015, 31(1):55-9.
[25]吴向华,陆云飞,黄名威.ERK及JNK/MAPK通路在复发转乳腺癌中的表达及临床意义[J].广东医学,2010,31(14):1841-3.
[25]Wu X H,Lu Y F,Huang M W. Expression and clinical significance in the recurrence of breast cancer in ERK and JNK/MAPK pathway[J].GuangdongMed,2010,31(14):1841-3.
Preliminary research on effect of combination of Ajuga decumbens and Poria cocos on invasion and metastasis of breast cancer
WANG Jing-jing1,PENG Bo2,HE Rong2, XU Qi-hua2,HAN Jing-ya2,Li Jian-rong2
(1.SchoolofLifeSciences,LiaoningNormalUniversity,DalianLiaoning116000,China;2.InstituteofChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China)
Aim To investigate the effect of Ajuga decumbens(HBG), Poria cocos(FL) and their combination on the metastasis of invasive breast cancer cells and the related mechanisms.Methods We conducted several assays including cell adhesion assay, scratch assay and transwell invasion assay. Western blot analysis was employed to detect the expression of associated proteins of EMT and MAPK signaling pathway.Results FL,HBG and their combination could significantly inhibit the adhesion, migration and invasion of MDA-MB-231 and SK-BR-3 cells. HBG and FL had markedly synergistic effect, and the best compatibility ratio was 10 ∶1. HBG, FL and their combination could reverse EMT of breast cancer cells, which increased the levels of epithelial biomarkers, such as β-catenin, E-cadherin and ZO-1, and reduced the levels of mesenchymal biomarkers, such as vimentin. Moreover, treatment of the cells with HBG, FL and their combination resulted in marked inhibition of phosphorylation of ERK1/2, JNK and p38. Conclusions The combination of HBG and FL have the ability to inhibit breast cancer cell invasion by targeting the expression of MAPK pathway as well as suppressing the epithelial-to-mesenchymal transition.
breast cancer; iridoids in Ajuga decumbens; triterpenes in Poria cocos; metastasis; MAPK pathway; invasion
时间:2017-3-13 8:38
http://kns.cnki.net/kcms/detail/34.1086.R.20170324.1248.052.html
2016-12-10,
2017-01-15
国家自然科学基金资助项目(No 81302981,81374058);中国中医科学院中药研究所基本科研业务费自主选题(No ZZ2014004,ZXKT15021)
王晶晶(1991-),女,硕士生,研究方向:中药肿瘤药理学,E-mail:974333143@qq.com; 彭 博(1979-),女,副研究员,研究方向:中药肿瘤药理学,E-mail:pumcpb@sina.com; 李建荣(1956-),女,博士,研究员,博士生导师,研究方向:中药药理学和毒理学,通讯作者,E-mail:jrongliem@sina.com
10.3969/j.issn.1001-1978.2017.04.026
A
1001-1978(2017)04-0581-08
R282.71;R289.1?;R329.24;R737.902.2;R977.6

