刺头复叶耳蕨总黄酮促进脐带间充质干细胞成骨分化
严 晨,殷嫦嫦,王子瑶,殷 明
(南昌大学 1.第二附属医院骨科、2.研究生院医学部,江西 南昌 330006;3.九江学院基础医学院生化教研室,江西 九江 332000)
刺头复叶耳蕨总黄酮促进脐带间充质干细胞成骨分化
严 晨1,2,殷嫦嫦3,王子瑶1,2,殷 明1
(南昌大学 1.第二附属医院骨科、2.研究生院医学部,江西 南昌 330006;3.九江学院基础医学院生化教研室,江西 九江 332000)
TFAE;hUCMSCs;增殖;Col1a1;OPN;成骨分化
骨缺损临床上常见,治疗起来比较棘手,经济花费多,常出现骨不连、骨不愈合、畸形、功能障碍等。随着人口老龄化、高能量暴力损伤逐年增多,大段骨缺损发生率也不断上升。骨组织工程技术治疗大段骨缺损是一种崭新的方法,试图减少骨缺损治疗并发症及经济费用,具有一定的应用价值。生长诱导因子是骨组织工程中的因素之一,在骨修复过程中起到至关重要的作用。一些外源性成骨生长诱导因子已应用于临床来促进骨修复,但其价格昂贵,剂量难以控制,长期大量应用可产生一定的毒副作用,使得其广泛应用受到一定约束。近年来研究发现,一些传统中药具有一定促成骨分化潜能,可替代外源性成骨生长诱导因子或作为补充[1]。
刺头复叶耳蕨( arachniodes exilis )为鳞毛蕨科复叶耳蕨属植物,多年来,作为一种民间用药,用于治疗急性黄疸型肝炎、腰腿疼、关节炎、烧伤等,已被证明具有抗菌及抗炎作用[2]。Zhou等[3]研究发现,刺头复叶耳蕨的乙醇提取物具有潜在的抗氧化和护肝作用,在治疗肝脏疾病方面具有一定的潜能。刺头复叶耳蕨提取物成分复杂,各种提取物的生物学作用尚不清楚,其中黄酮及多酚类衍生提取物研究颇多,具有一定的价值。Li等[4]研究发现,刺头复叶耳蕨提取物总黄酮能通过活化MAPK信号通路介导肝癌HepG2细胞凋亡,而对正常人肝LO2细胞增殖影响较小,特别是在低浓度时。Wu等[1]研究报道黄酮类化合物淫羊藿能够促进BMSCs成骨分化。Song等[5]研究证实淫羊藿促进MC3T3-E1细胞增殖,并能够通过雌激素受体(ER)介导激活ERK及JNK信号途径,促进成骨分化。本研究探讨TFAE对hUCMSCs增殖及成骨分化的作用,为药物的开发利用及骨缺损的治疗提供实验参考。
1 材料
1.1 脐带 人脐带由九江市妇幼保健院提供,产妇及胎儿健康。产妇及家属对本研究知情同意, 并经医院伦理委员会批准。
1.2 主要试剂 TFAE由九江学院药学院提供(采用超声辅助的乙醇浸提法及聚酰胺纯化提取,芦丁样结构化合物含量为75%),α-MEM培养基、Hyclone胎牛血清(Hyclone公司 美国),CCK-8细胞增殖检测试剂盒(上海经科化学),ALP测定试剂盒(上海荣盛生物),hUCMSCs成骨诱导分化培养基试剂盒、茜素红染色液(广州赛业生物科技),GREENspin组织/细胞RNA提取试剂盒(北京庄盟),HiFiscriptcDNA 第一链合成试剂盒、Goat Anti-Rabbit IgG、HRP(北京康为世纪),基因引物(上海生工生物工程),2×Tap Master Mix(上海近岸),总蛋白提取试剂盒(北京普利莱),兔抗人GAPDH、Col1a1、OPN多克隆抗体(Abcam 美国)。
1.3 主要仪器 倒置荧光显微镜(Nikon日本),酶标仪(Bio-Tek 美国),PCR仪(杭州博日科技有限公司),SIM凝胶成像系统(SIM公司 美国),电泳仪(Bio-RAD 美国)。
2 方法
2.1 hUCMSCs分离、培养 本研究团队已建立了hUCMSCs分离、培养及纯化、鉴定的实验研究条件[6]。无菌条件下分离脐带中的华通氏胶,将其剪成体积约3~5 mm3大小,接种于10 cm2塑料皿中,加入含10%胎牛血清的α-MEM培养基,置于37℃,5% CO2培养箱中培养,3 d更换一次培养基。待细胞融合达80%~90%后,消化接种于25 cm2培养瓶中,细胞融合达80%~90%后,按1 ∶3传代培养,取P3代进行实验,倒置相差显微镜观察细胞形态。
2.2 CCK-8法检测细胞活性 实验分为5组:0 mg·L-1TFAE组(对照组),1 mg·L-1TFAE组,5 mg·L-1TFAE组,10 mg·L-1TFAE组,20 mg·L-1TFAE组。取P3代hUCMSCs按5×103/孔接种于96孔板中,每孔200 μL培养基,培养24 h后,更换含不同浓度的TFAE等量培养基。各浓度组均设3个复孔和1个空白孔(只含药物不含细胞)。分别作用24、48、72 h后,每孔加入10 μL CCK-8试剂,37℃孵育2 h后取出,用酶标仪在450 nm波长处测各孔吸光度OD(A)值,各组吸光度OD=A细胞-A药空白,细胞活性/%=(1-OD实验/OD对照)×100%。
2.3 茜素红染色 配制完全成骨诱导液:将hUCMSCs成骨诱导分化培养基试剂盒中的各组分充分混合。实验分4组:空白对照组(常规培养基),阳性对照组(0 mg·L-1TFAE的成骨诱导培养基),1 mg·L-1TFAE组(1 mg·L-1TFAE的成骨诱导培养基),5 mg·L-1TFAE组(5 mg·L-1TFAE的成骨诱导培养基)。取第3代hUCMSCs按2×105个/孔接种于6孔板中,常规培养基培养,待细胞融合达60%~70%,按照分组更换常规培养基或含不同浓度的TFAE成骨诱导培养基,每3天换液一次,诱导14 d后行茜素红染色,培养板拍照及倒置相差显微镜下观察并计算每组10个视野钙结节数量,求平均值。
2.4 AMP法测定ALP活力 分组及培养、诱导方法同“2.3”,诱导3、7 d后,按ALP测定试剂盒(AMP法)使用说明书步骤操作于405 nm处酶标仪检测各组每分钟吸光度平均变化值A/min,共3 min,根据公式:ALP活力(U/L)=A/min×F(F=2 713),计算各组ALP活力。
2.5 RT-PCR检测成骨相关基因表达水平 分组及培养、诱导方法同“2.3”,诱导14 d后,按GREENspin组织/细胞快速提取试剂盒说明书提取细胞总RNA,按HiFiscriptcDNA第一链合成试剂盒说明书将RNA逆转录合成cDNA,按2×Tap Master Mix说明行DNA扩增,PCR扩增反应体系(共25 μL):2×Tap Master Mix 12.5 μL,上游引物1 μL,下游引流1 μL,CDNA 2 μL,ddH2O 8.5 μL,将扩增产物行1%琼脂糖凝胶电泳,SIM凝胶成像系统拍照,条带用Image J 软件分析其灰度值。目的基因:Col1a1、OPN、Runx2、Osx,内参:GAPDH。基因引物序列及产物大小见Tab 1。
2.6 Western blot检测成骨标记蛋白表达水平 分组及培养、诱导方法同“2.3”,诱导14 d后,按总蛋白抽提试剂盒操作说明提取各组细胞总蛋白,BCA法检测蛋白浓度,每孔蛋白上样量30 μg,进行聚丙烯酰胺(SDS-PAGE)凝胶电泳,转膜,5%脱脂牛奶封闭,一抗GAPDH(1 ∶4 000)、Col1a1(1 ∶1 000)、OPN(1 ∶1 000)孵育,1×TBTS洗膜3次,二抗(1 ∶6 000)孵育,1×TBTS洗膜3次,暗室中胶片曝光、显影、定影,胶片拍照,条带用Image J软件分析其灰度值。

Tab 1 Gene primer sequence and product length

Fig 1 Cellular morphology observation(×100)
A:Primary hUCMSCs cultured for 5 days;B:Primary hUCMSCs cultured for 12 days;C: hUCMSCs at passage 1 cultured for 2 days;D:hUCMSCs at passage 3 cultured for 3 days
3 结果
3.1 hUCMSCs形态学观察 脐带组织贴壁培养3~5 d后,镜下可见少许细胞爬出(Fig 1A),培养10~14 d,组织块周围长满成纤维样细胞(Fig 1B),经传代培养后,细胞呈均一的长梭形或纺锤形,排列紧密,呈鱼群样或旋涡状分布(Fig 1C、D)。
3.2 细胞活性检测结果 CCK-8检测结果分析显示:与对照组相比,低浓度TFAE组(1 mg·L-1TFAE组、5 mg·L-1TFAE组)细胞活性明显增强(P<0.05或P<0.01),而高浓度TFAE组(10 mg·L-1TFAE组、20 mg·L-1TFAE组)细胞活性明显减弱(P<0.05或P<0.01),说明在一定浓度范围内,TFAE促进hUCMSCs增殖,在范围外时则抑制其增殖(Fig 2)。

Fig 2 Effect of TFAE on proliferation in hUCMSCs(±s,n=4)
*P<0.05,**P<0.01vscontrol
3.3 茜素红染色结果 茜素红染色结果及分析显示:诱导14 d后,阳性对照组及不同浓度TFAE组均有钙结节形成,而空白对照组未见钙结节,与阳性对照组,1 mg·L-1TFAE组及5 mg·L-1TFAE组颜色加深及钙结节数量明显增多,差异有显著性(P<0.01),说明一定浓度的TFAE能促进hUCMSCs钙结节形成,促进成骨分化(Fig 3)。
3.4 ALP检测结果 AMP法检测ALP结果分析显示:诱导3、7 d后,与空白对照组相比,阳性对照组、1 mg·L-1TFAE组及5 mg·L-1TFAE组ALP活力明显增强(P<0.05或P<0.01),与阳性对照组,1 mg·L-1TFAE组及5 mg·L-1TFAE组ALP活力也明显增强,差异显著(P<0.05或P<0.01),且7 d时各组hUCMSCs的ALP活力均高于3 d时对应各组(Fig 4)。
3.5 RT-PCR检测结果 RT-PCR检测结果分析显示:诱导14 d后,与空白对照组相比,阳性对照组、1 mg·L-1TFAE组及5 mg·L-1TFAE组成骨相关基因Col1a1、OPN、Runx2、OsxmRNA表达量明显增加(P<0.01),与阳性对照组,1 mg·L-1LTFAE组及5 mg·L-1TFAE组Col1a1、OPN、Runx2、OsxmRNA表达量也明显增加,差异有显著性(P<0.05或P<0.01)(Fig 5)。
3.6 Western blot检测结果 Western blot检测结果分析显示:诱导14 d后,与空白对照组相比,阳性对照组、1 mg·L-1TFAE组及5 mg·L-1TFAE组Col1a1、OPN蛋白表达量明显增加(P<0.05或P<0.01),与阳性对照组,1 mg·L-1TFAE组及5 mg·L-1TFAE组Col1a1、OPN蛋白表达量也明显增加,差异有显著性(P<0.01)(Fig 6)。
4 讨论
hUCMSCs来源于人脐带华通胶组织,是一种多能干细胞,具有强大的增殖及分化潜能,在一定条件下可分化成骨细胞、软骨细胞、神经细胞、肌细胞、内皮细胞、脂肪细胞、肝细胞、胰岛样细胞等[7-11]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是目前组织工程技术中研究较多,应用较广的干细胞。随着hUCMSCs的发现及深入研究,其具有比BMSCs更大的优势,脐带属于医疗废物,因此hUCMSCs来源无创、广泛,易获取,可塑性更强,易培养扩增、免疫原性极低,冻存复苏生物性状不改变,传代培养对细胞增殖及分化能力影响极小,与骨组织工程支架具有良好的相容性,是未来具有广阔应用前景的种子细胞。
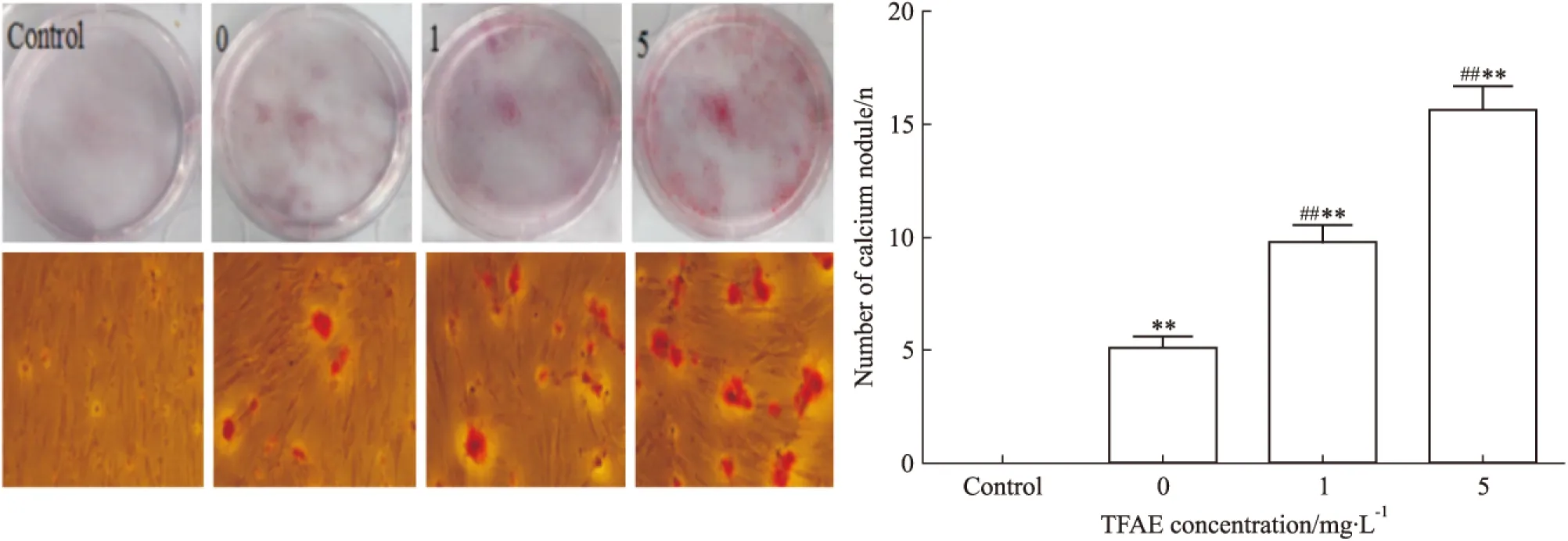
Fig 3 Effect of TFAE on calcium nodules formation in hUCMSCs(±s, n=4)**P<0.01 vs control;##P<0.01 vs positive control

Fig 4 Effect of TFAE on ALP activity in hUCMSCs(±s,n=4)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vspositive control
黄酮类化合物广泛存在大自然植物体内,具有抗炎、抗氧化、调节免疫、护肝、防治癌症等作用。刺头复叶耳蕨是我国民间传统中药,历史悠久。研究报道刺头复叶耳蕨总黄酮提取物TFAE具有促进肝细胞再生、抗病毒及杀伤癌细胞作用[3-4]。 有研究发现多种黄酮类化合物如黄芩苷、淫羊藿有促进细胞增殖及成骨分化作用[12]。本研究发现,低浓度的TFAE(1、5 mg·L-1)能够促进hUCMSCs增殖,高浓度TFAE抑制其增殖(10、20 mg·L-1),说明一定浓度范围TFAE能促进干细胞增殖,因此本实验取1、5 mg·L-1浓度的TFAE研究其在hUCMSCs成骨分化中的作用。

Fig 5 Effect of TFAE on expression level of osteogenesis-related gene Col1a1,OPN,Runx2,Osx mRNA in hUCMSCs(±s, n=4)
**P<0.01vscontrol;#P<0.05,##P<0.01vspositive control
ALP、Runx2、Osx、Col1a1、OPN及钙结节形成是评估成骨分化的重要标志[13],ALP的表达活性是成骨细胞分化的一个明显的特征,促进磷酸盐形成,在成骨分化早期,ALP表达丰富,在基质沉淀期,钙化的成骨细胞中,ALP表达下降[14]。Runx2是转录因子Runxx家族成员之一,作为一种成骨细胞的特异转录因子,对成骨及骨组织重建起着非常重要的作用,决定着干细胞向成骨细胞分化,调节多种成骨相关基因的表达[15],有研究报道Runx2基因缺失小鼠,成骨受损,而Runx2过表达导致新骨形成[16-17]。Osx位于Runx2基因下游,也是一种重要的调节成骨细胞分化的转录因子,在成骨分化及骨形成过程中起到非常重要的作用[18-19]。Runx2、Osx是成骨分化早期标志[20]。Col1a1、OPN与成骨分化晚期相关,表达在成熟的成骨细胞中[1],晚期阶段,成骨细胞最终形成钙结节,而钙结节的形成是MSCs成骨分化的最直接的证据。本研究一系列实验发现,hUCMSCs诱导后,与阳性对照相比,低浓度TFAE组钙结节形成明显增多,ALP活力明显增强,Runx2、Osx、Col1a1、OPNmRNA及Col1a1、OPN蛋白表达上调,成骨分化能力明显增强。

Fig 6 Effect of TFAE on expression level of osteogenesis-specific protein Col1a1,OPN in hUCMSCs(±s, n=4)
*P<0.05,**P<0.01vscontrol;##P<0.01vspositive control
综上所述,低浓度的TFAE具有促进hUCMSCs增殖及成骨分化作用,TFAE中成分较多,具体是什么成分发挥作用及作用机制有待于进一步研究。hUCMSCs也是组织工程领域中理想的种子细胞,应用前景广阔。
(致谢:本实验在九江学院基础医学院生化教研室实验室完成,感谢实验室全体成员对本实验的支持与帮助!)
[1] Wu Y, Xia L, Zhou Y, et al. Icariin induces osteogenic differentiation of bone mesenchymal stem cells in a MAPK dependent manner[J].CellProlif, 2015, 48(3): 375-84.
[2] Chinese Materia Medica Editorial Board, Chinese Materia Medica,Shanghai Scientific and Technical Press[M]. Shanghai,China, 1st edition, 1999.
[3] Zhou D, Ruan J, Cai Y, et al. Antioxidant and hepatoprotective activity of ethanol extract of Arachniodes exilis(Hance) Ching[J].JEthnopharmacol, 2010, 129(2): 227-32.
[4] Li H, Chen J, Xiong C, et al. Apoptosis induction by the total flavonoids from arachniodes exilis in HepG2 cells through reactive oxygen species-mediated mitochondrial dysfunction involving MAPK activation[J].EvidBasedComplementAlternatMed, 2014,2014:906-41.
[5] Song L, Zhao J, Zhang X, et al. Icariin induces osteoblast proliferation, differentiation and mineralization through estrogen receptor-mediated ERK and JNK signal activation[J].EurJPharmacol, 2013, 714(1-3):15-22.
[6] 胡文龙,吴平平,耿书国,等. 人脐带间充质干细胞分泌白细胞介素6促进骨肉瘤细胞增殖和迁移[J]. 中国病理生理杂志, 2016, 32(2): 201-7.
[6] Hu W L, Wu P P, Geng S G, et al. hUC-MSCs promote proliferation and migration of osteosarcoma cells by secreting IL-6[J].ChinJPathophysiol, 2016, 32(2): 201-7.
[7] Yoon J H, Roh E Y, Shin S, et al. Introducing pulsed low-intensity ultrasound to culturing human umbilical cordderived mesenchymal stem cells[J].BiotechnolLett, 2009,31(3): 329-35.
[8] Jo C H, Kim O S, Park E Y, et al. Fetal mesenchymal stem cells derived from human umbilical cord sustain primitive characteristics during extensive expansion[J].CellTissueRes,2008, 334(3): 423-33.
[9] Ishige I, Nagamura-Inoue T, Honda M J, et al. Comparison of mesenchymal stem cells derived from arterial, venous, and Wharton′s jelly explants of human umbilical cord[J].IntJHematol, 2009, 90(2): 261-9.
[10]Campard D, Lysy P A, Najimi M, et al. Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocytelike cells[J].Gastroenterology, 2008, 134(3): 833-48.
[11]Wu L F, Wang N N, Liu Y S, et al. Differentiation of Wharton′s jelly primitive stromal cells into insulin producing cells in comparison with bone marrow mesenchymal stem cells[J].TissueEngPartA, 2009,15(10): 2865-73.
[12]李晨睿,孟志远,牛银波,等. 黄芩苷通过Wnt/β-catenin信号通路对大鼠骨髓间充质干细胞成骨分化的促进作用[J]. 中国药理学通报, 2015, 31(7): 919-24.
[12]Li C R, Meng Z Y, Niu Y B, et al. Baicalin induces osteogenic differentition of rat bone marrow derived mesenchymal stem cells via Wnt/catenin signaling pathway[J].ChinPharmacolBull, 2015, 31(7): 919-24.
[13]Nagai H, Kobayashi-Fujioka M, Fujisawa K, et al. Effects of low crystalline carbonate apatite on proliferation and osteoblastic differentiation of human bone marrow cells[J].JMaterSciMaterMed, 2015, 26(2):99.
[14]Taskiran D, Evren V. Stimulatory effect of 17β-estradiol on osteogenic differentiation potential of rat adipose tissue-derived stem cells[J].GenPhysiolBiophys, 2011, 30(2):167-74.
[15]Chen S, Gluhak-Heinrich J, Wang Y H, et al. Runx2, osx, and dspp in tooth development[J].JDentRes, 2009, 88(10):904-9.
[16]D′Souza R N, Aberg T, Gaikwad J, et al. Cbfa1 is required for epithelial-mesenchymal interactions regulating tooth development in mice[J].Development, 1999, 126(13):2911-20.
[17]Takahashi T. Overexpression of Runx2 and MKP-1 stimulates transdifferentiation of 3 T3-L1 preadipocytes into bone-forming osteoblastsinvitro[J].CalcifTissueInt, 2011, 88(4):336-47.
[18]Wang Y, Zheng Y, Wang Z,et al. 10(-7) m17β-oestradiol enhances odonto/osteogenic potency of human dental pulp stem cells by activation of the NF-κB pathway[J].CellProlif, 2013, 46(6):677-84.
[19]Baek W Y, Lee M A, Jung J W, et al. Positive regulation of adult bone formation by osteoblast-specific transcription factor osterix[J].JBoneMinerRes, 2009, 24(6):1055-65.
[20]Li Y, Yan M, Wang Z, et al. 17beta-estradiol promotes the odonto/osteogenic differentiation of stem cells from a pical papilla via mitogen-activated protein kinase pathway[J].StemCellResTher, 2014, 5(6):125.
Total flavonoids from arachniodes exilis promotes osteogenic differentiation of hUCMSCs
YAN Chen1,2, YIN Chang-chang3, WANG Zi-yao1,2, YIN Ming1
(1.DeptofOrthopedics,theSecondAffiliatedHospitaltoNanchangUniversity,2.MedicalGraduateSchoolofNanchangUniversity,Nanchang330006,China;3.DeptofBiochemistry,SchoolofBasicMedicineofJiujiangCollege,JiujiangJiangxi332000,China)
Aim To study the role of the total flavonoids from arachniodes exilis(TFAE) in osteogenic differentiation of human umbilical cord mesenchymal stem cells(hUCMSCs).Methods hUCMSCs were isolated and cultured by tissue explants adherent method, hUCMSCs at passage 3 were used to do the experiment, hUCMSCs were treated by different concentrations of TFAE, and cellular viability was measured by CCK 8 assay; alkaline phosphatase(ALP) activity was tested by AMP method; calcium nodule formation was detected by alizarin red staining; expression level of osteogenesis-related gene type I collagen enzyme a1(collagen type Ia1, Col1a1), osteopontin(OPN), Runx2, Osterix(Osx) mRNA was measured by RT-PCR; expression level of Col1a1,OPN protein was measured by Western blot.Results Certain concentration of TFAE(1 mg·L-1, 5 mg·L-1) promoted cellular proliferation, calcium nodules were more, ALP activity was enhanced; expression level of osteogenesis-related gene Col1a1, OPN, Runx2, OsxmRNA and Col1a1, OPN protein was up-regulated.Conculsion A certain concentration of TFAE promotes proliferation and osteogenic differentiation of hUCMSCs.>)
TFAE; hUCMSCs; proliferation; Col1a1; OPN; osteogenic differentiation
时间:2017-3-13 8:38
http://kns.cnki.net/kcms/detail/34.1086.R.20170324.1247.042.html
2016-12-15,
2017-01-14
国家自然科学基金资助项目(No 81160226)
严 晨(1986-),男,硕士生,研究方向:创伤与骨肿瘤,E-mail:yanchen8623@163.com; 殷 明(1958-),男,教授,主任医师,博士生导师,研究方向:脊柱与肿瘤,通讯作者:E-mail: yinming0791@aliyun.com
10.3969/j.issn.1001-1978.2017.04.021
A
1001-1978(2017)04-0557-06
R284.1;R329.24;R394.2;R714.56;R977.3;R977.6摘要:目的 研究刺头复叶耳蕨总黄酮(total flavonoids from arachniodes exilis,TFAE)在人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)成骨分化中的作用。方法 采用组织块贴壁法分离培养hUCMSCs,取P3代细胞进行实验,不同浓度的TFAE处理hUCMSCs,CCK-8法检测细胞活性;AMP法测定碱性磷酸酶(ALP)活力,茜素红染色检测钙结节形成;RT-PCR检测成骨相关基因I型胶原酶a1(collagen type I alpha1, Col1a1)、骨桥蛋白(osteopotin, OPN)、Runx2、Osterix(Osx)mRNA表达水平,Western blot检测Col1a1、OPN蛋白表达水平。结果 在一定浓度范围内,TFAE(1、5 mg·L-1)促进细胞增殖;钙结节数量增多;ALP活力增强,成骨相关基因Col1a1、OPN、Runx2、OsxmRNA及Col1a1、OPN蛋白表达水平上调。结论 一定浓度的TFAE促进hUCMSCs增殖及成骨分化。

