吗啡诱导的大鼠条件性位置偏爱模型中关键脑区PEBP及ERK活性的变化
边佳明,吴 宁,李 锦
(1.陆军总医院药理科,北京 100700;2.军事医学科学院毒物药物研究所,北京 100850)
吗啡诱导的大鼠条件性位置偏爱模型中关键脑区PEBP及ERK活性的变化
边佳明1,吴 宁2,李 锦2
(1.陆军总医院药理科,北京 100700;2.军事医学科学院毒物药物研究所,北京 100850)
目的 研究大鼠阿片精神依赖状态下,相关脑区磷脂酰乙醇胺结合蛋白(PEBP)及ERK活性的变化。方法 建立条件性位置偏爱(CPP)模型模拟吗啡精神依赖的不同阶段,观察依赖相关重要脑区在大鼠CPP形成、熄灭及重建时PEBP表达和ERK活性的变化。结果 海马、前额叶皮层、纹状体、伏隔核等4个脑区,CPP各阶段均未见PEBP表达水平有明显变化;但在CPP形成时,前额叶皮层的ERK活性明显升高,而CPP重建后,海马的ERK活性明显降低。结论 吗啡成瘾不同阶段,药效-环境关联性记忆的形成和唤起涉及不同神经通路,ERK活性在其中十分关键,但PEBP可能并未参与ERK活性调节。
磷脂酰乙醇胺结合蛋白; ERK; 吗啡; 成瘾; 条件性位置偏爱; 阿片依赖
磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine-binding protein,PEPB)结构上高度保守,分子量23 ku,研究发现其具有调节ERK、NF-κB、GPCR等多个信号通路的功能[1]。吗啡通过GPCR调节细胞信号传导,继而影响整个神经通路,产生奖赏效应,但持续错误的奖赏导致躯体和精神双重依赖。研究已证实ERK活性调节在阿片依赖过程中扮演了十分重要的角色,在依赖不同阶段,不同脑区,ERK活性变化不完全相同[2]。本研究通过吗啡诱导的条件位置偏爱(conditioned place preference,CPP)模型,观察依赖相关脑区在关联性记忆不同阶段,PEBP表达以及ERK活性变化,探讨阿片依赖过程中PEBP和ERK之间可能存在的调节机制。
1 材料与方法
1.1 实验动物 健康SD大鼠(军事医学科学院实验动物中心,二级动物,动物合格证编号:SCXK-[(军)2007-004],♂,160 g~180 g,6只/笼,自由摄食饮水,室温控制18 ℃~24 ℃,日光灯照明,每12 h昼夜交替。
1.2 主要试剂 盐酸吗啡(青海制药厂,批号:910907,中国);兔抗PEBP 单克隆抗体(Abcam,ab76582,lot.658640,英国);小鼠抗pERK单克隆抗体(Santa Cruz,sc-7383,lot. I1009,美国);兔抗ERK2多克隆抗体(Santa Cruz,sc-154,lot.I0408,美国);小鼠beta-actin单克隆抗体(北京中杉金桥,TA-09,lot.091016);羊抗小鼠HRP-二抗(北京中杉金桥,中国);羊抗兔HRP-二抗(北京中杉金桥,中国)。
1.3 主要仪器 动物行为分析系统(宁波·安来,行为分析软件:Anilab 2.2,中国);EPS601型稳压稳流电泳仪(Amersham,美国);DYCZ-24D垂直电泳槽,DYCP-40C石墨半干转移槽(北京六一仪器厂,中国);EnVision2104多功能酶标仪 (Perkin Elmer,美国);5810R 型低温高速离心机(Eppendorf,美国);凝胶成像分析仪(Alpha,美国);VCX-130超声破碎仪(Sonics,美国)。
1.4 实验方法
1.4.1 条件性位置偏爱模型的建立 所用装置设计与许月芳等[3]相同,但箱体更大,黑、白箱(40×40×65) cm3,中间箱(40×15×65) cm3。训练方式(Fig 1):d 1、2为动物适应期,d 3、4上午9:00开始前测(initial test),时间15 min,根据自然偏爱结果(2次前测平均值),采用抗衡设计分为吗啡组和盐水对照组,使偏爱白箱的大鼠用黑箱伴药训练,偏爱黑箱的大鼠用白箱伴药训练,最终使吗啡组和盐水对照组均为一半伴白箱训练,一半伴黑箱训练。每天训练1轮,每轮上下午各注射1次(吗啡10 mg·kg-1s.c.,或生理盐水s.c.),每次训练45 min,共8轮。d 13为测试期,打开通道,动物放入中间箱任其自由穿梭,记录15 min内在伴药侧停留时间,测试CPP形成。熄灭:饲养条件不变,每周1次将动物放进中间箱,打开通道,任其自由穿梭15 min并记录,连续2 d的测试结果阴性认为CPP完全熄灭。重建:熄灭后的两组动物给予吗啡(2.5 mg·kg-1)后立即放入中间箱,测试15 min,检测CPP是否被诱导重建。

Fig 1 CPP experimental flow
1.4.2 样品制备 取材:分别在CPP形成测试后、完全熄灭测试后、重建测试后2 h内取材。大鼠断头,剥离大脑,冰的生理盐水中略漂洗,冰上分离海马(Hip)、前额叶皮层(PFC)、伏隔核(NAc)和纹状体(Str),取材后立即-70℃保存待用。样品制备:每100 mg湿重组织加1 mL裂解液(Tris,50 mmol·L-1;NaCl,150 mmol·L-1;EDTA,1 mmol·L-1;EGTA,1 mmol·L-1;NP40,1 g·L-1;Aprotinin,1 mg·L-1; Pepstatin,1 mg·L-1;Leupeptin,1 mg·L-1;PMSF,1 mmol·L-1;DTT,1 mmol·L-1;NaF,1 mmol·L-1;Na3VO4,1 mmol·L-1;pH=8.0),冰上超声破碎匀浆,裂解20 min,4℃,12 000 r·min-1,20 min离心,取上清,-70℃保存。
1.4.3 蛋白免疫印迹 蛋白浓度统一调至2.5 g·L-1,取40 μg总蛋白用12%的变性电泳聚丙烯酰胺凝胶分离,具体操作参照文献[4]进行。
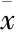
2 结果
2.1 吗啡诱导的大鼠CPP 8轮训练后的测试结果显示(Fig 2A):与前测比较,吗啡组在伴药侧停留时间明显延长,盐水对照组动物则无差异,表明吗啡成功诱导了大鼠CPP形成,而不具备奖赏效应的生理盐水不能引起大鼠位置偏爱或偏恶。3周自然熄灭后的测试结果(Fig 2B)显示:与前测比较,吗啡组和盐水对照组在伴药侧停留的时间差异均无显著性,表明CPP已经完全熄灭。CPP效应熄灭后,立即注射吗啡诱导CPP重建,结果显示(Fig 2C):吗啡组大鼠在伴药侧的停留时间与前测比较明显延长,而注射吗啡的盐水对照组与前测比较无统计学差异,表明2.5 mg·kg-1吗啡成功唤起了大鼠将非条件性刺激(注射吗啡)与试验箱可辨别线索的关联记忆。
Fig 2A The residence time in drug-pairing box on CPP formation(n=24)**P<0.01 vs control

Fig 2B The residence time in drug-pairing box on CPP extinction(n=16)
2.2 CPP不同阶段依赖相关脑区PEBP表达分析 蛋白免疫印迹分析结果显示,在大鼠CPP的3个不同阶段,与对照组比较,海马、前额叶皮层、伏隔核、纹状体4个脑区均未见PEBP表达明显变化(Fig 3A、B、C)。
2.3 CPP不同阶段依赖相关脑区ERK活性分析 蛋白免疫印迹分析结果显示,CPP形成后,前额叶皮层pERK水平较对照组明显升高(1.6倍),其他脑区未见ERK活性明显变化;CPP熄灭后,与对照组比较,4个脑区均未见ERK活性明显变化;CPP重建后,海马pERK水平较对照组明显降低(0.6倍),其他脑区未见ERK活性明显改变(Fig 4A、B、C)。

Fig 2C The residence time in drug-pairing box on CPP reinstatement(n=8)*P<0.05 vs control

Fig 3A PECP expression in different brain regions on CPP formation(n=8)
C,Con:saline control group;M,Mor:morphine group
3 讨论
我们前期在吗啡慢性处理模型上的研究显示,PEBP在吗啡递增给药诱导的大鼠依赖模型上出现表达升高的现象,用反义核酸下调海马PEBP表达可导致吗啡依赖加重,提示PEBP参与了阿片依赖的病理过程[5]。但这一模型不能用于评价依赖过程中关联性记忆的形成,因此我们采用CPP模型进一步评价阿片精神依赖中关联性记忆的形成、消退以及重新唤起对PEBP的影响。另外,ERK活性调节在依赖形成过程中具有不可或缺的作用[6],PEBP已被证实为ERK的内源性抑制蛋白[7],因此同时研究PEBP和ERK在成瘾不同阶段相关重要脑区的变化具有重要意义。

Fig 3B PECP expression in different brain regions on CPP extinction(n=8)
C,Con:saline control group;M,Mor:morphine group
Fig 3C PECP expression in different brain regions when CPP reinstatement(n=8)
C,Con:saline control group;M,Mor:morphine group
CPP模型是利用条件性线索研究关联性学习记忆的一种动物模型,通过一段时间将条件性线索与药物效应(非条件刺激)关联的训练,使这种条件线索能够诱发动物对非条件刺激的记忆[8]。本实验采用完全抗衡设计,将所有受试动物的自然偏性均衡分配,并设生理盐水组做同步对照。在训练周期安排上,也充分考虑训练次序、箱号、时间的影响,做出相应的均衡设计,尽可能排除因实验设计不合理和实验装置的个体差异对结果造成的影响。训练8轮后的测试表明大鼠形成CPP,窗口大约100 s左右。3周后该关联性记忆已经消退,再用小剂量吗啡注射诱导则可重建原有关联记忆。整个实验过程中,生理盐水对照组大鼠在CPP形成、熄灭和重建的不同阶段其平均伴药箱停留时间都稳定在200~250 s左右,且两组动物的体质量在整个实验过程中同等程度和趋势增加,状态无异常,表明CPP实验条件非常稳定,实验结果可信赖。

Fig 4A Acticity of ERK in different brain regions on CPP formation(n=8)
C,Con:saline control group;M,Mor:morphine group,*P<0.05vscontrol

Fig 4B Acticity of ERK in different brain regions on CPP extinction(n=8)
C,Con:saline control group;M,Mor:morphine group

Fig 4C Acticity of ERK in different brain regions on CPP reinstatement(n=8)
C,Con:saline control group;M,Mor:morphine group,*P<0.05vscontrol
与前期吗啡慢性处理模型上观察到的结果不同,在CPP模型上没有检测到PEBP表达的变化,这可能与两个模型中吗啡给药剂量和方式密切相关。前者采用递增给药的方式,即从d 1至d 8按照10、20、20、30、30、40、40、50 mg·kg-1递增给药,每日皮下注射3次。与CPP训练采用的剂量相比,躯体依赖模型中每只大鼠的总给药剂量比CPP大鼠高9倍,且药物的蓄积更加严重,所产生的生理效应以及在最终生化指标的反映上两者可能会不同。此外,课题组前期研究发现PEBP在海马的升高程度与吗啡摄入量相关,因此在CPP模型中未观察到PEBP表达变化或可从给药剂量上予以部分解释。
记忆需要蛋白质的合成,ERK作为一种重要的转录激活因子,其激活在长时程记忆中是必要条件,因此在成瘾性药物相关的记忆中有重要作用[9]。大脑皮层是信号整合的高级中枢,我们推测前额叶皮层发生的ERK活性升高是训练伴随产生的记忆而导致的。目前对原有关联性记忆唤起的机制知之甚少,但比较一致的观点认为海马对于环境关联性记忆的唤起至关重要[10]。急性给予吗啡不会造成海马ERK活性的变化[11],但这里检测到CPP效应重建后海马ERK活性的明显降低,提示海马脑区出现的ERK活性降低与关联性记忆的唤起有关。海马接受隔区的GABA能传入,这些GABA能神经末梢共同构成对海马锥体细胞、齿状回颗粒细胞的调控,负性调控的结果导致钙电流受到抑制,从而可能导致ERK活性降低。
总之,我们的研究发现PEBP在关联性学习记忆的建立和唤起过程中没有参与调控ERK活性,关于PEBP在阿片依赖中的调节机制还需要进一步研究。
(致谢:本研究在军事医学科学院毒物药物所完成,除本文作者外,还特别感谢研究所李斐、赵太云副研究员在分子生物学实验方面的指导,感谢香港中文大学陈文强博士、海军总医院李亮博士对CPP实验的指导。)
[1] 边佳明, 吴 宁, 李 锦. 磷脂酰乙醇胺结合蛋白的信号转导机制及生物学功能研究进展[J].生理学报,2013,65(2): 237-43.
[1] Bian J M, Wu N, Li J. Roles of phosphatidylethanolamine-binding protein in cell signaling and its biological functions[J].ShengLiXueBao, 2013,65(2): 237-43.
[2] Zamora-Martinez E R, Edwards S.Neuronal extracellular signal-regulated kinase (ERK) activity as marker and mediator of alcohol and opioid dependence[J].FrontIntegrNeurosci,2014,8:24.
[3] 许月芳, 苏瑞斌, 杨日芳, 等. Y-IP5对小鼠吗啡行为敏化和条件性位置偏爱的影响[J].中国药理学通报, 2009,25(12):1578-83.
[3] Xu Y F, Su R B, Yang R F, et al. Effects of Y-IP5 on morphine-induced behavioral sensitization and conditioned place preference in mice[J].ChinPharmacolBull,2009,25(12):1578-83.
[4] Bian J M, Wu N, Su R B, Li J. Phosphatidylethanolamine binding protein is not involved in μ-opioid receptor-mediated regulation of extracellular signal-regulated kinase[J].MolMedRep, 2015,11(5):3368-74.
[5] Wei Q H, Wu N, Bian J M, et al. Involvement of hippocampal phosphatidylethanolamine-binding protein in morphine dependence and withdrawal[J].AddictBiol, 2013, 18(2): 230-40.
[6] Lu L, Hope B T, Dempsey J, et al. Central amygdala ERK signaling pathway is critical to incubation of cocaine craving[J].NatNeurosci, 2005, 8(2): 212-9.
[7] Trakul N, Menard R E, Schade G R, et al. Raf kinase inhibitory protein regulates Raf-1 but not B-Raf kinase activation[J].JBiolChem, 2005, 280(26): 24931-40.
[8] 邓慧琼, 周旭辉, 张登科, 等. 条件性位置实验方法及非倾向性实验设计在药物依赖研究中的应用[J]. 中国药物依赖性杂志, 2006,15(2):8-11.
[8] Deng H Q, Zhou X H, Zhang D K, et al. The application of conditioned place experiments and unbiased design in drug dependence study[J].ChinJDrugDepend, 2006,15(2):8-11.
[9] Bian J M, Wu N, Su R B, et al. Opioid receptor trafficking and signaling: what happens after opioid receptor activation[J]?CellMolNeurobiol, 2012, 32(2):167-84.
[10]Urcelay G P, Miller R R. Learning and Memory:AComprehensiveReference[M],Volume one, Retrieval from Memory:53-73.
[11]Girault J A, Valjent E, Caboche J,Herve D. ERK2: a logical and gate critical for drug-induced plasticity[J]?CurrOpinPharmacol, 2007, 7(1): 77-85.
Analysis of brain PEBP and ERK in morphine-induced CPP model in rats
BIAN Jia-ming1, WU Ning2,LI Jin2
(1.DeptofPharmacology,PLAArmyGeneralHospital,Beijing100700,China;2.InstituteofPharmacologyandToxicology,AcademyofMilitaryMedicalScience,Beijing100850,China)
Aim To analyze the expression of phosphatidylethanolamine-binding protein(PEBP) and ERK in critical brain regions of psychological dependence rats.Methods Morphine-induced rats conditioned place preference(CPP) model was established to mimic different stages of morphine psychological dependence, during which PEBP expression and ERK activity were assayed in different brain regions.Results PEBP expression in hippocampus, prefrontal cortex, striatum and nucleus accumbens showed no change at three stages of psychological dependence. However, ERK activity increased notably in prefrontal cortex on CPP formation, and decreased remarkably in hippocampus on CPP reinstatement.Conclusions The formation and retrieval of associated memory between morphine effects and environment involve different neural circuits, in which ERK activity is critical, and PEBP might not be involved in such a memory-related ERK regulation.
phosphatidylethanolamine-binding protein; ERK; morphine; addiction; conditioned place preference; opioid dependence
时间:2017-3-13 8:38
http://kns.cnki.net/kcms/detail/34.1086.R.20170324.1247.036.html
2016-11-20,
2016-12-20
国家高技术研究发展计划(973项目)资助项目(No 2009CB522008);国家自然科学基金资助项目(No 30772563);北京市自然科学基金资助项目(No 7082075)
边佳明(1976-),男,博士,副主任药师,研究方向:阿片依赖,遗传药理学,药学信息,E-mail:bianbenjamin@163.com; 李 锦(1957-),男,博士,研究员,博士生导师,研究方向:阿片依赖,分子药理学,E-mail: jinli9802@163.com
10.3969/j.issn.1001-1978.2017.04.018
A
1001-1978(2017)04-0542-05
R-332;R322.81;R341;R749.61;R971.2

