别嘌醇改善果糖诱导的大鼠高尿酸血症与调节肠道葡萄糖转运子表达的关系研究
陈 刚,贾 萍
(1.重庆市天然药物研究重点实验室,重庆工商大学环境与资源学院,重庆 400067;2. 重庆医科大学附属第一医院中西医结合科,重庆 400016)
◇论 著◇
别嘌醇改善果糖诱导的大鼠高尿酸血症与调节肠道葡萄糖转运子表达的关系研究
陈 刚1,贾 萍2
(1.重庆市天然药物研究重点实验室,重庆工商大学环境与资源学院,重庆 400067;2. 重庆医科大学附属第一医院中西医结合科,重庆 400016)
目的 观察别嘌醇和苯溴马隆对高果糖饮水诱导的高尿酸血症(hyperuricemia, HUA)大鼠血尿酸水平、肝脏黄嘌呤氧化酶活性以及肠道果糖转运子(glucose transporter, GLUT)2和5表达的影响。方法 Wistar大鼠连续饮用10%果糖水8周以制备高尿酸血症大鼠模型,其中从第5周开始分别给予大鼠灌胃5 mg·kg-1别嘌醇或10 mg·kg-1苯溴马隆,共4周。磷钨酸法检测大鼠血尿酸水平,比色法检测肝脏XOD活性,Western blot法和免疫组化染色法检测肠道GLUT2和GLUT5的表达。结果 别嘌醇明显降低果糖诱导的HUA大鼠血尿酸水平(P<0.01)和肝脏XOD活性(P<0.01),减少了HUA大鼠肠道GLUT5的表达(P<0.01),但对肠道GLUT2的表达无明显影响。与此同时,苯溴马隆也明显降低了果糖诱导的HUA大鼠血尿酸水平(P<0.01),但对HUA大鼠肝脏XOD活性、肠道GLUT2和GLUT5的表达均无明显影响。结论 别嘌醇可明显降低果糖诱导的HUA大鼠血尿酸水平,其机制与抑制肝脏XOD活性以减少尿酸产生,抑制GLUT5表达以减少肠道果糖转运吸收,最终减少果糖代谢产生尿酸相关。
别嘌醇;果糖;尿酸;高尿酸血症;葡萄糖转运子2;葡萄糖转运子5
随着人们生活水平的提高和饮食结构的改变,高尿酸血症(hyperuricemia, HUA)发病率明显升高[1]。HUA不仅可导致痛风,还与肥胖、代谢综合征、2型糖尿病、高血压、冠心病、肾病等密切相关[2-3],因此如何防治HUA已成为全社会关注的公共健康课题。近10年来有关高果糖饮食与HUA高发病率的关系备受关注[4],学术界至今仍争论不休。高果糖玉米糖浆于1967年问世,此后迅速成为最常用的甜味剂,被广泛添加到软饮料、蛋糕、面包等饮料食品中[5]。由于果糖在体内代谢过程中会伴随有大量尿酸的产生,而高果糖玉米糖浆的使用又恰好与HUA高发病率时期相重叠,因此大多数学者支持高果糖饮食与HUA高发病率呈正相关[6-8]。
在肠道,果糖的吸收、转运主要受到葡萄糖转运子(glucose transporters, GLUT)2和5的调节。人体摄入的果糖通过GLUT5转运入小肠上皮细胞,然后通过GLUT2扩散入血[9]。由于尿酸产生过多和(或)尿酸排泄不足是HUA的基本病理特征[10],因此,当前临床治疗HUA药物主要是两类[11],一是抑制黄嘌呤氧化酶(xanthine oxidase, XOD)而减少尿酸产生的药物,如别嘌醇(allopurinol, API)、非布司他;二是促进尿酸排泄的药物如苯溴马隆(benzbromarone, BBR)。尽管这两类药物降尿酸疗效确切,但其对果糖在肠道的转运、吸收入血的影响如何,至今未见报道。为此,本研究应用10%果糖饮水诱导的大鼠HUA模型,观察了别嘌醇和苯溴马隆对HUA大鼠血尿酸水平、肝脏XOD活性、十二指肠GLUT2和GLUT5表达的影响。
1 材料
1.1 主要试剂 BBR购自德国赫曼大药厂(产品批号:1304549);API购自重庆青阳药业有限公司(产品批号:120903);尿酸试剂盒、XOD试剂盒及BCA蛋白测定试剂盒均购自南京建成生物工程研究所;XOD、GLUT2、GLUT5和β-actin抗体均购自Santa Cruz公司;PVDF膜和ECL试剂购自Milipore公司;免疫组织化学染色试剂盒(二步法)购自北京中杉金桥生物技术有限公司;其他试剂均为国产分析纯。
1.2 主要仪器 Infinite M200型全标仪BioTek公司产品;RC24型高速冷冻离心机为Thermo Scientific Sorvall公司产品;Mill-iQ型纯水系统为Millipore公司产品;ChemiDoc XRS型成像系统为Bio-Rad公司产品;80i型正置荧光显微镜为Nikon公司产品。
1.3 实验动物 Wistar大鼠,♂,200~220 g,购自重庆医科大学实验动物中心(动物合格证号:SCXK(渝)2012-0001)。所有动物适应性喂养1周后开始实验。
2 方法
2.1 模型制备与分组给药 40只Wistar大鼠随机分成4组,每组10只,分别为对照组、HUA组、API组(5 mg·kg-1)、BBR组(10 mg·kg-1)。对照组给予正常饮水,其他各组均给予10%果糖溶液饮水,连续饮用8周。从第5周开始分别灌胃给予API和BBR,连续4周。末次灌胃给药1 h后,大鼠麻醉处死、取材进行相关检测。
2.2 尿酸检测 大鼠麻醉后心脏取血,4℃静置过夜,4 000 r·min-1离心20 min,取血清,磷钨酸法测定大鼠血尿酸水平含量[12]。
2.3 XOD活性检测 取大鼠肝脏组织于按1 ∶9的比例(W/V)加入生理盐水在冰浴中充分匀浆,4℃下12 000 r·min-1离心10 min,取上清液,XOD活性检测与蛋白浓度检测均依照试剂盒说明书进行。
2.4 Western blot 迅速取出大鼠十二指肠组织,生理盐水清洗后纵向剪开十二指肠,刮取肠腔黏膜层组织,液氮保存备用。十二指肠黏膜组织总蛋白提取依照文献进行[13],简言之,取组织加入RIPA裂解液和蛋白酶抑制剂在冰浴中充分匀浆,4℃下12 000 r·min-1离心20 min,取上清液。取等量蛋白进行SDS-PAGE电泳,转移蛋白至PVDF膜,5%脱脂奶粉封闭,4℃下与GLUT2或GLUT5及β-actin抗体共同孵育过夜,再与相应的二抗在室温下共同孵育1 h,滴加ECL试剂后成像系统检测分析信号。
2.5 尿酸转运子表达分析 迅速取出大鼠十二指肠组织,生理盐水清洗,10%多聚甲醛固定24 h,石蜡包埋组织、切片。切片脱蜡至水,二步法免疫组化检测按照试剂盒说明书进行。显微镜下(400×)分析阳性染色的光密度值,每张切片取5个视野的平均光密度值纳入该蛋白表达的统计分析。
3 结果
3.1 API和BBR对HUA大鼠血尿酸水平的影响 如Tab 1所示,给予10%果糖饮水8周诱导了大鼠血尿酸水平明显升高,与对照组比较差异有统计学意义(P<0.01)。给药5 mg·kg-1API治疗4周明显降低了10%果糖诱导升高的大鼠血尿酸水平(P<0.01)。同样,10 mg·kg-1BBR给药治疗4周也使得10%果糖诱导升高的大鼠血尿酸水平明显降低(P<0.01)。

1:Control;2:HUA;3:API;4:BBR.GLUT2 protein was tested by Western blot (A) and bar chart represented semi-quantitative analysis of GLUT2 bands by densitometry(B). GLUT2 expression in the small intestine was tested by immunohistochemistry staining and representative results in all groups were presented(C, 200×) and bar charts showed semi-quantitative analysis of positive-stained cells(D).##P<0.01vscontrol group
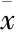
1:Control;2:HUA;3:API;4:BBR.GLUT5 protein was tested by Western blot(A) and bar chart represented semi-quantitative analysis of GLUT5 bands by densitometry(B). GLUT5 expression in the small intestine was tested by immunohistochemistry staining and representative results in all groups were presented(C, 200×) and bar charts showed semi-quantitative analysis of positive-stained cells(D).##P<0.01vscontrol group.**P<0.01vsHUA group
Tab 1 Effect of API or BBR on uric acid level in serum and XOD activity in liver of fructose-induced HUA rats(±s,n=10)
**P<0.01vscontrol group;##P<0.01vsHUA group
3.2 API和BBR对HUA大鼠肝脏XOD活性的影响 连续给予8周10%果糖饮水导致大鼠肝脏XOD活性明显升高,与对照组相比较差异有统计学意义(P<0.01),见Tab 1。连续给予4周5 mg·kg-1API治疗后,大鼠肝脏XOD活性明显降低,与HUA组相比较差异有统计学意义(P<0.01),见Tab 1。但是,给予10 mg·kg-1BBR治疗后,大鼠肝脏XOD活性与HUA组相比较,差异没有统计学意义。
3.3 API和BBR对HUA大鼠十二指肠GLUT2表达的影响 连续给予8周10%果糖饮水明显诱导升高了大鼠十二指肠GLUT2蛋白表达水平,与对照组相比较差异有统计学意义(P<0.01),见Fig 1。连续给予4周5 mg·kg-1API或10 mg·kg-1BBR治疗后,大鼠十二指肠GLUT2蛋白表达水平与HUA组相比较,差异没有统计学意义。
3.4 API和BBR对HUA大鼠十二指肠GLUT5表达的影响 如Fig 2所示,连续给予8周10%果糖饮水导致了大鼠十二指肠GLUT5蛋白表达水平明显升高,与对照组相比较差异有统计学意义(P<0.01)。连续给予4周5 mg·kg-1API治疗使得10%果糖诱导高表达的十二指肠GLUT5表达量明显减少,与HUA组相比较差异有统计学意义(P<0.01)。但是,连续给予10 mg·kg-1BBR治疗4周后,大鼠十二指肠GLUT5蛋白表达量与HUA组相比较,差异没有统计学意义。
4 讨论
本研究应用10%果糖溶液饮水诱导的HUA大鼠模型,发现API和BBR均可明显降低HUA大鼠血尿酸水平。同时,API还明显抑制了HUA大鼠肝脏XOD活性和十二指肠GLUT5表达,而BBR对HUA大鼠肝脏XOD活性和十二指肠GLUT5表达均无明显影响。另外,API和BBR对HUA大鼠十二指肠GLUT2表达均无明显影响。
近10多年,伴随着果糖作为甜味剂被广泛使用,HUA发病率明显增高[1]。尽管还有争论,但是大多数流行病学研究提示高果糖消费与HUA发病率呈正相关[4]。在肝脏,吸收的果糖被果糖激酶快速代谢成为1-磷酸果糖。此过程消耗了大量的三磷酸腺苷,产生大量一磷酸腺苷和肌苷酸,后两者代谢生成次黄嘌呤和黄嘌呤,最终在XOD作用下代谢为尿酸[14]。在本研究中,给予10%果糖溶液连续饮用8周后,大鼠血尿酸水平明显升高1.45倍;给予临床治疗HUA常用药物API或者BBR后,大鼠血尿酸水平均明显降低。由此可见,10%果糖溶液饮水8周可成功诱导大鼠HUA模型,这一结果与文献报道基本一致[15]。Lanaspa等[16]报道,给予大鼠10%果糖饮水10 d即可形成HUA和脂肪肝。Carran等[17]发现,一次性消费600 ml含果糖软饮料1 h后可使健康人血尿酸升高23 μmol·L-1,且一次性消费335 mL和600 mL含果糖软饮料的升高尿酸作用无明显差异。上述研究发现结合本实验结果再次提示了高果糖饮食与HUA高发病率密切相关。
尿酸是嘌呤碱代谢终产物,尿酸产生过多和(或)排泄减少被认为是HUA的基本病理特征。肝脏中富含的XOD是黄嘌呤代谢为尿酸的关键限速酶。机体内产生的尿酸70%通过肾脏排泄,30%通过消化道排出[10]。基于上述认识,抑制XOD活性而减少尿酸产生,或者通过促进尿酸排泄被公认为治疗HUA的主要手段。临床常用的降尿酸药物别嘌醇、非布司他均是XOD抑制剂,而苯溴马隆则是尿酸排泄促进剂。本研究中,我们发现10%果糖饮水明显诱导了大鼠血尿酸水平升高和肝脏中XOD活性增加,提示本模型存在着尿酸产生增加的病理变化。给予别嘌醇治疗4周后,HUA大鼠肝脏XOD活性降至对照组大鼠XOD活性相似水平,而BBR治疗后肝脏XOD活性无明显变化,再次证明了API和BBR降低HUA血尿酸水平的不同的药理机制。
机体摄入的果糖进入肠道后, 通过位于十二指肠上皮细胞的果糖特异性转运子 GLUT5的作用转运至肠上皮细胞内[18], 然后通过 GLUT2的作用迅速吸收入血,通过门静脉进入肝脏进行代谢[19]。已发现多种因素可以影响GLUT2和GLUT5的表达。Davidson等[18]发现随着年龄的增长,小肠GLUT5的表达也逐渐增高。有意思的是,昼夜节律也会影响大鼠GLUT5的表达:光周期的末期GLUT5表达量明显高于光周期的早期[20]。炎性介质肿瘤坏死因子-α可降低家兔果糖的转运和空肠GLUT5的表达[21]。与此同时,葡萄糖、果糖和半乳糖均可上调大鼠肠道GLUT2的表达[22]。另有研究发现,在链脲佐菌素诱导的糖尿病大鼠模型的肠道和肝脏均出现GLUT2高表达,提示血糖和胰岛素水平均可调节GLUT2的表达[23]。API和BBR是经典的降尿酸制剂,其药理机制是针对尿酸的产生和排泄,但两者对GLUT介导的果糖转运和吸收的影响如何至今不甚清楚。本研究发现,10%果糖饮水8周诱导的HUA大鼠十二指肠GLUT2和GLUT5均出现明显高表达,提示10%果糖饮水诱导了大鼠肠道对果糖转运和吸收的增强。给予API治疗4周后GLUT5表达明显降低,而BBR治疗4周后GLUT5表达并无明显变化,说明API可减少十二指肠上皮细胞对果糖的转运,从而最终减少吸收进入血循环的果糖量,而BBR则无此作用。有意思的是,我们发现给药API和BBR后大鼠十二指肠GLUT2表达均无明显变化,提示API 和BBR对果糖从肠上皮细胞扩散入血的过程无影响。
综上所述,本研究结果发现API可降低果糖诱导的HUA大鼠血尿酸水平,其机制既与抑制XOD介导的尿酸产生有关,又与调控GLUT5介导的果糖转运吸收,最终减少果糖代谢产生尿酸密切相关。本研究再次印证了高果糖饮食与HUA高发病率密切相关的观点,并从全新角度阐明了API降尿酸作用与其调节果糖在十二指肠的转运吸收密切相关的药理机制,为扩展API治疗高果糖饮食导致的相关疾病提供了实验依据。
(致谢:本实验均在重庆工商大学重庆市天然药物研究重点实验室完成。感谢该实验室提供优良的实验室环境以及先进的实验设备,感谢该实验室孔淑贞博士、殷钟意高级实验师给予的技术支持。)
[1] Luk A J, Simkin P A. Epidemiology of hyperuricemia and gout[J].AmJManagCare, 2005, 11(15):S435-42.
[2] Kuwabara M. Hyperuricemia, cardiovascular disease, and hypertension[J].Pulse(Basel),2016,3(3-4):242-52.
[3] Borghi C, Rosei E A, Bardin T, et al. Serum uric acid and the risk of cardiovascular and renal disease[J].JHypertens, 2015,33(9):1729-41.
[4] Bomback A S, Derebail V K, Shoham D A, et al. Sugar-sweetened soda consumption, hyperuricemia, and kidney disease[J].KidneyInt, 2010, 77(7): 609-16.
[5] Craig G G, Knox K W. Letter: The use of high-fructose corn syrup as a sweetener[J].AustDentJ, 1975, 20(6): 414.
[6] Nakagawa T, Tuttle K R, Short R A, et al. Hypothesis: fructose-induced hyperuricemia as a causal mechanism for the epidemic of the metabolic syndrome[J].NatClinPractNephrol, 2005, 1(2): 80-6.
[7] Choi H K, Willett W, Curhan G. Fructose-rich beverages and risk of gout in women[J].JAMA, 2010, 304(20): 2270-8.
[8] Bobridge K S, Haines G L, Mori T A, et al. Dietary fructose in relation to blood pressure and serum uric acid in adolescent boys and girls[J].JHumHypertens, 2013, 27(4): 217-24.
[9] Douard V, Ferraris R P.The role of fructose transporters in diseases linked to excessive fructose intake[J].JPhysiol,2013,591(2): 401-14.
[10]Mandal A K, Mount D B. The molecular physiology of uric acid homeostasis[J].AnnuRevPhysiol, 2015, 77: 323-45.
[11]Shahid H, Singh J A. Investigational drugs for hyperuricemia[J].ExpertOpinInvestigDrugs, 2015, 24(8):1013-30.
[12]普菁莹, 牛艳芬, 高丽辉, 等. 3,5,2′,4′-四羟基查尔酮对尿酸诱导高尿酸血症小鼠尿酸排泄的影响研究[J].中国药理学通报,2015,31(8): 1091-5.
[12]Pu J Y, Niu Y F, Gao L H, et al. Effects of 3,5,2,4-tetrahydroxychalcone on urate excretion in hyperuricemic mice[J].ChinPharmacolBull, 2015, 31(8):1091-5.
[13]李茹柳, 陶玉珠, 曾 丹, 等. 党参、甘草糖提取物对小肠上皮细胞迁移多胺信号通路的影响[J]. 中国药理学通报, 2016, 32(2): 245-51.
[13]Li R L, Tao Y Z, Zeng D, et al. Effect of Codonopsis and Glycyrrhizae saccharide extracts on polyamine-dependent signaling pathway during cell migration in IEC-6[J].ChinPharmacolBull, 2016, 32(2): 245-51.
[14]Hallfrisch J. Metabolic effects of dietary fructose[J].FASEBJ, 1990, 4(9): 2652-60.
[15]Hu Q H, Wang C, Li J M, et al. Allopurinol, rutin, and quercetin attenuate hyperuricemia and renal dysfunction in rats induced by fructose intake: renal organic ion transporter involvement[J].AmJPhysiolRenalPhysiol, 2009, 297(4): F1080-91.
[16]Lanaspa M A, Sanchez-Lozada L G, Cicerchi C, et al. Uric acid stimulates fructokinase and accelerates fructose metabolism in the development of fatty liver[J].PLoSOne, 2012, 7(10): e47948.
[17]Carran E L, White S J, Reynolds A N, et al. Acute effect of fructose intake from sugar-sweetened beverages on plasma uric acid: a randomised controlled trial[J].EurJClinNutr, 2016, 70(9): 1034-8.
[18]Davidson N O, Hausman A M, Ifkovits C A, et al. Human intestinal glucose transporter expression and localization of GLUT5[J].AmJPhysiol,1992,262(3 Pt 1): C795-800.
[19]Stumpel F, Burcelin R, Jungermann K, et al. Normal kinetics of intestinal glucose absorption in the absence of GLUT2: evidence for a transport pathway requiring glucose phosphorylation and transfer into the endoplasmic reticulum[J].ProcNatlAcadSciUSA, 2001, 98(20): 11330-5.
[20]Castello A, Guma A, Sevilla L, et al. Regulation of GLUT5 gene expression in rat intestinal mucosa: regional distribution, circadian rhythm, perinatal development and effect of diabetes[J].BiochemJ, 1995, 309(Pt 1): 271-7.
[21]Garcia-Herrera J, Navarro M A, Marca M C, et al. The effect of tumor necrosis factor-alpha on D-fructose intestinal transport in rabbits[J].Cytokine, 2004, 25(1): 21-30.
[22]Miyamoto K, Hase K, Takagi T, et al. Differential responses of intestinal glucose transporter mRNA transcripts to levels of dietary sugars[J].BiochemJ, 1993, 295(Pt 1): 211-5.
[23]Miyamoto K, Hase K, Taketani Y, et al. Diabetes and glucose transporter gene expression in rat small intestine[J].BiochemBiophysResCommun, 1991, 181(3): 1110-7.
Effect of allopurinol on serum level of uric acid and intestinal expression of glucose transporters in rats with fructose-induced hyperuricemia
CHEN Gang1, JIA Ping2
(1.ChongqingKeyLaboratoryofNatureMedicineResearch,CollegeofEnvironmentandResources,ChongqingTechnologyandBusinessUniversity,Chongqing400067,China;2.DeptofCombinationofChineseandWesternMedicine,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
Aim To investigate the effect of allopurinol and benzbromarone on serum level of uric acid, hepatic xanthine oxidase(XOD) activity and intestinal expression of glucose transporter(GLUT) 2 and 5 in rats with fructose-induced hyperuricemia.Methods Wistar rats were fed with 10% fructose in drinking water for consecutive 8 weeks to induce HUA. Treatment with 5 mg·kg-1allopurinol or 10 mg·kg-1benzbromarone were intragastricly administered from 5~8 weeks. Serum level of uric acid and XOD activity in liver were tested. Expression of GLUT2 and GLUT5 in intestine was analyzed by immunohistochemistry staining and Western blot.Results Treatment with allopurinol or benzbromarone significantly decreased the serum level of uric acid in fructose-induced hyperuricemic rats. At the same time, allopurinol treatment significantly reduced the XOD activity in liver and GLUT5 expression in intestine. Nevertheless, benzbromarone treatment did not show inhibitory effect on hepatic XOD activity and intestinal GLUT5 expression. In addition, neither allopurinol nor benzbromarone showed inhibitory effect on GLUT2 expression in intestine.Conclusions Allopurinol decreases serum level of uric acid in fructose-induced hyperuricemic rats. The mechanism is related to reducing XOD-mediated uric acid production in liver, and decreasing GLUT5-mediated fructose absorption in intestine.
allopurinol; fructose; uric acid; hyperuricemia; glucose transporter 2; glucose transporter 5
时间:2017-3-13 8:38
http://kns.cnki.net/kcms/detail/34.1086.R.20170324.1247.012.html
2016-10-22,
2016-12-18
国家自然科学基金资助项目(No 81503420);重庆市教委科学技术研究项目(No KJ1400626);重庆市科委前沿与应用基础研究项目(No cstc2016jcyja0475)
陈 刚(1974-),男,博士,副教授,研究方向:高尿酸血症与痛风的发病机制与药物防治,E-mail:licoricech@ctbu.edu.cn
10.3969/j.issn.1001-1978.2017.04.006
A
1001-1978(2017)04-0469-06
R-332;R343.23;R446.11;R589.7;R589.9

