MicroRNA-101、L型钙通道β2及钠钙交换体在房颤病人血清中的表达变化及临床意义
李 菲
MicroRNA-101、L型钙通道β2及钠钙交换体在房颤病人血清中的表达变化及临床意义
李 菲
目的 比较MicroRNA-101(miR-101)、L型钙通道β2(L-type calcium channel β2Subunit,CACNB2)及钠钙交换体(NCX)在房颤(AF)病人血清中的表达变化,并分析其临床意义。 方法 筛选2014年3月—2015年3月来就诊的100例AF病人为研究对象,设为试验组(n=100);同时选取100例正常病人作为空白对照组(n=100)。试验时,分别应用荧光定量逆转录聚合酶链式技术(Real-Time quantity PCR)和免疫印迹(Western blot)方法检测两组右心耳组织中 miR-101和CACNB2、NCX的表达水平变化,探讨miR-101 与CACNB2、NCX表达水平的相关性,阐述 miR-101 在房颤发生与维持中可能机制及临床检测意义。 结果 ①治疗前,两组受试者在年龄、性别、手术方式等临床资料比较无有统计学意义(P>0.05),试验组左房内径(58.9±7.2)mm,大于对照组(37.9±8.1)mm,差异具有统计学意义(P<0.05)。②实时荧光定量 PCR结果表明,AF病人右心耳组织中的microRNA-101表达量(0.620 7±0.132 1),较正常病人(2.310 0±0.342 2)低;AF病人右心耳组织中的CACNB2、NCX通道mRNA表达量(1.980 0±0.315 1,1.802 7±0.281 1),较正常病人(0.752 6±0.383 0,0.602 1±0.291 1)表达量高,组间差异具有统计学意义(P<0.05)。免疫印迹(Western blot)结果表明,AF病人右心耳组织中的CACNB2和NCX蛋白的表达水平(1.36±0.18,1.46±0.12)均较正常病人(1.10±0.25,1.06±0.21)高,组间差异具有统计学意义(P<0.05)。 结论 AF病人右心耳组织中 miR-101的表达水平与AF的发生具有相关性,CACNB2、NCX通道是miR-101的靶向调控位点,参与AF的发生。
房颤;MicroRNA-101;L型钙通道β2;钠钙交换体
房颤(AF)是临床中常见的一种心房电生理紊乱疾病,病人表现为无序的快速心房颤动,失去心肌的正常收缩、舒张功能,容易引发心功能受损、血栓等严重并发症。 微小 RNA(microRNAs)在AF的发生过程中具有重要作用,其中microRNA-101(miR-101)是AF疾病表征的重要指标[1-2]。L 型钙通道β2亚基(CACNB2)[3]和钠钙交换体(NCX)[4]的表达水平变化可能与miR-101的水平变化有紧密联系,成为导致AF的重要原因,但是一直没有相关报道进行研究证实。本次研究针对AF病人右心耳组织中 miR-101和CACNB2、NCX的表达水平变化进行检测,初步探讨了miR-101 与CACNB2、NCX表达水平的相关性及miR-101在AF疾病发生中的可能机制。
1 资料与方法
1.1 临床资料
1.1.1 研究对象 选取2014年3月—2015年3月就诊的AF病人,采集病史并完善术前检查,共选出100例AF病人作为试验组,男性50例,女性50例,年龄30岁~55岁(40.28岁±5.17岁)。同时筛选100例正常病人作为空白对照,男性47例,女性53例,年龄30岁~55岁(40.30岁±4.87岁)。所有参试者均自愿签订同意书,参加本次研究。
1.1.2 入选标准 临床确诊为AF病人。排除标准:口服钙离子拮抗剂;感染性心内膜炎和风湿性疾病;糖尿病;肝肾功能障碍;各种精神疾患。
1.1.3 失联原因及其应对措施 预计原因为中途退出试验或者在试验过程中转院治疗;应对措施为按照1∶1比例相应补充受试病人进试验组。
1.1.4 伦理学考量 病人及其直系家属在充分了解研究过程的基础上签署参与该临床研究的知情同意书;相关诊治和监护措施均以临床指南相关原则为依据,对病人的医疗治疗和安全有充分保障;对信息及诊疗记录予以保密,保护隐私权;试验过程遵循《渥太华工作组关于临床试验注册的声明》(Ottawa Group Statement for Clinical Trial Registration)。
1.1.5 双盲原则 研究人员分为4组:第一组研究人员负责筛选和随机分配试验对象;第二组负责施行疼痛治疗;第三组负责进行观察指标数据采集;第四组负责数据的整理和统计分析以及文章撰写。试验对象的分组情况严格保密:试验对象和具体施行镇痛治疗的研究人员均不清楚试验对象的具体分组。4个研究组的研究人员对各自的操作互相保密。
1.2 方法 将100例AF病人设为试验组(n=100),100例正常病人作为空白对照组(n=100)。试验时,应用荧光定量逆转录聚合酶链式技术(Real-Time quantity PCR)和免疫印迹(Western blot)方法,检测右心耳组织中 miR-101和CACNB2、NCX的表达水平变化,探讨miR-101 与CACNB2、NCX表达水平的相关性。
1.2.1 检测方法 灌注心肌停搏液前剪取200 g左右右心耳组织,用冰生理盐水洗净后剪成两部分,分别置于两个冻存管中(不含RNA酶),迅速放入液氮中冻存,冻实后快速置于-80 ℃冰箱中保存待用。
1.2.2 PCR检测miR-101表达水平 将-80 ℃冰箱中保存的右心耳组织取出称重,冰上剪碎后加入1 mL的Buffer RLM 组织裂解液;片刻后,将裂解液转移到DEPC 处理水处理过的 5 mL 匀浆管中,将组织充分粉碎、混匀,室温下放置5 min;待组织充分裂解后,加入200 μL 氯仿,振荡 15 s 后室温静置 5 min。再将裂解液置于4 ℃离心机中12 000 r/min离心15 min,取上层无色水相置于1.5 mL EP管中,加入1/2体积的无水乙醇,混匀后转入收集管(Collection Tube 2 mL)内的吸附柱R(Mspin Column RM)中,4 ℃离心机中12 000 r/min离心30 s,收集流出液,加入2/3体积无水乙醇,混匀后转入吸附柱RS中,4 ℃离心机中12 000 r/min离心30 s后,将吸附柱RS重新放入收集管中,加入 700 μL Buffer RWT,4 ℃离心机中12 000 r/min离心30 s后,再次向吸附柱RS中加入500 μL LBuffer RW2,4 ℃离心机中12 000 r/min离心30 s后,重复加入500 μL Buffer RW2,4 ℃离心机中12 000 r/min离心1 min后,将吸附柱 RS 置于室温下晾干。最后,将吸附柱 RS 置于干净1.5 mL 离心管中,加入 20 μL~30 μL RNase-Free Water,室温下静置 1 min,4 ℃离心机中12 000 r/min离心1 min后,收集溶液,测定总microRNA 浓度和纯度。通过microRNA逆转录得到cDNA,进行荧光定量 PCR。荧光定量 PCR使用美国ABI7500 实时荧光定量PCR仪完成,每样设定3个平行,严格按照说明操作。
1.2.3 免疫印迹(Western blot)法 将右心耳组织取出后处理,加入500 μLRIPA 裂解液裂解,再加入蛋白酶抑制剂(1 mM),待充分混匀、裂解后,静置15 min,置于4oC离心机中12 000 r/min离心15 min,取上清进行BCA试剂盒对蛋白定量,使用SDS-PAGE 电泳法得到凝胶图像,进行半定量分析。严格按照说明书操作。

2 结 果
2.1 两组临床资料比较 两组在年龄、性别、手术方式等方面差异无统计学意义(P>0.05);超声心动图结果显示AF病人左房内径(58.9±7.2) mm。较对照组(37.9±8.1) mm显著增大,差异具有统计学意义(P<0.05)。详见表1。

表1 两组临床资料比较
2.2 两组miR-101、CACNB2和NCX通道mRNA的表达水平 试验组miR-101表达水平较对照组低,CACNB2和NCX通道的mRNA水平均较对照组高,差异具有统计学意义(P<0.05)。详见表2。
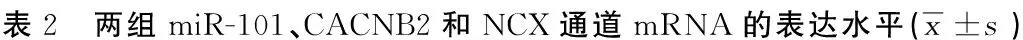

组别nmiR-101CACNB2的mRNA水平NCX的mRNA水平试验组1000.6207±0.13211.9800±0.31511.8027±0.2811对照组1002.3100±0.34220.7526±0.38300.6021±0.2911P<0.05<0.05<0.05
2.3 免疫印迹法对CACNB2和NCX蛋白表达水平分析 CACNB2和NCX蛋白的表达水平均较对照组高,与CACNB2和NCX通道的mRNA水平具有相同的变化,差异具有统计学意义(P<0.05)。详见表3。


组别nCACNB2蛋白表达NCX蛋白表达试验组1001.36±0.181.46±0.12对照组1001.10±0.251.06±0.21P<0.05<0.05
3 讨 论
AF是一种严重的心律失常疾病,病人失去规则有序的心房活动,导致心房颤动。近年来,伴随人口老龄化日益加重,我国AF患病率逐年上升,严重影响了人们的健康生活,特别是高致死率的特点成为AF病人的巨大阴影。由于现在医疗条件和科技发达程度的限制,人们对于AF的发病机制尚不明确。目前针对AF的治疗主要包括抗凝药物和抗心律失常药物的开发和使用,但是对于持续性AF的治疗具有很大限制。为了临床AF防治手段的开发,探索AF的发病机制,需找新的靶点成为医学研究的重要内容。
研究报道[5-7],miR-101表达量的下调可能与AF的发生有关。随后研究者又发现CACNB2[3]、NCX[4,8]可能是miR-101的靶基因,但是未给出深入研究。另外,关于CACNB2的表达变化与miR-101表达之间的关系也尚未可知。
本研究针对miR-101和CACNB2、NCX的表达量与AF之间的相关性及CACNB2、NCX表达量与miR-101表达量的调控关系进行了验证。以AF病人为主要研究对象,设为试验组,与非AF病人进行对照研究。结果表明,两组在年龄、性别、手术方式等方面的差异无统计学意义,AF病人左房内径较对照组显著增大。通过生物信息学手段,对两组病人右心耳组织中的总microRNA表达量和CACNB2、NCX通道的mRNA表达量进行检测。实时荧光定量 PCR结果表明,AF病人右心耳组织中的microRNA-101表达量较正常病人低,与文献报道一致[9-10]。证实了右心耳组织中的microRNA-101表达量与AF有关,在AF病人中的表达量下调。同时发现,AF病人右心耳组织中的CACNB2、NCX通道的mRNA表达量较正常病人表达量高,说明右心耳组织中的CACNB2、NCX通道与AF的发生也具有相关性,参与AF的发生。通过免疫印迹法对CACNB2和NCX蛋白表达水平进行定量,结果发现,AF病人右心耳组织中的CACNB2和NCX蛋白的表达水平均较正常病人高,与CACNB2和NCX通道的mRNA表达量具有相同的变化规律,符合microRNA-101的生理调节规律,证实了CACNB2和NCX通道作为microRNA-101的调节靶点,参与了AF的发生。由于NCX是心肌细胞膜上的一种膜转运蛋白,具有维持细胞内钙离子平衡的作用。NCX表达量的改变证明了电子通道在AF发病机制中发挥了重要作用[8,11],也说明了心肌细胞内过量的钙离子对引发AF发生的重要作用[12]。
microRNA-101表达量与AF的发生和发展相关联,即AF病人血清中的microRNA-101表达下调。此外,CACNB2和NCX蛋白与microRNA-101的表达相关,即microRNA-101上调CACNB2和NCX的表达,继而诱发或加重AF。
[1] Li GQ,Lei XY.MicroRNAs and atrial fibrillation[J].International Journal of Pathology and Clinical Medicine,2011,31(6):507-512.
[2] Wang Z,Lu Y,Yang B.MicroRNAs and atrial fibrillation:new fundamentals[J].Cardiovasc Res,2011,89(4):710-721.
[3] 蒙滋滋,钟国强,涂荣会,等.L 型钙通道β2亚基在心房颤动中的表达变化[J].中国实用医药,2014,9(7):22-23.
[4] 刘元生,郭林娜,郭继鸿,等.钙离子通道基因 mRNA 表达在心房颤动发生机制中的作用[J].临床心血管病杂志,2009,3:170-174.
[5] Luo XB,Zhang JC,Chen GR,et al.Crintical Role of miRNA-101 in atrial electrical remodeling in experimental atrial fibrillation[J].Circulation,2009,120:S617.
[6] Luo XB,Zhang HJ,Xiao JN,et al.Regulation of human cardiac ion channel genes by MicroRNAs:theoretical perspective and pathophysiological implications[J].Cell Physiol Biochem,2010,25:571-586.
[7] Luo XB,Pan ZW,Xiao JN,et al.Crintical role of microRNAs miR-26 and miRNA-101 in atrial electrical remodeling in experimental atrial fibrillation[J].Circulation,2010,122:A19435.
[8] 连雯雯,郝丽英.钙通道在心房颤动时表达及功能变化的研究进展[J].实用药物与临床,2013,16(2):151-154.
[9] Lu Y,Zhang Y,Wang N,et al.Micro RNA-328 contributes to adverse electrical remodeling in atrial fibrillation[J].Circulation,2010,122(23):2378-2387.
[10] Wakili R,Voigt N,Kääb S,et al.Recent advances in the molecular pathophysiology of atrial fibrillation[J].Clin Invest,2011,121(8):2955-2968.
[11] 李耀东,汤宝鹏.钙离子通道与老龄心房颤动心房电重构的研究进展[J].心血管病学进展,2011,32(5):718-720.
[12] Niels Voigt,Na Li,Enhanced sarcoplasmic reticulum Ca2+leak and increased Na+-Ca2+exchanger function underlie delayed after depolarizations in patients with chronic atrial fibrillation[J].Circulation,2012,125:2059-2070.
(本文编辑王雅洁)
同济大学附属同济医院分院(上海 200092),E-mail:gghvx2342@163.com
引用信息:李菲.MicroRNA-101、L型钙通道β2及钠钙交换体在房颤病人血清中的表达变化及临床意义[J].中西医结合心脑血管病杂志,2017,15(6):712-714.
R541.7 R256.2
B
10.3969/j.issn.1672-1349.2017.06.027
1672-1349(2017)06-0712-03
2016-09-03)

