一组涉及化学式和化学方程式计算的典型选择题解析
山东省莱芜市实验中学(271100) 张延臣 ●
一组涉及化学式和化学方程式计算的典型选择题解析
山东省莱芜市实验中学(271100) 张延臣 ●
本文例析了中考试题中涉及化学式和化学方程式定量计算的选择题的解题策略,提出了运用差量法和关系式解法两种解题方法.
化学式;化学方程式;选择题;差量法;关系式解法
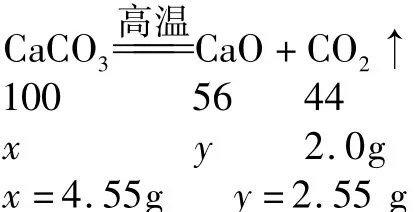
生成CaO的质量为2.55g,剩余CaCO3的质量为10.0g-4.55g=5.45g.所以,正确答案是A.
2.60g镁、铁、锌混合物与足量的稀硫酸反应得到混合溶液,蒸发得到252g硫酸盐固体.则反应产生的氢气质量为( ).
A.4.0g B.3.9g C.3.0g D.2.5g
解析 Mg、Zn、Fe的混合物60g与足量的稀硫酸完全反应后,生成MgSO4、ZnSO4、FeSO4的混合物252g.根据质量守恒定律,反应前后元素的质量不变,所以MgSO4、ZnSO4、FeSO4三种物质的混合物中含SO4的质量为252g-60g=192g.
分析反应的三个化学方程式可知,每有一个H2SO4分子参加反应就会生成一个H2分子.根据硫酸中氢元素与硫酸根的质量比,可以计算出氢元素的质量,即反应产生
近年来,涉及化学式和化学方程式定量计算的选择题频频出现在中考试题中.根据我的教学实践,我发觉这类题型因为常常需要借助“差量法”和“关系式解法”进行巧解,正在成为学生的软肋.所以 ,我从近年的中考题和模拟题中精心选择了一部分典型题进行归类剖析,希望能对广大师生有一些启迪.
1.取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,剩余固体中钙元素的质量分数为50.0%.下列判断正确的是( ).
A.生成2.0gCO2气体
B.原来CaCO3的质量为14.3g
C.生成了5.6gCaO
D.剩余CaCO3的质量为3.0g
解析 CaCO3高温加热一段时间,意味着CaCO3可能未完全反应,8.0g剩余固体可能是CaO和CaCO3的混合物,无法直接带入化学方程式进行计算.
根据质量守恒定律,反应前后钙元素的质量不变,反应后剩余固体中钙元素的质量为8.0g×50.0%=4.0g,则原来CaCO3中钙元素的质量也为4.0g.利用“化合物中某元素的质量=化合物的质量×化合物中该元素的质量分数”,可求得原来CaCO3的质量为:4.0g/40%=10.0g.反应前后固体的质量差为10.0g-8.0g=2.0g,即生成CO2气体的质量.
根据化学方程式,知道CO2气体的质量可以计算参加反应的CaCO3和生成的CaO的质量.设参加反应的CaCO3和生成的CaO的质量分别为x、y.氢气的质量.硫酸的化学式为H2SO4,其中氢元素与硫酸根的质量比=(1×2)∶(32+16×4)=1∶48.设硫酸中氢元素的质量为x,则1∶48=x∶192g,x=4g,即反应产生的氢气质量为4g.
也可根据下列关系式进行计算:

故正确答案选A.
3.为测定某过氧化氢溶液中氢元素的质量分数,某同学向100g过氧化氢溶液中加入5g二氧化锰固体,充分搅拌至不再产生气泡为止,称得剩余固液混合物的质量为101.3g,则该过氧化氢溶液中氢元素的质量分数为( ).
A.6% B.11.1% C.20% D.10.7%解析 根据质量守恒定律和化学方程 2H2O2MnO
====22H2O+O2↑可知,原过氧化氢溶液(包括溶质H2O2和溶剂H2O)中氢元素的质量与完全反应后剩余水中氢元素的质量相当.因为二氧化锰是催化剂,反应前后质量不变,所以,完全反应后水的质量为101.3g-5g= 96.3g,其中氢元素的质量为96.3g×11.1%=10.7g.原过氧化氢溶液中氢元素的质量分数=(10.7g/100g)× 100%=10.7%.故正确答案选D.
4.实验室有碳酸钾和碳酸钙的固体混合物75g,使之与500g质量分数为14.6%的盐酸充分反应,将反应后的溶液蒸干得到82.7g固体.则原混合物中金属元素的质量分数为( ).
A.44% B.46% C.50% D.55%
解析 碳酸钾和碳酸钙的固体混合物75g,与500g质量分数为14.6%的盐酸充分反应,充分反应后盐酸可能有剩余,蒸发时剩余的盐酸挥发掉,故此题不能用稀盐酸中氯元素的质量进行计算.
2-(60份质量)参加反应,所得固体就会净增71-60=11份质量.实际反应后固体质量净增82.7g-75g=7.7g,则原混合物中含CO3的质量x是多少?成正比例关系.根据关系式进行如下计算:
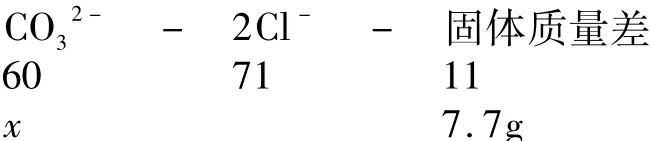
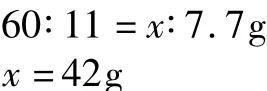
原混合物中金属元素的质量为75g-42g=33g,则原混合物中金属元素的质量分数为(33g/75g)100%= 44%.故正确答案选A.
5.烧杯中有一定质量的MgO和MgCO3的混合物,向其中加入150g稀盐酸,恰好完全反应.一定温度下,得到156g不饱和溶液.下列数据中,与该溶液的溶质质量分数最接近的是( ).
A.16.6% B.6.1% C.12.2% D.9.1%
解析 分析MgO、MgCO3与盐酸反应的两个化学方程式可知,MgO、MgCO3固体分别与等质量的盐酸恰好完全反应时,生成的溶质MgCl2质量相同,溶液的增重相同,所得溶液的溶质质量分数也一定相同.
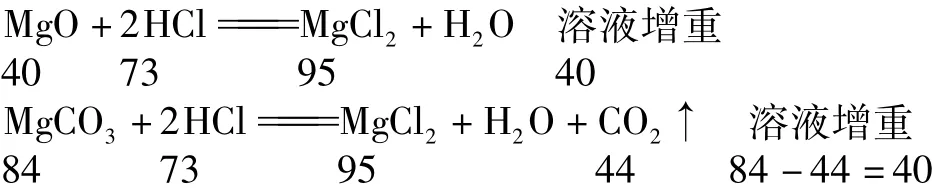
设生成的氯化镁的质量为x.根据关系式进行如下计算:

6.有9.3gNaOH与Na2CO3的固体混合物,测得其中钠元素与碳元素的质量比为23∶3.在室温下,将该混合物与50g稀硫酸混合,恰好完全反应,所得不饱和溶液的质量为57.1g,则原固体混合物中含有钠元素的质量为下列的( ).
A.1.15g B.2.3g C.4.6g D.6.9g
解析 方法一 根据质量守恒定律可以计算出二氧化碳的质量为:9.3g+50g-57.1g=2.2g.原混合物中碳元素的质量就是二氧化碳中碳元素的质量:2.2g×(12/ 44)×100%=0.6g.
设原混合物中钠元素的质量为x.则23∶3=x∶0.6g,x =4.6g.所以正确答案选C.
方法二 根据质量守恒定律可以计算出二氧化碳的质量.然后由生成二氧化碳的质量根据碳酸钠与硫酸反应的化学方程式,计算混合物中碳酸钠质量,进而求出氢氧化钠的质量.最后利用“化合物中某元素的质量=化合物的质量×化合物中该元素的质量分数”求解.
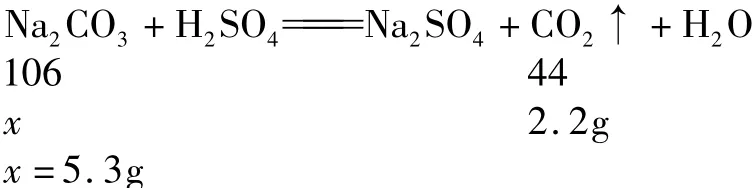
NaOH的质量为:9.3g-5.3g=4g.
5.3gNa2CO3中 钠 元 素 的 质 量 为 5.3g× =2.3g
则原固体混合物中钠元素的质量为2.3g+2.3g=4.6g.正确答案选C.
G632
B
1008-0333(2017)02-0082-02

