好食脉孢菌液体发酵产脂肪酶条件的优化
邓永平,郭建华,艾瑞波,马占春,刘晓兰,王晓杰
(1.齐齐哈尔大学食品学院,黑龙江齐齐哈尔 161006; 2.黑龙江省普通高校农产品深加工重点实验室,黑龙江齐齐哈尔 161006; 3.齐齐哈尔大学理学院,黑龙江齐齐哈尔 161006)
好食脉孢菌液体发酵产脂肪酶条件的优化
邓永平1,2,郭建华1,2,艾瑞波3,马占春3,刘晓兰1,2,王晓杰1,2
(1.齐齐哈尔大学食品学院,黑龙江齐齐哈尔 161006; 2.黑龙江省普通高校农产品深加工重点实验室,黑龙江齐齐哈尔 161006; 3.齐齐哈尔大学理学院,黑龙江齐齐哈尔 161006)
本文以脂肪酶活力为测定指标,通过单因素和正交实验确定好食脉孢菌液体发酵产脂肪酶的培养基组成和培养条件。实验结果表明:培养基由麸皮和豆粕组成,比例为5∶3,培养基中添加1.0%的tween80以及0.1 g/L的 KCl,培养基初始pH为6.0,250 mL三角瓶装液量50 mL,接种量为1%,摇床转速150 r/min,培养温度28 ℃,培养时间72 h,优化后脂肪酶活力达到377.51 U/mL,较优化前提高了约6倍。通过优化有效的提高了好食脉孢菌产脂肪酶的活力。
好食脉孢菌,脂肪酶,液体发酵,培养基优化,培养条件
脂肪酶(Lipase,EC3.1.1.3)又称为三酰基甘油酰基水解酶,在油水界面可以催化三酰甘油酯及一些水不溶性酯类的水解、醇解、酯化、转酯化及酯类的逆向合成反应[1]。脂肪酶催化反应具有区域选择性和对映选择性,反应条件温和,副产物少,被广泛的应用于食品、化工、畜牧业、制药等领域[2]。市售的脂肪酶价格均相对较高,限制了其大规模的工业应用,因此,亟需研发新型质优价廉的脂肪酶。微生物生长条件宽泛、培养周期短、易于大规模培养,是开发商业脂肪酶的主要来源。科研人员研究了Candidautilis(假丝酵母)、PenicilliumcamembertiiKCCM 11268(卡门柏青霉)、Thermomyceslanuginosus(嗜热丝孢菌)、CandidarugosaNCIM 3462(皱褶假丝酵母)、Pichiapastoris(毕赤酵母)、Stenotrophomonasmaltophilia(嗜麦芽寡养单胞菌)、Penicilliumchrysogenum(产黄青霉)等微生物产脂肪酶的情况[3-9]。
工业和农业加工下脚料一般含丰富的有机质,且价格低廉、来源丰富,是培养微生物的良好基质,通过固体发酵或液体发酵可以用于生产脂肪酶等菌体代谢产物。Moftah O A研究了假丝酵母固态发酵橄榄油饼生产脂肪酶的培养基和培养条件,碱处理橄榄油饼后,补充麦芽糖和酵母提取物使脂肪酶产量提高了39%[3]。Coradi G V等人比较了哈茨木霉发酵农业或工业废渣产脂肪酶的情况,发现无论液体发酵还是固体发酵,培养基中添加1%(v/v)的橄榄油都可以有效提高产酶量[10]。Salgado J M等人利用橄榄油厂和酒厂的下脚料作为培养基质固态发酵曲霉生产脂肪酶,发现尿素是影响脂肪酶产量的关键因子[11]。Venkatesagowda B等人以椰子油粕为原料固体发酵LasiodiplodiatheobromaeVBE-1,发现一定量的矿物盐和椰油均可以增强脂肪酶活性[12]。Fleuri L F等人研究发现以75%麦麸和25%甘蔗渣为培养基,含水量40%时脂肪酶产量为10.82 U/g[13]。利用工农业加工下脚料培养微生物生产脂肪酶,不仅可以降低脂肪酶的生产成本,而且为这些物质的再利用及生产高附加值产品提供了新的途径。
本文中使用的菌种是分离自北方传统发酵食品的好食脉孢菌(Neurosporasitophila)菌株17号,该菌株是遗传学和生物化学研究中非常重要的模式生物,是FDA组织认证的安全菌株之一[14]。好食脉孢菌生长速率快,是其它工业真菌如黑曲霉和产黄青霉的两到三倍。本研究利用麸皮和豆粕为底物培养好食脉孢菌液体发酵产脂肪酶,通过单因素和正交实验确定了培养基组成和培养条件,以期为微生物发酵廉价底物生产脂肪酶提供新思路,为降低脂肪酶的生产成本提供新方法。
1 材料和方法
1.1 材料与仪器
好食脉孢菌(Neurosporasitophila),保藏号CGMCC No.1836。
对硝基苯酚棕榈酸酯(p-NPP) ALADDIN,其余试剂均为国产分析纯试剂;隔水式电热恒温培养箱PYX-DHS 上海跃进医疗器械厂;双层振荡培养箱DZP-2F 金坛市城西峥嵘仪器厂;PHS-25型酸度计 上海精密科学仪器有限公司;himac CF15RX冷冻离心机 天美科学仪器有限公司。
1.2 脂肪酶的生产
斜面培养:斜面培养基为马铃薯葡萄糖琼脂培养基(PDA),配制方法见参考文献[15]。将菌体接种在马铃薯葡萄糖琼脂培养基(PDA)中,在28 ℃培养3 d。
种子培养:种子培养基组成为3%麸皮水和1.5%蛋白胨。将15 g麸皮加入到500 mL水中,浸泡1 h,煮沸1 h,向过滤后的滤液中加入7.5 g蛋白胨,冷却到室温,补水至500 mL,初始pH为5.0。250 mL三角瓶中装50 mL培养基,灭菌冷却后加入1 mL孢子悬浮液(107个孢子/mL)。将三角瓶在28 ℃、150 r/min摇床上振荡培养15 h。
液体发酵:碳源、氮源及浓度根据实验需要而定。250 mL三角瓶中含有50 mL发酵培养基,121 ℃灭菌30 min。培养结束后,将发酵液在4 ℃条件下10000 r/min离心10 min,取上清液即为粗酶液。
1.3 液体发酵培养基的优化
碳源分别为麸皮、马铃薯汁、玉米粉、葡萄糖和蔗糖,添加量均为0.8 g/L;氮源分别为玉米蛋白粉、蛋白胨、玉米粉、豆粕、豆渣和豆饼,添加量均为0.8 g/L,通过实验确定合适的碳、氮源。培养基干料共8 g,调整碳氮源比例为7∶1、6∶2、5∶3、4∶4、3∶5、2∶6进行实验,接种量1%,28 ℃、150 r/min振荡培养72 h,离心后取上清液测定脂肪酶活力,平行实验三次。
1.4 诱导物种类的筛选
待筛选诱导物分别为大豆油、橄榄油、玉米油,添加量为0.1 g/L,表面活性剂为tween80和SDS,其中tween80的体积分数为0.1%,SDS的添加量为0.01 g/L,接种量1%,28 ℃、150 r/min振荡培养72 h,离心后取上清液测定脂肪酶活力。
分别调节培养基中诱导物的体积分数为0.1%、0.5%、1.0%、1.5%、2.0%,从而确定诱导物的最适添加量。
1.5 金属离子对酶活力的影响
实验研究了0.1 g/L KCl、CaCl2、MgSO4、FeSO4对产酶的影响,对照组不添加金属离子。在250 mL三角瓶中添加5 g麸皮、3 g豆粕、0.1 mL/L tween80,加入蒸馏水40 mL,121 ℃灭菌30 min,冷却后加入经0.22 μm的微孔滤膜过滤除菌的0.5 g/L金属离子溶液10 mL,接种量1%,28 ℃、150 r/min振荡培养72 h,离心后取上清液测定脂肪酶活力,平行实验三次。
1.6 液体发酵条件的优化
通过单因素实验对影响好食脉孢菌液体发酵产脂肪酶的培养条件进行了优化,包括培养基初始pH(以0.1 mol/L的HCl或NaOH溶液调节培养基的初始pH分别为4.5、5.0、5.5、6.0、6.5、7.0),接种量(液体种子的体积分数为0.5%、1%、3%、5%、7%、10%、15%),培养温度(23、28、33、38 ℃),摇床转速(90、120、150、180、210 r/min)和发酵时间(24、36、48、60、72、84、96 h),并且在后续的实验中使用最佳条件,平行实验三次。
利用正交实验进一步优化培养条件。在单因素实验基础上选择优化因素和水平,具体见表1。

表1 正交实验因素及水平Table 1 factors and levels of optimization study
1.7 脂肪酶活力测定
通过对硝基苯酚棕榈酸酯(p-NPP)方法测定脂肪酶的活性。在37 ℃条件下,将脂肪酶1 h催化p-NPP生成1 μg的对硝基苯酚(p-NP)定义为一个酶活力单位,以U/mL表示[16]。
1.8 数据统计分析
利用Excel 2003和SPSS 11.5分析软件对数据进行统计分析,并结合Duncan氏法做多重比较,所有实验均重复三次,结果用平均值±标准差表示。
2 结果与分析
2.1 p-NP标准曲线的测定
通过对硝基苯酚棕榈酸酯(p-NPP)方法测定脂肪酶的活性。图1为p-NP标准曲线。

图1 p-NP标准曲线Fig.1 Standard curve of p-NP
如图1所示,标准曲线的R2为0.9983,接近于1,可以用于计算脂肪酶的活力。
2.2 碳源、氮源对产酶的影响
2.2.1 碳源对产酶的影响 碳源是微生物细胞营养和能量的来源,在选择碳源时要考虑其降解物对脂肪酶生物合成的阻遏和诱导作用。实验选择麸皮,马铃薯汁,玉米粉,葡萄糖和蔗糖,添加量均为0.8 g/L,结果见图2。

图2 碳源对产酶的影响Fig.2 Effect of carbon sources on lipase production
如图2所示,与麸皮作为碳源的结果相比,培养基中添加葡萄糖显著影响脂肪酶的合成(p<0.05),酶的活力只有7 U/mL。Moftah O A等人在研究产朊假丝酵母发酵油粕生产蛋白酶时,也发现葡萄糖对产酶有明显负面影响[3]。麸皮中含有丰富的纤维和淀粉,经酶促水解后两者皆可为好食脉孢菌菌体的生长及产酶提供碳元素。从本实验结果来看,麸皮作为碳源对酶的生产最有利,脂肪酶活性为58.5 U/mL。
2.2.2 氮源对产酶的影响 氮源在酶的合成中起重要作用,氮源分为无机氮源和有机氮源。无机氮源常常是速效氮源,能够使生物量快速增高,但是不利于酶的生产[3]。有机氮源可为细胞生产提供生长因子和氨基酸,这是细胞代谢和酶的合成所需要的。因此,本研究主要考察了有机氮源对脂肪酶生产的影响。实验结果见图3。

图3 氮源对产酶的影响Fig.3 Effect of nitrogen sources on lipase production
玉米蛋白粉含62%~71%的蛋白质,但是由于溶解性差,限制了其应用范围[17]。采用微生物法或酶法可以改善玉米蛋白粉性质,增加溶解性及利用率[18]。从图3结果可以看出,好食脉孢菌可以利用玉米蛋白粉为底物生产脂肪酶,但是产酶活力较低。豆粕和豆饼都为制油的副产物,含有约41%~42%的蛋白质,但是两者蛋白质的氨基酸组成上有差异[19-20],从图3可以看出,豆粕适宜作为脂肪酶生产的氮源。玉米粕中含粗蛋白质约18%~20%[21],豆渣蛋白质含量约3.0%[22],蛋白质含量都明显低于豆粕,产酶活力也不高。
有机氮源可提高脂肪酶产量,可能是因为其含有的蛋白质降解产生的短肽可作为产酶诱导剂[23]。推测豆粕被菌体代谢产物降解产生的肽段更有利于好食脉孢菌产脂肪酶,所以选择豆粕作为氮源。
2.2.3 碳氮源比例对产酶的影响 碳氮源比例对微生物的生长和产物的合成很重要,比例不当则会使微生物的生长和产物的合成受到抑制,或者营养物质不足减缓微生物生长和产物的合成。碳氮源比例对脂肪酶活力的影响结果见图4。

图4 麸皮与豆粕比例对产酶的影响Fig.4 Effect of the ratio of wheat bran and soybean meal on lipase production
如图4所示,当培养基中碳氮源比例为5∶3时,即麸皮10%和豆粕6%时脂肪酶的活力最高。麸皮是培养微生物的良好碳源,能够参与构成氨基酸分子的碳骨架,为酶的合成提供充足的碳。豆粕中蛋白质含量较高,可用于菌体合成核酸和蛋白质等含氮元素的有机化合物。
2.3 诱导物种类和浓度对产酶的影响
微生物来源的脂肪酶是诱导酶,添加诱导物可以有效提高酶活力,油脂以及可以增强细胞膜通透性的表面活性剂常被用作脂肪酶诱导物[10,24]。诱导物对脂肪酶产量的实验结果见图5。
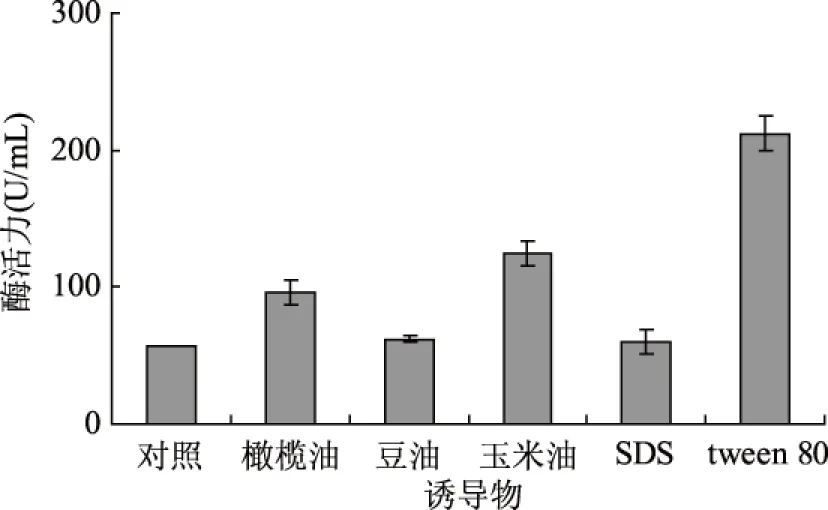
图5 诱导物对产酶的影响Fig.5 Effect of inducer on lipase production
tween 80可以影响细胞脂代谢、改变细胞膜的组成和结构而促进营养物质的吸收和酶向细胞外的分泌[25]。在培养基中适量添加tween80有利于提高好食脉孢菌脂肪酶的活力(见图5)。Christova N等人报道了表面活性剂能够提高酵母细胞的通透性[24];Long等发现培养基中tween80浓度的增高有利于提高粘质沙雷氏菌脂肪酶活力[26]。本文的研究结果与报道相似,因此,选择tween80做为产酶诱导物。
培养基中添加适量的tween80有利于提高产酶量,但是tween80过量添加可能会导致细胞膜破裂,菌体内容物外溢而死亡,所以需要考察其合适的添加量,实验结果见图6。

图6 培养基中tween80添加量对产酶的影响Fig.6 Effect of tween 80 concentration on lipase production
当培养基中添加1.0%的tween80时好食脉孢菌产脂肪酶的活力最高(见图6)。当继续增加tween80添加量时不能进一步提高酶的活力,反而会引起酶活力下降,这是因为tween80浓度提高对菌体细胞膜产生较大损伤,因而抑制了生长代谢。所以,确定tween80的添加量为1.0%。
2.4 金属离子对产酶的影响
金属离子可作为酶的激活剂或参与物质代谢,在微生物的代谢过程中具有重要作用。金属离子对脂肪酶的影响结果见图7。
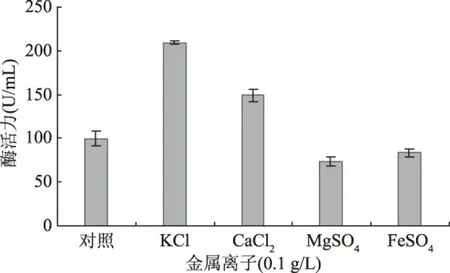
图7 金属离子种类对产酶的影响Fig.7 Effect of metal ion on lipase production
如图7所示,与对照相比,培养基中添加0.1 g/L的KCl或0.1 g/L的CaCl2对产酶有明显促进作用,其中0.1 g/L KCl的促进作用更明显,而0.1 g/L的MgSO4、FeSO4对产酶有一定的抑制作用。
2.5 培养条件对脂肪酶产量的影响
培养基初始pH影响微生物原生质膜所带的电荷以及某些营养物质的分解和电离程度,从而影响微生物对营养物质的吸收。脂肪酶产量随培养基初始pH的变化如图8所示。培养基的初始pH对脂肪酶的活力影响较大,当培养基初始pH为6.0时对酶活力影响显著(p<0.05),好食脉孢菌产脂肪酶活力最高;当pH降低至5.5时,酶活力比pH6.0下降了50%以上;当pH超过6.0时,菌丝体生长不旺盛,产酶能力同时也下降。

图8 培养基初始pH对产酶的影响Fig.8 Effect of initial pH of the medium on lipase production
好食脉孢菌为好氧菌,接种量过大,会导致培养容器内可利用氧被菌体快速消耗,使菌体在培养后期面临乏氧而影响生长代谢;接种量过低会导致产酶量降低,底物利用率降低。接种量对好食脉孢菌发酵产脂肪酶的影响情况见图9。接种量1%时好食脉孢菌产脂肪酶活力最高,当继续增大接种量时不能进一步提高产酶活力,降低接种量酶的活力也随之降低,因此,选择1%的接种量进行下一步研究。

图9 接种量对产酶的影响Fig.9 Effect of inoculation amount on lipase production
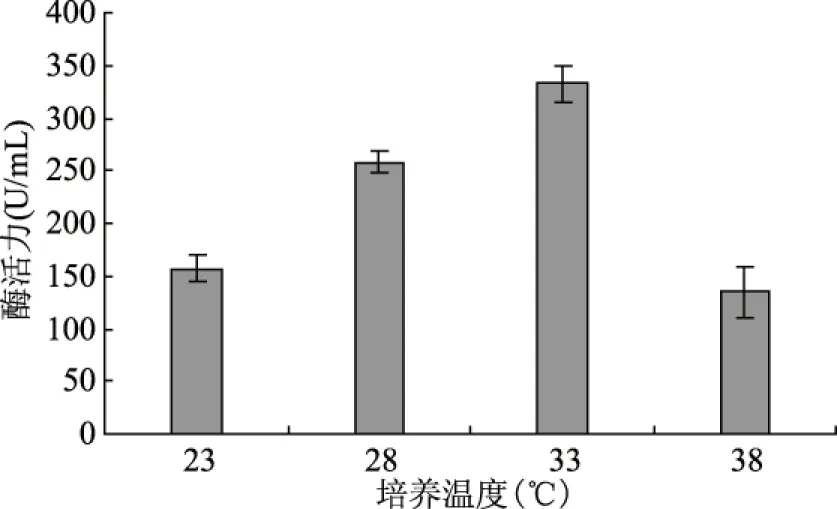
图10 培养温度对产酶的影响Fig.10 Effect of culture temperature on lipase production
温度主要通过影响细胞膜的流动性和生物大分子的活性影响微生物生命活动,当温度升高时生物体代谢速率和生长速率都提高,但是温度过高会导致生物活性物质发生变性,细胞功能下降,甚至死亡。因此,研究合适的培养温度对好食脉孢菌产脂肪酶有重要的意义。实验结果见图10,温度对脂肪酶的生产有显著的影响(p<0.05),该菌株的最适产脂肪酶温度为33 ℃,此时酶活力为332.67 U/mL,温度继续升高导致产酶活力下降,对菌体生长也存在负面影响。

表3 方差分析结果Table 3 The result of analysis of variance
摇床转速对脂肪酶产量的影响见图11,当摇床低转速时,酶活力下降,可能是因为溶氧量降低导致菌体代谢缓慢,产酶能力下降;提高摇床转速时,溶氧量虽然随之提高,但是剪切力增加,使成熟菌丝横隔间空泡的增大,导致部分菌丝体断片无法生长,影响了产酶[27]。当摇床转速为150 r/min时,好食脉孢菌产脂肪酶活力最高,在此转速时,可能也较适宜tween80乳化诱导产酶。

图11 摇床转速对产酶的影响Fig.11 Effect of rotation rate on lipase production
培养时间对脂肪酶产量的影响见图12。培养时间对脂肪酶的生产有显著的影响(p<0.05),培养时间过短,菌体生长迅速,但是不利于产酶,脂肪酶合成量少;培养时间过长,培养基中产生的脂肪酶可能会被菌体分泌到胞外的蛋白酶降解,所以72 h为最佳的培养时间。

图12 培养时间对产酶的影响Fig.12 Effect of the culture time on lipase production
2.6 正交实验
经过单因素实验结果的统计分析,确定培养基初始pH、培养温度和培养时间的变化对酶活力影响较显著,以这三个因素作为实验因子,采用L9(34)设计表进行正交实验,对好食脉孢菌液体发酵产脂肪酶的培养条件进一步优化。每个实验水平均重复3次,对应的酶活力取3次实验结果的平均值,结果见表2。

表2 L 9(34)实验结果Table 2 The result of L 9(34)orthogonal experiment
由表2可知,根据其均值判断其优组合为A2B1C2,即初始pH6.0、培养温度28 ℃、培养时间72 h。根据极差判断影响产酶因素的主次顺序依次为B>A>C,即培养温度>初始pH>培养时间。
方差分析结果如表3所示,培养基初始pH和培养温度对产酶影响显著。
经过发酵实验验证该工艺条件较稳定。最终确定产酶条件为:250 mL三角瓶中装有50 mL培养液,其中含有5 g麸皮、3 g豆粕、1% tween80、0.1 g/L的KCl,初始pH为6.0,接种量为1.0%,摇床转速150 r/min,在28 ℃培养72 h后脂肪酶活力达到377.51 U/mL,较优化前提高了约6倍。
3 结论
本文采用麸皮和豆粕这两种农产品加工下脚料作为培养基主要成分培养好食脉孢菌,利用液体发酵法生产脂肪酶,确定了好食脉孢菌液体发酵产脂肪酶的培养基组成和培养条件。优化后的培养基由麸皮和豆粕组成,两者比例为5∶3,培养基中添加1.0%的tween80以及0.1 g/L的KCl,初始pH为6.0,250 mL三角瓶装50 mL培养液,接种量为1%,摇床转速150 r/min,在28 ℃培养72 h后脂肪酶活力达到377.51 U/mL,较优化前提高了约6倍。
通过该方法获得的脂肪酶来源于安全菌株,具有较高的安全性;所使用的培养基原料不仅来源广泛,价格低廉,而且为这些原有资源的开发利用提供了新的途径,将取得较好的经济效益和社会效益。
[1]Martins A B,Silva A M D,Schein M F,et al. Comparison of the performance of commercial immobilized lipases in the synthesis of different flavor esters[J]. Journal of Molecular Catalysis B Enzymatic,2014,105(7):18-25.
[2]王建荣,刘丹妮,李鹏,等. 雪白根霉脂肪酶基因在毕赤酵母中的高效表达及其酶学性质研究[J]. 食品与发酵工业,2014,40(2):83-88.
[4]Malilas W,Kang S W,Kim S B,et al. Lipase fromPenicilliumcamembertiiKCCM 11268:Optimization of solid state fermentation and application to biodiesel production[J]. Korean Journal of Chemical Engineering,2013,30(2):405-412.
[5]Avilacisneros N,Velascolozano S,Huertaochoa S,et al. Production of thermostable lipase byThermomyceslanuginosuson solid-state fermentation:selective hydrolysis of sardine oil[J]. Applied Biochemistry & Biotechnology,2014,174(5):1859-1872.
[6]Rajendran A,Thangavelu V. Utilizing agricultural wastes as substrates for lipase production byCandidarugosaNCIM 3462 in solid-state fermentation:response surface optimization of fermentation parameters[J]. Waste & Biomass Valorization,2012,4(2):347-357.
[7]Fang Z,Xu L,Pan D,et al. Enhanced production ofThermomyceslanuginosuslipase in Pichia pastoris via genetic and fermentation strategies[J]. Journal of Industrial Microbiology & Biotechnology,2014,41(10):1541-1551.
[8]Neethu C S,Rahiman K M M,Rosmine E,et al. Utilization of agro-industrial wastes for the production of lipase fromStenotrophomonasmaltophiliaisolated from arctic and optimization of physical parameters[J]. Biocatalysis & Agricultural Biotechnology,2015,4(4):703-709.
[9]Fleuri L F,Oliveira M C D,Arcuri M D L C,et al. Production of fungal lipases using wheat bran and soybean bran and incorporation of sugarcane bagasse as a co-substrate in solid-state fermentation[J]. Food Science & Biotechnology,2014,23(4):1199-1205.
[10]Coradi G V,Visitaçäo V L D,Lima E A D,et al. Comparing submerged and solid-state fermentation of agro-industrial residues for the production and characterization of lipase byTrichodermaharzianum[J]. Annals of Microbiology,2013,63(2):533-540.
[11]Salgado J M,Abrunhosa L,Venancio A,et al. Integrated use of residues from olive mill and winery for lipase production by solid state fermentation withAspergillussp.[J]. Applied Biochemistry & Biotechnology,2014,172(4):1832-1845.
[12]Venkatesagowda B,Ponugupaty E,Barbosa A M,et al. Solid-state fermentation of coconut kernel-cake as substrate for the production of lipases by the coconut kernel-associated fungusLasiodiplodiatheobromaeVBE-1[J]. Annals of Microbiology,2014,65(1):129-142.
[13]Fleuri L F,Oliveira M C D,Arcuri M D L C,et al. Production of fungal lipases using wheat bran and soybean bran and incorporation of sugarcane bagasse as a co-substrate in solid-state fermentation[J]. Food Science & Biotechnology,2014,23(4):1199-1205.
[14]Perkins D D,Davis R H. Evidence for safety of Neurospora species for academic and commercial uses[J]. Applied & Environmental Microbiology,2000,66(12):5107-5109.
[15]周德庆,徐德强. 微生物学实验教程[M]. 北京:高等教育出版社(第三版),2013.03:350.
[16]Godoy M G,Gutarra M L E,Maciel F M,et al. Use of a low-cost methodology for biodetoxification of castor bean waste and lipase production[J]. Enzyme & Microbial Technology,2009,44(5):317-322.
[17]尤新. 玉米深加工技术[M]. 北京:中国轻工业出版社,2008:255.
[18]Xiao-jie Wang,Xi-qun Zheng,Narasimha-kumar Kopparapu,et al. Purification and evaluation of a novel antioxidant peptide from corn protein hydrolysate[J]. Process Biochemistry,2014,49(9):1562-1569.
[19]张燕鹏,杨瑞金,华霄,等. 蒸汽爆破辅助提取高温豆粕中的蛋白质[J]. 食品与发酵工业,2013,39(1):190-193.
[20]陈代文,杨凤,陈可容,等. 仔猪补饲及不同类型的饲粮蛋白质对仔猪小肠粘膜形态结构的影响[J]. 动物营养学报,1996,8(2):18-24.
[21]李军军,崔波,檀琮萍. 米曲霉固态发酵玉米胚芽粕制备玉米肽的研究[J]. 中国食品添加剂,2012(2):75-80.
[22]相玉琳,相玉秀,王立鹏,等. 超声波/微波协同提取豆渣蛋白质的研究[J]. 食品工业科技,2015,36(14):266-270.
[23]Turki S,Kraeim I B,Weeckers F,et al. Isolation of bioactive peptides from tryptone that modulate lipase production inYarrowialipolytica[J]. Bioresource Technology,2009,100(10):2724-2731.
[24]Christova N,Tuleva B,Galabova D. Dependence of yeast permeabilization with Triton X-100 on the cell age[J]. Biotechnology Techniques,1996,10(2):77-78.
[25]丁长河. 链霉菌高产木聚糖酶及其酶学性质的研究[D]. 北京:中国农业大学,2003.
[26]Long Z D,Xu J H,Jiang P. Significant improvement of Serratia marcescens lipase fermentation,by optimizing medium,induction,and oxygen supply.[J]. Applied Biochemistry & Biotechnology,2007,142(2):148-57.
[27]Stuart D M,Mitchell D A,Johns M R,et al. Solid-state fermentation in rotating drum bioreactors:Operating variables affect performance through their effects on transport phenomena[J]. Biotechnology & Bioengineering,1999,63(4):383-391.
Optimization of lipase production byNeurosporasitophilathrough liquid fermentation
DENG Yong-ping1,2,GUO Jian-hua1,2,AI Rui-bo3,MA Zhan-chun3,LIU Xiao-lan1,2,WANG Xiao-jie1,2
(1.College of Food and Biological Engineering,Qiqihar University,Qiqihar 161006,China; 2.Key Laboratory of Processing Agricultural Products of Heilongjiang Province,Qiqihar 161006,China; 3.College of Science,Qiqihar University,Qiqihar 161006,China)
In this paper,using lipase activity as index,fermentation liquid medium composition and culture conditions for lipase production byNeurosporasitophilawere determined by single factor and orthogonal experiment. The results showed that the optimum conditions were as follows:the medium was composed of wheat bran and soybean meal,and the ratio of wheat bran and soybean meal was 5∶3,1.0% of tween 80 and 0.1 g/L of KCl were added to the medium,initial pH of the medium was 6.0,liquid medium volume was 50 mL in 250 mL triangle bottled,inoculation quantity was 1%,rotate speed was 150 r/min,culture time was 72 h and culture temperature was 28 ℃. Under the optimum conditions,lipase activity reached 377.51 U/mL which was improved by about 6 times than that before optimization. The lipase production fromNeurosporasitophilawas enhanced effectively by optimization.
Neurosporasitophila;lipase;liquid fermentation;optimization;fermentation conditions
2016-09-29
邓永平(1978-),女,硕士,副教授,研究方向:微生物学、酶学,E-mail:913913_monkey@163.com。
黑龙江省自然科学基金资助项目(C201329);齐齐哈尔大学青年教师科学技术类科研启动支持计划项目(2014k-Z08);齐齐哈尔市科学技术计划项目(SFGG-201578)。
TS201.3
A
1002-0306(2017)07-0135-07
10.13386/j.issn1002-0306.2017.07.000

