不同加工条件对模拟体系中晚期糖基化终产物生成的影响
刘慧琳,陈晓默,吴春玲,刘美林,王 静
(北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048)
不同加工条件对模拟体系中晚期糖基化终产物生成的影响
刘慧琳,陈晓默,吴春玲,刘美林,王 静*
(北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048)
通过构建牛血清蛋白-葡萄糖模拟体系,研究不同加工条件对晚期糖基化终产物(Advanced Glycation End products,AGEs)生成的影响,包括加工时间、温度、pH、蛋白质和葡萄糖浓度对AGEs荧光产物、非荧光产物的影响,以及不同的处理条件下荧光和非荧光产物生成量之间的联系。结果表明,当加热时间为40 min,加热温度为100 ℃,pH为7.0时荧光产物的生成量达到最大值,增加底物浓度在一定程度可以增加荧光产物的量;非荧光产物羧甲基赖氨酸(Nε-(Carboxymethyl)lysine,CML)随着加热时间的延长呈现增加的趋势,当加热温度达到110 ℃,pH为碱性时CML的生成量达到最大值。利用SPSS软件对不同处理条件下荧光产物和非荧光产物生成量的相关性进行研究,二者随着加热时间的变化呈现负相关,随着其他加工条件的变化并没有呈现直接相关性。
晚期糖基化终产物,非荧光产物,羧甲基赖氨酸,生成规律,加工模型
美拉德反应最初是由法国化学家美拉德于1912年将甘氨酸和葡萄糖混合共热时发现的,故称美拉德反应。由于产物是棕色的,也被称为褐变反应。美拉德反应是食品加热或贮藏过程中,氨基化合物(氨基酸、肽及蛋白质)与羰基化合物(糖类)之间发生的复杂反应。美拉德反应可使食品颜色加深并赋予食品一定的风味,但是在美拉德反应的后期阶段会产生一些对人体有危害的物质,如类黑精以及晚期糖基化终产物(Advanced Glycation End products,AGEs)等[1]。图1即为AGEs主要的生成阶段图[2]。AGEs可以分为荧光性交联化合物和非荧光性化合物两大类,前者包括交联素、戊糖素等,后者的典型代表是羧甲基赖氨酸(Nε-(Carboxymethyl)lysine,CML)。

图1 AGEs主要的生成阶段图Fig.1 The mainly generated phase diagram of AGEs
食源性AGEs主要产生于食品加工的过程中,与食品的营养成分有着很大的关系,高蛋白高脂肪类的食品例如肉类食品,高碳水化合物高油脂食品如饼干和面包等食品在加工过程中会产生相对较多的AGEs[3]。此外,AGEs的生成与不同的食品加工工艺也有着很大的关联,如,食品在蒸煮、油煎、油炸、烘烤、焙烧等高温的加工条件下能够产生更多的AGEs[4]。大量的动物实验和临床实验表明,AGEs在体内大量积累可诱导糖尿病、肾病(尿毒症)、动脉粥样硬化,衰老和阿兹海默症等疾病的发生[5-8],严重危害人体健康。本文建立了牛血清蛋白-葡萄糖加工模型,通过改变时间、温度、pH、蛋白质浓度、葡萄糖浓度来研究AGEs荧光产物、非荧光产物含量的变化规律以及对不同条件下荧光产物和非荧光产物二者之间存在的相互关系进行分析,为食品加工过程中通过控制加工条件来达到降低AGEs的含量提供理论基础,对食品食用安全提供了保障。
1 材料与方法
1.1 材料与仪器
牛血清蛋白、葡萄糖、二水合磷酸二氢钠、十二水合磷酸氢二钠、硼氢化钠、三氯乙酸 分析纯,国药集团化学试剂有限公司;丙酮、无水乙醇、盐酸、硼酸、氨水、硼酸钠、氢氧化钠 分析纯,北京化工厂;乙腈、三氟乙酸 色谱纯,北京百灵威科技有限公司。
3K15高速冷冻离心机 德国 SIGMA Laborzentrifugen GmbH;BioTek Synergy H1MDG多功能酶标仪 美国BioTekInstruments,Inc.;UGC-24M氮吹仪 北京优晟联合科技有限公司;精密强制对流干燥箱 中豪莱伯科技有限公司;HH-2恒温水浴锅 金坛市杰瑞尔电器有限公司;酒精喷灯 济南鲁盈化工有限公司;KQ-700GVDV多用途恒温超声清洗仪 昆山市超声波清洗器;AL203电子分析天平 瑞士METTLER TOLEDO;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;Starter2000pH计 美国奥豪斯(上海)有限公司;安捷伦1260 infinity液相色谱-质谱联用 美国安捷伦公司。
1.2 实验方法
1.2.1 食品加工过程模拟体系的建立 取牛血清白蛋白(BSA,10 mg/mL)和葡萄糖(Glucose,500 mmol/L)溶于磷酸盐缓冲液(0.1 mol/L,pH7.4),加入叠氮化钠(0.02%)[9],放置冰箱4 ℃保存待用。
1.2.2 AGEs荧光产物的检测 实验方法参照房红娟等[10]的方法,分别固定激发波长为300,320,340,360,380,400 nm,发射波长范围为400~700 nm,寻找最大发射波长为450 nm,且在380 nm激发时荧光强大最大。因此,将热加工牛血清蛋白-葡萄糖模拟体系反应混合物在激发波长设置为380 nm,发射波长为450 nm处记录样品的荧光值。该读数代表模拟体系中AGEs荧光产物的生成量。
1.2.3 AGEs非荧光产物CML的检测
1.2.3.1 预处理 硼氢化钠还原:取200 μL的样品(相当于2 mg蛋白质当量)于2 mg的离心管中,再向离心管中加入133.3 μL硼酸钠缓冲液(0.5 mol/L,pH9.2),使缓冲液的浓度为0.2 mol/L,然后继续向离心管中加入17.54 μL硼氢化钠溶液(2 mol/L,用0.1 mol/L NaOH配制而成),使硼氢化钠溶液的浓度为0.1 mol/L[11],最后将离心管置于4 ℃下,样品还原10 h。
蛋白质分离(TCA沉淀法):加入60%的三氯乙酸(TCA)获得最后样品中的最终TCA浓度为20%[12]。10000 r/min离心分离10 min以沉淀蛋白质,获得的蛋白质用丙酮洗涤2次(离心沉淀)。
蛋白质水解:沉淀的蛋白加入1 mL的6 mol/L盐酸(HCl)110 ℃下水解24 h[13-14],然后氮气吹扫进行干燥。
除杂纯化:将干燥的蛋白质水解物重新溶入2 mL水中,PCX固相萃取柱预活化(依次通过3 mL甲醇和3 mL水)[14]。取复溶的样品溶液通过预活化了的PCX固相萃取柱,然后分别用3 mL水和3 mL甲醇冲洗,最后目标化合物通过5 mL的甲醇(5%的氨水)洗脱,通过氮气吹扫干燥,重新溶于2 mL水中,然后通过0.22 μm滤膜过滤待测,所有样品均做三次平行实验。
1.2.3.2 HPLC-MS/MS检测CML的色谱条件 HPLC条件:流动相A为含有0.1%三氟乙酸(TFA)的水溶液[15],B为乙腈(ACN),流速为0.2 mL/min,进样量10 μL。梯度洗脱条件为0~0.5 min为90% A,0.5~4.0 min为90% A~60% A[11],柱温为30 ℃,运行时间为25 min。
MS/MS条件:电喷雾离子源正模式;多反应监控模式(MRM),离子源温度为300 ℃;毛细管电压为4 kV;一级质谱四级杆温度为100 ℃、二级质谱四级杆温度为100 ℃;MRM模式的设置为m/z 205.0→m/z 84.0,m/z 205.0→m/z 130.0[15]。
1.2.4 不同加工时间下食品模拟体系的制备 用磷酸盐(PB)缓冲液(0.1 mol/L,pH7.4)溶解BSA和葡萄糖[13,16],并定容至100 mL,使牛血清蛋白浓度为10 mg/mL和葡萄糖浓度为500 mmol/L,分装于5 mL密封耐高压高温玻璃管中,拧紧管盖。在100 ℃水浴条件下分别加热10、20、25、30、35、40、60、90、120、150、180、210、240 min,随后放于冰水浴中冷却。测定不同时间下模拟体系中AGEs荧光产物和CML的含量变化。
1.2.5 不同温度下食品模拟体系的制备 用PB缓冲液(0.1 mol/L,pH7.4)溶解牛血清蛋白和葡萄糖[13,16],并定容至100 mL,使牛血清蛋白浓度为10 mg/mL和葡萄糖浓度为500 mmol/L,分装于5 mL密封耐高压高温玻璃管中,拧紧管盖。为了模拟低温和高温热加工,分别采用水浴加热和油浴加热两种加热模式。
取装有模拟体系的玻璃管,分别在40、60、80、90、100、110、120、140、160、180、200、220 ℃下加热40 min,然后冰水浴冷却待测。测定不同温度下模拟体系中AGEs荧光产物和CML的含量变化。
1.2.6 不同pH下食品模拟体系的制备 将PB缓冲液配制成pH为5.0、6.0、7.0、7.2、7.4、7.6、7.8、8.0、9.0的溶液,溶解牛血清蛋白和葡萄糖,并定容至100 mL,使牛血清蛋白浓度为10 mg/mL和葡萄糖浓度为500 mmol/L,分装于5 mL密封耐高压高温玻璃管中,拧紧管盖,在100 ℃条件下加热40 min。测定不同pH下模拟体系中AGEs荧光产物和CML的含量变化。
1.2.7 不同底物浓度下食品模拟体系的制备
1.2.7.1 改变牛血清蛋白的浓度下食品模拟体系的制备 用PB缓冲液(0.1 mol/L,pH7.4)溶解牛血清蛋白和葡萄糖,并定容至100 mL,保持葡萄糖的浓度为500 mmol/L,牛血清蛋白的浓度为5、10、20、30、50 mg/mL,分装于5 mL密封耐高压高温玻璃管中,拧紧管盖,分别在100 ℃下加热40 min。测定不同条件下AGEs荧光产物及CML的含量变化。
1.2.7.2 改变葡萄糖的浓度下食品模拟体系的制备 PB缓冲液(0.1 mol/L,pH7.4)溶解牛血清蛋白和葡萄糖,并定容至100 mL,保持牛血清蛋白的浓度为10 mg/mL,葡萄糖的浓度为100、200、500、800、1000 mmol/L,分装于5 mL密封耐高压高温玻璃管中,拧紧管盖,分别在100 ℃下加热40 min。测定不同条件下AGEs荧光产物及CML的含量变化。
1.3 统计分析方法
采用SPSSv19.0软件进行相关性和显著性分析,所有样品进行三次测定(n=3),标准偏差用±SD表示。
2 结果与分析
2.1 不同加工时间对AGEs生成的影响
AGEs中荧光产物随着加工时间变化的结果如图2所示,加工时间达到40 min之前,热加工模拟体系中荧光产物随着加工时间的增加而增加,在加热40 min时,荧光产物的量达到了峰值,然后随着加工时间的继续增加,荧光产物的量开始减少,与房等的结果基本一致[10]。可能是因为随着温度升高AGEs会进一步生成不具有荧光性的类黑精,导致模拟体系中荧光值的下降[17]。热加工模拟体系中非荧光产物CML的生成量的变化如图3所示,在热加工时间240 min以内,随着时间的增加,CML的生成量在不断的增加,并且热加工时间在40 min内,CML的增加速率较慢,而在40 min到240 min之间,生成速率增加。

图2 加热时间对荧光产物形成的影响Fig.2 Effect of heating time on the formation of fluorescent products注:图中不同字母表示数据间具有显著性差异(p<0.05),图3~图11同。
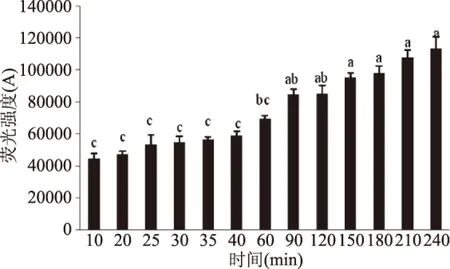
图3 加热时间对CML形成的影响Fig.3 Effect of heating time on the formation of CML
通过SPSS软件分析可知,本研究中荧光产物与CML的含量随着时间的变化趋势之间呈现出负相关的关系(r=-0.712,p<0.01),表明荧光产物的生成量和CML的生成量是有关联的。目前有关CML可能的生成途径主要集中在两方面,一方面是葡萄糖和赖氨酸脱水直接生成席夫碱,然后经由席夫碱生成乙二醛,最终和赖氨酸生成CML[16],另一方面是葡萄糖自氧化或者席夫碱经过Amadori重排生成果糖基赖氨酸,而果糖基赖氨酸经氧化生成CML[18]。而从本研究的结果荧光产物和CML的生成规律来看,CML的活性前体也有可能来自于AGEs中其他荧光产物,加热40 min之后荧光产物一方面生成类黑素导致模拟体系的颜色加深,一方面转化成CML导致CML的含量增加。。
2.2 不同加工温度对AGEs生成的影响
荧光产物随加工温度变化的结果如图4所示,温度低于80 ℃时,AGEs中荧光产物增加缓慢,而温度高于80 ℃时,荧光产物的量增加迅速,并随着温度继续升高继续增加,在温度达到100 ℃时达到最大量,然后随着温度继续增加底物开始生成不具有荧光性的物质(如类黑素)[10]则开始减少。当温度高于140 ℃时,荧光产物量的变化整体呈现出先增加后减少的趋势,这与高温下荧光产物的裂解以及与蛋白质再交联有关。图5中检测结果显示,当温度小于80 ℃时,模拟体系非荧光产物CML的量缓慢增加,而当温度超过80 ℃时,CML量则呈现出迅速增加的趋势,当温度达到110 ℃时,CML的量达到峰值,随着温度的继续增加,则呈现出下降的趋势,Nguyen等研究也证明了葡萄糖/乳糖+酪蛋白模拟体系在加热条件为120、130 ℃时CML存在热不稳定性[19]。结合图4和图5发现,140 ℃之后CML的含量急剧降低而荧光产物的含量却有所回升,也可能是因为CML和荧光产物之间存在相互转化的关系,这与改变加热时间得到的结论相同,由此可以看出,适当的降低温度对于食品中AGEs的控制可以起到不错的效果,这也是现在提倡低温油炸来加工食品的方式越来越多的受到重视的原因之一。

图4 加热时间对荧光产物形成的影响Fig.4 Effect of temperature on the formation of fluorescent products

图5 加热温度对CML形成的影响Fig.5 Effect of temperature on the formation of CML
2.3 不同加工pH对AGEs生成的影响
荧光产物的量随pH变化如图6所示,pH从偏酸性增加到中性的过程中荧光产物不断增加,在pH7.0时达到最大,而随着温度的进一步增加则呈现出减少的趋势,而这个结果与其他学者研究的结果相似[10],图7中的检测结果显示,CML随着pH不断变化的规律和荧光产物有所不同,没有呈现出先增加后减少的趋势,而是随着pH的不断增加逐渐出现趋于平衡的趋势。

图6 加工pH对荧光产物形成的影响Fig.6 Effect of pH on the formation of fluorescent products

图7 加工pH对CML形成的影响Fig.7 Effect of pH on the formation of CML
从荧光产物的变化规律和CML的变化规律可以看出,酸性条件不利于AGEs的生成,而微碱性环境有利于荧光产物的生成,过碱性环境不利于荧光产物的生成而对CML的生成影响不大。Nagai等研究也表明,碱性条件下,Amdori化合物转变成CML,而导致荧光性产物随pH的增大而减少[20]。Matiacevich等提出在低pH条件下,模拟体系更有利于类黑精的生成,因而荧光产物的量较少[17]。因此,在食品加工过程中,适当的降低加工pH有利于抑制食品中AGEs的产生。
2.4 不同底物浓度对食品加工过程中AGEs生成的影响

图8 牛血清白蛋白浓度对荧光产物形成的影响Fig.8 Effect of concentration of BSA on the formation of fluorescent products注:葡萄糖浓度为500 mmol/L,图10同。
葡萄糖浓度为500 mmol/L,不断变化牛血清蛋白浓度时荧光物质的变化规律如图8所示。当牛血清蛋白浓度大于20 mg/mL时,荧光物质的量增加速度开始降低,有趋于平衡的趋势。葡萄糖浓度不变为500 mmol/L,牛血清蛋白浓度变化时CML的生成规律如图10所示,当浓度大于30 mg/mL后,CML的浓度有逐渐趋于平衡的趋势,说明存在底物饱和的现象。

图9 葡萄糖浓度对荧光产物形成的影响Fig.9 Effect of concentration of Glu on the formation of fluorescent products注:牛血清蛋白的浓度为10 mg/mL。

图10 牛血清白蛋白浓度对CML形成的影响Fig.10 Effect of concentration of BSA on the formation of CML注:葡萄糖浓度为500 mmol/L。
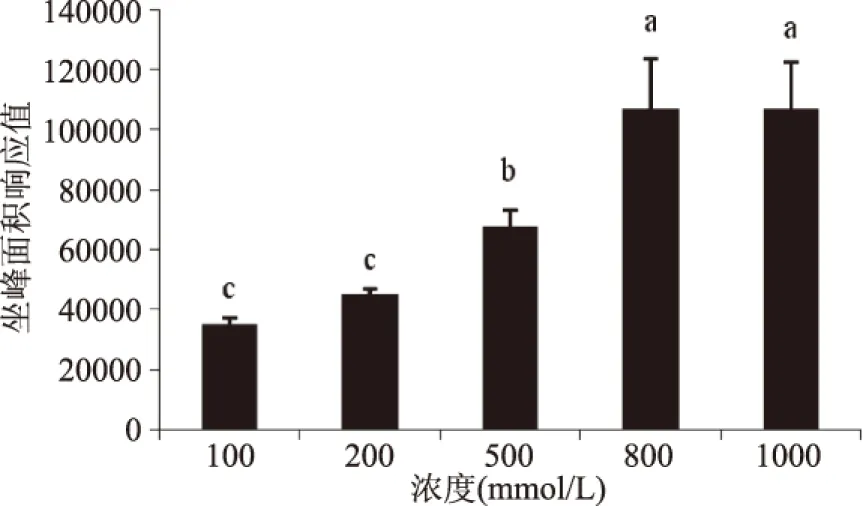
图11 葡萄糖浓度对CML形成的影响Fig.11 Effect of concentration of Glu on the formation of CML注:牛血清蛋白浓度为10 mg/mL。
牛血清蛋白不变,不断变化葡萄糖浓度时荧光物质的变化规律如图9所示。当牛血清蛋白浓度保持在10 mg/mL不变时,葡萄糖浓度大于800 mmol/L时,随着葡萄糖浓度继续增大,荧光产物有达到平衡的趋势。牛血清蛋白浓度不变为10 mg/mL,葡萄糖浓度变化时CML的生成规律如图11所示,当葡萄糖浓度大于800 mmol/L时,随着葡萄糖浓度的增加,CML的生成浓度有趋于平衡的趋势。这与荧光产物随着底物浓度变化的生成规律相似。
从荧光产物和CML随葡萄糖和牛血清蛋白浓度的变化而变化的趋势可知,食品加工过程中营养成分的含量对于AGEs的形成影响很大,可以在蛋白为主要原料的食品需要高温加工时适当减少碳水化合物的含量,而在以碳水化合物为原料需要高温加工的食品可以适当减少蛋白质或者油脂的含量,以此来控制AGEs在食品加工过程中的产生量。
3 结论
食品加工模型牛血清蛋白-葡萄糖体系所产生的AGEs荧光产物和非荧光产物(CML)分别使用荧光光谱法和高效液相色谱-质谱联用法进行了研究。不同加工条件对模型中AGEs荧光产物和CML的生成具有重要的影响,通过研究模型中AGEs的生成规律,为其进一步扩大到真实食品体系,进而通过改变加工条件来控制AGEs的产生,最大程度的降低AGEs的含量提供理论支持。
[1]Martins S I F S,Jongen W M F,Van Boekel M A J S. A review of Maillard reaction in food and implications to kinetic modelling[J]. Trends in Food Science & Technology,2000,11(9):364-373.
[2]Nagai R,Shirakawa J-I,Ohno R-I,et al. Inhibition of AGEs formation by natural products[J]. Amino acids,2014,46(2):261-266.
[3]Arribas-lorenzo G,Morales F J. Estimation of dietary intake of 5-hydroxymethylfurfural and related substances from coffee to Spanish population[J]. Food and chemical toxicology,2010,48(2):644-649.
[4]Ahrne L,Andersson C-G,Floberg P,et al. Effect of crust temperature and water content on acrylamide formation during baking of white bread:Steam and falling temperature baking[J]. Lwt-Food Science and Technology,2007,40(10):1708-1715.
[5]Uribarri J,Cai W,Sandu O,et al. Diet-Derived Advanced Glycation End Products Are Major Contributors to the Body’s AGE Pool and Induce Inflammation in Healthy Subjects[J]. Annals of the New York Academy of Sciences,2005,1043(1):461-466.
[6]Vlassara H,Palace M R. Diabetes and advanced glycation endproducts[J]. Journal of internal medicine,2002,251(2):87-101.
[7]Takeuchi M,Kikuchi S,Sasaki N,et al. Involvement of advanced glycation end-products(AGEs)in Alzheimer’s disease[J]. Current Alzheimer Research,2004,1(1):39-46.
[8]冯建勋,李红,田建伟. 饮食中晚期糖基化终产物对健康 SD 大鼠肾脏的影响[J]. 中国临床康复,2006,10(36):116-119.
[9]Ho S-C,Chang P-W,Tong H-T,et al. Inhibition of Fluorescent Advanced Glycation End-Products and N-Carboxymethyllysine Formation by Several Floral Herbal Infusions[J]. International Journal of Food Properties,2013,17(3):617-628.
[10]房红娟,李红姣,张双凤,等. 加工条件对BSA-Glucose模拟体系中晚期糖基化末端产物形成的影响[J]. 食品科学,2012,(21):6-10.
[11]Assar S H,Moloney C,Lima m,et al. Determination of Nepsilon-(carboxymethyl)lysine in food systems by ultra performance liquid chromatography-mass spectrometry[J]. Amino acids,2009,36(2):317-326.
[12]Dittrich R,Hoffmann I,Stahl P,et al. Concentrations of N-epsilon-carboxymethyllysine in human breast milk,infant formulas,and urine of infants[J]. J Agric Food Chem,2006,54(18):6924-6938.
[13]Bourais I,Amine A,Moscone D,et al. Investigation of glycated protein assay for assessing heat treatment effect in food samples and protein-sugar models[J]. Food Chemistry,2006,96(3):485-390.
[14]Sun X,Tang J,Wang J,et al. Formation of advanced glycation endproducts in ground beef under pasteurisation conditions[J]. Food Chem,2015,172:802-807.
[15]Yoon S-R,Shim S-M. Inhibitory effect of polyphenols in Houttuynia cordata on advanced glycation end-products(AGEs)by trapping methylglyoxal[J]. LWT-Food Science and Technology,2015,61(1):158-163.
[16]Fogliano V,Mmonti S M,Ritieni A,et al. An immunological approach to monitor protein lactosylation of heated food model systems[J]. Food Chemistry,1997,58(1/2):53-58.
[17]Matiacevich S B,Buera M P. A critical evaluation of fluorescence as a potential marker for the Maillard reaction[J]. Food Chemistry,2006,95(3):423-430.
[18]Milkovska-Stamenova S,Schmidt R,Frolov A,et al. GC-MS Method for the Quantitation of Carbohydrate Intermediates in Glycation Systems[J]. J Agric Food Chem,2015,63(25):5911-5919.
[19]Nguyen H T,van der Fels-Klerx H J,van Boekel M A J S. Kinetics of Nε-(carboxymethyl)lysine formation in aqueous model systems of sugars and casein[J]. Food chemistry,2016,192:125-133.
[20]Nagai R,Ikeda K,Kawasaki Y,et al. Conversion of Amadori product of Maillard reaction to Nε-(carboxymethyl)lysine in alkaline condition[J]. FEBS letters,1998,425(2):355-360.
Effects of different processes on the formation of Advanced Glycation End products in the model system
LIU Hui-lin,CHEN Xiao-mo,WU Chun-ling,LIU Mei-lin,WANG Jing*
(Beijing Advanced Innovation Center for Food Nutrition and Human Health,Beijing Engineering and Technology Research Center of Food Additives,Beijing Technology & Business University(BTBU),Beijing 100048,China)
This paper researched on the formation of AGEs in different processing conditions,and the effects of processing time,temperature,pH and the concentrations of protein and glucose on the formation of fluorescent and non-fluorescent products,and the connection between them. The results showed that the largest amounts of fluorescent products were formed at 40 min,100 ℃,pH7.0,and increasing the concentration of substrates could increase the amount of fluorescent products to some extent. As for non-fluorescent products of Nε-(Carboxymethyl)lysine(CML),the production of CML was increased with prolonged heating time,and maximum at 110 ℃ and alkaline condition. The connection of fluorescent and non-fluorescent product in different processing conditions by SPSS software analyzed. It showed a negative correlation with the change of processing time,and other conditions did not show a direct correlation.
Advanced Glycation End products;non-fluorescent products;Nε-(Carboxymethyl)lysine;formation rule;processing model
2016-09-13
刘慧琳(1987-),女,博士,讲师,研究方向:食品安全检测,E-mail:liuhuilin@btbu.edu.cn。
*通讯作者:王静(1976-),女,博士,教授,研究方向:食品营养与安全,E-mail:wangjing@th.btbu.edu.cn。
国家自然科学基金(31501559,31571940)。
TS207.3
A
1002-0306(2017)07-0096-06
10.13386/j.issn1002-0306.2017.07.010

