高放射土壤中拮抗放线菌菌株的筛选及鉴定
李阳,李健强,宋素琴,王静,楚敏
(1.新疆农业大学食品科学与药学学院,乌鲁木齐 830052;2.新疆轻工职业技术学院,乌鲁木齐 830021; 3.新疆农业科学院微生物应用研究所,乌鲁木齐 830091; 4.中国农业大学植物病理学系,种苗健康北京市工程研究中心,北京 100193)
高放射土壤中拮抗放线菌菌株的筛选及鉴定
李阳1,2,李健强3,4,宋素琴3,王静1,楚敏3
(1.新疆农业大学食品科学与药学学院,乌鲁木齐 830052;2.新疆轻工职业技术学院,乌鲁木齐 830021; 3.新疆农业科学院微生物应用研究所,乌鲁木齐 830091; 4.中国农业大学植物病理学系,种苗健康北京市工程研究中心,北京 100193)
【目的】从新疆高放射土壤中分离和筛选出对苹果树腐烂病等有拮抗作用的放线菌,并对其进行鉴定。 【方法】采用对峙培养法通过初筛、复筛测定拮抗菌对8种病原菌的拮抗效果,根据筛选出菌株CH10的形态特征、生理生化特性及 16S rDNA 序列对其进行鉴定。【结果】从70种放线菌中筛选出对苹果树腐烂病等8种新疆作物重要病原菌都具有良好拮抗效果的 CH10。【结论】菌株CH10属于链霉菌属,对苹果树腐烂病菌等有良好的拮抗效果,为该病害的生物防治提供研究基础。
拮抗放线菌;病原菌;苹果腐烂病;16S rDNA;链霉菌
0 引 言
【研究意义】苹果树腐烂病(Applevalsacanker)俗名“臭皮病、烂皮病、串湿病”等,是ValsamaliMiyabeetYamada(苹果腐皮壳属真菌)侵染引起的一种病害,该病在我国苹果产区普遍发生,可导致果树主干及整树死亡,严重时甚至毁园[1-2]。国家有关部门2008年调查结果表明,苹果树腐烂病的平均发病率为52.7%,发病严重的地区发病率甚至高达85%以上[3]。2011年甘肃省苹果树腐烂病总面积7.5×104hm2,平均发病率达到40%,对苹果产业的市场发展造成了严重的影响[4]。2011年4~5月在新疆阿克苏市红旗坡农场腐烂病平均发病率为26.79%,比往年均高。苹果是多年生木本植物,迄今为止尚未发现特别有效的抗腐品种[5-6]。历年来苹果树腐烂病防治主要通过化学药剂控制或延缓病情发展,但大量化学药剂的使用也造成了严重后果,例如果园生态环境污染恶化,病原菌产生抗药性,除此之外还给食品带来严重的安全隐患等等。因此,寻找对环境污染小、高效的生物防治方法,防治苹果腐烂病有重要意义。【前人研究进展】20世纪80年代以来,生物防治作为一种安全有效的防治方法越发关注。郜佐鹏等[7]研究发现多种植物内生的放线菌可以抑制苹果树腐烂病。高克祥等[8]、Xin & Shang[9]、邓振山等[10]先后报道哈茨木霉Trichodermaharzianum、深绿木霉Trichodermaatroviride和螺旋毛壳Chaetomiumspirale对苹果树腐烂病主要病原菌具有重寄生或抑制效果;展丽然等[11]在土壤样品中筛选到对腐烂病菌具有拮抗作用的放线菌 Z-6,初步鉴定为金色类群Aureus,属于链霉菌属Streptomyces。张清明等[12]从健康苹果树枝条分离到了一株拮抗放线菌卡伍尔链霉菌(Streptomycescavourensis)A-2,其发酵滤液对苹果树腐烂病的抑制率达90%以上。【本研究切入点】采自新疆高放射土壤的放线菌,其是微生物中重要的一类菌,放线菌中的许多属如链霉菌(Streptomyces)作为一种植物根圈促生菌(plantgrowth-promotingrhizobacteria,PGPR)在文献已有大量报道[13]。近千种的抗生素及其衍生物来源于放线菌,已投入到生产与生活应用中的有90种左右[14]。目前已经发掘的抗生素80%是由放线菌产生的[15],该生物资源有着广泛的应用前景。【拟解决的关键问题】拮抗菌形态特征及鉴定生理生化特性,及其发酵液的抑菌作用和成分分析。
1 材料与方法
1.1 材 料
1.1.1 供试菌种
放线菌来自新疆放射土壤。供试病原菌苹果树腐烂菌-ValsamaliAkesu,苹果茎点霉-PhomaPomi,拟分枝孢链孢霉-FusariumSporotrichioides,大丽轮枝菌-VerticilliumdahliaShihezi,色二孢属真菌-Diplodiaseriata,立枯丝核-Solani,链格孢-Alternariaalternata,苹果树腐烂病菌-ValsamaliQingdao由石河子大学农学院、新疆农科院农产品加工所等提供,分离自果树或果实。表1
表1 病原菌种类
Table 1 Category pathogens
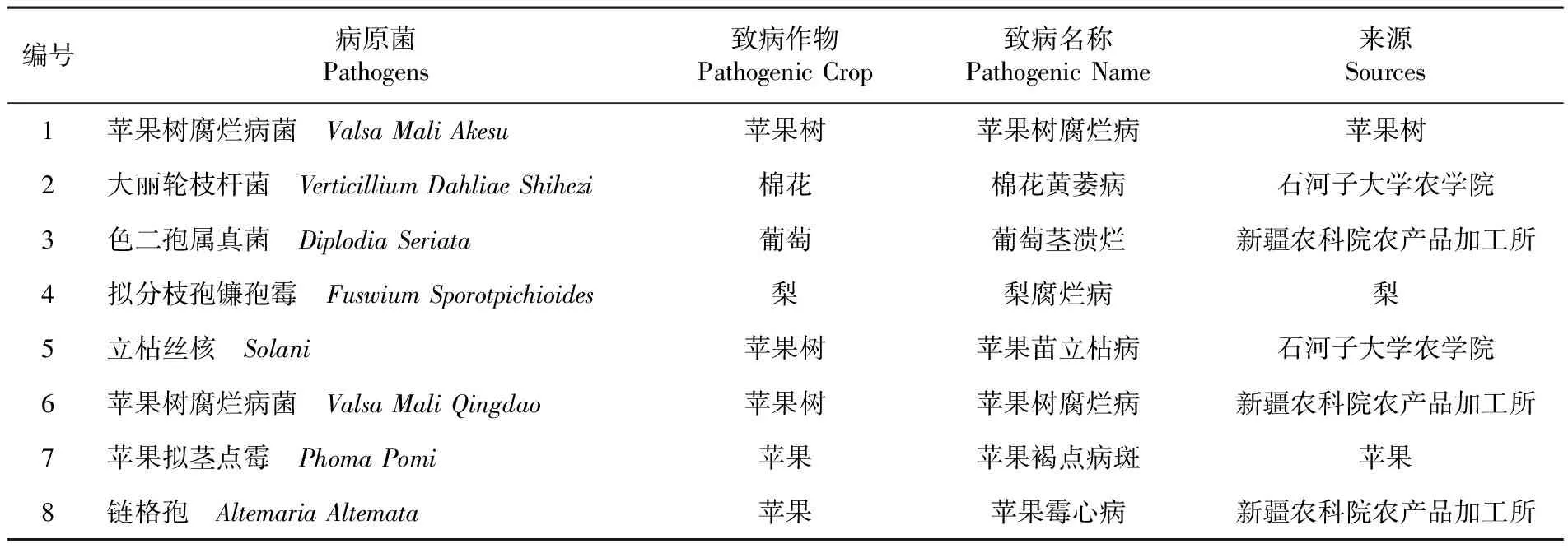
编号病原菌Pathogens致病作物PathogenicCrop致病名称PathogenicName来源Sources1苹果树腐烂病菌 ValsaMaliAkesu苹果树苹果树腐烂病苹果树2大丽轮枝杆菌 VerticilliumDahliaeShihezi棉花棉花黄萎病石河子大学农学院3色二孢属真菌 DiplodiaSeriata葡萄葡萄茎溃烂新疆农科院农产品加工所4拟分枝孢镰孢霉 FuswiumSporotpichioides梨梨腐烂病梨5立枯丝核 Solani苹果树苹果苗立枯病石河子大学农学院6苹果树腐烂病菌 ValsaMaliQingdao苹果树苹果树腐烂病新疆农科院农产品加工所7苹果拟茎点霉 PhomaPomi苹果苹果褐点病斑苹果8链格孢 AltemariaAltemata苹果苹果霉心病新疆农科院农产品加工所
1.1.2 培养基配制
PDA培养基:用于培养病原菌。配制方法:称200 g马铃薯切成小块,加1 000 mL水煮沸30 min,用双层纱布过滤,加水至1 000 mL,然后加入20 g葡萄糖完全溶解,加琼脂20 g,pH自然。
高氏培养基:用于培养放线菌。配制方法:可溶性淀粉20 g,KNO31 g,NaCl 0.5 g,K2HPO40.5 g,MgSO4.7H2O 0.5 g,FeSO40.01 g,琼脂20 g,蒸馏水1 000 mL pH=7.2~7.4。
1.1.3 主要仪器
LDZX-50KBS全自动高压蒸汽灭菌器;SPX-288生化培养箱。
THZ-98A回转式恒温调速摇床;Fa2204电子天平。
1.2 方 法
1.2.1 放线菌菌株的分离与拮抗菌株的筛选
1.2.1.1 放线菌菌株的分离与纯化
土样来自新疆高放射区土壤,经风干后筛滤保存。电子天平上称取样品10.000 g放入装有90 mL无菌水和玻璃珠的三角瓶中,于摇床上振荡30 min后样品与无菌水充分混合均匀制得样品悬液。然后在无菌条件下用移液枪吸取1 000 μL注入无菌水中,稀释至10 mL溶液,然后按比例制成样品稀释液10∶2、10∶3、10∶4、10∶5、10∶6。分别吸取100 μL上述稀释液,在高氏培养基上采用稀释涂布法分离放线菌菌株,30℃培养24 h,然后根据其形态、透明度、颜色等挑取形状差异明显的菌落。挑取单菌落采用平板划线进行纯化、培养并编号,5℃保存[16]。
1.2.1.2 苹果树腐烂病菌拮抗菌株的初筛
通过传统的对峙培养法进行初筛[17],将活化好的8株常见作物病菌制成直径约5 mm的菌饼,依次用灭过菌的镊子接种在倒有PDA培养基的中央,同时将活化好的放线菌菌株,以菌饼形式接于距病原菌相同距离的4个角上,每皿重复三次,以不接种放线菌菌株只接种病原菌的平皿作为对照,置30℃培养箱培养。待菌落长满培养皿后,记录对照平板菌落直径,观察记录处理试验有无抑菌圈并测量病原菌菌落直径。
1.2.1.3 苹果树腐烂病菌拮抗菌株的复筛
挑取病原菌丝放入5 mL无菌水中,移取200 μL病原菌悬浮液于PDA 培养基中,用刮铲铺匀,对称接种直径一定的放线菌菌饼,以加入等体积无菌病原菌培养液的处理作为对照,每皿重复三次,30℃恒温培养3 d,测量处理菌落直径并计算其抑菌率。选取对苹果树腐烂病菌具有较好活性的拮抗菌CH10进行广谱性测定。按上述方法对8种供试病原菌进行拮抗率测定,每皿重复三次,30℃恒温培养测量拮抗圈直径并计算抑菌率。
d0-为对照病原菌直径(mm);
d-为处理病原菌直径(mm);
5-菌饼直径(mm);
1.2.2 菌株CH10的鉴定
形态及生理生化特征鉴定:根据《放线菌的分离与鉴定》[18]进行。通过16S rDNA的序列进行菌株鉴定,实验过程如下:
1.2.2.1 主要仪器
表2 仪器耗材
Table 2 Instrument supplies
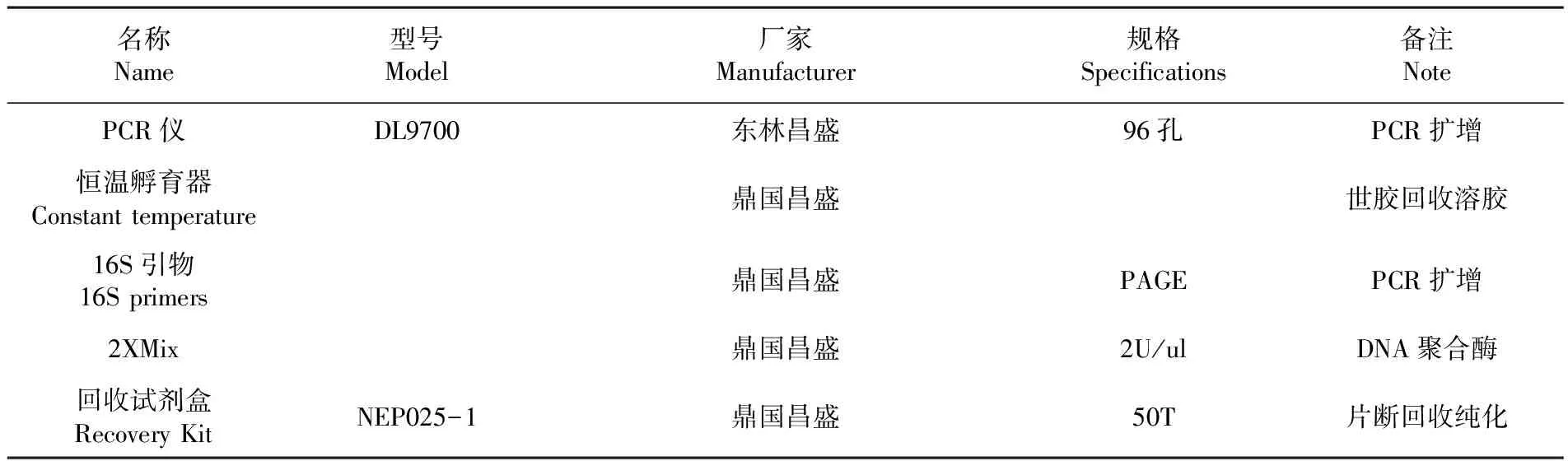
名称Name型号Model厂家Manufacturer规格Specifications备注NotePCR仪DL9700东林昌盛96孔PCR扩增恒温孵育器Constanttemperature鼎国昌盛世胶回收溶胶16S引物16Sprimers鼎国昌盛PAGEPCR扩增2XMix鼎国昌盛2U/ulDNA聚合酶回收试剂盒RecoveryKitNEP025-1鼎国昌盛50T片断回收纯化
1.2.2.2 实验流程
细菌基因组提取
(1)2 mL沉菌,加入800 μL CTAB抽提液,65℃水浴40 min。
(2)加入800 μL氯仿异戊醇,混匀,12 000 r/min,离心10 min。
(3)取上清,加600 μL氯仿异戊醇,12 000 r/min,离心10 min。
(4)取上清,加入1 mL CTAB沉淀液,12 000 r/min,离心10 min。
(5)倒掉上清,10 min挥发晾干,加200 μL H2O,吸打混匀。
(6)加入400 μL无水乙醇,20 μL 3MNaAC,-20℃沉淀30 min。
(7)4℃,12 000 r/min,10 min离心加入500 μL 80%乙醇洗2次,12 000 r/min,10 min离心到上清,溶70 μL水。
1.3.2.2 目的片段扩增
引物合成:
F16S-27:AGAGTTTGATCCTGGCTCAG;
R16S-1492:CGGTTACCTTGTTACGACTTC;
反应体系
表3 反应体系
Table Reaction system

组成Constitution体积Volume(μL)2XMix2527F(10μM)11492R(10μM)1DNA模板2ddH2O21
反应条件:

回收PCR产物
(1)2.0%琼脂糖凝胶电泳,切取目的片断。
(2)加入回收试剂溶液A 300 μL/0.1 g,60℃水浴至胶完全溶化。
(3)加入50 μL回收试剂溶液B,混匀。
(4)将溶液置于离心柱中,静置5 min,12 000 r/min,1 min,弃去液体。
(5)加入500 μL 80%乙醇,12 000 r/min,离心1 min,弃液体,重复一次。
(6)12 000 r/min,离心5 min,甩干余液,弃液体,晾干5~8 min。
(7)将离心柱置于新的离心管中,加入30 μL灭菌双蒸水,静置10 min。
(8)13 000 r/min,离心3 min,管底即为纯化产物,取3 μL电泳检测。
将测序得到的序列采用 NCBI 数据库中的BLAST软件与GenBank 中的核酸序列进行比对分析,检索同源性高的菌株用于系统发育分析。
2 结果与分析
2.1 苹果树腐烂病拮抗放线菌菌株的筛选
供试土壤样品中共分离70株放线菌菌株,经初筛和复筛获得拮抗性较好的有4株:CH10、P4-A7、BE44-B1(A)、BE3-B6(A)。
在 PDA 平板对峙试验中,这4株放线菌对腐烂病菌菌丝产生较好的抑菌作用,拮抗菌边缘的病原菌生长速度减缓或停止,形成一个明显的抑菌圈。其中菌株CH10对8种常见作物病原菌的拮抗效果最好。因此,选取拮抗菌 CH10作进一步研究。图1
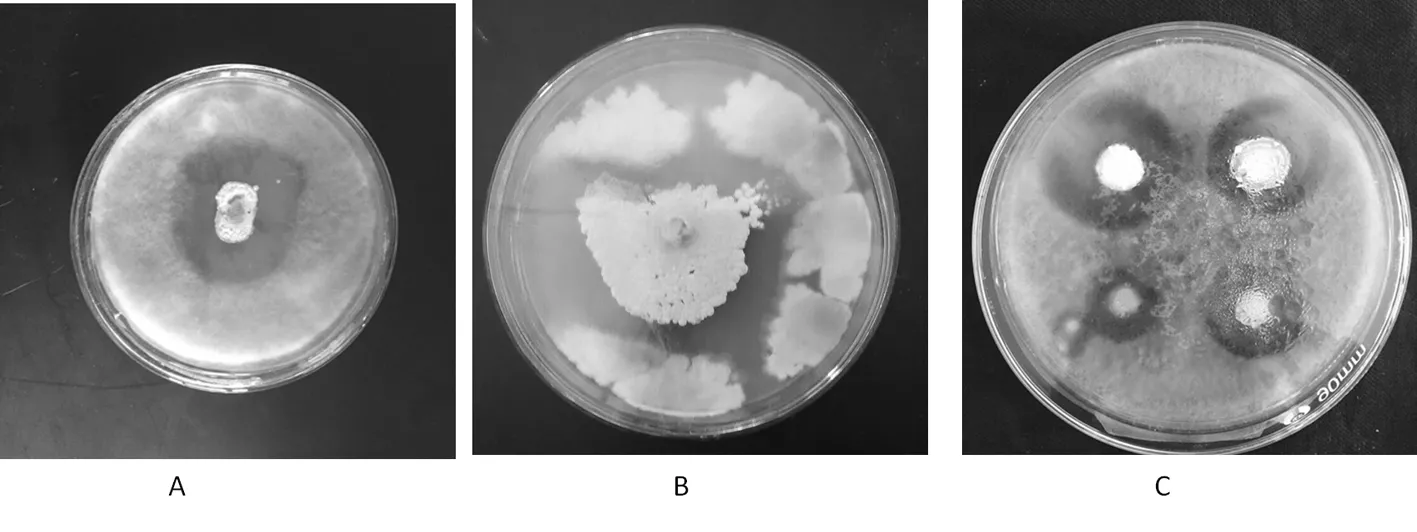
图1 拮抗菌筛选图
Fig.1 The screening of antagonistic actinomycetes
2.2 菌株对8种果树病原菌的抑制作用
以上筛选出4个菌株对供试病原菌均有不同程度的抑制作用,抑菌率在 18.75%~62..50%,表现出良好的抑菌性。表3,表4
表3 放线菌拮抗圈直径(mm)
Table 3 Diameter of antagonistic actinomycetes

拮抗菌Antagonist病原菌 Pathogens苹果树腐烂病菌ValsamaliAkesu(mm)大丽轮枝杆菌VerticilliumdahliaShihezi(mm)色二孢属真菌Diplodiaseriata(mm)拟分枝孢镰孢菌Fusariumsporotrichioides(mm)立枯丝核Solani(mm)苹果树腐烂病菌ValsamaliQingdao(mm)苹果拟茎点霉Escherichiahermannii(mm)链格孢Alternariaalternata(mm)CH1034603050245518711664157714211940P4-A731502898278828421685245028422788BE44-B1(A)27402628214323941870302120802270BE3-B6(A)28152892213018541932177323552018
表4 放线菌拮抗效果
Table 4 Antagonistic effection of actinomycetes

拮抗菌Antagonist病原菌 Pathogens苹果树腐烂病菌ValsamaliAkesu(mm)大丽轮枝杆菌VerticilliumdahliaShihezi(mm)色二孢属真菌Diplodiaseriata(mm)拟分枝孢镰孢菌Fusariumsporotrichioides(mm)立枯丝核Solani(mm)苹果树腐烂病菌ValsamaliQingdao(mm)苹果拟茎点霉Escherichiahermannii(mm)链格孢Alternariaalternata(mm)CH1062505125375026252269212518752750P4-A753754750449046152305374146154490BE44-B1(A)43754125312536252625265330053375BE3-B6(A)45524734310225942734245335472891
2.3 拮抗菌株 CH10的鉴定
2.3.1 形态特征及生理生化特性
在高氏培养基上CH10菌落呈白色, 边缘光滑,菌落卵圆形且紧贴培养基,湿润、不透明,菌体呈线状。CH10的适宜生长温度为28~32 ℃,在培养基上培养及显微镜100倍油镜下观察。图2
2.3.2 16S rDNA 序列分析
通过 PCR 扩增菌株 CH10 的 16S rDNA,得到1条大约 1 500 bp 的片段,测序结果表明该区段长度为1 459 bp。将该序列与NCBI数据库Blast进行比对(登录号为KT986228)。图3,图4
2.3.3 分子鉴定结果
测序比对测序结果在http://www.ncbi.nlm.nih.gov/上BLAST比对,利用MEGA5.1软件构建系统发育树。结果显示,在以16S rDNA序列构建的系统发育树中菌株CH10与娄彻氏链霉菌(StreptomycesrocheiNBRC12908T)、和淡紫褐链霉菌(StreptomycesenissocaesilisNRRLB-16365T)、褶皱链霉菌(StreptomycesplicatusNBIC13071T)位于系统进化树上同一分支,其序列的同源性都高达99%,表明它们的亲缘关系较近。结合形态特征、培养特征及生理生化特性比较,因此将菌株CH10初步鉴定为链霉菌属。图5
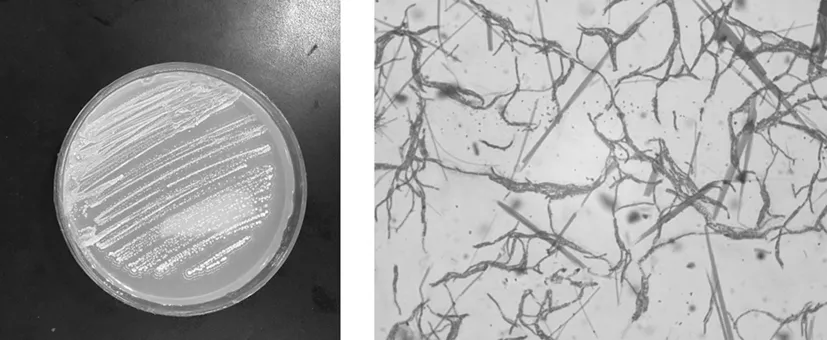
图2 CH10的形态特征
Fig.2 Morphological character of CH10

图3 DNA电泳
Fig.3 Electrophoretic pattern of DNA
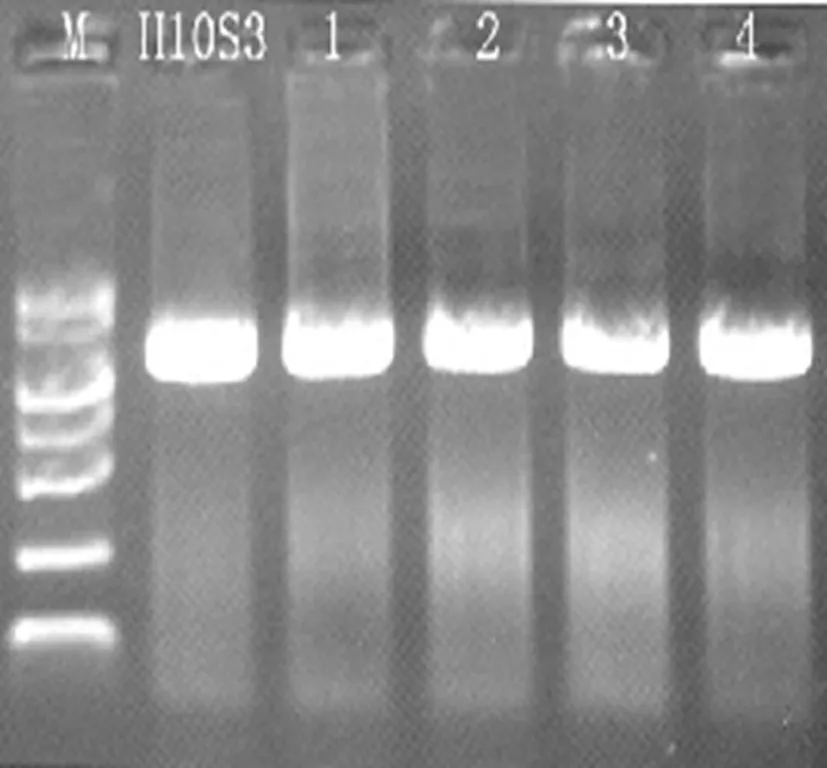
注:maker为2000,1600,1000,750,500,250,100bp
图4 PCR电泳检测
Fig.4 Electrophoresis detection of PCR

图5 依据菌种CH1016S rDNA序列的N-J法构建的系统进化树
Fig.5 Phylogenetic tree of strain CH10 based on 16S rDNA sequences
3 讨 论
植物根际土壤和植物内部存在大量微生物,这些微生物在长期的进化中与植物和病原菌形成了彼此密切关系,其中一些微生物对病原菌产生抑制作用[19]。刘琴[20]、柳成宾[21]、张丽[22]分别分离出的链霉菌SR-1102、链霉菌TRM42561、娄彻氏链霉菌YL-2粗提取液,分别对黄瓜枯萎病(F.oxysporumf.sp.cucumerinum)、棉花黄萎病(Verticilliumdahliae)、稻瘟病菌(Pyriculariaoryzae)都有较好的抑菌作用。该实验通过简单、直观、快速的对峙培养法,通过观察拮抗圈的大小,在一定时间内就可以对很多放线菌菌株进行筛选,以期为该病害的防治提供参考。
4 结 论
4.1 研究通过初筛和复筛,从来自新疆高放射区土壤中的70株放线菌中筛选得到4株对苹果树腐烂病菌具有显著拮抗作用的菌株,其中 CH10拮抗效果最好。
4.2 经菌落形态培养观察、生理生化鉴定以及 16S rDNA 序列分析,最终确定菌株CH10为链霉菌属。
4.3 菌株CH10对苹果采摘后贮藏保鲜的作用、发酵滤液的抑菌作用和拮抗物质、对苹果树腐烂病的具体生防效果有待进一步研究。
References)
[1] 陈策.苹果树腐烂病发生规律和防治研究[M]. 北京: 中国农业科学技术出版社,2009:9-17.
CHEN Ce.(2009).Theoccurrenceregularityandcontrolofappletreerot[M]. Beijing: China Agricultural Science and Technology Publishing House: 9-17.(in Chinese)
[2]陈策,李美娜,史秀琴,等.苹果树腐烂病(ValsamaliMiyabeetYamada) 侵染时期研究[J].植物病理学报,1987,17(2):65-68.
CHEN Ce, LI Mei-na, SHI Xiu-qin,et al.(1987).Studies on the infection period of Valsa mali Miyabe et Yamada [J].JournalofPlantPathology,17(2):65-68. (in Chinese)
[3]曹克强,国立耘,李保华,等.中国苹果树腐烂病发生和防治情况调查[J].植物保护,2009, 35(2):114-117.
CAO Ke-qiang, GUO Li-yun, LI Bao-hua, et al.(2009). Investigations on the occurrence and control of apple canker in China [J].PlantProtection,35(2) :114-117.(in Chinese)
[4] 陈臻, 徐秉良, 蒲崇建, 等.不同环境下苹果树腐烂病菌有性态的发生及生物学特性研究[J]. 果树学报, 2013,30(4):644-649.
CHEN Zhen, XU Bing-liang, PU Chong-jian, et al.(2013).Studies on the occurrence and biological characteristics of the pathogen of apple tree rot in different environments [J].JournalofFruitScience, 30(4):644-649. (in Chinese)
[5]Abe, K., Kotoda, N., Kato, H., & Soejima, J. (2007). Resistance sources to valsa canker (Valsaceratosperma) in a germplasm collection of diverse malus species.PlantBreeding, 126(4):449-453.
[6]Abe, K., Kotoda, N., Kato, H., & Soejima, J. I. (2011). Genetic studies on resistance to valsa canker in apple: genetic variance and breeding values estimated from intra- and inter-specific hybrid progeny populations.TreeGenetics&Genomes, 7(2):363-372.
[7]郜佐鹏,柯希望,韦洁玲,等.七株植物内生放线菌对苹果树腐烂病的防治作用[J].植物保护学报,2009,36(5):410-416.
GAO Zuo-peng, KE Xi-wang, WEI Jie-ling, et al.(2009).The effeciont of seven strains of Endophytic Actinomycetes on the controliton of Valsa mali Miyabe et Yamada [J].JournalofPlantProtection,36(5):410-416. (in Chinese)
[8]高克祥,刘晓光,郭润芳,等.木霉菌对五种植物病原真菌的重寄生作用[J].山东农业大学学报,2002,33(1):37-42.
GAO Ke-xiang, LIU Xiao-guang, GUO Run-fang, et al.(2002).The heavy parasitism of five kinds of plant pathogenic fungi [J].JournalofShandongAgriculturalUniversity, 33(1):37-42. (in Chinese)
[9]Xin, Y. F., & Shang, J. J. (2005). Bio-control trials of chaetomium spirale, nd35 against apple canker.JournalofForestryResearch,16(2):121-124.
[10]邓振山,赵龙飞,张薇薇,等.银杏内生真菌的分离及其对苹果腐烂病病原菌的拮抗作用[J].西北植物学报,2009,29(3):608-613.
DENG Zhen-shan, ZHAO Long-fei, ZHANG Wei-wei, et al.(2009).Isolation of Endophytic Fungi from Ginkgo biloba and its antagonistic effect on the pathogenic bacteria of Valsa mali Miyabe et Yamada[J].NorthwestJournalofBotany, 29(3):608-613.(in Chinese)
[11]展丽然,张克诚,冉隆贤,等.苹果腐烂病菌拮抗放线菌的分离与鉴定[J].河北林果研究,2008,23(2):182-186.
ZHAN Li-ran, ZHANG Ke-cheng, RAN Long-xian, et al.(2008).Isolation and identification of Antagonistic Actinomycetes against Valsa mali Miyabe et Yamada [J].HebeiJournalofForestryandOrchardResearch, 23(2):182-186.(in Chinese)
[12] 张清明,王彩霞,王海燕,等.苹果树腐烂病内生拮抗放线菌A-2的鉴定及活性评价[J].农药学学报,2013, 15(3):286-292.
ZHANG Qing-ming, WANG Cai-xia ,WANG Hai-yan, et al. (2013)Identification of antagonistic endophytic actinomycetes A-2 and evaluation of its activity against Valsa mali [J].ChineseJournalofPesticideScience, 15(3):286-292. (in Chinese)
[13] Bakker, P. A. H. M., Bakker, A. W., Marugg, J. D., Weisbeek, P. J., & Schippers, B. (1987). Bioassay for studying the role of siderophores in potato growth stimulation by pseudomonas, spp in short potato rotations.SoilBiology&Biochemistry, 19(19):443-449.
[14] 阮继生,刘志恒,梁立儒,等.放线菌研究及应用[M].北京:科学出版社,1990.
RUAN Ji-sheng, LIU Zhi-heng, LIANG Li-ru, et al.(1990).ResearchandapplicationofActinomycetes[M].Beijing: Science Press.(in Chinese)
[15] 北京农业大学.微生物命名学[M].北京:农业出版社,1986.
Beijing Agricultural University.(1986).Microbialnomenclature[M]. Beijing: Agricultural Press.(in Chinese)
[16]东秀珠,蔡妙英. 常见细菌系统鉴定手册[K].北京: 科学出版社,2001.
DONG Xiu-zhu, CAI Miao-ying. (2001).Handbookofcommonbacterialsystemidentification[K]. Beijing: Science Press.(in Chinese)
[17]贾凤安,陈亮,陈立,等.大棚甜瓜三种主要真菌病害拮抗细菌的筛选与鉴定[J].植物保护学报,2010,37(6):505-510.
JIA Feng-an, CHEN Liang, CHEN Li, et al.(2010). Screening and identification of Antagonistic Bacteria against three major fungal diseases in Greenhouse [J].JournalofPlantProtection, 37(6):505-510.(in Chinese)
[18] 阎逊初.放线菌的分离与鉴定[M].北京:科学出版社,1992.
YAN Xun-chu.(1992).IsolationandidentificationofActinomycetes[M]. Beijing: Science Press.(in Chinese)
[19] Liu, D., Anderson, N. A., & Kinkel, L. L. (1996). Selection and characterization of strains of streptomyces suppressive to the potato scab pathogen.CanadianJournalofMicrobiology, 42(5):487-502.
[20]刘琴,徐建,刘怀阿,等.黄瓜内生防菌SR-1102分离及对枯萎病菌拮抗活性研究[J].扬州大学学报,2015,36(2):83-88.
LIU Qin, XU Jian, LIU Huai-a, et al.(2015). Isolation and antagonistic activity of endophytic actinomycete SR-1102 toFusariumoxysporumf. sp. cucumebrium of cucumber [J].JournalofYangzhouUniversity(AgriculturalandlifeScience). 36(2):83-88. (in Chinese)
[21] 柳成宾,万传星,贾晓宇,等.新疆盐环境棉花黄萎菌拮抗放线菌的筛选及菌株TRM42561的防效测定和鉴定[J].中国生物防治学报,2014,30(3):408-413.
LIU Cheng-bin, WAN Chuan-xing, JIA Xiao-yu, et al.(2014). Screening of antagonistic actionomycetes against Verticillium dahliae from saline environments in Xinjiang as well as the antagonistic activities and identification of strain TRM42561 [J].ChineseJournalofBiologicalControl, 30(3):408-413. (in Chinese)
[22] 张丽,纪明山,余志国,等.娄彻链霉菌YL-2代谢产物对稻瘟病菌的抑制活性及其稳定性[J].沈阳大学学报,2014, 45(2):143-146.
ZHANG Li, JI Ming-shan, YU Zhi-guo, et al.(2014).lAntifunga activities and stability of metabolites from Streptomyces rochei against Pyricularia oryzae [J].JournalofShenyangAgriculturalUniversity, 45(2):143-146. (in Chinese)
Fund project:Supported by Key Projects in the National Science & Technology Pillar Program during the Twelfth Five-year Plan Period. (2012BAD42B02); The project of the introduction of the higher-grade talented persons of the Xinjiang Uygur Autonomous Region(2015-2017)
The Screening and Identification of Antagonistic Actinomycetes Strains from the High Radiation Soil
LI Yang1,2, LI Jian-qiang3,4, SONG Su-qin3,WANG Jing1, CHU Min3
(1.CollegeofFoodandPharmaceuticalSciences,XinjiangAgriculturalUniversity,Urumqi830052,China; 2.XinjiangInstituteofLightIndustryTechnology,Urumqi830021;3.ResearchInstituteofAppliedMicrobiology,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China;4.DepartmentofPlantPathology,BeijingEngineeringResearchCenterofSeedandPlantHealth,ChinaAgriculturalUniversity,Beijing100193,China)
【Objective】 This project aims to isolate and screen 70 actinomycetes strains from the high radiation soil of Xinjiang by antagonistic effect of 8 kinds of pathogenic bacteria such as theValsamaliMiyabeetYamada.【Method】By the plate confrontation culture method, and through initial screening and repeated screening of antagonistic effect of 8 kinds of pathogenic bacteria, and according to the morphological characteristics of the strains of CH10, the physiological and biochemical characteristics and 16S rDNA sequence went through identification and analysis.【Result】The results showed that 8 kinds of important pathogens of Xinjiang crops, such as theValsamaliMiyabeetYamada, were screened out from 70 kinds of actinomycetes, which had good antagonistic effect called CH10.【Conclusion】Strain CH10 belongs to the genus streptomyces and it has good antagonistic effect on theValsamaliMiyabeetYamada, which has provided a foundation for the biological control of the disease.
antagonistic actinomycetes; pathogenic bacteria; 16S rDNA identification; streptomyces
2016-09-22
新疆科技援疆项目(201491150);高层次引进人才(2015-2017)
李阳(1985-),女,助教,硕士研究生,研究方向为植物生理学,(E-mail)1501740810@qq.com
宋素琴(1976-),女,副研究员,硕士,研究方向为微生物活性产物和植物病理学,(E-mail)suqin_song@163.com 王静(1978-),女,副教授,博士研究生,研究方向为果蔬贮藏保鲜,(E-mail)1944142847@qq.com
10.6048/j.issn.1001-4330.2017.01.017
S182
A
1001-4330(2017)01-0132-08

