库尔勒香梨成熟果实石细胞含量与POD4基因表达量的相关性分析
李文慧,冯建荣,唐章虎,董胜利,徐麟,章世奎,张龑
(1.新疆农业科学院轮台果树资源圃,新疆轮台 830000;2.石河子大学农学院园艺系,新疆石河子 830000; 3.新疆农业科学院品种资源研究所,乌鲁木齐 830000)
库尔勒香梨成熟果实石细胞含量与POD4基因表达量的相关性分析
李文慧1,冯建荣2,唐章虎1,董胜利1,徐麟3,章世奎1,张龑3
(1.新疆农业科学院轮台果树资源圃,新疆轮台 830000;2.石河子大学农学院园艺系,新疆石河子 830000; 3.新疆农业科学院品种资源研究所,乌鲁木齐 830000)
【目的】研究成熟期库尔勒香梨粗皮果和正常果的石细胞含量与POD4基因即时表达量的相关性,为改良香梨果实品质提供分子依据。【方法】以成熟期库尔勒香梨粗皮果和正常果为试材,测定香梨果实的硬度和石细胞含量。提取香梨果肉总RNA,用qRT-PCR(Real-time fluorescent quantitative polymerase chain reaction)方法测定POD4(peroxidase4)基因的即时表达量,分析硬度和石细胞含量与POD4基因表达的相关性。【结果】库尔勒香梨石细胞含量在0.4~0.52 g;硬度在245.22~314.71 kg/cm2;POD4基因在成熟果实中的即时表达量在106.89~743.29。【结论】粗皮果石细胞含量是正常果的1.3倍,硬度是正常果的1.28倍,POD4基因的即时表达量是正常果的6.59倍。石细胞含量与POD4基因表达量成显著正相关(r=0.823),与果实硬度存在正相关(r=0.783),POD4基因表达量与果实硬度存在正相关(r=0.770)。POD4基因表达差异与形成两种表型库尔勒香梨果实成正相关。
库尔勒香梨;石细胞含量;qRT-PCR
0 引 言
【研究意义】库尔勒香梨以皮薄、汁多味甜、肉质酥脆著称,是新疆地域性很强的名优特果品之一。库尔勒香梨的生产在新疆名优特果品生产乃至国民经济中占有极其重要的地位。但是由于自然环境和果树生理方面的因素[1],树势和果实生长位置的不同,在树势生长旺盛的果枝部位,容易出现不同程度的粗皮果。前人在库尔勒香梨果实石细胞发生原因[2~5]、显微结构[6]、与矿质元素的关系[7]、发病防治[8]及果实脱萼宿萼[9]石细胞发育规律[10]等方面进行了研究。库尔勒香梨近果心的石细胞开始发育在盛花后15 d,随后近果皮和果肉中的石细胞发育,并随着果实的生长增大,石细胞团的直径也逐渐增大,到花后110 d左右达到高峰,之后趋于稳定,并有下降趋势[10]。砀山梨石细胞团的纵横径随果实发育先逐渐增大而后减小[11]。果实中的石细胞形成与木质素代谢有很大的关系,木质素代谢的最后一步关键性酶是过氧化物酶(PeroxidasePOD),通过催化各种木质醇单体发生脱氢聚合反应,参与并调节木质素在细胞壁的聚合过程。POD酶是一个庞大的基因家族,各成员功能很多。植物过氧化物酶超家族可以分为Ⅰ、Ⅱ、Ⅲ3类;第Ⅲ类POD为典型的植物POD,来源于高等植物中分泌型POD,参与多种不同的生理功能,但是对参与木质素合成的关键性酶POD却研究很少[12]。POD4基因属于第三类分泌型POD,研究成熟期两种表型的库尔勒香梨在果实硬度、石细胞含量与POD4基因表达方面的差异,分析两种表型的库尔勒香梨POD4基因表达量与果实硬度、石细胞含量的相关程度,对库尔勒香梨两种差异表型的发生机理和候选基因的提供有重要意义。【前人研究进展】于娟娟等[13]认为在砀山酥梨位于石细胞细胞壁及邻近区域的POD参与木质素在石细胞细胞壁上的沉积;PPOD是砀山酥梨果实发育过程木质素代谢关键酶POD的主要类型,参与木质素的合成,促进石细胞的发育。刘莉等[14]在研究砀山酥梨果皮中木质素合成相关基因时发现:果皮中存在的POD1、POD2、POD3、POD4基因,木质素增量仅与POD4 基因表达量存在极显著正相关性。【本研究切入点】前人研究均未涉及到表型和基因表达相关性方面的研究。库尔勒香梨果实在7月以后开始分化,逐渐分化成了粗皮果和正常梨,到商品采摘期,两种表型及石细胞、果实硬度差异已很明显,选取此时的果实作为试材,研究成熟期两种表型库尔勒香梨在果实硬度、石细胞含量和POD4基因表达量方面的差异,分析POD4基因与果实硬度、石细胞含量的相关性。【拟解决的关键问题】研究两种表型库尔勒香梨果实硬度、石细胞含量和POD4基因表达量的相关程度,确定三者之间的相关性,为今后阐述库尔勒香梨两种差异表型的发生机理提供候选基因。
1 材料与方法
1.1 材 料
1.1.1 库尔勒香梨
供试材料取自新疆农科院轮台果树资源圃农户香梨园,树龄20年。
2015年9月,样品采摘果树冠外围果实100个,果实发育期150 d。样品采摘后分类:粗皮果标准:选取果皮粗糙,目测果面明显凸凹不平,果点粗大或萼端绿色达到果实1/3;正常果选取果面较为光滑,目测无凸凹,果点小,脱萼或萼端微凸的果实。果实采摘后按上述标准分组测量切块,迅速放于液氮中冷冻处理,再放至-80℃冰箱长期保存。图1,图2
1.1.2 试剂
荧光定量引物POD4F和POD4R由上海生物工程技术服务有限公司合成。RNA prep Pure Plant Kit购自天耿公司,PrimeScriptR RT reagent Kit购自Takara公司,SyBR Premi×ExTaqTM购自TOYOBO、CFX96TMReal-Time System实时荧光定量PCR仪(美国Bio-Rad),DNATaq酶购自广东东盛生物科技有限公司。

图1 粗皮果
Fig.1 Rough skin pear

图2 正常果
Fig.2 Normal skin pear
1.2 方 法
1.2.1 粗皮果和正常果硬度和石细胞含量测定
硬度:取10个果实,去皮,用BY-B型硬度计测定。
石细胞含量:参照聂敬全[15]的方法进行。称取9个果实中部离果皮2.0 mm至果心处的混合果肉35.0 g,-20℃冷冻24 h,在20 000 r/min下匀浆3 min,匀浆加入水静置,倒出上层悬浮物,重复3次,所得石细胞烘干后称质量,重复3次。
石细胞含量=测定的石细胞干质量/35×100。
1.2.2POD4基因即时表达检测
总RNA的提取:参考RNA prep Pure Plant Kit进行操作,取质量较好的总RNA进行反转录。
cDNA 的合成:参照PrimeScriptR RT reagent Kit 说明书,以100 ng 总RNA模板为起始材料,进行cDNA第一条链的合成。反应体系包括100 ng 总RNA,2 μL 5×PrimeScriptR Buffer,0.5 μL PrimeScriptR RT EnzymeMix I、0.5 μL Oligo dT Primer(50 μmol/L),0.5 μL Random 6 mers (10 μmol/L),RNAse Free dH2O补足体积至10 μL。反转录程序为:37℃温育15 min,85℃失活5s。反应结束后,样品于-20℃保存备用。
内标参考基因序列AY965342引物参考田鹏等[16]设计引物序列。POD4基因引物依据qRT-PCR引物设计原则,以AFY97687.1基因序列为模板,利用Premier 5.0软件进行设计。表1
PCR荧光定量扩增反应条件:SYBR®Green Realtime PCR Master Mix12.5 μL,POD4F和POD4R各0.8 μL,cDNA1 μL,RNAse Free dH2O补足体积至25 μL。
PCR的循环条件:95℃预变性30s,95℃变性10s,60℃退火10s,72℃延伸30s,40个cycles,65℃采集荧光信号0.05S。反应结束后生成溶解曲线。每个基因各设置3个平行重复,使用2-△△ct法进行相对定量的测定。
表1 实时定量qRT-PCR所使用的引物
Table 1 Primers of the selected for qPCR
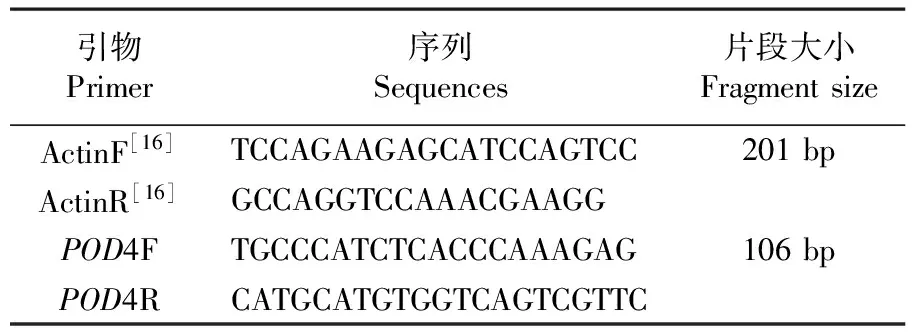
引物Primer序列Sequences片段大小FragmentsizeActinF[16]TCCAGAAGAGCATCCAGTCC201bpActinR[16]GCCAGGTCCAAACGAAGGPOD4FTGCCCATCTCACCCAAAGAG106bpPOD4RCATGCATGTGGTCAGTCGTTC
1.2.3 石细胞含量和POD4基因表达量的相关性
实时荧光定量PCR扩增数据采用2-△△ct方法分析。△Ct(目标基因)=Ct(目标基因)-Ct(同一样本actin),△△Ct(目标基因)=处理组△Ct(目标基因)-对照组△Ct(目标基因),相对倍数=2-△△ct(目标基因)。果实硬度和石细胞含量与POD4基因相对表达量做相关性分析。
1.3 数据统计
采用Excel2007及SPSS17统计软件进行数据分析。
2 结果与分析
2.1 粗皮果和正常果硬度和石细胞含量
研究表明,粗皮果果实硬度314.71 km/cm2,正常果是245.22 km/cm2,粗皮果是正常果的1.28倍。图3
粗皮果石细胞含量的平均值比正常果高30%,粗皮果每百克果肉中含石细胞0.52 g,在正常果中每百克果肉中含石细胞0.4 g。图4

图3库尔勒香梨果实硬度
Fig.3 Fruit firmness of Korla fragrant pear

图4 库尔勒香梨果实石细胞含量
Fig.4 The content of stone cell of Korla fragrant pear
2.2 RNA提取质量检测
提取的果实RNA样本,经琼脂糖凝胶电泳检测表明,获得的总RNA均含有28S和18S两条带,且条带清晰,无蛋白质和DNA的污染,说明RNA样品完整、无降解;RNA样品A260/A280的值在1.95~2.00,说明样品具有较高的纯度,可满足下一步荧光定量的要求。图5
2.3 POD4基因表达量
利用qRT-PCR技术对成熟果实进行基因表达量检测表明,POD4基因在成熟期香梨粗皮果果肉中表达量为743.29,正常果表达量106.89,POD4在粗皮果中表达量是正常果的6.59倍。图6
2.4 石细胞增量和差异基因相对表达量的相关性
研究表明,石细胞含量与POD4基因表达量存在显著正相关性,其相关系数为0.823,石细胞增量与果实硬度相关性达到0.783,POD4基因表达量与果实硬度相关性r=0.770。表2

注:1.粗皮果RNA;2.正常果RNA
Note: 1.rough skin pear RNA; 2.normal skin pear RNA
图5 粗皮果和正常果RNA电泳图
Fig.5 Agarose gel electrophoresis of total RNA

图6POD4基因表达量
Fig.6 The expression ofPOD4
表2 石细胞含量和POD4基因相对表达量相关性
Table 2 The relative expressions ofPOD4 genes and stone cell content

石细胞含量Contentofstonecell果实硬度FruitfirmPOD4石细胞含量Contentofstone'cell1果实硬度Fruitfirm07831POD40823∗07701
注:*.表示在0.05水平上显著相关
Note: indicate significantly difference at 0.05 level
3 讨 论
石细胞含量对梨果实品质有重要的影响,粗皮果的石细胞含量和果实硬度均较正常果高[3],这与研究的结论是一致的。石细胞中约含有18%的木质素[17]。石细胞的形成受木质素合成的影响,砀山梨果实发育过程中,石细胞含量与木质素含量呈显著正相关,相关系数R2=0.984 7[14]。陶书田等[18]研究了砀山梨果实发育过程中木质素代谢相关酶的变化,认为PAL、POD、PPO是影响石细胞形成的关键酶。在砀山梨果实中POD的确参与了木质素单体的聚合及次生细胞壁的加厚过程。刘莉等[14]认为砀山酥梨果皮中木质素增量仅与POD4酶基因表达量存在极显著正相关性。于娟娟等[13]对酥梨果实发育过程中木质素进行了显微观察并通过组织定位化学分析,验证了POD参与了梨石细胞形成过程中木质素的合成和沉积;PPOD与木质素含量、石细胞含量的直接相关性最强。研究中石细胞含量与POD4基因表达量存在显著正相关性,这与于娟娟[13]的试验结论相一致。
4 结 论
粗皮果石细胞含量是0.52 g,是正常果的1.3倍,粗皮果硬度314.71 km/cm2,是正常果的1.28倍,用qRT-PCR检测POD4在成熟粗皮果果实中的相对表达量743.29,是正常果相对表达量的6.59倍。石细胞含量与POD4基因表达量成显著正相关(r=0.823),与果实硬度存在正相关(r=0.783),POD4基因表达量与果实硬度存在正相关(r=0.770)。因此,POD4基因表达差异与形成两种表型库尔勒香梨果实成正相关。库尔勒香梨果实硬度和石细胞含量出现变化,是相关代谢基因差异表达的结果。
References)
[1] 李玲, 蔡永萍, 刘小阳. 梨果实的石细胞[J]. 植物生理学通讯, 2004,40(5):629-632.
LI Ling, CAI Yong-ping, LIU Xiao-yang. (2004). Stone Cell of Pear, Plant Physiology Communications [J].PlantPhysiologyCommunications, 40(5):629-632. (in Chinese)
[2]徐庆岫, 覃伟铭, 李春江, 等. 库尔勒香梨产生粗皮果的原因分析[J]. 落叶果树, 2002,(1):5-9.
XU Qing-xiu, TAN Wei-ming, LI Chun-jiang, et a1.(2002).The Causes Analysis of Roush Fruit Fragrant Pear [J].DeciduousFruits, (1):5-9.(in Chinese)
[3]李疆, 任莹莹, 覃为铭, 等. 库尔勒香梨粗皮果的初步研究[J]. 塔里木大学学报, 2008,(3):8-10.
LI Jiang, REN Ying-ying, TAN Wei-ming, et a1.(2008).The Primary Study on Rough Fruit of Korla Fragrant Pear [J].JournalofTarimUniversity, (3):8-10. (in Chinese)
[4]贾晓辉, 王文辉, 李世强, 等. 库尔勒香梨粗皮果发生原因初步分析[J]. 中国南方果树,2014,(2):92-94.
JIA Xiao-hui, WANG Wen-hui, LI Shi-jiang, et a1.(2014). The preliminary analysis of coarse skin fruit in Korla Fragrant Pear [J].ChinaSouthernFruitTrees, (11):92-94. (in Chinese)
[5]卡哈尔,木合塔尔·扎热,刘玲. 库尔勒香梨粗皮果形成相关因子的分析[J]. 黑龙江农业科学,2013,(9):49-52.
Kahar, Muhtamafi,LIU Ling.(2013).Analysis on Relevant Factors of Rough Fruit Formation in Korla Fragrant Pear [J].HeilongjiangAgriculturalSciences, (9):49-52.(in Chinese)
[6]马宏超. 库尔勒香梨果实脱萼宿萼和粗皮果的显微结构及品质研究[D].乌鲁木齐:新疆农业大学硕士论文,2010.
MA Hong-chao.( 2010).StudiesonQualityandMicrostructureofCalyxLeavingfromFruitandPersistentCalyxandRoughSkininKorlaFragrantPearFruitXinjiangAgriculturalSciences[D]. Master Dissertation. Xinjiang Agricultural University, Urumqi. (in Chinese)
[7] 翟晓东, 齐曼·尤努斯, 张峰,等. 库尔勒香梨粗皮果形成与叶片、土壤养分状况的相关性研究[J]. 新疆农业科学,2015,(1):14-19.
ZHAI Xiao-dong, Qiman Yunus, ZHANG Fen.(2015).Research on the Correlation of Korla Fragrant Pear Rough Fruit with Leaf and Soil Nutrient Status Nuermaimaiti Maihesumu,Pafiguli Nuerdon [J].XinjiangAgriculturalSciences,(1):14-19. (in Chinese)
[8]玉山·库尔班,齐曼·尤努斯,李疆,等. 库尔勒香梨脱萼、宿萼正常果和粗皮果的品质比较[J]. 新疆农业科学,2012,(6):1 028-1 034.
Yusan Kuerban,Qiman Yunusi,LI Jiang,et al. (2012) Comparison of Fruit Quality of Normal and Roughbark Pear in Persistent Calyx and Dropping Calyx of Korla Fragrant Pear [J].XinjiangAgriculturalSciences, (6):1,028-1,034. (in Chinese)
[9] 刘妮, 陶书田, 张绍铃,等. 授粉品种对'库尔勒香梨'果实萼片宿存及品质的影响[J]. 南京农业大学学报,2011,(3):43-47.
LIU Ni, TAO Shu-tian, ZHANG Shao-ling, et a1.(2011) Effect on persistent and quality of Pollination varieties of 'Korla Fragrant Pear fruit sepals [J].JounalofNanjingAgriculturalUniversity, (3):43-47. (in Chinese)
[10] 刘玲, 李疆, 覃伟铭. 库尔勒香梨果实石细胞发育及其对果实肉质影响初探[J]. 西北植物学报,2005,(10):1 965-1 968
LIU Ling, LI Jiang, TAN Wei-ming.(2005).Stone cell development and its effects on the sarccatp of Korla Fragrant Pear [J].ActaBOt.Boreal.-Occident.Sin, (10):1,965-1,968. (in Chinese)
[11] 张绍铃,张振铭,乔勇进,等 不同时期套袋对幸水梨果实品质、石细胞发育及其相关酶活性变化的影响[J].西北植物学报,2006,26 (7):1 369-1 377.
ZHANG Shao-ling, ZHANG Zhen-ming, QIAO Yong-jin, et a1.(2006).Effects of Fruit Bagging at Different Stages On Pear Quality and Sclereid Dewelopment and the Actieities of Their Related Enzymes in the pear Variety Kousui [J].ActaBotanicaBoreali-OccidentaliaSinica, (7):1,369-1,377. (in Chinese)
[12] Welinder, K. G. (1991). Bacterial catalase-peroxidases are gene duplicated members of the plant peroxidase superfamily.BiochimicaEtBiophysicaActa, 1,080(3):215-220.
[13]于娟娟,李玲,金青,等. 砀山酥梨石细胞发育过程中木质素代谢关键酶POD类型的分析[J]. 园艺学报,2011,(6):1 037-1 044.
YU Juan-juan,LI Ling,JIN Qing,et al. (2011). Studies on Key Enzyme POD Types of Lignin Metabolic Pathway During Stone Cell Development ofPyrusbretschneideri[J].ActaHorticulturaeSinica,(6):1,037-1,044. (in Chinese)
[14] 刘莉, 孙虹丽, 程召阳,等 砀山酥梨褐皮芽变果皮中木质素生物合成相关基因克隆与表达分析[J]. 华北农学报,2013,(6):88-92.
LIU Li, SUN Hong-li, CHENG Zhao-yang, et a1.(2013). Biosynthesis gene cloning and expression analysis of the peel lignin in the beige bud mutation of Dangshan [J].NorthChinaagriculture, (6): 88-92. (in Chinese)
[15]聂敬全.砀山酥梨果实石细胞解剖学研究及木质素合成途径的初步分析[D].合肥:安徽农业大学硕士论文,2009.
NIE Jing-quan. ( 2009).AnatomicalStudyonStoneCellandPreliminaryAnalysisofSynthesisPathwayofLignininPyrusbretschneideriCV[D]. Master Dissertation. Anhui Agricultural University, Hefei. (in Chinese)
[16]田鹏, 康保珊, 魏闻东, 等.不同红梨果皮类黄酮合成基因表达模式分析[J]. 西北植物学报,2011,(12):2 437-2 442.
TIAN Peng, KANG Bao-shan, WEI Wen-dong, et al. (2011),Analysis of the Transcription Profiles of the Flavonoid-related Genes in the Red Skin of the Different Pear Varieties [J].ActaBOt.Boreal. -Occident.Sin., 31(12):2,437-2,442 (in Chinese)
[17] Ranadive, A. S., & Haard, N. F. (1973). Chemical nature of stone cells from pear fruit (pages 331-333).JournalofFoodScience, 38(2):331-333.
[18]陶书田. 梨(Pyrus)果实石细胞的结构成分分析及相关酶基因的克隆[D].南京: 南京农业大学博士论文,2009.
TAO Shu-tian. (2009).CompositionofthefruitstonecellanalysisandrelatedenzymegenecloninginPear(Pyrus) [D]. PhD Dissertation. Nanjing Agricultural University, Nanjing. (in Chinese)
Fund project:Supported by the germplasm resources preservation project of the Ministry of Agriculture (2016NWB019)
Correlation Analysis of Solid Stone Cell Content and Expression ofPOD4 Gene in Korla Fragrant Pear
LI Wen-hui1,FENG Jian-rong2,TANG Zhang-hu1, DONG sheng-li1, XU Lin3,ZHANG Shi-kui1, ZHANG Yan3
(1.LuntaiGardenofPomologyResourcesofXinjiangAcademyofAgriculturalSciences,LuntaiXinjiang841600,China; 2.HorticultureDepartmentofCollegeofAgronomy,ShiheziUniversity,ShiheziXinjiang832000,China; 3.ResearchInstituteofCropGermplasmResources,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China)
【Objective】 To study the correlation of stone cell content andPOD4 gene expression in rough skin pear and normal skin fruit of mature Korla Fragrant Pear in the hope of providing molecular basis for improving the fruit quality.【Method】Rough skin fruit and normal skin fruit of Korla Fragrant Pear during the mature period were used as materials, and the firmness and the content of stone cell were determinated. Total RNA was extracted from fragrant pear fruit pulp, quantification expression ofPOD4 gene was determinated by Real-time fluorescent quantitative polymerase chain reaction (qRT PCR), the correlation of the firmness and the content of stone cell and quantification expression ofPOD4 gene were analyzed.【Result】The content of fruit stone cell was between 0.4 and 0.52 gram, pear firmness was between 245.22 and 314.71 PA and quantification expression ofPOD4 gene in mature pear was between 106.89 and 743.29.【Conclusion】The content of stone cell in rough skin fruit is 1.3 times than the normal skin fruit, the hardness was 1.28 times,POD4 gene expression was 6.59 times. The correlation between the content of stone cell and the quantification expression ofPOD4 gene was significantly positive (r= 0.823), and correlation between the content of stone cell and the fruit hardness was positive (r= 0.783). The correlation between quantification expression ofPOD4 and fruit firmness was positive (r= 0.770). Therefore, the level of expression ofPODgene can be used as a reference index for the identification of the content of stone cell.
Korla Fragrant Pear; content of stone cells; qRT-PCR
10.6048/j.issn.1001-4330.2017.01.008
2016-10-24
农业部种质资源保种项目(2016NWB019)
李文慧(1975-),女,新疆人,副研究员,硕士,研究方向为果树种质资源创新与利用,(E-mail)lwh-2003@163.com
徐麟(1968-),男,湖北人,推广研究员,研究方向为农作物种质资源评价和利用,(E-mail)18608960012@163.com
S661.2
A
1001-4330(2017)01-0060-06

