E-cad在低位直肠癌淋巴结转移裸鼠模型血清及移植瘤中的表达及其意义
艾斯克尔·吐拉洪,陈 凯,邓大伟*
(1. 新疆医科大学第一附属医院肿瘤中心,乌鲁木齐 830000;2. 新疆医科大学第五附属医院普外科,乌鲁木齐 830000)
研究报告
E-cad在低位直肠癌淋巴结转移裸鼠模型血清及移植瘤中的表达及其意义
艾斯克尔·吐拉洪1,陈 凯2,邓大伟2*
(1. 新疆医科大学第一附属医院肿瘤中心,乌鲁木齐 830000;2. 新疆医科大学第五附属医院普外科,乌鲁木齐 830000)
目的 探讨裸鼠低位直肠癌淋巴结转移模型血清及移植瘤组织中E-钙黏蛋白(E-cad)的表达情况,分析其在直肠癌淋巴结转移过程中的作用。方法 取对数生长期的人大肠癌细胞株SW480接种于裸鼠直肠黏膜下,建立裸鼠低位直肠癌淋巴结转移模型。120只裸鼠随机分为3组,每组40只,A组(直肠癌模型组)采用二甲基肼注射+SW480种植,B组(二甲基肼对照组)采用二甲基肼注射,C组(空白对照组)不作任何处理。采用ELISA检测血清E-cad的含量,采用Western blot法、RT-PCR法检测种植瘤组织中E-cad蛋白及mRNA表达水平。结果 A组裸鼠的血清E-Cad含量为(19.48±1.25)mg/L,明显高于B组裸鼠和C组裸鼠的血清E-Cad含量(2.36±0.18 mg/L和2.15±0.12 mg/L)(t=8.28,9.01,P< 0.05)。发现侧方淋巴结转移的裸鼠血清E-Cad含量,明显高于未发现侧方淋巴结转移的裸鼠,差异有显著性(t=10.28,P< 0.05)。A组裸鼠移植瘤组织中E-Cad蛋白的表达强度弱于B组和C组(t=9.81,7.69,P< 0.05)。A组中,有侧方淋巴结转移发生的裸鼠移植瘤组织中E-Cad蛋白表达强度较未有侧方淋巴结转移发生的裸鼠移植瘤组织中表达明显减弱,差异有显著性(t=9.36,P< 0.05)。A组裸鼠移植瘤组织中E-Cad mRNA 表达明显下调,与B组和C组比较,有明显的差异(P< 0.05)。A组中发现侧方淋巴结转移的裸鼠移植瘤组织中E-Cad mRNA表达强度明显下调,与未发现侧方淋巴结转移的裸鼠比较,差异有显著性(t=7.85,P< 0.05)。结论 血清E-cad的表达水平可能与直肠癌淋巴转移密切相关,同时直肠癌组织中E-Cad蛋白和mRNA表达减弱或缺失,导致癌细胞间粘附性降低,促进癌细胞获得侵袭和转移的能力。
直肠癌;淋巴结转移;E-钙黏蛋白;裸鼠
直肠癌的转移侵袭是影响患者术后复发及生存率的关键因素,其是一个复杂演进的过程,与多种蛋白分子及基因相关。细胞黏附是癌细胞转移侵袭的一个重要步骤,E-钙黏蛋白(E-cad)作为其中重要执行分子,主要介导正常和肿瘤组织中细胞与细胞间的黏附过程[1]。目前研究资料表明,E-cad 表达在肿瘤组织中的表达与其发生浸润转移的几率存在负相关性,即肿瘤组织中E-cad表达降低时,其介导的黏附作用相应随之减弱,致使肿瘤细胞能更容易脱离原发灶,同时相对血清中E-cad含量会相应增高,与肿瘤转移浸润能力呈现正相关[2,3]。本研究选用人大肠癌细胞株SW480建立低位直肠癌淋巴结转移模型,检测E-cad在裸鼠低位直肠癌淋巴结转移模型血清及移植瘤组织中的表达情况,探讨其在直肠癌淋巴结转移过程中的可能作用机制。
1 材料和方法
1.1 材料
BALB/C-nu/nu雄性裸鼠120只,SPF级,购自新疆医科大学动物实验研究中心【SCXK(新)2011-0001】,鼠龄6~8周,体重18~22 g,分笼饲养于屏障系统的洁净层流架内【SYXK(新)2015-0002】。随机分为3组,每组40只裸鼠,A组(直肠癌模型组)采用二甲基肼注射+人大肠癌细胞株SW480种植,B组(二甲基肼对照组)仅采用二甲基肼注射,C组(空白对照组)不作任何处理。
1.1.2 细胞来源
人大肠癌细胞株SW480(取自中科院上海细胞生物研究所)在含10%胎牛血清的RPMI-1640培养基中进行培养,培养环境是37℃、5%CO2的培养箱。
1.1.3 主要试剂
胎牛血清(FBS)购自杭州四季青公司,胰蛋白酶购自Sigma公司,RPMI-I64O培养基购自Gibco公司;小鼠E-cad酶联免疫吸附测定(ELISA)试剂盒分别购自Bender Medsystems公司;小鼠 E-Cad一抗及酶标试剂盒(96孔)购自美国Santa Cruz公司。BCA法蛋白定量测定试剂盒购自武汉博士德生物工程技术有限公司。PCR 试剂盒购自美国Promega公司。
1.2 实验方法
1.2.1 人大肠癌细胞株SW480的培养
光线从背后照过来,叶晓晓半躺在一张贵妃榻上,右手支着头,左手顺着身体轻轻抚在髋骨上,头微扬。光线打在脸上,镀上了一层柔和的小麦色光芒,身体的调子半明半暗,立体感很强,光洁如玉的身体因为青春和饱满微微发出润泽的光芒。
采用的培养基为含10%胎牛血清的RPMI-1640,培养箱的环境要求为:37℃、5%CO2,首先用0.25%胰酶对SW480细胞进行消化,收集并配置细胞悬液的浓度达1×106个/mL,备用。
1.2.2 裸鼠低位直肠癌淋巴结转移模型的建立
A组和B组裸鼠均采用二甲基肼注射液(生理盐水配制,浓度为1%,pH值为6.5 ~ 7.0)进行颈部皮下注射,注射剂量和时间:30 mg/kg,1次/周,至第8周末。B组裸鼠完成8周的注射后分笼饲养。A组裸鼠继续进行接种实验:裸鼠在进行实验前禁食12 h,10%水合氯醛(0.3 mL∶100 g)腹腔内注射进行麻醉裸鼠,消毒会阴、肛门以及直肠腔,将直肠黏膜外翻,以显露于扩张的肛门口外,取配置好备用的大肠癌细胞株SW480悬液0.2 mL,在裸鼠背侧肛门缘上2 mm处,缓慢注射细胞悬液于直肠黏膜组织下。实验后A组裸鼠分笼饲养,继续禁食禁水6 h后给予高能量饮食。C组裸鼠不作任何处理。对三组裸鼠分别于制模实验完成后第6周时,各取10只裸鼠采用颈部脱曰法处死,处死前取裸鼠心脏血6 mL,处死后切开腹腔,切取A组裸鼠的移植瘤组织及周围组织(包括侧方淋巴结组织,对于侧方淋巴结清扫范围为自直肠筋膜脏层进行分离、膀胱下筋膜内侧骨盆神经丛和髂血管之间以及髂内血管和盆壁及闭孔筋膜之间),而对B组和C组的裸鼠,则切取相对应位置的直肠及周围组织(包括侧方淋巴结组织)。
1.2.3 血清E-Cad含量检测
各组裸鼠血清E-Cad含量检测采用ELISA双抗夹心法进行检测,方法严格按操作说明书进行,设标准孔8 孔,稀释血清标本,配置底物及标准液,每孔中加入第一抗体工作液50 μL,将反应板充分混匀后置37℃ 60 min,洗板后每孔加酶标抗体工作液100 μL,将反应板置37℃ 30 min,洗板后每孔加入底物工作液100 μL,置37℃暗处反应5 ~ 15 min。于492 nm处测吸光值并绘制标准曲线,根据曲线图得出E-Cad含量。
1.3 Western blot法检测移植瘤组织中E-钙黏蛋白的表达
将各组裸鼠的部分移植瘤组织浸入生理盐水中,经研磨成为细胞悬液,收集细胞,将400 μL含PMSF的裂解液加入细胞培养板上,培养板置于冰上作用30 min,使细胞完全裂解,提取细胞株的总蛋白,用Bradford法测定蛋白浓度并计算出标准曲线方程,然后进行Western印迹检测,图片扫描后用Quatity One 软件分析条带灰度值。
1.4 RT-PCR法检测移植瘤组织中E-钙黏蛋白的表达
按TRIzol总RNA提取试剂说明书进行操作,采用Trizol一步法提取各组裸鼠肿瘤组织的总RNA,并经紫外分光光度计测定,计算提取物RNA浓度,按照逆转录试剂盒合成cDNA,设计DJ-1和PTEN mRNA引物,各引物均由上海生工合成。RT-PCR反应条件为40℃ 30 min,94℃ 1 min,94℃ 15 s,50℃ 1 min,72℃ 1 min,取cDNA 1 μg,10× buffer 2 μL,MgCl24 μL,10 mmol/L dNTPs 2 μL,引物100 ng,TagDNA多聚酶 1 U,总体系20 μL,将PCR扩增之后的产物经1.5%琼脂糖凝胶电泳,应用Gel-pro凝胶分析软件对电泳谱带mRNA进行基因表达差异分析。
1.5 统计学方法
采用SPSS 11.0统计分析软件进行数据处理。计量资料数据比较采用方差检验,组间比较采用t检验。
2 结果
2.1 各组裸鼠血清E-Cad含量检测结果
A组裸鼠的血清E-Cad含量为(19.48±1.25)mg/L,明显高于B组裸鼠和C组裸鼠的血清E-Cad含量(2.36±0.18 mg/L和2.15±0.12 mg/L)(t=8.28,9.01,P< 0.05),而B组和C组之间比较,差异无显著性(t=0.69,P> 0.05)。A组中发现6例出现侧方淋巴结转移,发现侧方淋巴结转移的裸鼠血清E-Cad含量(24.07±1.65 mg/L),明显高于未发现侧方淋巴结转移的裸鼠血清E-Cad含量(12.64±1.35 mg/L),差异有显著性(t=10.28,P< 0.05)。
2.2 Western blot法检测各组裸鼠移植瘤组织中E-Cad蛋白的表达
A组裸鼠移植瘤组织中E-Cad蛋白的表达强度(0.42±0.09)弱于B组(1.56±0.18)和C组(1.25±0.32)(t=9.81,7.69,P< 0.05),而B组和C组之间比较,E-Cad表达强度则差异无显著性(t=1.29,P> 0.05),见图1。A组中,有侧方淋巴结转移发生的裸鼠移植瘤组织中E-Cad蛋白表达强度(0.14±0.05)较未有侧方淋巴结转移发生的裸鼠移植瘤组织中表达强度(0.62±0.15)明显减弱,差异有显著性(t=9.36,P< 0.05),见图2。

注:A:直肠癌模型组(A组);B:二甲基肼对照组(B组);C:空白对照组(C组)。图1 各组裸鼠移植瘤组织中E-Cad蛋白表达Note. A: Rectal cancer model group (group A); B: Dimethylhydrazine control group (group B); C: Blank control group (group C).Fig.1 The protein expression of E-cad in the tumor tissues of nude mice

注:1:发生侧方淋巴结转移;2:未发生侧方淋巴结转移。图2 A组伴有侧方淋巴结转移发生和未伴有转移发生的裸鼠移植瘤组织中E-Cad蛋白表达比较Note. 1: Lateral lymph node metastasis; 2: Without lateral lymph node metastasis.Fig.2 Comparison of the protein expression of E-cad in the mice of group A with or without lateral lymph node metastasis
2.3 RT-PCR法检测各组裸鼠移植瘤组织中E-Cad mRNA的表达
A组裸鼠移植瘤组织中E-Cad mRNA 表达明显下调,与B组和C组比较,差异有显著性(P< 0.05),而B组和C组之间比较差异无显著性(P> 0.05),见图3。A组中发现侧方淋巴结转移的裸鼠移植瘤组织中E-Cad mRNA表达强度明显下调,与未发现侧方淋巴结转移的裸鼠比较,差异有显著性(t=7.85,P< 0.05),见图4。

注:M:Maker;A:直肠癌模型组(A组);B:二甲基肼对照组(B组);C:空白对照组(C组)。图3 各组裸鼠移植瘤组织中E-Cad mRNA的表达Note. M: Marker; A: Rectal cancer model group (group A); B: Dimethylhydrazine control group (group B); C: Blank control group (group C).Fig.3 mRNA expression of E-cad in the tumor tissues of nude mice
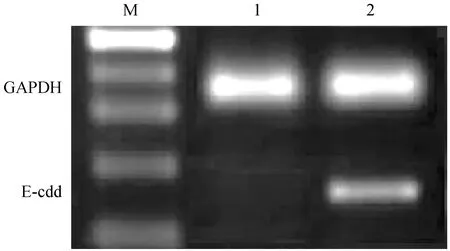
注:M: Maker;1:发生侧方淋巴结转移;2:未发生侧方淋巴结转移。图4 A组发生侧方淋巴结转移和未发生的裸鼠种植瘤组织中E-Cad mRNA表达比较Note. M: Marker; 1: With lateral lymph node metastasis; 2: Without lateral lymph node metastasis.Fig.4 The mRNA expression of E-cad in the mice of the group A with or without lateral lymph node metastasis
3 讨论
恶性肿瘤的转移浸润过程中涉及多分子参与、多因素影响,包含了粘附能力下降、降解、新生血管生成、免疫逃逸等多个方面,其中肿瘤细胞与内皮细胞之间粘附能力下降是发生转移浸润的第一步,而粘附分子则是这个过程中起重要作用的分子基础,其表达是决定细胞间粘附行为的重要因素。E-Cad属于粘附分子家族,是一种钙依赖跨膜糖蛋白,在静息状态下,E-Cad在大多数上皮组织的细胞表面都有表达,其主要功能是通过钙离子形成同源二聚体介导同型细胞黏附,从而参与胚胎发育以及正常组织中上皮细胞层的形成和维持。研究表明,E-Cad通过与连环蛋白之间的交联性改变,细胞生长、分化的粘附信号随之发生改变,细胞粘附力被降低,从而为肿瘤浸润、转移的发生提供了更好的机会[4]。血清可溶性sE-cad是细胞内E-cad的降解物,最早是1983年Damsky等在人乳腺癌细胞MCF-7的无血清培养液中检测到sE-cad[5],之后在临床的血清检测结果中发现肿瘤患者的sE-cad含量要明显高于正常人水平,推测血清E-cad含量的增高可能与肿瘤细胞内E-cad释放入血有关,提示sE-cad的血清指标可以用于监测肿瘤患者的预后。国内外研究也发现前列腺癌、肺癌、胃癌患者血清中能监测到较高水平的E-cad含量,肿瘤切除后患者血清E-cad水平迅速下降[6, 7]。
二甲基肼是目前公认致大肠癌的较为特异致癌剂,主要在肝脏被氧化成甲基偶氮甲醇,与β-葡萄糖醛酸结合,在肠道细菌和肠黏膜上皮的β-葡萄糖苷酸酶作用下,氧化甲基偶氮甲醇又重新游离出来,代谢成终致癌物,导致大肠黏膜上皮癌变。本课题组采用二甲基肼预处理裸鼠,再经肛门种植大肠癌细胞株SW480于直肠粘膜下,能够缩短实验建模时间,保证造模成功。本实验成功建立了裸鼠低位直肠癌淋巴结转移模型,在此基础上通过ELISA法检测了裸鼠血清E-cad的表达水平,研究结果发现A组裸鼠的血清E-Cad含量为(19.48±1.25)mg/L,明显高于B组裸鼠和C组裸鼠的血清E-Cad含量(2.36±0.18 mg/L和2.15±0.12 mg/L)(t=8.28,9.01,P< 0.05),而B组和C组之间比较,差异无显著性(t=0.69,P> 0.05)。证明了成功制模的裸鼠血清中能检测到较高水平的E-Cad表达,较正常裸鼠明显增高,证明了血清E-cad含量的增高可能与癌细胞内E-cad释放入血有关这一推测,也进一步证明了E-cad在直肠癌的发生、生长过程中扮演着重要的角色。同时,本研究的A组中发现6例出现侧方淋巴结转移,发现侧方淋巴结转移的裸鼠血清E-Cad含量,明显高于未发现侧方淋巴结转移的裸鼠,差异有显著性(t=10.28,P< 0.05),提示血清E-cad的表达水平可能与直肠癌淋巴转移密切相关,可作为一种新的监测直肠癌患者淋巴结转移的新分子学参考指标。
E-cad是影响直肠癌发生淋巴结转移的重要因素之一,影响肿瘤生长速度、浸润深度、大小及癌细胞向远处的转移[8]。近年来对多肿瘤细胞和癌组织从分子水平上进行了较深入的研究,发现癌组织黏膜中E-cad表达与肿瘤浸润之间存在负相关性,而当E-cad 表达降低或缺失时,由介导的细胞黏附功能出现障碍,癌细胞之间的同质性黏附功能减弱,癌细胞更易于脱离原发灶,从而增加癌细胞侵袭和转移的几率[9-11]。本研究在建立低位直肠癌淋巴结转移裸鼠模型的基础上,检测E-cad在裸鼠移植瘤组织中的蛋白和mRNA表达情况,结果显示制模组裸鼠移植瘤组织中E-Cad蛋白和mRNA的表达强度均弱于二甲基肼对照组和空白对照组(P< 0.05),进一步证明了E-Cad作为细胞之间的钙依赖性跨膜糖蛋白参与了直肠癌的发生过程,可能在直肠癌细胞的分化、增殖的环节中发挥着重要的生物学效应[12]。本研究进一步探讨了发生侧方淋巴结转移裸鼠和未发生侧方淋巴结转移裸鼠之间E-Cad蛋白表达情况比较,结果发现制模组中发现侧方淋巴结转移的裸鼠移植瘤组织中E-Cad蛋白和mRNA表达强度均明显减弱,与未发现侧方淋巴结转移的裸鼠比较,差异有显著性(P< 0.05)。提示E-Cad基因及其蛋白表达的异常可能参与了直肠癌的淋巴结转移发生发展过程,由于E-Cad表达的减弱或缺失,致使其介导的粘附系统在癌组织中失去其功效,从而降低癌细胞间粘附性,促进癌细胞迁移、浸润及转移,这对癌组织的浸润及淋巴结转移的发生过程是具有重要促进作用的[13-15]。
综上所述,本研究结果提示,血清E-cad的表达水平可能与直肠癌淋巴转移密切相关,可作为一种新的监测直肠癌患者淋巴结转移的新观察指标;同时直肠癌组织中E-Cad蛋白和mRNA表达减弱或缺失,导致癌细胞间粘附性降低,促进癌细胞获得侵袭和转移的能力。但由于本研究样本数较少,且未对E-Cad介导粘附作用的具体机制进行探讨,结果存在一定局限性,有待进一步深入研究。
[1] 霍西茜,王宁. 钙粘素蛋白-E与肿瘤发生及生物学行为相关性的研究进展[J]. 现代肿瘤医学, 2013, 21(8): 1879-1882.
[2] Reinhold WC, Reimers MA, Lorenzi P, et al. Multifactorial regulation of Ecadherin expression: an integrative study [J]. Mol Cancer Ther, 2010, 9(1): 1-16.
[3] Wheelock MJ, Shintani Y, Maeda M, et al. Cadherin switching [J]. J Cell Sci, 2008, 121(6): 727-735.
[4] 吴桦宗. 胃癌患者证素湿与血清E-Cad、sICAM-1、L-selectin的关系[D]. 福建中医药大学, 2013.
[5] Damsky CH, Richa J, Solter D, er al. Identification and purification of a cell sarface glycoprotein mediating intercellular adhesion in embryonic and adult tissue[J]. Cell, 1983,34(2): 455-466.
[6] 许洪卫,蔡诚忠,谭龙益. 胃癌根治手术与血清、组织E-钙黏附素变化的关系[J] 中华实验外科杂志, 2003, 20(8): 751- 752.
[7] 黄正军. 食管癌患者手术前后血清E-cad、SICAM-1和IL-8检测的临床意义[J]. 放射免疫学杂志, 2013, 26(4): 395-396.
[8] Razavi R, Harrison LE. Thermal sensitization using induced oxidative stress decreases tumor growth in an in vivo model of hyperthermic intraperitoneal pefusion [J]. Ann Surg Oncol,2010, 17(1): 304-311.
[9] 娜仁,谈顺,饶翔,等. P120和E-cad在乳腺癌中的表达及鉴别诊断意义[J]. 中国妇幼保健, 2012, 27(6): 896-899.
[10] 肖帅,裘正军,黄陈,等. 转录因子Snail及黏附分子E-cadherin在直肠癌中的表达及意义 [J]. 国际外科学杂志, ISTIC, 2010, 37(8): 514-519.
[11] Bezdekova M, Brychtova S, Sedlakova E, et al. Analysis of snail-1, e-cadherin and claudin-1 expression in colorectal adenomas and carcinomas [J]. Inter J Mol Sci, 2012, 13(2): 1632-1643.
[12] 艾斯克尔·吐拉洪,陈凯,邓大伟. 低位直肠癌淋巴结转移动物模型的建立及其E-钙黏蛋白的表达[J]. 中国医药导报, 2015, 12(23): 17-20.
[13] 张伟,李芳,张飞燕,等. 基质金属蛋白酶-7、上皮性钙黏附蛋白和血管内皮生长因子在乳腺癌中表达及意义的研究[J]. 中国医药导报, 2012, 09(18): 71-74.
[14] 江泽,许华,李胜水,等. MTT法检测乳腺癌细胞对化疗药物敏感性的研究[J]. 中国医药导报, 2010, 7(3): 28-29.
[15] 王志华. 细胞因子诱导的杀伤细胞治疗癌症的基础与临床[J]. 中国医药导报, 2013, 10(7): 4-8.
Expression and significance of E-cadherin in the serum and transplanted tumor of nude mouse model of low rectal cancer with lymph node metastasis
AISHIKEER·tulahong1, CHEN Kai2, DENG Da-wei2*
(1. Cancer Center, the First Affiliated Hospital of Xinjiang Medical University, Urumqi 830000, China;2. Department of General Surgery, the Fifth Affiliated Hospital of Xinjiang Medical University, Urumqi 830000)
Objective To establish a nude mouse model of low rectal cancer with lymph node metastasis, to detect the expression of E-calcium (E-cad) in the serum and transplanted tumor tissue of the mice, and to analyze the role of E-cad in lymph node metastasis of rectal cancer. Methods Human colorectal adenocarcinoma cells (SW-480) were inoculated into the rectal submucosa of nude mice to establish a model of low rectal cancer with lymph node metastasis. 120 nude mice were randomly divided into three groups (40 mice in each group). Group A (rectal cancer model group) was injected with dimethylhydrazine and implanted with SW480 cells. Group B (dimethylhydrazine control group) was injected with dimethylhydrazine alone. The group C (control group) received no treatment. Serum E-cad was detected by ELISA. The mRNA and protein expression of E-cad in the tumor tissue was detected by RT-PCR and western blot, respectively. Results The serum level of E-cad in group A was 19.48±1.25 mg/L, significantly higher than those in groups B (2.36±0.18 mg/L) and C (2.15±0.12 mg/L) (t=8.28, 9.01,P< 0.05). The serum levels of E-cad were significantly higher in the nude mice with lateral lymph node metastasis than those without lymph node metastasis (t=10.28,P< 0.05). The protein expression of E-cad in the group A was lower than that in the groups B and C (t=9.81, 7.69,P< 0.05). In the group A, the protein expression of E-cad in the nude mice with lateral lymph node metastasis was significantly lower than that without lateral lymph node metastasis (t=9.36,P< 0.05). The mRNA expression of E-cad in the group A was significantly lower than that in the groups B and C (P< 0.05), and the mRNA expression of E-cad in the nude mice with lateral lymph node metastasis was significantly lower than that in the mice without lateral lymph node metastasis (t=7.85,P< 0.05). Conclusions The serum level of E-cad may be closely associated with the lymphatic metastasis of rectal cancer, and the mRNA and protein expressions of E-cad in colorectal cancer tissue were weak or absent, leading to a decrease of adhesion ability between cancer cells, and promote the invasion and metastasis of cancer cells.
Rectal cancer; Lymph node metastasis; E-cadherin; Nude mice
新疆维吾尔自治区自然科学基金(项目编号:2014211C131)。
艾斯克尔·吐拉洪(1980-),硕士,主治医师,研究方向:肝胆肿瘤。Email: 277405546@qq.com
邓大伟,Email: Hexiaoxiao2010@sina.com
R-33
A
1671-7856(2017) 03-0031-06
10.3969.j.issn.1671-7856. 2017.03.006
2016-11-28

