靶向性近红外荧光染料在肝癌模型研究中的应用
赵宁宁,张彩琴,赵 勇,谭邓旭,师长宏
(第四军医大学实验动物中心, 西安 710032)
研究报告
靶向性近红外荧光染料在肝癌模型研究中的应用
赵宁宁,张彩琴,赵 勇,谭邓旭,师长宏*
(第四军医大学实验动物中心, 西安 710032)
目的 探讨七甲川花菁近红外荧光(near-infrared fluorescence,NIRF)染料IR-783在肝癌模型影像研究中的应用,分析该染料靶向肿瘤细胞的分子机制。方法 将标记荧光素酶的人肝癌细胞HepG2皮下接种裸鼠,测试肿瘤发生部位生物发光(bioluminescence,BIL)信号与NIRF信号的相关性。采用肾包膜下移植的方式建立人肝癌裸鼠移植(patient-derived xenograft,PDX)模型,观察IR-783对肿瘤边界的识别能力;苏木素-伊红染色(hematoxylin -eosin staining,H&E staining)确认肿瘤发生的部位,免疫组织化学(Immunohistochemistry,IHC)检测肝癌肿瘤组织中CEA、AFP、HIF1α和OATP3A1的表达;使用线粒体示踪剂(Mito Tracker)和溶酶体示踪剂(Lyso Tracker)确认NIRF染料在肝癌细胞中的结合部位;测试IR-783对正常肝细胞中混合培养的肝癌细胞鉴别能力。结果 人肝癌裸鼠皮下移植瘤BIL与NIRF强度具有较好的相关性;NIRF染料IR-783能够清晰识别肾包膜移植肝癌肿瘤边缘;IHC染色显示肿瘤组织中CEA、AFP、HIF1α和OATP3A1均高表达;IR-783主要结合在肿瘤细胞的线粒体与溶酶体中;标记GFP的人肝癌细胞HepG2能够被IR-783特异性识别。结论 IR-783是一种具有肿瘤靶向和成像特征的新型近红外荧光染料,其靶向性可能与肝癌组织中HIF1α和OATP3A1的高表达相关。
近红外荧光染料;肝癌模型;低氧诱导因子;有机阴离子转运肽
近红外荧光(near-infrared fluorescence,NIRF)成像技术可以从细胞、分子层面探测正常组织的病变,具有无创、实时、特异、精细等优点[1, 2]。该技术较常使用的染料为吲哚菁绿(indocyaninegreen,ICG),该染料是唯一被美国食品药品监督管理局(Food and Drug Administration,FDA)批准的可用于临床诊断的NIRF染料,主要用于肝硬化、肝纤维化及胃肠道血管疾病等诊断。该类染料的稳定性差,在极性溶剂中会迅速聚集并分解,且光照会加速分解,最终在水溶液中的不稳定性及在血浆中的快速清除率限制了其在荧光成像、目标组织定位方面的应用[3]。近年来,一种新型的NIRF染料—七甲川花菁染料得到了广泛应用,该类染料具有成像和靶分子的双重功能,自发荧光非常低,但与生物分子结合后,由于化学修饰提高了分子团的稳定性,可促发形成强的荧光,特异性的集聚在肿瘤细胞中,从而识别肿瘤发生部位,在肿瘤诊断,辅助肿瘤手术切除和肿瘤治疗等方面具有良好的应用前景[4-6]。本研究分别选择了人肝癌细胞系移植模型和PDX模型,探讨了该类染料的成像和靶向特性。
1 材料和方法
1.1 实验动物与试剂
雄性BALB/c裸鼠,4~6周龄,由北京维通利华公司提供【SCXK(京)2012-0001】,饲养在第四军医大学实验动物中心屏障动物房【SYXK(陕)2014-001】。人体肝癌肿瘤标本来自于第四军医大学西京医院肝胆外科,通过了西京医院伦理委员会的批准(编号2015432)。七甲川花菁NIRF染料IR-783由美国Cedars-Sinai Medical Center,Leland Chung教授馈赠;动物麻醉使用水合氯醛7 mg/只;肿瘤移植所用基质胶(Matrigel Matrix)购买于美国BD公司;实验中所用一抗CEA、AFP、HIF1α和OATP3A1均购买于上海艾博抗体有限公司;Mito Tracker,Lyso Tracker购买于美国Invitrogen公司;DAPI购买于北京雷根生物技术有限公司;标记GFP的HepG2肝癌细胞由本实验室保存;动物实验通过了第四军医大学伦理委员会的批准(编号14013)。
1.2 实验方法
1.2.1 生物发光和近红外荧光强度与肿瘤体积变化的关系
将标记有荧光素酶(luciferase, LUC)的HepG2肝癌细胞以1×106个/只移植于5只裸鼠的右侧背部皮下,1周后,使用Caliper Lumina II小动物光学成像系统同一体位分别测定不同小鼠肿瘤部位BIL与NIRF强度ROI(regions of interest, ROI)并测量肿瘤体积,其中,LUC于成像前10 min腹腔注射,剂量为每只1.5 mg;NIRF染料于成像前24 h腹腔注射,每只100 μL(浓度为100 μmol/L)。持续对小鼠肿瘤部位BIL和NIRF强度监测并测量肿瘤体积,分别分析两种光强度与肿瘤体积的相关性。
1.2.2 近红外荧光染料对肿瘤边界的识别
采用裸鼠肾包膜下移植的方式建立了3例人肝癌移植(patient-derived xenograft,PDX)模型[4],病人的住院号分别为B66873、C34566、C64003。模型建立两周后进行NIRF成像。将小鼠处死取出肾脏同样方法进行NIRF成像,最后把小鼠肾脏制成冰冻切片并HE染色,在带有NIRF滤光片的荧光显微镜下观察对比冰冻切片的组织形态和IHC结果。
1.2.3 肝癌组织中CEA、AFP、HIF1α和OATP3A1的表达
将3例PDX模型中得的传代肝癌组织做石蜡切片,分别进行HE染色,并使用IHC检测肿瘤组织中CEA、AFP、HIF1α和OATP3A1的表达。
1.2.4 近红外荧光染料在肿瘤细胞中的染色定位
将HepG2细胞以1×105/个铺于两个激光共聚焦平皿,37℃孵育24 h后,吸出平皿内培养基,加入浓度为20 μmol/L的NIRF染料IR-783孵箱内孵育30 min后,PBS洗掉多余的染料,分别加入浓度为75 nmol/L的Mito tracker和浓度为200 nmol/L的Lyso Tracker,37℃孵育30 min后,PBS洗掉多余染料,4%的多聚甲醛固定后,DAPI染核。在激光共聚焦下观察,其中IR-783的近红外荧光以633 nm的光束激发,Mito Tracker的橘黄色荧光和Lyso Tracker的绿色荧光以543 nm的光束激发。
1.2.5 近红外荧光染料对肿瘤细胞的特异性识别
将标记GFP的HepG2肝癌细胞与正常的肝细胞混合培养24 h后,加入IR-783(20 nmol/L)作用30 min后,PBS洗掉多余的染料,多聚甲醛固定,DAPI染色,方法同1.2.4,在装有NIRF滤光片的显微镜下观察。
1.3 数据分析
所有结果以均数±标准差表示,两组间的数据比较采用Student’st检验,以P< 0.05为差异有显著性。
2 结果
2.1 肿瘤部位生物发光信号与近红外荧光信号具有较好的相关性
将人肝癌细胞HepG2接种裸鼠建立皮下移植模型,活体成像结果显示,肿瘤部位生物发光和近红外荧光强度均随着肿瘤体积的增长而增强,两者R2值分别达到0.9986和0.9974,具有较好的相关性(图1)。
2.2 近红外荧光染料能够特异性识别肿瘤边界
将3例临床肝癌手术标本采用裸鼠肾包膜移植的方法成功建立PDX模型,该模型NIRF活体成像和肾脏离体成像均显示IR-783染料特异性集聚在肿瘤部位;取肾脏部位做冰冻切片,在荧光显微镜下观察发现NIRF染料能够清晰的识别肿瘤边缘,且与HE染色和IHC结果相一致,符合肝癌特征(图2)。
2.3 肝癌组织中CEA、AFP、HIF1α和OATP3A1呈强阳性表达
三例PDX模型肝癌组织中CEA、AFP、HIF1α和OATP3A1的表达均呈强阳性。CEA主要用于消化道肿瘤的检测,而AFP是诊断原发性肝癌的特异性标志物,联合二者结果可有效提高原发性肝癌的确诊率,说明上述肿瘤组织不仅在病理形态上与病人保持一致,同时也维持了原发肿瘤的分子特征[7, 8],结果见图3。
2.4 近红外荧光染料主要定位于肿瘤细胞的线粒体和溶酶体
培养的肝癌细胞加入NIRF染料进行了细胞定位,共聚焦显微镜观察显示NIRF染料主要聚集在肿瘤细胞的胞浆内,与线粒体和溶酶体示踪剂显示的部位一致,即NIRF染料主要与肿瘤细胞的线粒体和溶酶体结合(图4)。
2.5 近红外荧光染料能够特异性的识别肿瘤细胞
将标记GFP的HepG2细胞与正常肝细胞混合培养后,加入NIRF染料IR-783,荧光显微镜下发现NIRF染料只聚集在带有GFP的肿瘤细胞部位,而正常的肝细胞无红色荧光(图5)。
3 讨论
IR-783是一种新型的NIRF七甲川花菁染料,它不需要结合肿瘤靶分子便可直接集聚于肿瘤部位,动态观察肿瘤的生长变化[7-9];与其它NIRF染料相比,这种染料可特异性识别肿瘤细胞,且自发荧光低,穿透力强[10, 11];与BIL相比,IR-783在小鼠体内24 h后便可清晰成像,甚至48 h后仍然能够显像。常规生物发光信号一般在注射底物后20 min后就开始淬灭,而且其BIL成像,需要将荧光素酶转染入细胞,步骤比较繁琐,无法直接应用于PDX模型成像[12]。NIRF染料具有的肿瘤靶向性和成像特征有可能成为肿瘤监测的良好工具。

图1 生物发光强度、近红外荧光强度与肿瘤体积变化的相关性Fig.1 The correlation between bioluminescence intensity, NIRF intensity and tumor volume
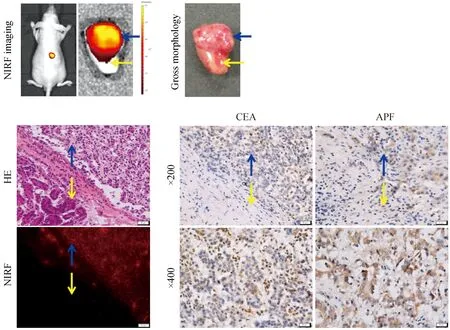
注:蓝色箭头为肿瘤组织,黄色箭头为正常组织图2 近红外荧光染料集聚于肿瘤部位Note: Blue arrows indicate the tumor tissue, and yellow arrows indicate normal tissueFig.2 NIRF dyeis retained in the tumor tissue
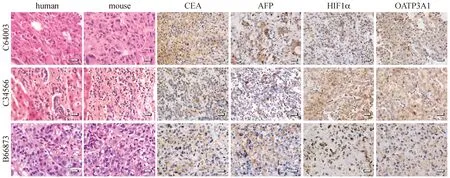
图3 PDX模型肿瘤组织HE染色与免疫组化结果(×400)Fig.3 Morphology of the tumors and distribution of the biomarker expressions in the tumor tissues (H&E and IHC staining)
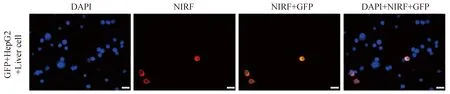
图5 近红外荧光染料特异性识别肿瘤细胞(×400)Fig.5 Tumor cells are specifically labeled by the NIRF dye IR-783
本研究选择的PDX模型是将人的肝癌组织直接移植于小鼠体内的肾包膜下,这种模型保留了肝癌生长的三维环境,与原发肿瘤具有较高的相似性,是一种理想的肿瘤模型[13]。结果显示IR-783可以特异性的集聚于肿瘤部位,并且BIL与NIRF强度均随肿瘤体积的增大而增强,二者具有较好的相关性,从而验证了IR-783用于NIRF成像的可靠性;在肾包膜移植的PDX模型体内注射IR-783,染料特异性的集聚在肿瘤部位,离体成像显示肿瘤部位具有较强的荧光。将切片进行H&E染色,NIRF荧光成像和IHC染色,结果显示NIRF染料集聚在肿瘤部位,并且能够清晰的识别肿瘤边缘,这可能成为肿瘤外科手术良好的监测方法;通过免疫组织化学方法分别检测肿瘤组织中CEA,AFP,HIF1α和OATP3A1的表达,结果显示,肿瘤组织中的这4种生物标志物表达均呈强阳性,其中,CEA主要用于消化道肿瘤的检测,而AFP是诊断原发性肝癌的特异性标志物,联合二者结果可有效提高原发性肝癌的确诊率,说明上述肿瘤组织不仅在病理形态上与病人保持一致,同时也维持了原发肿瘤的分子特征;肿瘤组织中HIF1α和OATP3A1的表达比正常组织明显增高,根据文献报道,通过HIF1α/OATPs信号分子的调控促进了前列腺癌细胞与前例腺癌移植模型肿瘤部位对该染料的吸收,低氧和OATPs的表达是肿瘤细胞广泛存在的现象,因此我们推测可以将IR-783广泛应用于其它类型肿瘤细胞的特异性识别;同时,文献报道,IR-783集聚于肿瘤部位的机制与HIF1α/OATPs信号分子轴有关,在低氧的条件下肿瘤细胞中染料的吸收显著增加,相反,通过沉寂肿瘤细胞中HIF1α的表达,阻止了低氧的诱导,与常氧条件下相比IR-783的吸收没有明显增加;OATPs通过HIF1α的诱导调节将IR-783转运至细胞,结合已有文献的报道,HIF1α和OATP3A1很可能与IR-783染料集聚在肿瘤细胞中有关[1, 14]。体外实验显示IR-783特异性聚集于肿瘤细胞,而在正常细胞中少有结合,说明这种染料可以特异性的识别肿瘤细胞[15]。进一步研究发现NIRF染料主要集聚在肿瘤细胞的线粒体与溶酶体中,由于线粒体和溶酶体与细胞的衰老、死亡等密切相关,结合NIRF染料对肿瘤的靶向性,很可能这种染料经过修饰,联合药物后可成为一种治疗肿瘤的新工具[9, 10, 16]。
[1] Wu JB, Shao C, Li X, et al. Near-infrared fluorescence imaging of cancer mediated by tumor hypoxia and HIF1α/OATPs signaling axis[J]. Biomaterials, 2014, 35(28): 8175-8185.
[2] Tsai EH, Bentz BZ, Chelvam V, et al. In vivo mouse fluorescence imaging for folate-targeted delivery and release kinetics[J]. Biomed Opt Express, 2014, 5(8): 2662-2678.
[3] Abran M, Stähli BE, Merlet N, et al. Validating a bimodal intravascular ultrasound (IVUS) and near-infrared fluorescence (NIRF) catheter for atherosclerotic plaque detection in rabbits[J]. Biomed Opt Express, 2015, 6(10): 3989-3999.
[4] 赵宁宁,张彩勤,赵勇,等.近红外荧光染料在胃癌人源性肿瘤组织移植模型研究中的应用 [J]. 中国实验动物学报,2015, 12(6): 643-647.
[5] Keating JJ, Nims S, Venegas O, et al. Intraoperative imaging identifies thymoma margins following neoadjuvant chemotherapy[J]. Oncotarget, 2016, 7(3): 3059-3067.
[6] James NS, Ohulchanskyy TY, Chen Y, et al. Comparative tumor imaging and PDT efficacy of HPPH conjugated in the mono- and di-forms to various polymethine cyanine dyes: part-2[J]. Theranostics, 2013, 3(9): 703-718.
[7] 张丹,李远,徐泽强,等. 外周血肝癌标志物在肝癌诊断中的价值[J].中华实用诊断与治疗杂志, 2011, 25(8): 742-744.
[8] Yhee JY, Kim SA, Koo H, et al. Optical imaging of cancer-related proteases using near-infrared fluorescence matrix metalloproteinase-sensitive and cathepsin B-sensitive probes[J]. Theranostics, 2012, 2(2): 179-189.
[9] Yu Z, Sun Q, Pan W, et al. A near-infrared triggered nanophotosensitizer inducing domino effect on mitochondrial reactive oxygen species burst for cancer therapy[J]. ACS Nano, 2015, 9(11): 11064-11074.
[10] Wan Q, Chen S, Shi W, et al. Lysosomal pH rise during heat shock monitored by a lysosome-targeting near-infrared ratiometric fluorescent probe[J].AngewChemInt Ed Engl, 2014, 53(41): 10916-10920.
[11] Yue C, Zhang C, Alfranca G, et al. Near-infrared light triggered ROS-activated theranostic platform based on Ce6-CPT-UCNPs for simultaneous fluorescence imaging and chemo-photodynamic combined therapy[J]. Theranostics, 2016, 6(4): 456-469.
[12] Chen F, Nayak TR, Goel S, et al. In vivo tumor vasculature targeted PET/NIRF imaging with TRC105(Fab)-conjugated, dual-labeled mesoporous silica nanoparticles[J].Mol Pharm, 2014, 11(11): 4007-4014.
[13] Einarsdottir BO, Bagge RO, Bhadury J, et al. Melanoma patient-derived xenografts accurately model the disease and develop fast enough to guide treatment decisions[J]. Oncotarget, 2014, 5(20): 9609-9618.
[14] Wlcek K1, Svoboda M, Riha J, et al. The analysis of organic anion transporting polypeptide (OATP) mRNA and protein patterns in primary and metastatic liver cancer[J]. Cancer BiolTher, 2011, 11(9): 801-811.
[15] 郑明彬,郑翠芳,龚萍,等. 吲哚菁绿纳米颗粒在癌症诊断和治疗中的应用[J]. 生物化学与生物物理进展, 2013, 40(10): 971-976.
[16] Bunschoten A, Buckle T, Kuil J, et al. Targeted non-covalent self-assembled nanoparticles based on human serum albumin[J]. Biomaterials, 2012, 33(3): 867-875.
Application of targeting near-infrared fluorescence dye in the study of liver cancer models
ZHAO Ning-ning, ZHANG Cai-qin, ZHAO Yong, TAN Deng-xu, SHI Chang-hong*
(Laboratory Animal Center, the Fourth Military Medical University, Xi’an 710032, China)
Objective To study the application of hepatamethine cyanine near-infrared fluorescence (NIRF) dye IR-783 in the mouse models of human liver cancer exenografts, and to analyze the molecular mechanisms of the NIRF dye targeting tumor cells. Methods Luciferase-tagged HepG2 cells were inoculated subcutaneously into the nude mice. We detected the correlation of NIRF intensity and bioluminescence intensity (BIL) in the tumor region. Patient-derived xenograft (PDX) model was established in mouse by subrenal capsular implantation of clinic liver cancer specimen. After injecting the IR-783 dye, the interface between mouse kidney and the xenograft tumors was confirmed by NIRF analysis, and the tumor tissue in kidney was observed by pathology using H&E staining. The expression of CEA, AFP, HIF1α and OATP3A1 in the liver cancer tissue was detected by immunohistochemical staining. The intracellular retention of NIRF dyes was observed under fluorescence microscope after adding Mito Tracker or Lyso Tracker into cultured HepG2 cells. We added IR-783 in a co-culture system of HCCs and normal liver cells to test the specifical identification ability of IR-783 of the liver cancer cells. Results There was a good correlation between NIRF intensity and BIL intensity of the subcutaneous liver cancer xenograft region in nude mice. The margin between the mouse kidney tissue and xenograft tumors was clearly identified by IR-783.Compared with normal kidney tissue, CEA, HIF1α, OATP3A1 and AFP were highly expressed in the tumor region detected by IHC staining. The NIRF dye IR-783 was mainly accumulated in the mitochondria and lysosomes of cancer cells. GFP-tagged HepG2 cells could be recognized directly, whereas red fluorescence was not detected in normal liver cells. Conclusions IR-783 is a novel near-infrared fluorescent dye with tumor targeting and imaging properties. Its targeting ability may be related to the high expression of HIF1α and OATP3A1 in the liver cancer tissue.
Near-infrared fluorescence dye; Liver cancer models; Hypoxia-inducible factor1α; Organic anion-transporting peptides
国家自然科学基金项目(31572340);军队实验动物专项课题(SYDW2014-002)。
赵宁宁(1985-),女,硕士,讲师,研究方向:人体肿瘤分子影像。
师长宏,教授,主要从事疾病动物模型研究。E-mail: changhong@fmmu.eu.cn
R-33
A
1671-7856(2017) 03-0008-06
10.3969.j.issn.1671-7856. 2017.03.002
2016-08-19

