日本鳗鲡TLR21基因的鉴定、免疫应答与启动子分析
李春艳黄 贝熊 静彭喜霞梁 英聂 品黄文树,
(1. 集美大学水产学院, 厦门 361021; 2. 鳗鲡现代产业技术教育部工程研究中心, 厦门 361021; 3. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 4. 福建省海洋生物资源开发利用协同创新中心, 厦门 361005)
日本鳗鲡TLR21基因的鉴定、免疫应答与启动子分析
李春艳1,2黄 贝1,2熊 静1,2彭喜霞1,2梁 英1,2聂 品1,3黄文树1,2,4
(1. 集美大学水产学院, 厦门 361021; 2. 鳗鲡现代产业技术教育部工程研究中心, 厦门 361021; 3. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 4. 福建省海洋生物资源开发利用协同创新中心, 厦门 361005)
为研究TLR21 (Toll like receptor 21)在低等脊椎动物中的功能及表达调控机制, 我们扩增获得了日本鳗鲡TLR21 (AjTLR21)cDNA序列, 其编码的蛋白具有TLR家族的共同特征。AjTLR21基因结构与其他鱼类和两栖类TLR21相同, 由单个外显子编码。荧光定量结果显示, AjTLR21在血液、鳃、脾脏、中肾等11个组织/器官中转录表达, 其中在血液中表达量最高。经Poly I:C诱导后8h, AjTLR21在脾脏和中肾中的表达量显著性上调;诱导后16h, AjTLR21在血液、鳃、肠和脾脏中的表达量显著性上调(P<0.05)。双荧光素酶报告基因结果显示,在AjTLR21 5′上游调控序列-1179 bp到+117 bp存在Poly I:C调节的正调控元件。经Edwardsiella tarda诱导后16h和72h, AjTLR21分别在血液和中肾组织的表达量显著性上调, 表明AjTLR21同时也参与了抗细菌免疫应答,其在机体免疫系统中的功能具有多样性。研究对于理解日本鳗鲡AjTLR21的免疫学功能具有重要的理论意义和应用价值。
日本鳗鲡; TLR21; 基因表达; 免疫应答; 启动子
天然免疫系统是机体抵御病原入侵的第一道防线, Toll样受体(Toll like receptors, TLRs)是天然免疫系统中的重要成分之一[1]。TLRs是可识别入侵微生物的病原相关分子模式(Pathogen associated molecular patterns, PAMPs), 包括细菌的脂多糖、脂肽、肽聚糖、糖脂、鞭毛蛋白、核苷酸等成分;真菌的酵母聚糖, 磷脂甘露糖、甘露聚糖等成分;寄生虫的甘油肌磷脂、疟原虫色素、弓形体胶原蛋白样分子(Profilin-like molecule)等成分; 病毒DNA、双链/单链RNA分子、外壳蛋白等[2]。TLRs是Ⅰ型跨膜蛋白, 其胞外区为多个富含亮氨酸的重复序列(Leucine-rich repeat, LRR), 主要行使识别功能。胞内区含TIR结构域(Toll-IL-1 receptor domain, TIR结构域), 可募集同样含有TIR结构域的衔接分子如髓样分化因子88 (Myeloid differentiation primary response gene 88, MyD88)或β干扰素TIR结构域衔接蛋白[Toll/interleukin 1 receptor (TIR)-domain-containing adaptor protein inducing interferonβ, TRIF]等, 通过级联反应, 将信号向下游传递, 进而调节靶基因的表达[3]。
迄今为止, 在人类中共克隆获得10个TLR基因(TLR1—10, 其中TLR11为假基因)[4], 而硬骨鱼类中目前已鉴定获得了至少17种不同的TLR。其中, TLR14及TLR19—23、TLR25、TLR26是首先在硬骨鱼类中被克隆、鉴定[5,6]。TLR21基因最早发现于河豚中, 且在人和小鼠基因组中未能发现其直系同源物, 一度被认为是一个鱼类特有的TLR基因[7]。此后, 研究人员相继从爪蟾[8]和红原鸡[9,10]中鉴定获得了该基因。鸟类TLR21定位于内质网和内溶酶体, 其功能与哺乳动物TLR9类似, 参与识别病原微生物的CpG寡脱氧核苷酸。由于缺乏鸟类TLR9基因, TLR21被认为是TLR9的替代者[10], 有趣的是,鱼类同时具有中TLR9和TLR21基因[11]。斑马鱼TLR21和TLR9具有相似的表达模式, 在胚胎发育早期就能检测到其表达。在成鱼中, TLR21和TLR9大量表达于免疫相关组织中, 包括肠、脾脏和肾脏[12]。斑马鱼TLR9广泛识别不同基序的CpG-ODN。相比于其他CpG-ODN, 包含GACGTT或AACGTT基序的CpG-ODN可显著上调TLR9介导的NF-κB的活化, 而斑马鱼TLR21则对包含GTCGTT基序的CpGODN的响应最为强烈[12]。已有研究表明, 鱼类TLR21基因的表达具有多样性。斑点叉尾TLR21基因广泛表达于除肌肉外的各组织器官中[13]; 斜带石斑鱼TLR21基因主要表达于头肾、中肾、脾脏和心脏中, 刺激隐核虫感染后, 斜带石斑鱼的皮肤和鳃组织中TLR21基因表达量显著上调[14]。牙鲆TLR21基因主要表达于鳃和脾脏中, 在血液、心脏, 肌肉中的表达量较低, 而在头肾组织中表达量最低。鳗弧菌(Vibrio anguillarum)、CpG ODN和Poly I:C均可上调牙鲆TLR21基因的表达[15]。
鳗鲡(Anguilla spp.)是我国重要的养殖鱼类, 特别是近十年来, 鳗鲡养殖发展迅速, 2014年, 我国鳗鲡产量近2.2×108kg, 主要集中在福建、广东和江西三省[16]。由于养殖所需鳗苗完全依靠天然捕捞,在鳗苗资源逐年下降的背景下, 病害防治在鳗鲡养殖中的地位尤显重要。目前, 有关鳗鲡免疫反应机理的研究较为匮乏, 对于鳗鲡免疫系统如何识别病原, 及针对所识别病原引发的免疫反应的分子机理未见报道。本研究首次克隆获得了日本鳗鲡TLR21基因, 并对其基因结构、在不同病原感染状态下的表达规律以及启动子区域进行了初步分析。本研究结果有助于深入了解鳗鲡的抗病机制, 奠定其病害防治的免疫学基础。另一方面, 对不同进化类群鱼类的免疫系统的研究, 可丰富鱼类先天免疫的理论, 有助于认识脊椎动物免疫系统的进化规律。
1 材料与方法
1.1 实验动物
日本鳗鲡(203±53) g购于福建省集美大学水产养殖基地, 实验前暂养2周, 养殖水温 (28±2)℃。采样前用0.05%的丁香酚麻醉。采集血液、鳃、心脏、肝脏、肠、胃、脾脏、中肾、鳔、皮肤和性腺用以研究AjTLR21在不同组织中的分布。免疫刺激实验分组设置: 设PBS对照组、Poly I:C刺激组(1 mg/100 g鱼, Sigma)、LPS刺激组(1 mg/100 g鱼, Sigma)、迟缓爱德华氏菌(Edwardsiella tarda)刺激组(2×107cfu/100 g鱼)。分别在腹腔注射8h、16h、 24h和72h后采样, 每组每个时间点随机取鳗鲡8尾,每尾鱼分别采集上述组织/器官用以研究免疫刺激后AjTLR21的基因表达变化。采集血液及组织/器官样品的处理参考本实验室以前的研究[17]。
1.2 基因组DNA、RNA提取以及cDNA合成
采用MiniBEST Universal Genomic DNA Extraction Kit Ver.4.0试剂盒(TaKaRa, 日本)提取日本鳗鲡基因组DNA。总RNA提取参照Trizol®reagent试剂盒说明书。利用琼脂糖凝胶电泳法检测总RNA/DNA的完整性, 采用分光光度计NanoDrop 2000 (Thermo, 美国)检测RNA或DNA的浓度及纯度。
脾脏总RNA经RNase-free DNase Ⅰ (New England Biolabs Inc, 美国)处理后, 利用反转录试剂盒SMARTerTMRACE cDNA Amplification Kit (Clontech, 美国)合成第一链, 制备RACE PCR模板。
参照GoScripTMReverse Transcription System反转录试剂盒(Promega, 美国)说明书, 取4 μg各组织总RNA进行反转录用以制备荧光定量模板。所制备模板用1×TE buffer稀释后保存于-20℃备用。
1.3 日本鳗鲡TLR21 cDNA、基因组以及启动子序列克隆
以斑马鱼TLR21基因作为种子序列, 对日本鳗鲡基因组数据(GenBank登录号: AVPY00000000.1)进行比对, 利用Primer Premier 6.0 软件对所获得最佳匹配序列的潜在编码区设计引物(表 1)。以脾脏cDNA为模板进行PCR扩增。反应体系为: cDNA 1 μL, 上下游引物(表 1, 10 μmol/L)各1 μL, Taq DNA聚合酶(2.5 U/μL, HSTMKit, 东盛生物)0.25 μL, 2 ×HSTMReaction Mix 12.5 μL, 补充无菌水至总体积为25 μL, 反应条件为: 94℃预变性3min后; 94℃变性30s, 56℃退火30s, 72℃延伸 2min, 运行35个循环; 72℃延伸10min。根据获得的中间片段设计RACE引物, 参照SMARTer试剂盒说明书进行PCR,获得AjTLR21 cDNA全长。PCR反应条件为: 94℃预变性3min后; 94℃变性30s, 62℃退火30s, 72℃延伸2min, 运行7个循环; 94℃ 变性30s, 60℃ 退火30s, 72℃ 延伸2min, 18个循环; 72℃延伸10min。从第一轮PCR扩增产物中取1 μL做为第二轮PCR反应的模板, 反应条件同上, PCR反应运行35个循环。
以肌肉基因组DNA为模板, 引物Ex_TLR21_F和Ex_TLR21_R (表 1)进行扩增AjTLR21基因组全长。PCR反应体系: 基因组DNA 1 μL, 上下游引物(10 μmol/L)各1 μL, LA Taq DNA聚合酶(5 U/μL, TaKaRa, 日本)0.25 μL, 10 × LA PCR Buffer Ⅱ(Mg2+Plus) (TakaRa, 日本)2.5 μL, dNTP Mixture (2.5 mmol/L)4 μL, 补充无菌水至总体积为25 μL。反应条件为: 94℃ 预变性3min; 94℃ 变性30s, 64℃退火30s, 72℃ 延伸2min, 35个循环, 72℃延伸10min。
根据本地比对到的基因组序列, 设计5′侧翼序列引物, 以肌肉基因组DNA为模板进行PCR扩增。利用JASPAR数据库(http://jaspar.genereg.net/)分析其潜在的转录因子结合位点。根据位点设计引物(表 1), 构建全长及5个缺失表达载体并分别命名为pGL-3-TLR21P1- pGL-3-TLR21P6。
1.4 AjTLR21的转录表达研究
荧光定量PCR在Lightcycler 480 Ⅱ PCR仪(Roche, 德国)上进行。参照Lightcycler 480 SYBR Green I试剂盒(Roche, 德国)说明设置PCR反应体系, 体系如下: cDNA模板4 μL, 正反向引物(qTLR21F/ qTLR21R, 10 μmol/L)各0.25 μL, LightCycler 480 SYBR Green I Master (2×) 10 μL, 补充水至20 μL。反应条件: 95℃变性20 s, 58℃退火 20s, 72℃延伸25s, 80℃采集荧光信号, 运行40个循环。反应结束后分析扩增产物的溶解曲线, 检验扩增产物的特异性。
以β-actin作为内参基因。梯度稀释已知拷贝数的AjTLR21和β-actin质粒样品, 与组织/器官样品同时进行PCR扩增, 绘制标准曲线, 计算扩增的浓度以及引物扩增效率。AjTLR21基因表达量用βactin进行校准; 刺激前后AjTLR21基因表达倍数变化是根据同一时间点(实验组AjTLR21基因表达量)/ (对照组AjTLR21基因表达量)来表示[18]。
数据用Excel软件和DPS软件进行计算, 用单因素方差分析法和Student t test分析不同组织样品和免疫原刺激样品间AjTLR21表达量差异。P<0.05表示差异显著, P<0.01和P<0.001表示差异极显著。利用GraphPad.Prism.v5.0软件进行作图。
1.5 双荧光素酶报告基因分析
将回收纯化后的PCR产物TLR21P1-TLR21P6和荧光素酶报告基因pGL-3-Basic载体(Promega公司)经过BglⅡ/KpnⅠ双酶切。酶切产物进行回收纯化后, 利用T4 DNA连接酶将目的片段和载体连接, 构建获得AjTLR21启动子荧光素酶报告基因载体, 并将其分别命名为pGL-3-TLR21P1 (-1875/+117)、pGL-3-TLR21P2 (-1555/+117)、pG-L3-TLR21P3 (-1179/+117)、pGL-3-TLR21P4 (-907/+117)、pGL-3-TLR21P5 (-635/+117)、pGL-3-TLR21P6 (-332/+ 117)。
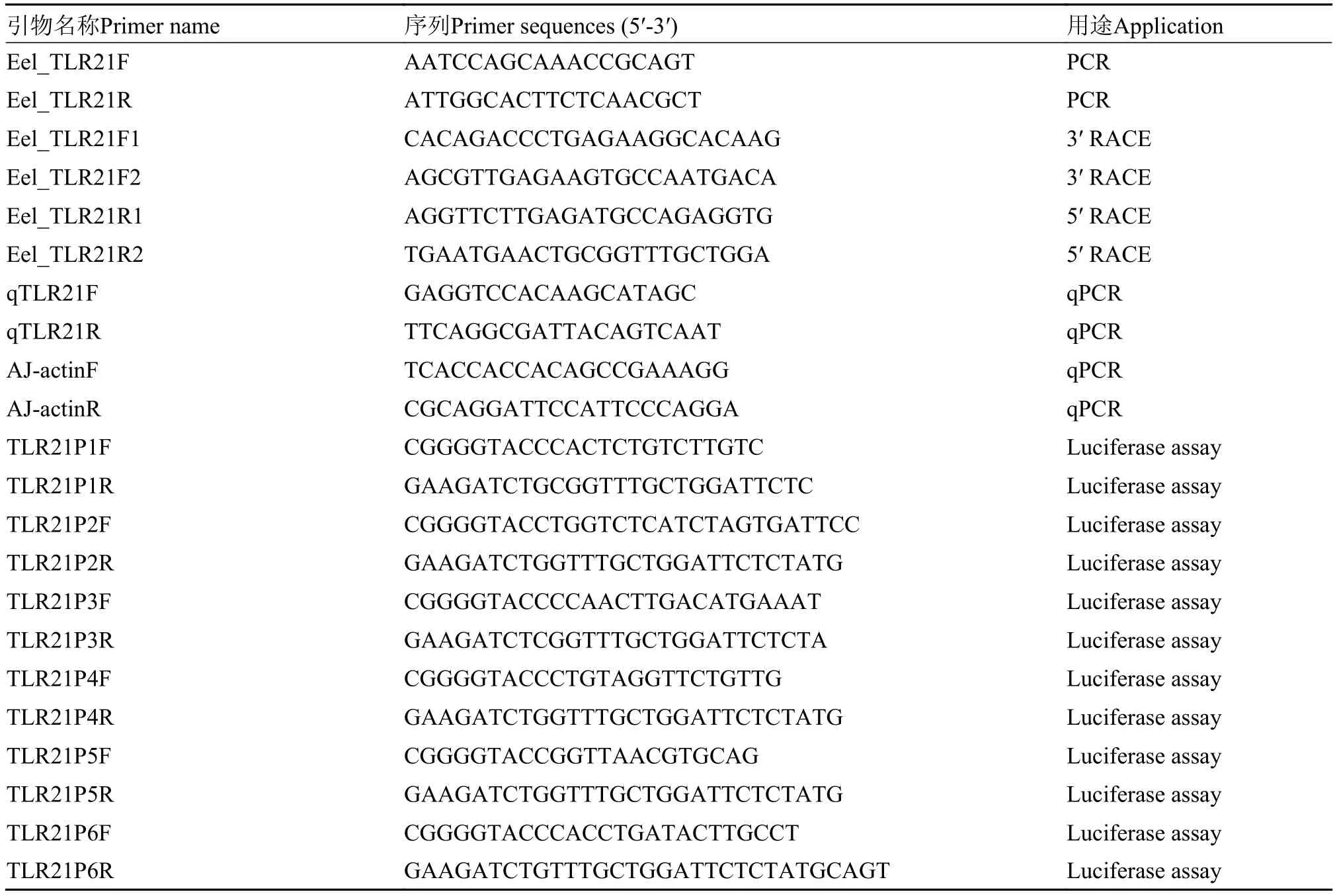
表 1 所用引物序列Tab. 1 Primers used in the study
用Endo-free Plasmid Mini Kit Ⅱ试剂盒(Omega, 美国)提取质粒。细胞转染利用Lipofectamine3000试剂盒(Invitrogen, 美国), 按照产品说明书进行转染。转染前1天, 细胞以1×104/孔的密度接种于24孔板上。HEK293在含10%胎牛血清、100 Units/mL青霉素和100 μg/mL链霉素的高糖型DMEM培养基(Gibco, 美国)中培养, 培养条件为37℃、5% CO2, 细胞用0.25%胰蛋白酶-EDTA (Gibco, 美国)进行消化传代。转染时, pGL-3-TLR21P1-pGL-3-TLR21P6或pGL-3 Basic与pRL-TK共转染HEK293细胞, 其中pRL-TK作为内参质粒。用Promega公司的Dual-Luciferase Reporter Assay System (E1910)进行样品荧光素酶活性检测。
1.6 序列生物信息学分析

图 1 日本鳗鲡TLR21和其他脊椎动物TLR21基因结构及TIR结构域的比较Fig. 1 Comparative analysis in gene structure and TIR domain of TLR21 in vertebrates多重比对灰色部分表示TIR结构域上3个保守基序: Box1-Box3在序列上方注释; 序列上方的箭头表示TIR结构域二级结构中的β折叠,矩形框表示α螺旋The grey parts in the alignments indicate three conserved motifs of TIR domain, Box1-Box3 that annotated above the sequence. The arrows above the sequence represent β folding structure of TIR domain, and the boxes represent α helix
如图 1, 用NCBI网站中的Blast (http://blast.ncbi. nlm.nih.gov/Blast.cgi)进行序列查找, 利用ExPASy的翻译工具(http://web.expasy.org/translate/)推导AjTLR21的氨基酸序列, ExPASy (http://web.expasy. org/compute_pi/)预测分子量和pI值, 用SignalP 4.1 Server程序(http://www.cbs.dtu.dk/services/SignalP/)分析信号肽, 用SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi)预测LRRs、TIR结构域和跨膜区; Phyre2程序(http://www.sbg.bio.ic.ac.uk/ phyre2/html/page.cgi?id=index)预测AjTLR21 TIR结构域的二级结构。利用DNAman软件对AjTLR21的TIR结构域进行氨基酸序列的多重比对, 应用MEAG6.0软件, 采用邻位相接法(NJ法)构建系统发育树。其他鱼类基因组数据来源于Ensembl数据库(http:// asia.ensembl.org/index.html)。
2 结果
2.1 日本鳗鲡TLR21基因序列分析
日本鳗鲡TLR21cDNA全长为4013 bp (AjTLR 21 GenBank登录号: KU950320), 其中开放阅读框(ORF)2937 bp, 5′ UTR 447 bp, 3′ UTR 629 bp。ORF编码978个氨基酸, 其分子量为112.60 kD, pI为8.92。基因结构分析结果显示, AjTLR21的结构类似于其他鱼类TLR21, 由单个外显子编码。氨基酸序列结构分析结果显示, AjTLR21由胞外区、跨膜区和胞内区构成, 其胞外区含有一个信号肽、14个LRRs, 各LRR都包含“LxxLxLxxN”这一共同基序;跨膜区为单次跨膜, 属于Ⅰ型跨膜蛋白; 胞内区含有TIR结构域, 并含有3个典型基序: Box1 (FDAFISY), Box2 (LCY/LxxRDxLPG), Box3 (FW)(图 1)。序列同源性比对分析结果显示AjTLR21成熟肽的氨基酸序列与大西洋鲑相似性达68.2%; 其次为条石鲷和蟾胡鲶, 分别为65.74%和65.33% (表 2)。AjTLR21的TIR结构域也是与大西洋鲑相似性最高, 其次为蟾胡鲶和斑点叉尾。将硬骨鱼类TLR21和其他脊椎动物TLRs氨基酸序列用MEGA6.0软件构建了NJ系统进化树(Jones Taylor Thornton model, JTT模型)。系统进化树的拓扑结构表明: 脊椎动物TLR21聚为一枝, 然后再与鱼类TLR19、TLR20、TLR22、TLR23、TLR26以及小鼠TLR11聚为一枝, 并与小鼠其他TLR分开(图 2)。
2.2 AjTLR21基因在不同组织中的分布
定量结果显示, AjTLR21在所检测的不同组织/器官中均有转录表达, 其中血液中的表达量最高,其平均表达量是β-actin的0.13倍(图 3), 性腺中的表达量最低。

表 2 各物种TLR21的序列信息和相似性Tab. 2 Sequence information and similarity of TLR21

图 2 鱼类TLR21及脊椎动物TLRs系统进化分析Fig. 2 Phylogenetic analysis of teleost TLR21 and vertebrate TLRs节点上的数字表示为bootstrap的置信度。所用序列的Gen-Bank登录号如下: 斜带石斑鱼TLR21 AEK49148.1; 条石鲷TLR21 AIT52504.1; 牙鲆TLR21 AFW04263.1; 罗非鱼TLR21 AHK 13949.1; 红鳍东方鲀TLR21 AAW69371.1; TLR22 AAW69372.1; TLR23 AAW70378.1; 蟾胡鲶TLR21 AGM39445.1; 草鱼TLR20 AHH85805.1; TLR21 AGM21642.1; 斑马鱼TLR21 NP_0011-86264.1; TLR22 AAI63527.1; 日本鳗鲡TLR21 KU950320; 红原鸡TLR21 NP_001025729.1; 斑点叉尾TLR19 AEI59675.1; TLR20.1 AEI59676.1; TLR22 AEI59679.1; TLR26 AEI59681.1;大西洋鲑TLR19 CDH93609.2; TLR20a CDH93610.2; TLR20d CDH93613.1; TLR21 CDH93614.1; 鲤TLR20 AHN49762.1; 小鼠TLR1 AAG37302.1; TLR2 EDL15415.1; TLR3 AAH99937.1; TLR4 EDL31078.1; TLR5 AAI25248.1; TLR6 BAA78632.1; TLR7 AAI32386.1; TLR8 EDL40710.1; TLR9 EDL21125.1; TLR11 AAI09165.1Bootstrap values are indicated at nodes. GenBank accession numbers are as follows: E. coioides TLR21 AEK49148.1; O. fasciatus TLR21 AIT52504.1; P. olivaceus TLR21 AFW04263.1; O. niloticus TLR21 AHK13949.1; T. rubripes TLR21 AAW69371.1; TLR22 AAW69372.1; TLR23 AAW70378.1; C. batrachus TLR21 AGM39445.1; C. idella TLR20 AHH85805.1; TLR21 AGM21642.1; D. rerio TLR21 NP_001186264.1; TLR22 AAI63527.1; A. japonica TLR21 KU950320; G. gallus TLR21 NP_001025729.1; I. punctatus TLR19 AEI59675.1; TLR20.1 AEI59676.1; TLR22 AEI59679.1; TLR26 AEI59681.1; S. salar TLR19 CDH93609.2; TLR20a CDH93610.2; TLR20d CDH93613.1; TLR21 CDH93614.1; C. carpio TLR20 AHN49762.1; M. musculus TLR1 AAG37302.1; TLR2 EDL15415.1; TLR3 AAH99937.1; TLR4 EDL31078.1; TLR5 AAI25248.1; TLR6 BAA78632.1; TLR7 AAI32386.1; TLR8 EDL40710.1; TLR9 EDL21125.1; TLR11 AAI09165.1
2.3 免疫刺激后AjTLR21的基因表达变化
日本鳗鲡在感染迟缓爱德华氏菌后, 其血液中的AjTLR21的表达量在16h上调7.66倍(P<0.05)。而感染72h后, 其中肾组织中AjTLR21的表达量上调5.83倍(P<0.01)(图 4)。Poly I:C能显著诱导AjTLR21的上调表达。在刺激8h后, 脾脏中AjTLR21的表达量极显著性上调(P<0.01)并达到最高水平, 为对照组的6.44倍, 随后开始下降, 在16h后, Poly I:C刺激组的表达量为对照组的。Poly I:C刺激后16h, AjTLR21在血液、皮肤、鳃、肠和肾中的表达量显著上调,分别为对照组的5.76、3.32、5.47、5.83和4.40倍(图 5)。
2.4 AjTLR21启动子活性分析
利用生物信息学软件对我们所扩增得到的AjTLR21 5′侧翼序列中所包含的潜在的转录因子结合位点进行分析, 发现其中含有C/EBP-β、AP-1、STAT 、NF-κB、IRF、Sp-1等转录因子结合位点(图 6A)。对所获得的TLR21 5′调控序列进行删除突变。将截短后的片段与载体pGL-3 Basic相连, 构建重组质粒, 即pGL-3-TLR21P1- pGL-3-TLR 21P6。将重组质粒转染到HEK293细胞中, 利用双荧光素酶报告基因系统检测启动子活性。结果显示, pGL-3-TLR21P1-pGL-3-TLR21P5的荧光素酶活性均显著高于对照组, 分别为对照组的2.28、2.81、5.51、2.79、4.06倍(P<0.01), 其中pGL-3-TLR21P3的荧光素酶活性最高, 推测在该区域(-635/-332)具有控制AjTLR21启动子转录活性的关键片段(图 6B)。此外, 在Poly I:C(50 μg/mL)刺激下, 转染pGL-3-TLR21P3的HEK293细胞的荧光素酶活性升高, 为对照组的2.59倍(图 6C)。
3 讨论
本研究首次从日本鳗鲡中克隆得到了TLR21基因, 并对其基因结构、表达模式和启动子活性等进行了初步的研究。AjTLR21基因结构与已报道的硬骨鱼类、两栖类TLR21基因结构类似, 其编码区无内含子[8,11,13,14,19,20]。而鸟类TLR21基因由两个外显子构成[21]。序列相似性比对分析结果显示脊椎动物TLR21的胞外区的相似性为58%—63%, 跨膜区的相似性为44%—81%, 胞内区TIR结构域的相似性为64%—91%。这表明相比于其胞外区和跨膜区, TLR21的TIR结构域在脊椎动物进化的过程中更为保守。已有的研究揭示, TLR基因的胞外区主要由2—25个LRR结构域构成, 负责识别病原相关分子模式[22]。AjTLR21胞外区含有14个LRR重复序列, 除第6个LRR外, 其LRR重复序列中都含有典型的LxxLxLxxN基序, LRR6中第三位的亮氨酸被疏水性的苯丙氨酸所替代。在LxxLxLxxN基序中, 其侧链中3个位置十分保守的亮氨酸用以形成疏水性核心, 天冬氨酸则可保持蛋白整体结构。其中亮氨酸偶有被疏水性氨基酸, 如缬氨酸、异亮氨酸和苯丙氨酸所替代, 末端的天冬氨酸可被苏氨酸、丝氨酸和半胱氨酸所替代[4]。AjTLR21胞内段的TIR结构域含有3个保守的基序, Box1-Box3, 其中Box1与Box2形成β折叠, 主要参与信号转导; Box3则形成α螺旋, 可与细胞骨架的相互作用, 介导受体在细胞内的定位[23,24]。位于Box2中的脯氨酸对TLR分子的信号转导至关重要, 突变该位点的小鼠TLR4对LPS的刺激无应答[23,25]。斑马鱼TLR21 TIR结构域Box2的C827、R831和L835突变后, 对CpGODN的刺激无应答[12]。对鱼类TLR21序列比对结果显示, 日本鳗鲡TLR21分子的TIR结构域都具有这些保守的基序, 表明其信号转导机制可能类似于斑马鱼TLR21和其他脊椎动物TLRs。

图 3 TLR21基因在健康日本鳗鲡不同组织/器官中相对表达量Fig. 3 Expression of TLR21 in different tissues/organs from Japanese eelβ-actin为内参基因, 误差线表示平均数±SEM (N≥3)β-actin served as an internal control. Vertical bars indicating the mean±SEM (N≥3)

图 4 日本鳗鲡TLR21在迟缓爱德华氏菌刺激后的表达变化Fig. 4 Expression of AjTLR21 following the E. tarda stimulation in Japanese eel检测腹腔注射迟缓爱德华菌8、16、24和72h后日本鳗鲡的血液、皮肤、鳃、肠、脾脏和中肾组织中AjTLR21表达量; 以β-actin为内参基因; 星号表示诱导组和对照组存在显著性差异(*P<0.05, **P<0.01); 误差线表示平均数±SEM; N≥4The fish were injected intraperitoneally with E. tarda and tissues, such as blood, skin, gill, intestine spleen and kidney, were collected at 8, 16, 24 and 72 hour post injection for expression analysis. β-actin served as an internal control. The asterisk (*) indicates the significant difference between induced and control group (*P<0.05, **P<0.01). Vertical bars represented the mean±SEM (N≥4)

图 5 日本鳗鲡TLR21在Poly I:C刺激后的表达变化Fig. 5 Expression of AjTLR21 following the Poly I:C stimulation in Japanese eel检测腹腔注射Poly I:C 8、16、24和72h后日本鳗鲡的血液、皮肤、鳃、肠、脾脏和中肾组织中AjTLR21表达量; 以β-actin 为内参基因; 星号表示诱导组和对照组存在显著性差异(*P<0.05, **P<0.01, ***P<0.001)。误差线表示平均数±SEM; N≥4The fish were injected intraperitoneally with Poly I:C and tissues, such as blood, skin, gill, intestine spleen and kidney, were collected at 8, 16, 24 and 72 hour post injection for expression analysis. β-actin served as an internal control. The asterisk (*) indicates the significant difference between induced and control group (*P<0.05, **P<0.01, ***P<0.001). Vertical bars represented the mean±SEM (N≥4)

图 6 AjTLR21启动子活性分析Fig. 6 Analysis of AjTLR21 promoter activityA. AjTLR21的5′调控序列的潜在转录因子结合位点及报告基因构建模式图, pGL-3-TLR21P1 (-1875/+117)、pGL-3-TLR21P2(-1555/+ 117)、pGL-3-TLR21P3(-1179/+117)、pGL-3-TLR21P4(-907/+117)、pGL-3-TLR21P5(-635/+117)、pGL-3-TLR21P6(-332/+117); B.在HEK293细胞中转染AjTLR21启动子缺失质粒; C. 用Poly I:C刺激HEK293细胞后的pGL-3-TLR21P3荧光素酶活性的变化。以pRLTK为内参, 误差线表示平均数±SEM (N=4); 星号表示存在显著性差异(***P<0.001)A. Schematic representation of AjTLR21 promoter construct and serial deletion constructs, pGL-3-TLR21P1 (-1875/+117, pGL-3-TLR21P2(-1555/+117), pGL-3-TLR21P3 (-1179/+117), pGL-3-TLR21P4 (-907/+117), pGL-3-TLR21P5 (-635/+117), pGL-3-TLR21P6 (-332/+117); B. HEK293 cells were cotransfected with the serial promoter constructs and pRL-TK which served as an internal control. C. Luciferase activity of pGL-3-TLR21P3 in HEK293 cells after stimulated by Poly I:C. pRL-TK was performed as an internal control. Vertical bars represented the mean±SEM (N=4). Asterisks (*) above each bar indicate significant difference (***P<0.001)
已有的研究表明, TLR21在不同硬骨鱼中有不同表达模式。TLR21主要在大西洋鳕的肾脏、肝脏、鳃和精巢中表达[20]; 而草鱼TLR21则在皮肤组织中表达量最高, 其次为脾脏和肠[26]。牙鲆TLR21在鳃和皮肤组织中表达量最高, 在头肾组织中表达量最低[15]。大西洋鲑TLR21主要在脾脏、鳃、头肾、肌肉和肝脏中表达。在本研究中, 荧光定量结果显示日本鳗鲡TLR21基因在所检测的不同组织/器官中均有转录表达, 其中血液中的表达量最高,其次为鳃、脾脏, 在性腺中表达量最低。Yeh等[12]通过体外实验验证, 斑马鱼TLR21主要参与识别含有GTCGTT基序的CpG寡脱氧核苷酸, 而对Poly I:C, LPS等无应答。在本研究中, 我们发现Poly I:C能显著诱导日本鳗鲡脾脏组织AjTLR21上调表达,在刺激8h后, 其表达量最高。启动子活性分析进一步证实了Poly I:C能显著诱导AjTLR21的表达。日本鳗鲡感染迟缓爱德华菌后, 其血液和中肾组织中的AjTLR21表达量也显著上调。Gao等[15]发现牙鲆TLR21在Poly I:C刺激或鳗弧菌感染1h后, 其表达量显著上调, 在鳗弧菌感染4h后达到高峰。此外, 草鱼感染呼肠孤病毒3h后, 其在鳃组织中TLR21基因显著上调表达, 嗜水气单胞菌可显著上调草鱼肝脏、脾脏中TLR21的表达[26]。条石鲷虹彩病毒、迟缓爱德华菌以及海豚链球菌均可显著诱导石鲷脾脏组织中TLR21基因的上调表达, 表明TLR21参与了机体抗病毒、抗细菌的免疫应答[27]。有趣的是,在感染刺激隐核虫的斜带石斑鱼的皮肤和鳃组织中, TLR21基因的表达量显著上调[14]。这表明鱼类TLR21在免疫系统中功能的具有多样性。已有的研究揭示, TLR11家族成员多以异源二聚体形式行使其免疫识别的功能[28]。TLR21属于TLR11家族, 鱼类TLR21基因对多种免疫刺激物都有应答, 其免疫功能的多样性是否源自于此, 亦或是TLR21基因的上调表达是机体为应对病原微生物感染所作出的次级应答, 还有待于进一步研究证实。
[1]Medzhitov R. Toll-like receptors and innate immunity [J]. Nature Reviews Immunology, 2001, 1(2): 135—145
[2]Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity [J]. Cell, 2006, 124(4): 783—801
[3]O'Neill L A, Bowie A G. The family of five: TIR-domain-containing adaptors in Toll-like receptor signaling [J]. Nature Reviews Immunology, 2007, 7(5): 353—364
[4]Kang J Y, Lee J O. Structural biology of the Toll-like receptor family [J]. Annual Review of Biochemistry, 2011, 80: 917—941
[5]Rebl A, Goldammer T, Seyfert H M. Toll-like receptor signaling in bony fish [J]. Veterinary Immunology and Immunopathology, 2010, 134(3—4): 139—150
[6]Palti Y. Toll-like receptors in bony fish: from genomics to function [J]. Developmental and Comparative Immunology, 2011, 35(12): 1263—1272
[7]Oshiumi H, Tsujita T, Shida K, et al. Prediction of the prototype of the human Toll-like receptor gene family from the pufferfish, Fugu rubripes, genome [J]. Immunogenetics, 2003, 54(11): 791—800
[8]Ishii A, Kawasaki M, Matsumoto M, et al. Phylogenetic and expression analysis of amphibian Xenopus Toll-like receptors [J]. Immunogenetics, 2007, 59(4): 281—293
[9]Brownlie R, Zhu J, Allan B, et al. Chicken TLR21 acts as a functional homologue to mammalian TLR9 in the recognition of CpG oligodeoxynucleotides [J]. Molecular Immunology, 2009, 46(15): 3163—3170
[10]Keestra A M, de Zoete M R, Bouwman L I, et al. Chicken TLR21 is an innate CpG DNA receptor distinct from mammalian TLR9 [J]. The Journal of Immunology, 2010, 185(1): 460—467
[11]Meijer A H, Gabby Krens S F, Medina Rodriguez I A, et al. Expression analysis of the Toll-like receptor and TIR domain adaptor families of zebrafish [J]. Molecular Immunology, 2004, 40(11): 773—783
[12]Yeh D W, Liu Y L, Lo Y C, et al. Toll-like receptor 9 and 21 have different ligand recognition profiles and cooperatively mediate activity of CpG-oligodeoxynucleotides in zebrafish [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(51): 20711—20716
[13]Baoprasertkul P, Xu P, Peatman E, et al. Divergent Toll—like receptors in catfish (Ictalurus punctatus): TLR5S, TLR20, TLR21 [J]. Fish and Shellfish Immunology, 2007, 23(6): 1218—1230
[14]Li Y W, Luo X C, Dan X M, et al. Molecular cloning of orange-spotted grouper (Epinephelus coioides) TLR21 and expression analysis post Cryptocaryon irritans infection [J]. Fish and Shellfish Immunology, 2012, 32(3): 476—481
[15]Gao H, Wu L, Sun JS, et al. Molecular characterization and expression analysis of Toll-like receptor 21 cDNA from Paralichthys olivaceus [J]. Fish and Shellfish Immunology, 2013, 35(4): 1138—1145
[16]Liu Z S, Li S M. China Fisheries Yearbook [M]. Beijing: China Agriculture Press. 2015, 315 [刘增胜, 李书民. 中国渔业年鉴. 北京. 中国农业出版社. 2015, 315]
[17]Duan M Z, Huang B, Liang Y, et al. Molecular cloning and expression analysis of a liver expressed antimicrobial peptide-2 in Japanese eel, Anguilla japonica [J]. Acta Hydrobiologica Sinica, 2016, 40(2): 252—260. [段明珠, 黄贝, 梁英, 等. 日本鳗鲡肝脏表达抗菌肽2基因的克隆与表达. 水生生物学报, 2016, 40(2): 252—260]
[18]Wang T, Gao Q, Nie P, et al. Identification of suppressor of cytokine signaling (SOCS) 6, 7, 9 and CISH in rainbow trout Oncorhynchus mykiss and analysis of their expression in relation to other known trout SOCS [J]. Fish and Shellfish Immunology, 2010, 29(4): 656—667
[19]Lee P T, Zou J, Holland J W, et al. Identification and characterisation of TLR18—21 genes in Atlantic salmon (Salmo salar) [J]. Fish and Shellfish Immunology, 2014, 41(2): 549—559
[20]Sundaram A Y, Kiron V, Dopazo J, et al. Diversification of the expanded teleost-specific toll-like receptor family in Atlantic cod, Gadus morhua [J]. BMC Evolutionary Biology, 2012, 12(1): 107—112
[21]Temperley N D, Berlin S, Paton I R, et al. Evolution of the chicken Toll-like receptor gene family: a story of gene gain and gene loss [J]. BMC Genomics, 2008, 9(1): 68—76
[22]Takeda K, Kaisho T, Akira S. Toll-like receptors [J]. Annual Review of Immunology, 2003, 21(1): 335—376
[23]Slack J L, Schooley K, Bonnert T P, et al. Identification of two major sites in the type I interleukin-1 receptor cytoplasmic region responsible for coupling to pro-inflammatory signaling pathways [J]. The Journal of Biological Chemistry, 2000, 275(7): 4670—4678
[24]O'Neill L A, Fitzgerald K A, Bowie A G. The Toll-IL-1 receptor adaptor family grows to five members [J]. Trends in Immunology, 2003, 24(6): 286—290
[25]Dunne A, Ejdeback M, Ludidi P L, et al. Structural complementarity of Toll/interleukin-1 receptor domains in Toll-like receptors and the adaptors Mal and MyD88 [J]. The Journal of Biological Chemistry, 2003, 278(42): 41443—41451
[26]Wang W, Shen Y, Pandit N P, et al. Molecular cloning, characterization and immunological response analysis of Toll-like receptor 21(TLR21) gene in grass carp, Ctenopharyngodon idella [J]. Developmental and Comparative Immunology, 2013, 40(3): 227—231
[27]Priyathilaka T T, Elvitigala D A, Whang I, et al. Molecular characterization and transcriptional analysis of nonmammalian type Toll like receptor (TLR21) from rock bream (Oplegnathus fasciatus) [J]. Gene, 2014, 553(2): 105—116
[28]Roach J C, Glusman G, Rowen L, et al. The evolution of vertebrate Toll-like receptors [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(27): 9577—9582
MOLECULAR CLONING AND CHARACTERIZATION OF TLR21 GENE FROM JAPANESE EEL, ANGUILLA JAPONICA
LI Chun-Yan1,2, HUANG Bei1,2, XIONG Jing1,2, PENG Xi-Xia1,2, LIANG Ying1,2, NIE Pin1,3and HUANG Wen-Shu1,2,4
(1. College of Fisheries, Jimei University, Xiamen 361021, China; 2. Engineering Research Center of the Modern Technology for Eel Industry, Ministry of Education PRC, Xiamen 361021, China; 3. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 4. Fujian Collaborative Innovation Center for Development and Utilization of Marine Biological Resources, Xiamen 361005, China)
Toll like receptor 21 (TLR21) is a non-mammalian Toll-like receptor that recognizes unmethylated CpG DNA to trigger innate immune responses against pathogenic microorganism infection. The present study cloned the full-length cDNA sequence of TLR21 (AjTLR21) from Japanese eel, Anguilla japonica, which had the common characteristics of Toll like receptors (TLRs). The intronless AjTLR21 shared similar gene structure with other vertebrate TLR21 genes. AjTLR21 widely expressed in all examined tissues/organs with the highest expression in blood. Poly I:C treatment significantly induced the expression of AjTLR21 in spleen and kidney at 8 hours and in blood, gill, intestine and spleen at 16 hours (P<0.05). Luciferase reporter assay exhibited that the 5′ flanking region of the AjTLR21 contains positive regulatory elements for Poly I:C induced AjTLR21 expression. The stimulation of Edwardsiella tarda also increased the expression of AjTLR21 in blood and kidney at both 16h and 72h, suggesting an important role in anti-bacterium immune response. Our results revealed multiple effects of teleosts TLR21 in immune system, which has important theoretical significance and application value to understand the immunological function of AjTLR21.
Anguilla japonica; TLR21; Expression; Immune response; Promoter
Q344+.1
A
1000-3207(2017)02-0296-10
10.7541/2017.36
2016-04-25;
2016-07-20
福建省自然科学基金(2014J05042、2012J06008); 国家自然科学基金(31402329、31174238和U1205123)资助 [Supported by the National Natural Science Foundation of Fujian Province (2014J05042, 2012J06008); the National Natural Science Foundation of China (31402329, 31174238 and U1205123)]
李春艳(1991—), 女, 河南安阳人; 硕士; 主要研究方向为鱼类免疫学。E-mail: 1114291018@qq.com; 黄贝(1982—), 男, 江西萍乡人; 博士; 主要研究方向为鱼类免疫学。E-mail: huangbei@jmu.edu.cn
聂品, E-mail: pinnie@ihb.ac.cn; 黄文树, E-mail: wshuang@jmu.edu.cn, Tel: 0592-6181597

