大黄鱼鱼卵磷脂酰胆碱的分离纯化
程新伟, 梁 鹏,2, 孙 鹤, 赵卉双, 金 红, 程文健,2, 陈丽娇,2
(1.福建农林大学食品科学学院;2.福建农林大学海洋研究中心,福建 福州 350002)
大黄鱼鱼卵磷脂酰胆碱的分离纯化
程新伟1, 梁 鹏1,2, 孙 鹤1, 赵卉双1, 金 红1, 程文健1,2, 陈丽娇1,2
(1.福建农林大学食品科学学院;2.福建农林大学海洋研究中心,福建 福州 350002)
以氯仿/甲醇法提取的大黄鱼鱼卵粗磷脂为原料,研究柱层析固定相种类、粒度,洗脱剂流速、配比及样品上载量等因素对分离纯化的鱼卵磷脂酰胆碱(Roe-PC)纯度和回收率的影响,以确定最佳的工艺参数.结果表明,在固定相为200~300目硅胶,流动相为氯仿/甲醇(3∶2),流速为2 mL·min-1,上载量为0.035 g·g-1(样品/硅胶)的条件下,分离纯化的大黄鱼Roe-PC的纯度可达96.34%,回收率为85.18%.
大黄鱼鱼卵; 磷脂酰胆碱; 分离纯化
磷脂酰胆碱(phosphatidylcholine, PC),又称卵磷脂或胆碱磷脂,是磷脂的一种主要组分,主要存在于蛋黄、大豆和动植物组织中[1-3].近年来的研究发现:以水产品为原料制备的PC富含二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)等n-3多不饱和脂肪酸,能有效预防人类冠状动脉疾病;同时,二十二碳六烯酸对大脑的发育也起着至关重要的作用[4-7].因此,从水产品中分离纯化并研究PC的活性功能已经成为当前研究的热点之一.
大黄鱼(Pseudosciaenacrocea)是我国主要的海水养殖经济鱼类之一,福建省宁德地区作为国内最大的大黄鱼繁殖和生产基地,其年产量近15万t.目前,大黄鱼的主要加工品为冻干品和黄鱼鲞等,而加工过程中的主要副产物鱼卵在多数情况下都被废弃,既污染环境又浪费资源[8-10].鱼卵是一种富含蛋白质、必需氨基酸、不饱和脂肪酸、磷脂和矿物质等多种营养素的海鲜产品,具有鸡蛋和大豆等陆生动植物磷脂中缺乏的二十二碳六烯酸和二十碳五烯酸等n-3多不饱和脂肪酸等[11-12].为更好地开发和利用大黄鱼鱼卵资源,本试验以大黄鱼鱼卵为原料分离纯化鱼卵磷脂酰胆碱(roe-phosphatidylcholine, Roe-PC),以Roe-PC的纯度和回收率为评价指标,筛选并确定影响纯化Roe-PC的柱层析固定相种类、粒度,洗脱剂流速、配比及样品上载量等因素,并分析大黄鱼Roe-PC的理化性质,旨在为更好地开发和利用大黄鱼鱼卵资源提供参考.
1 材料与方法
1.1 材料
冻干大黄鱼鱼卵为宁德市岳海水产有限公司产品;大豆卵磷脂标准品(PC 纯度≥99%)为Sigma公司产品;硅胶(100~200和200~300目,型号:ZCX-Ⅲ)为青岛海洋化工厂分厂产品;中性氧化铝(100~200目)为国药集团化学试剂有限公司产品;硅胶板(50 mm×100 mm,型号:GF254)为青岛海洋化工厂分厂产品;硝酸、高氯酸、浓硫酸、钼酸铵、抗坏血酸、磷酸氢二钾、氯仿、甲醇和磷酸等试剂均为分析纯;正己烷、异丙醇和甲醇等试剂均为色谱纯.
1.2 大黄鱼鱼卵粗磷脂的制备
称取一定量的冻干大黄鱼鱼卵于烧瓶中,按1∶10的料液比加入氯仿/甲醇(1∶2)[13],连接回流装置,于65 ℃水浴中加热,从微沸开始计时提取1 h.取出烧瓶,依次用布氏漏斗和G3砂芯漏斗过滤,并用氯仿/甲醇(1∶2)洗涤烧瓶、漏斗和滤器中的样品残渣,收集滤液,置于旋转蒸发仪中浓缩,并转移至培养皿中进行真空干燥,得膏状鱼卵粗磷脂,备用.
1.3 层析柱的制备
1.3.1 硅胶柱的制备 硅胶的活化:称取一定量的硅胶于洁净的烧杯中,分别向其加入氯仿和甲醇进行溶胀预处理,30 min后倒出浑浊的溶剂,并将处理过的硅胶倒入适宜大小的培养皿中,于120 ℃的烘箱中活化2 h,取出,于干燥器中冷却至室温,备用.
硅胶柱的制备:采用湿法装柱.称取一定量活化后的硅胶于烧杯中,加入适量预先准备的洗脱剂,用玻璃棒充分搅拌成浆状,沿着层析柱缓慢将硅胶浆倒入柱中,同时用洗耳球轻轻敲击柱子管壁,以防止柱中有气泡产生.静置过夜,使填料充分沉降.先用2~3倍柱体积的洗脱剂平衡层析柱后,进行上样洗脱[14-15].
1.3.2 氧化铝柱的制备 氧化铝的活化:称取一定量的氧化铝于培养皿中,在140 ℃的活化温度下活化2 h,取出,于干燥器中冷却至室温,备用.
氧化铝柱的制备:方法与硅胶柱的制备相同.
1.4 上样和洗脱
将一定量的鱼卵粗磷脂用少量的氯仿溶解,经0.45 μm滤膜微滤后,缓慢加入层析柱中,在不同洗脱剂流速和样品上载量的条件下,用不同比例的氯仿/甲醇进行洗脱,每100 mL收集一次,将其与PC标准品同时在薄层色谱下层析,确定Roe-PC的流出体积.
1.5 Roe-PC纯度的测定
将收集的洗脱剂按照层析结果合并浓缩成膏状,配成1.0 mg·mL-1样品,用LC-20AT高效液相色谱仪测定磷脂组成.色谱条件如下.色谱柱:ZORBAX RX-SIL;流动相:正己烷∶异丙醇∶甲醇∶1%乙酸=4∶9∶5∶2;流动相流速:0.5 mL·min-1;柱温:30 ℃;进样量:10 μL;漂移管温度:60 ℃;气体流速:2 mL·min-1.Roe-PC的纯度以峰面积的百分比计算[16].
1.6 标准曲线的绘制
精密称取PC标准品,并用正己烷/异丙醇(4∶9)配置成5 mg·mL-1PC标准溶液,并将该标准液稀释成不同浓度梯度的PC标准溶液,用于绘制PC含量和峰面积的标准曲线,得到PC含量(x)和峰面积(y)的回归方程:y=171 296x-31.469,R2=0.997 6.表明PC含量为1~5 mg·L-1时具有良好的线性关系.
1.7 Roe-PC回收率的计算
回收率/%=(精制磷脂的质量×精制磷脂的PC纯度)/(磷脂粗品的质量×磷脂粗品的PC纯度)×100.
1.8 Roe-PC纯化工艺参数的筛选
在柱层析分离工艺的参数中,固定相种类、粒度,洗脱剂种类、流速及样品上载量等因素对Roe-PC纯化效果的影响较为明显.因此,以Roe-PC的纯度和回收率作为评价指标,对上述工艺参数进行筛选.
1.9 数据处理
试验数据采用DPS软件进行分析.
2 结果与分析
2.1 固定相种类的选择
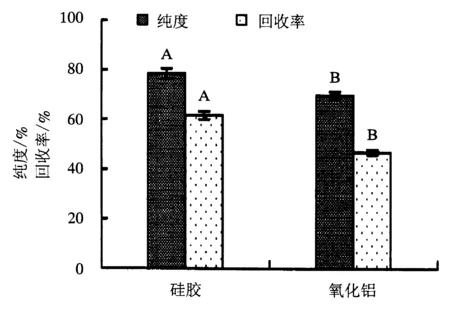
附不同大写字母者表示差异极显著(P<0.01).
PC分离纯化常用的固定相有硅胶和氧化铝.分别选取100~200目的硅胶和中性氧化铝为固定相,在流动相为氯仿/甲醇(2∶1),上载量为0.015 g·g-1(样品/硅胶),流速为1 mL·min-1的条件下,对大黄鱼鱼卵粗磷脂样品进行洗脱,流出液每100 mL收集一次,对Roe-PC流出液进行检测分析,考察不同固定相种类对Roe-PC纯化效果的影响,以确定最佳的固定相种类.Roe-PC的纯化结果如图1所示.
从图1可以看出,硅胶和氧化铝对Roe-PC纯度和回收率的影响差异极显著(P<0.01).以硅胶为固定相纯化的Roe-PC纯度为78.36%,而氧化铝纯化的只有69.86%;硅胶纯化的Roe-PC回收率为61.65%,高于氧化铝的46.99%.表明硅胶对Roe-PC的纯化效果优于氧化铝,因此选择硅胶作为纯化Roe-PC的固定相.
2.2 固定相粒度的选择
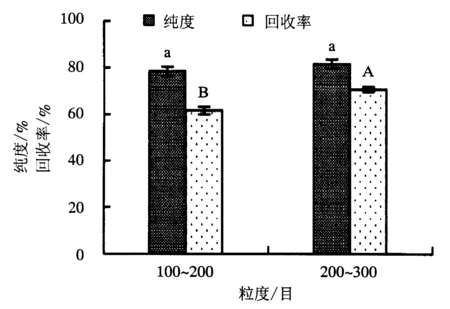
附不同大写字母者表示差异极显著(P<0.01),附相同字母者表示差异不显著(P>0.05).
分别以100~200和200~300目硅胶为固定相,在上载量为0.015 g·g-1(样品/硅胶),流动相为氯仿/甲醇(2∶1),流速为1 mL·min-1的条件下,对大黄鱼鱼卵粗磷脂样品进行洗脱,流出液每100 mL收集一次,对Roe-PC流出液进行检测分析,考察不同固定相粒度对Roe-PC纯化效果的影响,以确定最佳的固定相粒度.Roe-PC的纯化结果如图2所示.
从图2可以看出,硅胶粒度对Roe-PC纯度的影响不显著,但对Roe-PC回收率的影响极显著(P<0.01).100~200和200~300目硅胶纯化的Roe-PC纯度分别为78.36%和81.75%;200~300目硅胶纯化的Roe-PC回收率为70.92%,高于100~200目的61.65%.纯化的Roe-PC经浓缩后,发现用200~300目硅胶纯化的Roe-PC产品色泽较浅,为浅黄色;而用100~200目纯化的产品颜色较深,为橙黄色.表明固定相的粒度小,能起到一定的脱色作用,故选择200~300目硅胶作为纯化Roe-PC的固定相.
2.3 洗脱剂流速的选择
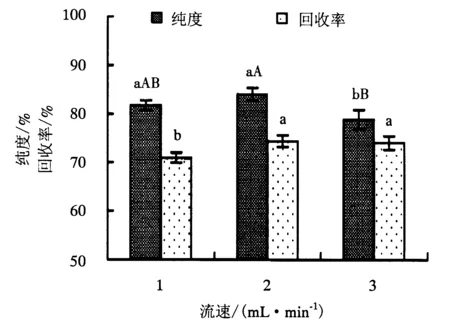
附不同大写字母者表示差异极显著(P<0.01),附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
柱层析分离时,选择合适的洗脱剂流速至关重要.洗脱剂流速应大于溶液在柱中的自然沉降速度,而小于溶质在柱中的吸附解吸速度.流速如果过小,会发生溶质不能分离一起流出的现象(达到饱和吸附后);如果过大,则会发生溶质吸附不到固定相上直接洗出[14].
本试验在固定相为200~300目硅胶,上载量为0.015 g·g-1(样品/硅胶),流动相为氯仿/甲醇(2∶1)的条件下,设置洗脱剂流速分别为1、2和3 mL·min-1,对大黄鱼鱼卵粗磷脂样品进行洗脱,流出液每100 mL收集一次,对Roe-PC流出液进行检测分析,考察不同洗脱剂流速对Roe-PC纯化效果的影响,以确定最佳的流速.Roe-PC的纯化结果如图3所示.
从图3可以看出,洗脱剂流速分别为1、2和3 mL·min-1时,Roe-PC的纯度随着洗脱剂流速的加快呈先上升后下降的趋势,分别为81.75%、83.98%和78.88%,可能是由于流速过快,不利于磷脂各组分的分离,从而造成纯度下降.洗脱剂流速为1 mL·min-1时的Roe-PC纯度与2 mL·min-1的差异不显著(P>0.05),1 mL·min-1与3 mL·min-1的差异显著(P<0.05),但2 mL·min-1与3 mL·min-1的差异极显著(P<0.01).流速分别为2和3 mL·min-1的Roe-PC回收率均大于1 mL·min-1的回收率,且2 mL·min-1与3 mL·min-1的差异不显著(P>0.05).流速为1 mL·min-1时,Roe-PC能充分分离,但所需的洗脱时间较长;流速增加到3 mL·min-1时,Roe-PC与其他磷脂组分能同时分离出来,并出现拖尾现象,造成纯度有所下降.综合考虑Roe-PC的纯度和回收率,选择2 mL·min-1作为最佳的流速.
2.4 洗脱剂配比的选择
硅胶柱层析法最常用的洗脱剂是氯仿—甲醇体系,该混合体系分离纯化的效果好,是制备高纯度PC的经典方法[17].为获取高纯度的Roe-PC,本试验以氯仿—甲醇体系为洗脱剂来分离纯化大黄鱼鱼卵粗磷脂中的Roe-PC.然而,要获得良好的分离洗脱效果,关键是氯仿与甲醇的比例.
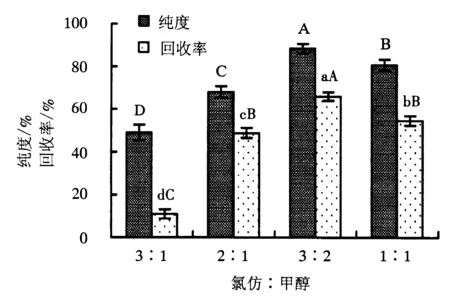
附不同大写字母者表示差异极显著(P<0.01),附不同小写字母者表示差异显著(P<0.05).
在固定相为200~300目硅胶,上载量为0.015 g·g-1(样品/硅胶),洗脱剂流速为2 mL·min-1的条件下,设置氯仿与甲醇的比例分别为1∶1、2∶1、3∶1、3∶2,对大黄鱼鱼卵粗磷脂样品进行洗脱,流出液每100 mL收集一次,对Roe-PC流出液进行检测分析,考察不同流动相配比对Roe-PC纯化效果的影响.Roe-PC的纯化结果如图4所示.
从图4可以看出,氯仿与甲醇的配比对Roe-PC纯度的影响极显著(P<0.01);配比为3∶2时对Roe-PC回收率的影响与1∶1、2∶1的配比相比,差异极显著(P<0.01);随着氯仿与甲醇配比的增加,Roe-PC的纯度和回收率均呈先提高后降低的趋势,且均在氯仿/甲醇为3∶2时达到最大值,分别为94.23%和82.75%.
这是因为硅胶柱层析的洗脱过程就是洗脱剂与粗磷脂中的各组分竞争占据硅胶吸附剂表面活性中心的过程.粗磷脂中极性弱的组分,占据硅胶吸附剂表面活性中心的能力弱,容易被极性弱的溶剂取代而被洗脱下来;粗磷脂中极性强的组分,占据硅胶吸附剂表面活性中心的能力强,需要洗脱剂的极性就强.因此,需要逐渐增大洗脱剂的极性,使得粗磷脂中的各个组分按照溶剂极性的强弱逐步分离开.
随着甲醇比例的增大,洗脱剂的极性逐渐增大,有利于鱼卵粗磷脂中极性较大的Roe-PC流出,但甲醇比例过大,也会造成其他磷脂组分的流出,导致Roe-PC的纯度和回收率均有所下降.
由于试验材料差异等方面的原因,在不同文献中选择的氯仿—甲醇洗脱体系配比各不相同.如韩雪等[18]采用硅胶柱梯度洗脱大豆粉末磷脂,确定氯仿与甲醇的体积比为3∶2是PC的最佳洗脱条件,PC的纯度达97%;赵彬侠等[19]以氯仿和甲醇为洗脱剂对25%蛋黄卵磷脂进行硅胶柱梯度洗脱分离,当氯仿与甲醇的体积比为1∶2时,PC被洗脱出,纯度达97.5%.这些文献都证明了氯仿—甲醇洗脱体系有助于制备高纯度的PC,但对不同材料、不同提取方法所得的粗磷脂在进行硅胶柱分离纯化时,在洗脱过程中需要按照实际情况调整洗脱体系各组分的比例,以提高洗脱效果.
综合考虑洗脱效果,最终选择氯仿与甲醇的体积比为3∶2作为最佳的配比.
2.5 上载量的选择
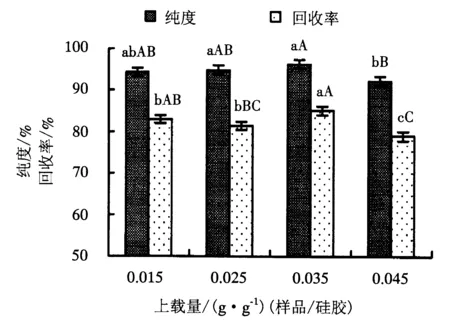
附不同大写字母者表示差异极显著(P<0.01),附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
上载量较低时吸附剂未能被充分利用;过高的上载量又难以保证分离效果.因此,采用柱层析法制备高纯度的Roe-PC时,需要确定合适的上载量.
在固定相为200~300目硅胶,流动相为氯仿/甲醇(3∶2),流速为2 mL·min-1的条件下,上载量分别设置为0.015、0.025、0.035、0.045 g·g-1(样品/硅胶),对大黄鱼鱼卵粗磷脂样品进行洗脱,流出液每100 mL收集一次,对Roe-PC流出液进行检测分析,考察不同上载量对Roe-PC纯化效果的影响.Roe-PC的纯化结果如图5所示.
从图5可以看出:上载量分别为0.015、0.025和0.035 g·g-1时,Roe-PC纯度的差异不显著(P>0.05);上载量为0.045 g·g-1时,Roe-PC的纯度有所下降.其中,0.015 g·g-1上载量的Roe-PC纯度与0.045 g·g-1的差异不显著(P>0.05),0.025 g·g-1与0.045 g·g-1的差异显著(P<0.05),0.035 g·g-1与0.045 g·g-1的差异极显著(P<0.01).上载量为0.035 g·g-1时的Roe-PC回收率与0.015、0.025 g·g-1的差异显著(P<0.05),但与0.045 g·g-1的差异极显著(P<0.01),表明上载量为0.045 g·g-1时,层析柱达到饱和.在洗脱纯化的过程中,上载量过低时,吸附剂未能被充分利用,且洗脱时拖尾现象严重,对Roe-PC的收集和浓缩造成困难;上载量过高时,层析柱的负担过重,难以保证分离效果.因此,综合考虑洗脱效果,选择0.035 g·g-1作为最佳的上载量.
2.6 最优纯化条件下Roe-PC的纯度和回收率
根据单因素试验结果,得到Roe-PC的最优纯化条件,即固定相为200~300目硅胶,流动相为氯仿/甲醇(3∶2),流速为2 mL·min-1,上载量为0.035 g·g-1(样品/硅胶).在此条件下对大黄鱼鱼卵粗磷脂进行纯化,所得的Roe-PC经高效液相色谱—蒸发光散射(HPLC-ELSD)检测,结果如图6所示.由回归方程y=171 296x-31.469计算出的纯度为96.34%,由PC回收率计算公式计算出的回收率为85.18%,表明获得的纯化条件适于大黄鱼Roe-PC的分离纯化.
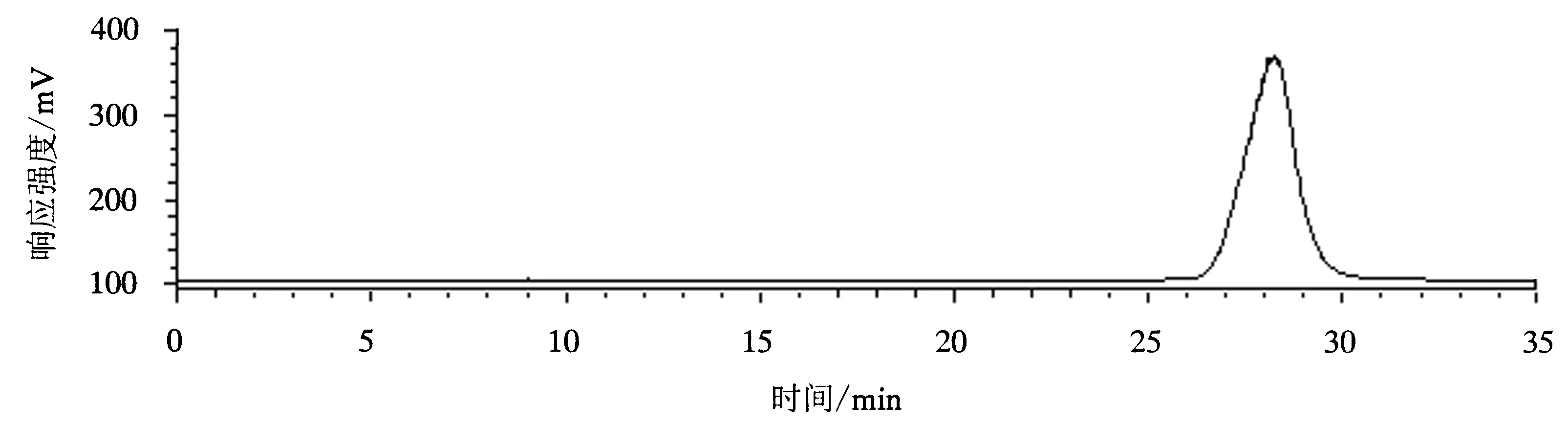
图6 大黄鱼Roe-PC的HPLC-ELSD图谱
2.7 Roe-PC和鱼卵粗磷脂的理化性质
从表1可以看出,大黄鱼鱼卵粗磷脂样品经柱层析纯化后,其品质大大提高,各项质量指标均符合卵磷脂一级质量标准[20].
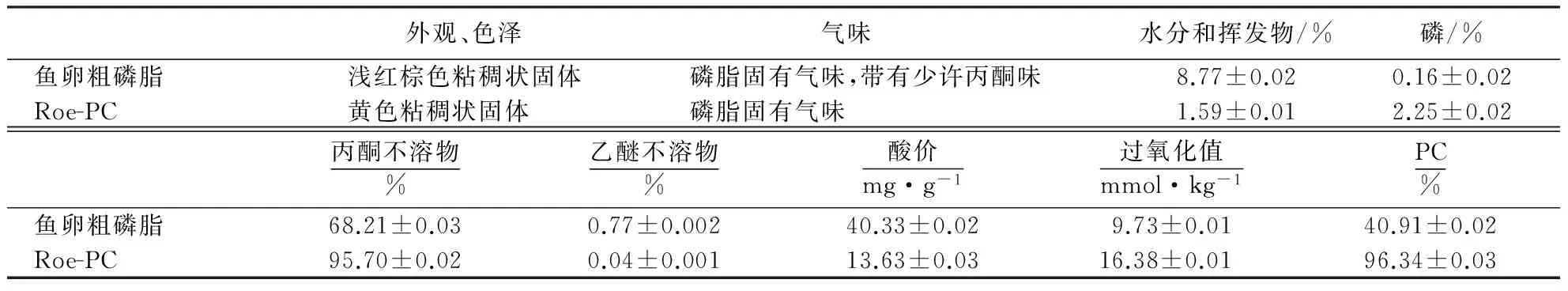
表1 Roe-PC的理化性质1)
1)数据为平均值±标准误(n=3).
3 结论
本试验以氯仿/甲醇法提取的大黄鱼鱼卵粗磷脂为原料,在固定相为200~300目硅胶,流动相为氯仿/甲醇(3∶2),流速为2 mL·min-1,上载量为0.035 g·g-1(样品/硅胶)的最佳工艺条件下,Roe-PC的纯度可达96.3%.表明本试验所选用的方法切实可行,有利于从大黄鱼中分离得到高纯度的PC.本试验获得的Roe-PC可进一步进行活性方面的验证,为大黄鱼鱼卵资源的高值化提供参考.
[1] 陈文娟,陈建福.大黄鱼鱼卵脂质含量及脂肪酸组成分析[J].肉类工业,2012(4):21-23.
[2] MOUSTAPHA O, JISSYK J, GOPINADHAN P. Effect of soy lecithin in enhancing fruit juice/sauce quality [J]. Food Research International, 2010,43(1):232-240.
[3] 王兆明,贺稚非,余力,等.动物源卵磷脂功效作用及其分析方法[J].食品工业科技,2014,35(19):362-367.
[4] WU Y, WANG T. Soybean lecithin fractionation and functionality [J]. Journal of the American Oil Chemists Society, 2003,80(4):319-326.
[5] 叶彬清,王锡昌,陶宁萍.海洋卵磷脂的提取纯化研究进展[J].食品工业科技,2013,34(18):379-382.
[6] 武风娟.海参脑苷脂和海参磷脂对阿尔兹海默病的改善作用研究[D].青岛:中国海洋大学,2014.
[7] 杨文鸽,张芝芬.贻贝Mytilusedulis磷脂成分的分析[J].浙江海洋学院学报,2000,9(1):47-50.
[8] 韩承义,廖红梅,陈庆荣.宁德市大黄鱼产业“2亿美元”现象及其发展[J].中国水产,2011,35(7):71-73.
[9] 廖红梅,林培华,高健.宁德市大黄鱼成鱼养殖现状及对策[J].贵州农业科学,2011,39(1):165-168.
[10] TAKAHASHI K, INOUE Y. Marine by-product phospholipids as booster of medicinal compounds [J]. Advances in Food & Nutrition Research, 2012,65:31-46.
[11] SALA-VILA A, COFN M, MATEO-GALLEGO R, et al. 57 marine N-3 fatty acids in serum phospholipids as biomarkers ofintake influence LDL heterogeneity in subjects with familial lipoprotein disorders [J]. Athersclerosis Supplements, 2011,12(1):14.
[12] LINEHAN L G, O′CONNOR T P, BURNELL G. Seasonal variation in the chemical composition and fatty acid profile of Pacific oysters (Crassostreagigas) [J]. Food Chemistry, 1999,64(2):211-214.
[13] FOLCH J, LEES M, SLOANE S G H. A simple method for the isolation and purification of total lipids from animal tissues [J]. Jounral Biological Chemistry, 1957,226(1):497-509.
[14] 王成涛.大豆磷脂制备高纯度磷脂酰胆碱的研究[D].郑州:河南工业大学,2010.
[15] 张潇予.南极磷虾磷脂酰胆碱的提纯[D].济南:山东师范大学,2012.
[16] 刘艳青,李兆杰,李国云,等.雌、雄皱纹盘鲍内脏脂肪酸及磷脂组成的比较分析[J].食品科学,2013,34(10):184-186.
[17] 林卓振.色谱法[M].北京:科学出版社,1982.
[18] 韩雪,汪勇,胡长鹰,等.柱层析法分离纯化大豆磷脂酰胆碱[J].食品研究与开发,2010(3):19-22.
[19] 赵彬侠,许晓慧,张小里,等.用柱层析法分离纯化蛋黄卵磷脂[J].西北大学学报(自然科学版),2003,33(2):171-173.
[20] 中华人民共和国国内贸易部.LS/T 3219-1994 磷脂通用技术条件[S]. 北京:中华人民共和国国内贸易部,1994.
(责任编辑:施晓棠)
Isolation and purification of phosphatidylcholine from large yellow croaker roe
CHENG Xinwei1, LIANG Peng1,2, SUN He1, ZHAO Huishuang1, JIN Hong1, CHENG Wenjian1,2, CHEN Lijiao1,2
(1.College of Food Science; 2.Marine Research Center, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Phosphatidylcholine (PC) was purified from phospholipids of large yellow croaker (Pseudosciaenacrocea) roe by chloroform/methanol system. Parameters including types of stationary phase, granularity, eluent rate and composition, loading quantity were investigated to optimize its yield and purity. The results showed that the optimum procedure was to co-eluate sample from silica gel 200-300 using chloroform/methanol (3∶2) at the rate of 2 mL·min-1, with loading amount being 0.035 g·g-1(sample/silica gel). Under this condition, the purity of PC can reach 96.34%, with recovery rate being 85.18%.
large yellow croaker roe; phosphatidylcholine; purification
2016-07-28
2016-10-18
福建省自然科学基金资助项目(2016J01106);福建省教育厅中青年教师A类项目(JA14109);福建农林大学高水平大学建设项目(612014043).
程新伟(1991-),女,硕士研究生.研究方向:水产食品科学.Email:18350155849@163.com.通讯作者陈丽娇(1962-),女,研究员.研究方向:水产品加工.Email:chenlijiao606@126.com.
TS254.9
A
1671-5470(2017)02-0228-06
10.13323/j.cnki.j.fafu(nat.sci.).2017.02.017

