化感水稻苗期茎叶组织中萜类物质检测和抑草活性分析
李家玉, 林志华, 李 立, 杨小燕, 张 奇, 何海斌
(福建省农业生态过程与安全监控重点实验室,福建农林大学生命科学学院,福建 福州 350002)
化感水稻苗期茎叶组织中萜类物质检测和抑草活性分析
李家玉, 林志华, 李 立, 杨小燕, 张 奇, 何海斌
(福建省农业生态过程与安全监控重点实验室,福建农林大学生命科学学院,福建 福州 350002)
采用稻稗抑草圈土壤盆栽种植方法,微波萃取和气质联用色谱技术测定苗期强化感水稻PI312777与非化感水稻Lemont的茎、叶中萜种类及总萜、单萜、含氧单萜浓度,并进行比较分析.根据物质分析结果,进一步考察含氧萜类对稗草的抑制能力.结果表明:化感水稻PI312777显著抑制其周围稗草的生长,且其苗期茎叶中总萜、单萜以及含氧单萜含量均高于非化感水稻Lemont.验证结果表明,所选择的7种含氧单萜的混合溶液对稗草的株高和干重的抑制作用随着浓度的增高而升高,且低浓度的含氧单萜混合溶液对常规水稻Ⅱ优航无危害作用,因此化感水稻苗期自然分泌的含氧单萜物质是一种潜在的生态安全除草剂.
化感水稻; 含氧单萜; GC-MS; 抑草圈; 抑草活性
植物化感作用(allelopathy)是指一个活体植物(供体)通过向环境中释放次生代谢物质,从而影响周围植物(受体)生长和发育的化学生态学现象[1].这些次生代谢物质称为化感物质(allelochemical).利用水稻自身的化感抑草作用控制农田杂草,减少对化学除草剂依赖,可保护农田生态环境[2].目前,酚酸是报道最多的一类化感物质[3],尽管Olofsdotter et al[4]对此提出质疑,但是已有研究表明,酚酸仍然是目前非常重要的一类化感物质[5].当然,其他类化感物质如黄酮、甾体等的研究报道也引起学者的重视[6-8].Kato-Noguchi et al[9-10]研究表明,二萜类物质momilactone B的化感活性强,该物质从水稻根部分泌后,进入水稻培养液或土壤中发挥化感活性.在室内生测试验中,含氧单萜尤其是单萜的醇类或酮类化合物在较低浓度下对受体的抑制活性高[11-13],而且其在水溶液里也具有较高溶解度[14].何海斌等[15]对根系分泌物乙醚萃取物的化学组成进行了系统分析,结果表明,化感水稻PI312777与非化感水稻Lemont的水稻根系分泌物组成中相同或相似的成分居多,差异主要在含氧萜类化合物.因此,萜类物质也成为一类重要的水稻化感物质.实验室前期模拟水稻的实际种植模式,探索出一种新的水稻化感潜力评价方法——抑草圈方法[16].本研究以抑草圈法种植的两种不同化感潜力水稻为研究对象,在土壤盆栽种植下,化感水稻有效抑制稗草生长时,对苗期水稻叶和茎组织中的萜类物质,特别是含氧萜类进行定性、半定量测定和比较分析,并实际验证含氧萜类的抑草能力,可为以后新型萜类除草剂的开发提供依据.
1 材料与方法
1.1 试验材料
采用国际上公认的化感潜力水稻品种PI312777(记为PI)和非化感水稻Lemont(记为Le)为供体材料[16],田间收集的无芒稗(Echinochloacrus-galliL.)为受体材料(收集并保存于冰箱1年以上之种子)进行水稻抑草圈种植.以常规杂交水稻Ⅱ优航为试验材料进行混合含氧单萜溶液抑草能力验证试验.
1.2 水稻的种植与收集
水稻种植方法参考前期抑草圈种植方法进行[16],略作修改.具体为:取20 kg稻田土壤于塑料圆盆中(圆盆规格为直径43 cm,高15 cm),加适量水并将其搅拌均匀,静置1天后,挑选6颗预萌发的水稻种子(刚冒白),以半径2 cm等间距成圆形播到在盆中央,以便形成一丛水稻之实际状况,每天定时浇水以保持土壤湿润,并拔除杂草.稗草种子用水浸泡,挑选沉于底部籽粒饱满的种子播于沙盘中萌发.待水稻长至5叶期时,挑选6颗预萌发的稗草种子,两两等间距绕水稻播种,稗草距离盆心水稻苗为12 cm.对照组为单种稗草.试验设置3个重复.2周后收获稗草,测定稗草株高和地上部干物质重,计算抑制率[18].同时,收集两种水稻的地上部分,分成叶和茎两部分,用于后续试验.
1.3 萜类物质的微波萃取
参照Carro et al[19]方法对水稻叶和茎组织中的萜类物质进行微波萃取并略作修改.3次重复种植的水稻叶或茎各自混匀,萃取时分别取2 g水稻叶或茎(分别剪碎至长宽1 cm)放入消解罐中,加入10 mL正己烷,同时添加内标物正十二烷(最后浓度1 μL·L-1).50 ℃微波萃取60 min,将萃取液尽可能多地转移至10 mL离心管中,用正己烷补齐至10 mL,混合20 s,3 000 rpm离心5 min,收集正己烷相,过0.22 μm有机系滤膜,收集滤液于GC瓶中,进行GC-MS测定.
1.4 萜类物质的GC/MS定性和半定量分析
将上述收集的正己烷相于气相色谱——质谱仪(Agilent 7890-5975A,美国)进行GC-MS定性及半定量分析.GC工作条件:DB-5 ms毛细管柱(30 m×250 μm×0.25 μm),前进样口温度280 ℃,以高纯氦气作载气,流速为1.0 mL·min-1;运行程序为:60 ℃保持1 min,以10 ℃·min-1升到170 ℃,保持2 min,后以5 ℃·min-1升到280 ℃,保持5 min,再以20 ℃·min-1升到300 ℃,保持1.5 min,最后运行300 ℃保持1 min;进样方式:分流模式,分流比30∶1,分流流量44.625 mL·min-1.质谱条件:离子源230 ℃,最大值250 ℃,MS四极杆150 ℃,最大200 ℃;采集模式为:全扫描模式,溶剂延迟2 min,荷质比40~220 m·z-1.每个样重复进样3次.根据谱图数据库NIST08检索确定萜类化合物的可能结构,且根据内标物和各萜类物质的峰面积进行半定量分析.
1.5 混合含氧单萜溶液抑草能力验证
化合物信息见表1,依据GC-MS分析结果(表2、表3),选取叶和茎中含有的或者结构相似的7种含氧单萜,即异胡薄荷醇和3,7-二甲基-1-辛醇(TCI公司,日本),可可醛(阿拉丁公司,中国),柠檬醛,(R)-(+)-香茅醛,(S)-(-)-香茅醛,羟基香草醛(Sigma公司,美国).参考化感水稻PI茎叶组织中的萜类含量,按照1∶1∶1∶1∶1∶1∶1比例配制浓度分别为900、700、500、300和100 μL·L-1的萜类混合液,Tween-80作为助溶剂(终体积分数为0.05%).
在沙盘中培育稗草至一叶期,选取高度为0.9~1.1 cm的稗草种植.按萜类浓度梯度设置5组处理组,另设不喷洒萜类溶液的对照组(含0.05% Tween-80),每组重复3盆,每盆种植4株稗草,每盆盛有2 kg土壤,盆长30 cm,宽21 cm,高15 cm.土壤理化性质与水稻种植时相同.移植稗草至盆中后,先恢复3天,之后进行萜类溶液喷洒,每3天喷洒100 mL,喷洒6天,30 ℃种植,第7天收集稗草地上部,量取株高和干物重,计算抑制率[17].此外将冒白的常规水稻Ⅱ优航种子按照稗草种植方法进行播种,待长到二叶一芯时,设置对照组,测定含氧单萜混合溶液对常规水稻Ⅱ优航株高和干物重的抑制率,方法同上.
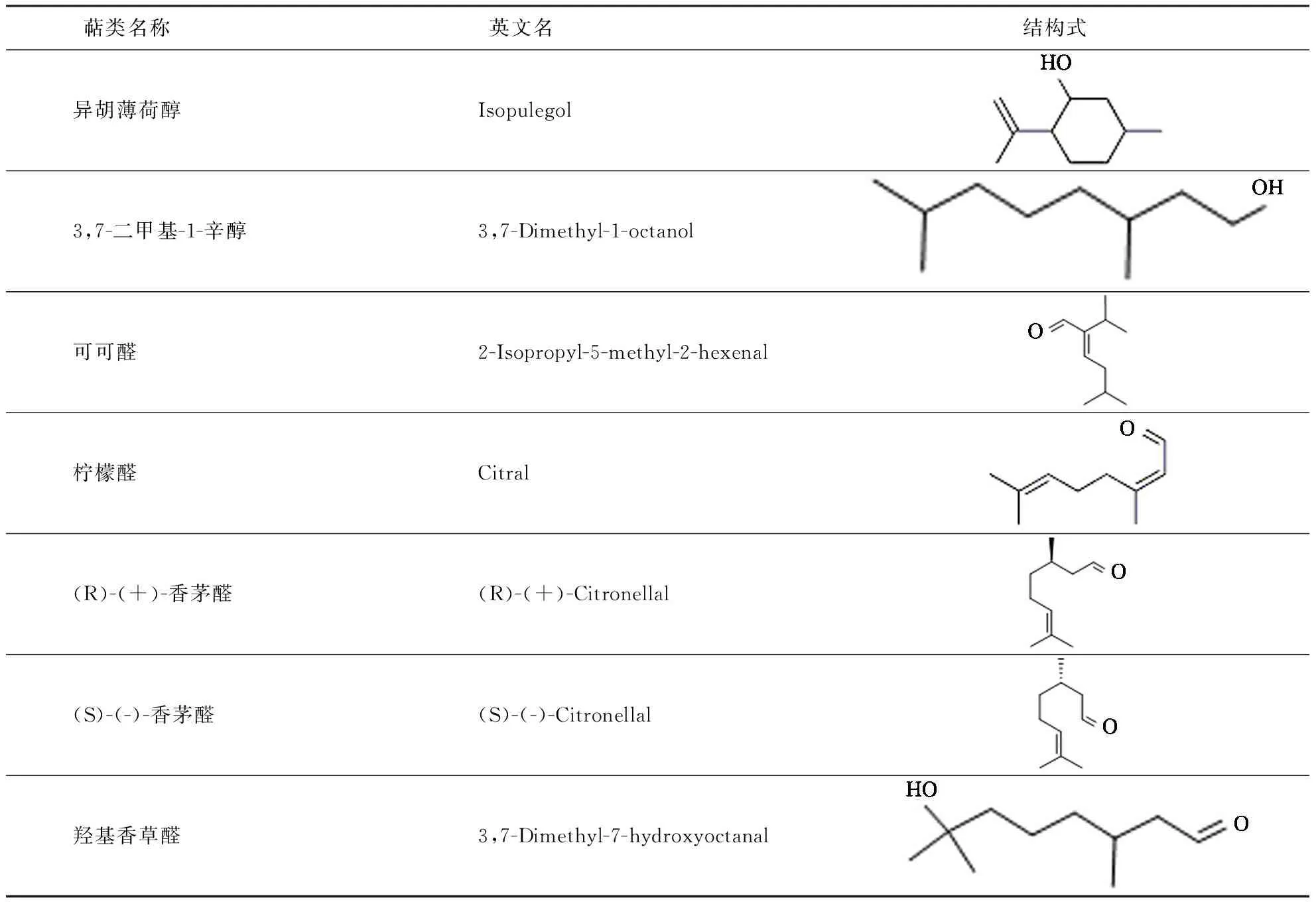
表1 生物活性测定选取的含氧单萜
1.6 数据统计分析
采用IBM SPSS 20.0单因素方差分析(one-way ANOVA)和LSD法进行水稻组织萜类物质含量的显著性差异分析,以小写字母表示差异达到显著水平(P<0.05).采用抑制率评价混合含氧单萜溶液对稗草生长的影响,即抑制率(IR),计算公式:IR=(CK-TR)/CK×100%,其中TR为处理值的生长指标,CK为对照值的生长指标.
2 结果与分析
2.1 水稻种植试验结果

不同小写字母表示差异显著(P<0.05).
水稻土培种植试验表明(图1),化感水稻PI对12 cm处稗草的株高和地上部干物重抑制率分别为46.7%和84.7%,而非化感水稻Le为16.4%和30.1%.此结果与作者前期抑草圈试验结果一致[16],表明了化感水稻有效抑制了其周围稗草的生长,此时水稻茎叶组织可以用于不同化感潜力收集的水稻活体自然分泌的萜类物质差异分析.
2.2 水稻茎叶组织萜类物质GC/MS定性和半定量分析
通过对两种水稻的茎部和叶部组织的萃取液的3次重复进样的GC/MS谱图进行定性分析,发现水稻PI叶部萃取液共有5种萜类物质,即3种含氧单萜和2种含氧倍半萜(表2);水稻PI茎部萃取液共有6种萜类物质,即1种含氧单萜、1种不含氧单萜、2种含氧倍半萜和2种二萜(表2);水稻Le叶部萃取液共有11种萜类物质,即5种含氧单萜、2种不含氧单萜、4种倍半萜(表3);水稻Le茎部萃取液共有4种萜类物质,即3种含氧单萜和1种不含氧单萜(表3).由此可见,不管是强化感水稻PI还是弱化感水稻Le,其叶片或者茎部都含有不同的萜类物质,而且含氧萜类物质种类高于其它萜类物质,但是两种水稻叶片或茎部组织的各类萜类物质相对含量有所差异.

表2 水稻PI312777叶与茎中主要萜类物质成分(3次进样)

表3 水稻Lemont叶与茎中主要萜类物质成分(3次进样)
根据内标物和萜类成分的GC/MS图谱峰面积,对不同水稻的叶片或茎组织的总萜、单萜、含氧单萜浓度的总量分别进行半定量分析,结果表明(图2),水稻茎部的总萜、单萜和含氧单萜含量显著高于叶片,这主要是由于萜类代谢物质由水稻叶片合成传输至茎部.从两种水稻相同组织每类萜类的相对含量结果分析,化感水稻PI312777茎的总萜、单萜和含氧单萜含量分别为1 767.76、1 522.10和1 361.32 mg·kg-1鲜重,显著高于非化感水稻茎部各类萜类的含量(1 100.99、1 032.76和906.36 mg·kg-1鲜重),而两种化感水稻叶片中同类萜类总量无显著差异.最后,本研究对PI312777及Lemont茎叶两种组织的萜类总量进行了统计,结果表明,化感水稻PI312777茎叶组织萜类总量为2 222.88 mg·kg-1鲜重,其中单萜为1 906.11 mg·kg-1鲜重,含氧单萜为1 723.98 mg·kg-1鲜重.Lemont中茎叶萜类总量为1 490.45 mg·kg-1鲜重,其中单萜和含氧单萜含量分别为1 362.15和1 197.97 mg·kg-1鲜重.结果表明,不论是化感水稻还是非化感水稻,其茎叶组织中的含氧单萜所占的比例均高于其它萜类物质,而且化感水稻茎叶总萜、单萜和含氧单萜含量显著高于非化感水稻.

A-叶,B-茎,不同小写字母表示差异显著(P<0.05).
2.3 含氧单萜混合溶液的抑草能力验证
根据以上GC-MS分析结果,两种水稻茎叶组织中含氧单萜的比例远高于其它类萜类,而且前期报道含氧萜类物质的水溶性也高于其它萜类,因此,综合考虑标准品购买的实际性,根据表2和表3的结果,选择并购买类似结构的7种含氧单萜标准品进行抑草活性分析.分析7种含氧单萜的萜类混合液对稗草和常规水稻II优航生长的抑制情况(图3、图4).随着浓度的增加,含氧单萜混合溶液对稗草株高和干重的抑制作用随之增强,含氧单萜混合溶液浓度为900 μL·L-1时,对稗草株高的抑制率达到44.49%,对稗草干重的抑制率为40.11%(图3).而含氧单萜混合溶液对常规稻II优航株高和干重的抑制作用在其浓度700 μL·L-1时,达到最大抑制率,其对株高和干物重的抑制率分别为19.08%和19.28%(图4),显著低于其对稗草株高和干重的抑制率.由此可见,含氧萜类物质对水稻本身的毒害作用低于对杂草的抑制作用.当含氧单萜混合溶液浓度为300 μL·L-1时,其对常规稻II优航的抑制率最小,而对稗草和常规稻II优航的抑制率差值相差极大,因此,300 μL·L-1的含氧单萜混合溶液具有最佳的田间抑草作用.

图3 含氧单萜混合溶液对稗草株高和干重的抑制作用
3 讨论
化感物质可以通过挥发、淋溶、根系分泌和残留物分解等方式释放到环境中,从而影响周围其它植物的生长.由于萜类物质大多具有挥发性,主要通过植物茎叶组织表面的挥发,介导植物—植物间的相互作用.以往的诸多研究主要针对水稻单体释放的化感物质进行定性和定量分析,与实际水稻大田环境有所偏离.本研究将水稻和稗草共同种植在土壤媒介的自然环境下,对能产生抑制稗草生长的苗期水稻茎叶组织的萜类物质进行分析,分析结果与实际情况基本一致.研究结果表明,化感水稻苗期对周围种植的稗草抑制率高于非化感水稻,其茎叶组织中的总萜和含氧单萜含量显著高于非化感水稻.
萜类是一类非常重要的植物毒性物质,其化学结构多变,种类繁多,目前已经鉴定出结构的萜类物质超过25 000种.许多双子叶植物如西红柿、棉花、番薯等均含有大量的植物毒性萜类物质,而单子叶植株仅水稻和玉米经确认能够合成具有植物毒性的萜类物质[20,21].目前,单萜、倍半萜和二萜类物质都被认为是潜在的化感物质.许多单萜物质如蒎烯、樟脑烯等以单一或者混合物的形式抑制受体的萌芽[11,12].尽管这些物质是脂溶性的,但是它们在水里还是具备一定的溶解度,溶解的有效浓度具有很强的抑制活性.而且,这些萜类物质挥发性很强,容易以空气作为媒介发挥化感效应,这与只有溶解在水溶液里才能发挥活性的酚酸物质不同;另一方面,含氧单萜比相同结构的不含氧单萜在水里的溶解度高[14],尤其是单萜的醇类或酮类化合物如樟脑、薄荷酮(醇)、桉油素、香芹酚、麝香草酚、香茅醛(醇)、香叶醇、橙花醛(醇)等对受体的抑制活性比单萜高[13].虽然化感植物分泌的萜类物质浓度比酚酸低,但是萜类物质对受体的抑制率比酚酸高[12,14].因此,含氧单萜类物质也是一类非常重要的化感物质.本研究也表明,在化感水稻苗期茎和叶组织中出现低浓度的7种含氧单萜溶液可以很好地抑制土壤种植的杂草生长,而对水稻生长无危害,具有较高的生态安全新型除草剂开发价值.
[1] RICE E L. Allelopathy[M]. Orlando: Academic Press, 1984:89-94.
[2] DILDAY R H, NASTAS P, LIN J, et al. Allelopathic activity in rice (OryzasativaL.) against ducksalad [Heterantheralimosa(Sw)][C]∥HANSON J D, SHAFFER M J, BELL D A, et al. Proceedings of Sustainable Agriculture for the Great Plains. MD: ARS, 1991:193-201.
[3] KHANH, T D. XUAN T D, CHUNG I M. Rice allelopathy and the possibility for weed management[J]. Annals of Applied Biology, 2007,151(3):325-339.
[4] OLOFSDOTTER M, NAVAREZ D, REBULANA M, et al. Weed suppressing rice cultivars-does allelopathy play a role[J]. Weed Research, 1999,39(6):441-454.
[5] LI J Y, ZHANG Q, YANG X Y, et al. A reappraisal of the content and the differences of phenolic acids between allelopathic and non-allelopathic rice accessions[J]. Allelopathy Journal, 2017,40(1):35-46.
[6] MACIA F A, CHINCHILLA N, VARELA R M, et al. Bioactive steroids fromOryzasativaL.[J]. Steroids, 2006,71(7):603-608.
[7] KONG C H, LI H B, HU F, et al. Allelochemicals released by rice roots and residues in soil[J].Plant Soil, 2006,288(1):47-56.
[8] THI H L, CHUNG-HO L, SMEDA R J, et al. Isolation and identification of an allelopathic phenylethylamine in rice[J]. Phytochemistry, 2014,108(12):109-121.
[9] KATO-NOGUCHI H, INO T. Rice seedlings release momilactone B into the environment[J]. Phytochemistry, 2003,63(5):551-554.
[10] KATO-NOGUCHI H, PETERS R J. The role of momilactones in rice allelopathy[J]. Journal of Chemical Ecology, 2013,39(2):175-185.
[11] VOKOU D, DOUVLI P, BLIONIS G J, et al. Effects of monoterpenoids, acting alone or in pairs, on seed germination and subsequent seedling growth[J]. Journal of Chemical Ecology, 2003,29(10):2 281-2 301.
[12] HE H B, WANG H B, FANG C X, et al. Herbicidal effect of a combination of oxygenic terpenoids onEchinochloacrus-galli[J]. Weed Research, 2009,49(2):183-192.
[13] MARTINO L D, MANCINI E, ALMEIDA L F R, et al. The antigerminative activity of twenty-seven monoterpenes[J]. Molecules, 2010,15(9):6 630-6 637.
[14] WEIDENHAMER J D, MACIAS F A, FISCHE N H, et al. Just how insoluble are monoterpenes? [J]. Journal of Chemical Ecology, 1993,19(8):1 799-1 807.
[15] 何海斌,何华勤,林文雄,等.不同化感水稻品种根系分泌物中萜类化合物的差异分析[J].应用生态学报,2005,16(4):732-736.
[16] LI J Y, GUO X K, ZHANG Q, et al. A novel screening method for rice allelopathic potential: the inhibitory-circle method[J]. Weed Research, 2015,55(5):441-448.
[17] DILDAY R H, MATTICE JD, MOLDENHAUER K A. An overview of rice allelopathy in the USA[C]∥KIM K U, SHIN D H. Rice Allelopathy. Korea: Chan Suk Park publish, 2000:15-26.
[18] 李家玉,张奇,何海斌,等.化感水稻抑草圈土壤及提取物的化感作用[J].福建农林大学学报(自然科学版),2014,43(6):632-636.
[19] CARRO M D, IANNI C, MAGI E. Determination of terpenoids in plant leaves by GC-MS: Development of the method and application toOcimumbasilicumandNicotianalangsdorffii[J]. Analytical Letters, 2013,46(4):630-639.
[20] SCHMELZ E A, HUFFAKER A, SIMS J W, et al. Biosynthesis, elicitation and roles of monocot terpenoid phytoalexins[J]. The Plant Journal, 2014.doi:10.1111/tpj.12436.
[21] MACIAS F A, JOSE M M, ROSA M V, et al. Allelopathy-a natural alternative for weed control[J]. Pest Management Science, 2007,63(4):327-348.
(责任编辑:吴显达)
Determination of terpenoids in the stems and leaves of allelopathic rice seedlings and their weed-suppressive activity
LI Jiayu, LIN Zhihua, LI Li, YANG Xiaoyan, ZHANG Qi, HE Haibin
(Fujian Provincial Key Laboratory of Agroecological Processing and Safety Monitoring, College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002)
In order to explore the effect of terpenoids from allelopathic rice on paddy weed, allelopathic rice cultivar PI312777, non-allelopathic rice cultivar Lemont, and barnyardgrass (EchinochloacrusgalliL.) were mixed cultured by inhibitory circle method in pot experiment with paddy soil, with the distance between rice and barnyardgrass being 12 cm. Contents of total terpenoid, monoterpenoid, and oxygenated monoterpenoid in the leaves and stem of rice seedlings were determined by GC-MS technique with microwave-assisted extraction. The results showed that the allelopathic rice PI312777 effectively suppressed the growth of adjacent barnyardgrass, and the contents of total terpenoids, monoterpenoids, and oxygenated monoterpenoids were higher in the leaves and stems of rice PI312777 than those in Lemont. Inhibitory effect of mixture of the target oxygenated monoterpenoids enhanced with the increased concentrations of the mixed solutions, while without inhibitory effect from conventional rice cultivar, Ⅱ Youhang, at low concentration. In conclusion, oxygenated monoterpenoids potentially could be used as an ecological herbicide.
allelopathic rice; oxygenated monoterpenoids; GC-MS, inhibitory-circle method; weed-suppressive activity
2016-07-17
2017-01-12
国家自然科学基金(31370380,31070447);闽台作物特色种质创制与绿色栽培协同创新中心福建2011项目(NO.2015-75).
李家玉(1983-),女,博士,讲师.研究方向:化学生态学.Email:lijiayubnu@126.com.通讯作者何海斌(1965-)男,博士,教授,博士生导师.研究方向:植物化学与化学生态学.Email:alexhhb@126.com.
S181
A
1671-5470(2017)02-0129-06
10.13323/j.cnki.j.fafu(nat.sci.).2017.02.002

