福建省象耳豆根结线虫的鉴定及分子检测
陈淑君, 肖 顺, 程 敏, 邓明雪, 张绍升, 刘国坤
(福建农林大学植物保护学院,福建 福州 350002)
福建省象耳豆根结线虫的鉴定及分子检测
陈淑君, 肖 顺, 程 敏, 邓明雪, 张绍升, 刘国坤
(福建农林大学植物保护学院,福建 福州 350002)
从福建省闽南地区的胡萝卜、辣椒和空心菜根系发现一种线虫,通过形态鉴定,结合ITS1-5.8S-ITS2 rDNA区、28S D2-D3区、COⅡ/IrRNA线粒体基因和线粒体DNA 63 bp重复区序列分析等分子生物学方法,将其鉴定为象耳豆根结线虫;采用特异性引物Me-F/Me-R对不同田块的象耳豆根结线虫种群进行进一步检测,结果表明,空心菜为象耳豆根结线虫的新寄主;受侵染的番石榴可能是闽南地区蔬菜象耳豆根结线虫病的重要初侵染源.由此说明,象耳豆根结线虫已经成为福建省蔬菜上的重要病原物,对蔬菜产业发展具有潜在重大威胁.
福建省; 象耳豆根结线虫; 形态鉴定; 分子检测
根结线虫(Meloidogynespp.)是世界农业生产上最重要的植物病原线虫之一[1],我国的根结线虫种类主要为南方根结线虫(M.incognita)、爪哇根结线虫(M.javanica)和花生根结线虫(M.arenaria).象耳豆根结线虫(M.enterolobii)在我国海南省的象耳豆树(Enterolobiumcontortisiliquum)上被发现[2],玛雅根结线虫(M.mayaguensis)[3]是其同物异名种[4].该线虫寄主范围广,危害严重,且能侵染多种对重要根结线虫具有抗性基因的作物,目前已成为全世界热带及亚热带地区最具潜在威胁性的病原线虫[5].欧洲和地中海植物保护组织(European and Mediterranean Plant Protection Organization,EPPO)及美国和韩国等多个国家均将其列为检疫性有害生物[6].
在我国,象耳豆根结线虫主要寄生于海南省、广东省的多种寄主植物上,包括豆科(Leguminosae)、葫芦科(Cucurbitaceae)、茄科(Sotanaceae)、番石榴(Psidiumguajava)、海巴戟(Morindacitrifolia)、丁香(Syzygiumaromaticum)等[7-8].福建省地处中国东南部,作物种类多样,根结线虫病害发生严重,主要种类为南方根结线虫和爪哇根结线虫.但近年来,象耳豆根结线虫在胡萝卜(Daucuscarotavar.sativus)、香蕉(Musanana)上均有发生[9-10].为此,作者在福建蔬菜产区对象耳豆根结线虫的发生进行调查与鉴定,以期为该线虫的防控提供依据.
1 材料与方法
1.1 样本采集及线虫保存
2014—2016年,在福建省主要蔬菜基地采集样本,以闽南地区蔬菜地为重点.番石榴是象耳豆根结线虫的易感寄主,因此,将番石榴根结线虫病果园及其周边蔬菜基地作为调查重点.采用随机采样法,采集作物根结,装入自封袋并记录.根结线虫种群保存方法:将单卵囊接种于灭菌土内的感病番茄(Lycospersiconesukurentamu)根部进行繁殖.
1.2 根结线虫的形态鉴定
根结线虫雌虫的分离采用直接剥离法;雄虫常黏附在卵囊周边,可以直接挑离;2龄幼虫由卵囊孵化.线虫的杀死、TAF固定、会阴花纹等标本制作均参照文献[11].在尼康Ni-U光学显微镜(配电脑摄像及测量系统)下直接拍照,并根据De Man公式[11]测计线虫各虫态的体长、体宽、口针长、DGO(背食道腺开口至口针基部球的距离)、EP(排泄孔至头端距离)、h(尾后部的透明区长)、尾长等.每个特征观察20个标本以上.
1.3 象耳豆根结线虫的分子鉴定及检测
1.3.1 DNA提取 线虫DNA的提取参照2龄幼虫微量DNA提取方法[12].将1~3条2龄幼虫经无菌水清洗2~3次后,挑入预先滴在灭菌干净载玻片上的4 μL WLB(线虫裂解液)中,在体视镜下用挑针将2龄幼虫从中间压成2段,用移液枪吸取并转移至含有预冷的17 μL WLB和1.2 μL蛋白酶K(1.2 mg·mL-1,TaKaRa)的eppendorf管中,迅速移至-20 ℃冰箱过夜.次日将离心管放入PCR仪中,65 ℃恒温1 h;95 ℃恒温10 min后,10 000 r·min-1离心1 min.取DNA悬浮液进行扩增或于-20 ℃冰箱保存备用.
1.3.2 靶标序列的的扩增 试验中所用引物由上海Sangon公司设计.25 μL PCR反应体系:DNA模版2 μL,引物对(10 nmol·mL-1)各1 μL,10×PCR Mix 12.5 μL,加ddH2O至25 μL.
(1)rDNA-ITS序列扩增.上下游引物为V5367/26S(5′-TTGATTACGTCCCTGCCCTTT-3′,26S:5′-TTTCACTCGCCGTTACTAAGG-3′)[13].PCR反应程序:94 ℃,4 min;94 ℃,30 s,55 ℃,30 s,72 ℃,60 s,35个循环;72 ℃,10 min;4 ℃,保存.
(2)28S D2-D3区序列扩增.上下游引物为D2A/D3B(5′-ACAAGTACCGTGAGGGAAAGTTG-3′,5′-TCGGAAGGAACCAGCTACTA-3′)[14].PCR反应程序:94 ℃,4 min;94 ℃,40 s,51 ℃,40 s,72 ℃,60 s,35个循环;72 ℃,10 min;4 ℃,保存.
(3)mtDNA的COⅡ与IrRNA基因间序列的扩增.上下游引物为C2F3/MRH106(5′-GGTCAATGTTCAGAAATTTGTGG-3′,5′-AATTTCTAAAGACTTTTCTTAGT-3′)[15].PCR反应程序:94 ℃,4 min;94 ℃,40 s,50 ℃,30 s,72 ℃,120 s,38个循环;72 ℃,10 min;4 ℃,保存.
(4)mtDNA 63 bp重复序列区扩增.上下游引物为63VNL/63VTH(5′-GAAATTGCTTTATTGTTACTAAG-3′,5′-TAGCCACAGCAAAATAGTT TTC-3′)[16].PCR反应程序:94 ℃,4 min;94 ℃,30 s,50 ℃,30 s,72 ℃,90 s,35个循环;72 ℃,10 min;4 ℃,保存.
将上述PCR产物进行1% Agagrose胶电泳检测、拍照观察并保存图片后,送至铂尚生物技术(上海)有限公司进行双向测序.测出的序列在GenBank登录并比对分析.
1.3.3 象耳豆根结线虫特异性引物检测 象耳豆根结线虫特异性引物为Me-F/Me-R(5′-AACTTTTGTGAAAGTGCCGCTG-3′,5′-TCAGTTCAGGCAGGATCAACC-3′)[17].PCR反应程序:94 ℃,4 min;94 ℃,30 s,62 ℃,30 s,72 ℃,60 s,38个循环;72 ℃,10 min;4 ℃,保存.
2 结果与分析
在福建省闽南东山岛、诏安、云霄等县(市)的番石榴、辣椒(Capsicumannuum)、胡萝卜、空心菜(Ipomoeaaquatic)等根系均鉴定到象耳豆根结线虫.在诏安县辣椒、龙海市空心菜发现象耳豆根结线虫的田块均位于发生象耳豆根结线虫病的番石榴基地旁.
2.1 4种受害寄主根结的主要症状特点
象耳豆根结线虫侵染为害番石榴、辣椒、胡萝卜、空心菜后均可造成严重的根结症状.在番石榴、辣椒上可形成大小不等的明显根结,根结处后期易腐烂,严重衰退,甚至死亡(图1A,B);受害胡萝卜肉质根可形成圆形或不规则隆起,隆起根结处易产生次生根,并易受侵染,形成明显根结,严重影响胡萝卜产量与品质(图1C);空心菜根系受害后,在侧根与主根上形成小根结,根结多在根上一侧隆起,后期产生明显卵囊(图1D).
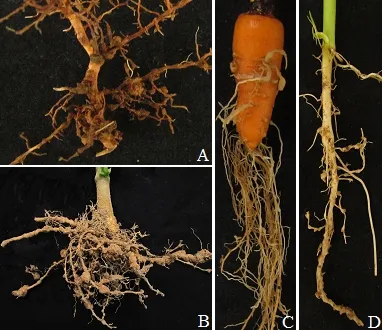
A.番石榴根部症状;B.辣椒根部症状;C.胡萝卜根部症状;D.空心菜根部症状.
2.2 象耳豆根结线虫的主要形态特点
从番石榴、辣椒、胡萝卜、空心菜分离到的根结线虫种群的形态测量值见表1.雌虫虫体梨形,头冠高,头区无环纹,口针纤细,锥体部与杆部基本等长,基部球明显,卵圆形,边缘略后倾.会阴花纹总体特征表现:整体圆形至卵圆形,线纹大多细密,背弓圆形至方形,中等至高;多数个体会阴花纹无侧线,但少数个体一侧或两侧具有微弱的侧线(图2).雄虫头冠高圆,头区无环纹,略缢缩;口针粗壮、直,口针基部球大,圆形与杆部分界明显,边缘向后倾斜.2龄幼虫头区无环纹,略缢缩;口针纤细,基部球小而圆,与杆部分界明显,边缘向后倾斜;尾部至尾端渐变细,末端钝圆,透明区明显.其测量值范围与形态特征均与文献[2]的象耳豆根结线虫描述相符.
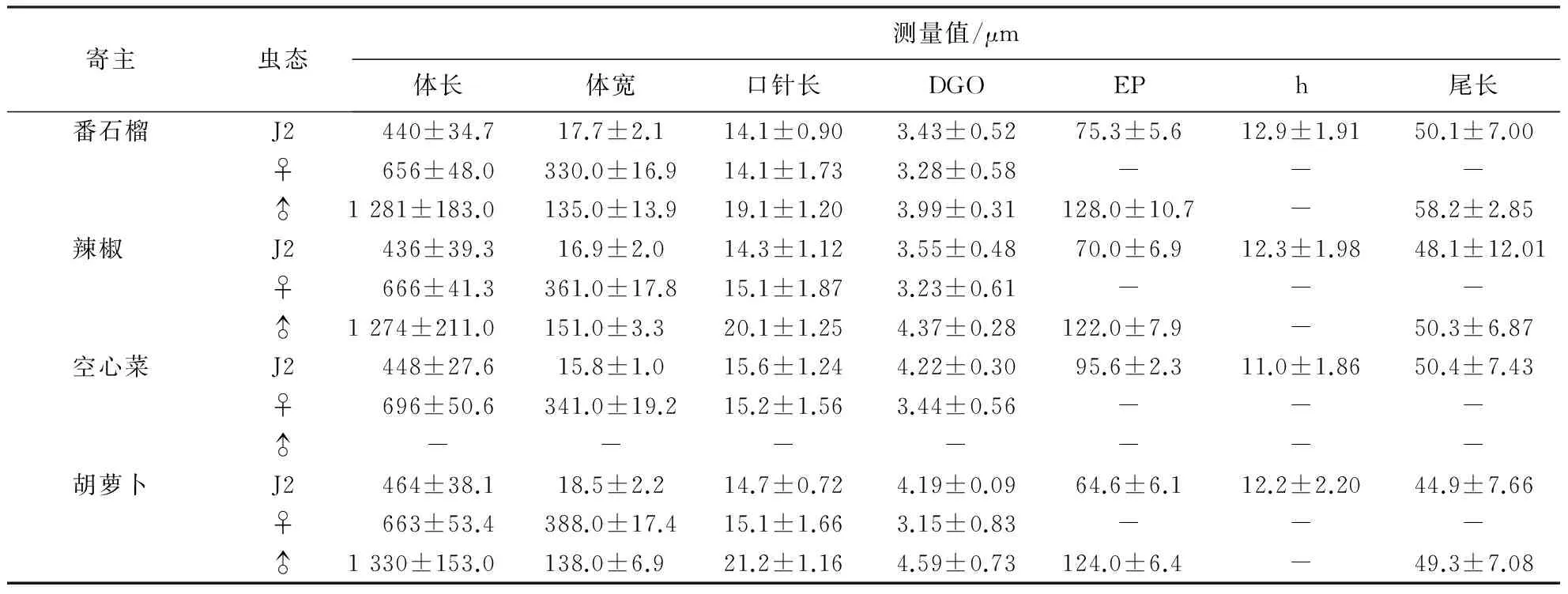
表1 象耳豆根结线虫种群的形态测量值(平均值±标准差)1)
1)J2=2龄幼虫;DGO=背食道腺开口至口针基部球的距离;EP=排泄孔至头端距离;h=尾后部的透明区长.
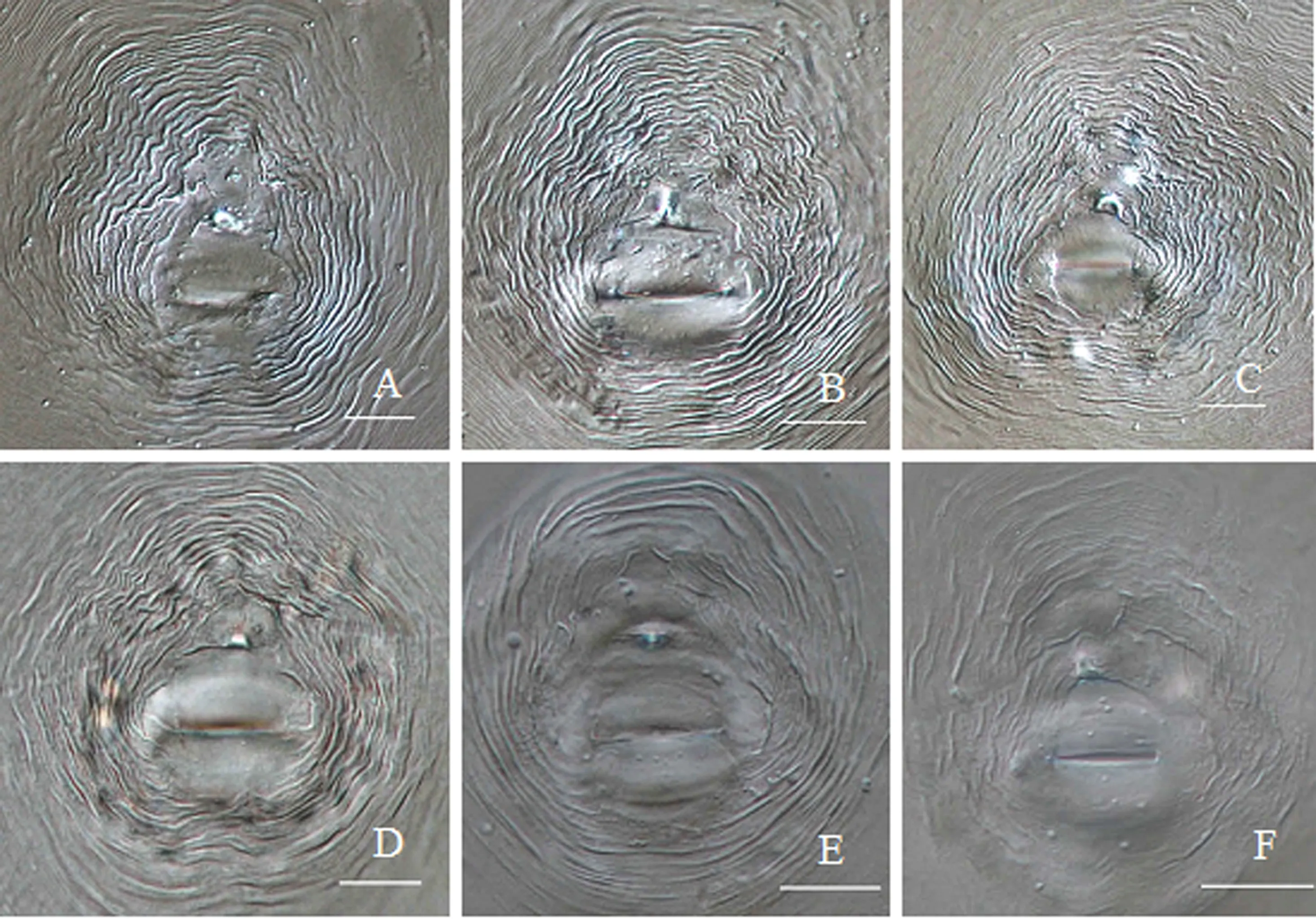
A-C.辣椒寄主;D.胡萝卜寄主;E.空心菜寄主;F.番石榴寄主(比例尺:20 μm).
2.3 分子生物学鉴定与检测
2.3.1 不同靶标基因扩增与比对 对采自福州、漳州番石榴、胡萝卜、辣椒、空心菜上的12个根结线虫种群进行了靶标基因扩增测序,并在GenBank上登录,其序列号见表2.利用V5367/26S引物对种群rDNA-ITS区均扩增出770 bp大小的条带,11个种群间的序列相似性为100%,与GenBank中象耳豆根结线虫的同区域序列(KJ146863.1、KF418369.1)相似性达99%~100%. 利用D2A/D3B扩增的28S D2-D3区条带为760 bp左右,11个种群间的序列相似性为100%,与GenBank中象耳豆根结线虫的同区域序列(KT354576.1、KT354574.1、KT354568.1)相似性达98%~100%. 采用C2F3/MRH106扩增的mtDNA的COⅡ与IrRNA基因间序列,均为约840 bp大小的条带,12个种群间的序列相似性为100%,与GenBank中象耳豆根结线虫的同区域序列(KJ146864.1)相似性达99%.利用63VNL/63VTH 扩增mtDNA 63 bp重复区序列,所检测的11个种群均获得320 bp大小的单一条带,种群间的序列相似性为100%,与GenBank中象耳豆根结线虫的同区域序列(KJ146861.1)相似性达99%~100%.上述靶标基因的扩增条带大小均与文献[16]一致;序列比对结果也表明,所有的测定种群均为象耳豆根结线虫.
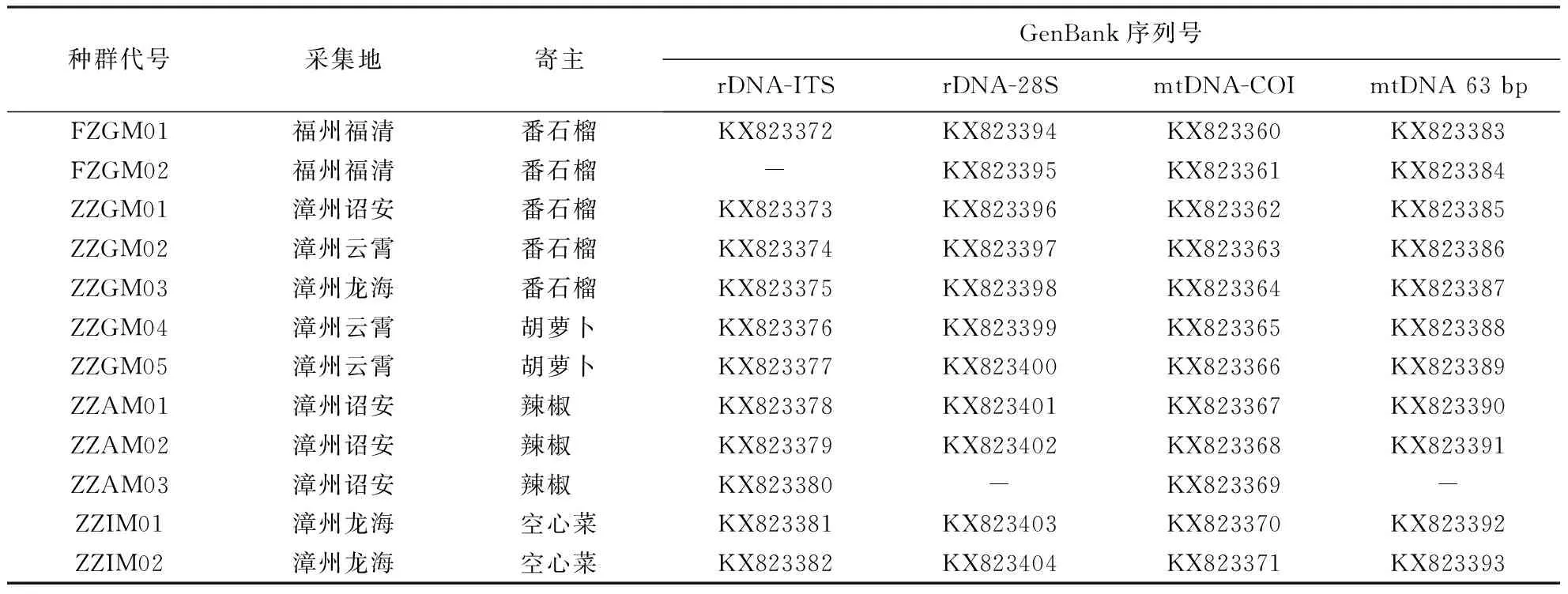
表2 本研究中象耳豆根结线虫种群及靶标基因序列登录号
2.3.2 特异性引物扩增 从发生根结线虫的空心菜、辣椒田块和经鉴定发生象耳豆根结线虫的蔬菜地,每块地随机采样5份,分离单雌虫,DNA提取后,采用特异性引物Me-F/Me-R进行随机扩增,均扩增出大小约236 bp的目的条带(图3),与Long et al[17]报道的条带大小一致,确定该种群为单一种群,均为象耳豆根结线虫.
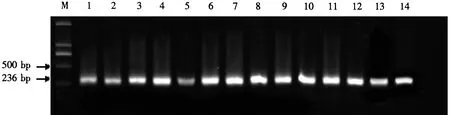
M.DL2000 DNA marker;1-5.辣椒寄主;6-10.空心菜寄主;11-14.番石榴寄主.
3 讨论
3.1 象耳豆根结线虫在福建蔬菜上的发生情况
通过形态学鉴定与分子生物学方法检测,在闽南地区诏安辣椒、云霄胡萝卜、龙海空心菜上均发现了象耳豆根结线虫.这是继闽南东山岛胡萝卜上发生象耳豆根结线虫[9]后的进一步发现,表明象耳豆根结线虫在闽南蔬菜产区已呈点状分布,植株受害严重.目前,已报道象耳豆根结线虫的寄主超过8个科20多个种[18],本次调查中空心菜是象耳豆根结线虫的新寄主.
孟永攀[19]用最优模型Maxent对象耳豆根结线虫在中国的潜在适生区进行了分析,表明福建南部为最佳适生区、高度适生区或中度适生区,福建中南部为低度适生区.目前,象耳豆根结线虫的分布,除福建中南部地区的福清市外,其余均在福建南部地区[9-10],与孟永攀[19]的研究结果吻合.
3.2 福建省象耳豆根结线虫病的侵染源
象耳豆根结线虫是番石榴上最重要的病原线虫,分布于四大洲近20个国家或地区,包括我国海南省,可引起植株严重衰退,造成重大的经济损失[8].闽南是种植番石榴的重要地区.本次调查发现,福建省发生的番石榴根结线虫均为象耳豆根结线虫,且危害严重.发生象耳豆根结线虫的诏安辣椒、龙海空心菜地块,均与发生番石榴根结线虫的地块紧邻.Zhou et al[10]在福建长泰县香蕉上发现象耳豆根结线虫寄生为害,其周边的田块即为番石榴象耳豆根结线虫病发生地.因此,番石榴上的象耳豆根结线虫可能是闽南地区蔬菜产区线虫病的重要初侵染源.线虫极易通过种苗、流水或农事活动等扩散到相邻的蔬菜等寄主植物上.鉴于象耳豆根结线虫寄主范围广,毒性强,危害严重,相关检疫部门或农业部门应给予高度重视,早日加强象耳豆根结线虫的预警与监控,防止该线虫的扩散与传播.
[1] JONES J T, HAEGEMAN A, DANCHIN E G J, et al. Top 10 plant-parasitic nematodes in molecular plant pathology[J]. Molecular Plant Pathology, 2013,46(2):946-961.
[2] YANG B, EISENBACK J D.Meloidogyneenterolobiin. sp. (Meloidogynidae), a root-knot nematode parasitizing pacara earpod tree in China[J]. Journal of Nematology, 1983,15(3):381-391.
[3] RAMMAH A, HIRSCHMANN H.Meloidogynemayaguensisn. sp. (Meloidogynidae), a root-knot nematode from Puerto Rico[J]. Journal of Nematology, 1988,20(1):58-69.
[4] KARSSEN G, LIAO J, KAN Z, et al. On the species status of the root-knot nematodeMeloidogynemayaguensisRammah & Hirschmann, 1988[J]. Zookeys, 2012,181:67-77.
[5] BRITO J, POWERS T O, MULLIN P G, et al. Morphological and molecular characterization ofMeloidogynemayaguensisisolates from Florida[J]. Journal of Nematology, 2004,36(3):232-240.
[6] 何旭峰,彭焕,丁中,等.植物罹病组织中象耳豆根结线虫的LAMP快速检测方法[J].中国农业科学,2013,46(3):534-544.
[7] 刘昊,龙海,鄢小宁,等.海南省番石榴根结线虫病病原的种类鉴定及其寄主范围的测试[J].南京农业大学学报,2005,28(4):55-59.
[8] 卓侃,胡茂秀,廖金铃,等.广东省和海南省象耳豆根结线虫的鉴定[J].华中农业大学学报,2008,27(2):193-197.
[9] WANG Y F, XIAO S, HUANG Y K, et al. First report ofMeloidogyneenterolobiion carrot in China[J]. Plant Disease, 2014,98(7):1 019.
[10] ZHOU X, CHENG X, XIAO S, et al. First report ofMeloidogyneenterolobiion banana in China[J]. Plant Disease, 2016,100(4):869.
[11] 张绍升.植物线虫病害诊断与治理[M].福州:福建科学技术出版社,1999.
[12] ZHANG S L, LIU G K, JANSSEN T, et al. A new stem nematode associated with peanut pod rot in China: morphological and molecular characterization ofDitylenchusarachisn. sp. (Nematoda: Anguinidae)[J]. Plant Pathology, 2014,63(5):1 193-1 206.
[13] VRAIN T C, WAKARCHUK D A, LÉVESQUE A C, et al. Intraspecific rDNA restriction fragment length polymorphism in theXiphinemaamericanumgroup[J]. Fundamental and Applied Nematology, 1992,15(6):563-573.
[14] SUBBOTIN S A, STURHAN D, CHIZHOV V N, et al. Phylogenetic analysis of Tylenchida Thorne, 1949 as inferred from D2 and D3 expansion fragments of the 28S rRNA gene sequences[J]. Nematology, 2006,8(3):455-474.
[15] STANTON J, HUGALL A, MORITZ C. Nucleotide polymorphisms and an improved PCR-based mtDNA diagnostic for parthenogenetic root-knot nematodes (Meloidogynespp.)[J]. Fundamental & Applied Nematology, 1997,20(3):261-268.
[16] BLOK V C, WISHART J, FARGETTE M, et al. Mitochondrial DNA differences distinguishingMeloidogynemayaguensisfrom the major species of tropical root-knot nematodes[J]. Nematology, 2002,4(7):773-781.
[17] LONG H, LIU H, JIAN-HUA X U. Development of a PCR diagnostic for the root-knot nematodeMeloidogyneenterolobii[J]. Acta Phytopathologica Sinica, 2006,36(2):109-115.
[18] CACTUS S T, IN I I C, DESCRIBED H, et al.Meloidogyneenterolobii[J]. Eppo Bulletin, 2014,44(2):159-163.
[19] 孟永攀.象耳豆根结线虫潜在适生区分析与风险评估[D].广州:华南农业大学,2012.
(责任编辑:杨郁霞)
Identification and molecular detection ofMeloidogyneenterolobiiin Fujian Province
CHEN Shujun, XIAO Shun, CHENG Min, DENG Mingxue, ZHANG Shaosheng, LIU Guokun
(College of Plant Protection, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
MeloidogyneenterolobiionDaucuscarotavar.sativus,CapsicumfrutescensandIpomoeaaquaticin the southern area of Fujian Province were identified by morphological characteristics and molecular characters, including the ITS1-5.8S-ITS2 rDNA region, 28S D2-D3 region, the COⅡ and theIrRNA mtDNA genes and mtDNA 63 bp repeat region. Furthermore, specific primers Me-F/Me-R forM.enterolobiiwere used for detecting nematode population in southern Fujian. This is the first report ofI.aquaticinfection byM.enterolobii, indicating thatPsidiumguajavaparasitized byM.enterolobiimay be an initial infection source for vegeTable in southern Fujian. To summarize, precaution ought to be taken sinceM.enterolobiihas posed significant threat to vegetable industry in Fujian Province.
Fujian Province;Meloidogyneenterolobii; morphological identification; molecular detection
2016-09-30
2016-10-27
国家自然科学基金项目(31171828);福建省蔬菜产业重大农技推广服务试点项目资助.
陈淑君(1990-),女,硕士研究生.研究方向:根结线虫分类.Email:chenshujuntale@126.com.通讯作者刘国坤(1972-),男,教授.研究方向:植物线虫病害及其防治.Email:liuguok@126.com.
S432.4
A
1671-5470(2017)02-0141-06
10.13323/j.cnki.j.fafu(nat.sci.).2017.02.004

