银杏叶聚戊烯醇对Aβ25-35诱导dPC12细胞损伤的保护作用研究Δ
陈卫卫,梁 迪,赵其秀,罗 毅,刘灵杰,莫丽萍,黄俊善,李海涛,3#(.广西中医药大学药学院,南宁53000;.南京中医药大学药学院,南京 003;3.江苏银杏研究院,江苏邳州 300)
银杏叶聚戊烯醇对Aβ25-35诱导dPC12细胞损伤的保护作用研究Δ
陈卫卫1,2,3*,梁 迪1,赵其秀2,罗 毅1,刘灵杰1,莫丽萍1,黄俊善1,李海涛2,3#(1.广西中医药大学药学院,南宁530001;2.南京中医药大学药学院,南京 210023;3.江苏银杏研究院,江苏邳州 221300)
目的:研究银杏叶聚戊烯醇(GP)对β淀粉样肽25-35(Aβ25-35)诱导dPC12细胞损伤的保护作用,为其用于阿尔茨海默病(AD)的治疗提供参考。方法:以神经生长因子(NGF)诱导PC12细胞分化为具有神经活性的dPC12细胞后,将dPC12细胞分为正常对照组(DMSO培养基)、Aβ25-35处理组(DMSO培养基)和GP试验组(分别含25、50、100、200、400µg/mL GP的DMSO培养基),培养24 h后,Aβ25-35处理组和GP试验组细胞均加入25 μmol/LAβ25-35诱导细胞损伤(即复制AD细胞模型),24 h后采用MTT法测定细胞存活率。另取细胞分为正常对照组(DMSO培养基)、Aβ25-35处理组(DMSO培养基)和GP试验组(分别含25、50、100、200 µg/mL GP的DMSO培养基),同法处理后检测细胞培养液中乳酸脱氢酶(LDH)、活性氧(ROS)、丙二醛(MDA)水平。结果:与Aβ25-35处理组比较,50、100、200、400µg/mL GP试验组dPC12细胞的存活率明显升高(P<0.05或P<0.01),100、200µg/mL GP试验组细胞培养液中LDH、ROS和MDA水平以及50µg/mL GP试验组细胞培养液中ROS水平均显著降低(P<0.05或P<0.01),且呈一定的浓度依赖性。结论:GP对Aβ25-35致dPC12损伤有一定的保护作用,为一种潜在的AD治疗药物。
银杏叶;聚戊烯醇;β淀粉样肽25-35;dPC12细胞;乳酸脱氢酶;活性氧;丙二醛
银杏叶为银杏(Ginkgo biloba L.)的干燥叶,被收载于2015年版《中国药典》(一部)中,具有活血化瘀、通络止痛、化浊降脂等功效[1],在临床使用较为广泛。迄今为止,已从银杏叶中发现了160多种化合物,主要包括黄酮、萜内酯、多糖、聚戊烯醇、挥发油及甾醇等。银杏叶聚戊烯醇(Polyprenols from the Ginkgo biloba leaves,GP)是银杏叶中一种具有显著生理活性的天然化合物,由15~21个异戊烯基单元构成,在银杏叶中的含量为1.0%~2.0%,高于银杏黄酮(0.8%~2.0%)和银杏萜内酯(0.2%~0.4%)[2-4]。研究表明,GP对高血压、糖尿病、慢性肝炎及肿瘤等具有明显改善作用,但关于其对阿尔茨海默病(Alzheimer’s disease,AD)的研究尚未见报道。国外对针叶聚戊烯醇的研究较为多见,将其用于早、中期AD和其他脑疾病的治疗观察研究中发现聚戊烯醇能提高认知能力、改善脑损伤程度和影响酶活性,对于脑疾病有一定的疗效[5-8]。因此,本实验以GP为研究对象,以神经生长因子(NGF)诱导PC12细胞分化为具有神经活性的dPC12细胞后,通过体外β淀粉样肽25-35(Aβ25-35)诱导dPC12细胞损伤,制备体外AD细胞模型,探讨GP的神经保护作用,为GP在AD的治疗研究方面提供理论依据,并为神经保护药物的研发提供实验依据。
1 材料
1.1 仪器
RT-6000酶标分析仪(深圳雷杜生命科学股份有限公司);FA2004电子天平(上海越平科学仪器有限公司);Sorvall ST16台式高性能离心机(美国Thermo公司);IX51荧光倒置显微镜(日本Olympus公司)。
1.2 提取物与试剂
GP(广西中医药大学药学院自制,批号:20150109,纯度:74.69%);胎牛血清(美国Hyclone公司);马血清、双抗(青链霉素)购自杭州四季青有限公司;微量丙二醛(MDA)试剂盒(批号:20150810)、乳酸脱氢酶(LDH)试剂盒(批号:20150615)均购自南京建成生物工程研究所;活性氧(ROS)检测试剂盒(批号:S0033)均购自碧云天生物技术研究院;Aβ25-35、NGF、二甲基亚砜(DMSO)、MTT均购自美国Sigma公司。
1.3 细胞株
鼠肾上腺嗜铬细胞瘤单克隆细胞系PC12细胞购自中国科学院上海生化与细胞所。
2 方法
2.1 GP的保存及Aβ25-35老化处理
取GP 40 mg,精密称定,溶于1 mL DMSO中,滤过除菌,分装,4℃条件下保存,备用。
[9-10]中方法,将1 mg Aβ25-35粉末溶于0.943 mL灭菌Mili-Q水中,制备成1 mmol/L的母液,振荡混匀,一次性无菌滤器过滤后于37℃环境中进行至少1周的老化,使其老化聚集产生神经毒性。将老化聚集的Aβ25-35溶液用1.5 mL EP管分装,-20℃冰箱中保存。试验前用所需培养液或细胞外液稀释至所需浓度。
2.2 PC12细胞培养
将PC12细胞培养于含6%马血清、6%胎牛血清和1%青链霉素的DMEM完全培养基中,在37℃、5%CO2培养箱中培养。隔天换液、传代,取状态良好的处于对数生长期的细胞用于试验。
2.3 NGF诱导PC12细胞分化
将对数生长期的PC12细胞接种于事先经0.1%多聚赖氨酸包被的96孔板中,接种密度为1×103个/孔。培养24 h后,换成含NGF(50 ng/mL)的分化培养基,置于37℃、5%CO2培养箱中继续培养。隔天换液,连续诱导分化6 d,得到分化的PC12细胞(即dPC12细胞),在荧光倒置显微镜下观察细胞的生长状态。
2.4 Aβ25-35对dPC12细胞的损伤作用
将dPC12细胞接种于96孔板中,每孔加入不同量的Aβ25-35,作为终浓度分别为6.25、12.50、25、50µmol/L的Aβ25-35处理组,同时设置正常对照组(加等体积的DMSO完全培养基正常培养,不作其他处理),共5组。各组细胞数基本相同,每组设6个复孔。将细胞置于37℃、5% CO2培养箱中培养24 h后,观察不同浓度Aβ25-35对dPC12细胞的损伤情况。每孔加入20µL MTT溶液(5 mg/mL),使MTT终质量浓度为0.5 mg/mL,37℃孵育4 h后终止培养。吸净上清,加入150µL DMSO,室温振荡10 min,使结晶物充分溶解,最后在酶标分析仪上测定570 nm波长处的光密度(OD)值。计算细胞的存活率(SR)[SR(%)=(试验组OD值/正常对照组OD值)×100%],以筛选最佳的损伤浓度。
2.5 GP对dPC12细胞存活率的影响
将dPC12细胞接种于96孔板中,每孔加入不同质量浓度的GP溶液,作为终质量浓度分别为25、50、100、200、400µg/mL的GP试验组,另设正常对照组(加等体积DMSO完全培养基常规培养,不作其他处理),共6组。各组细胞数基本相同,每组6个复孔。将细胞置于37℃、5%CO2培养箱中培养24 h。根据“2.4”项下方法操作,考察细胞的存活率。
2.6 GP对Aβ25-35诱导dPC12细胞损伤的保护作用
将dPC12细胞接种于96孔板中,试验共设置7组,分别为正常对照组(加等体积的DMSO完全培养基常规培养,不作其他处理)、Aβ25-35处理组(先用等体积DMSO完全培养基培养细胞24 h,再加入终浓度为25µmol/L的Aβ25-35溶液继续培养24 h)与GP试验组(先分别经25、50、100、200、400µg/mL GP药液预处理24 h,再加入终浓度为25µmol/L的Aβ25-35溶液继续培养24 h)。各组细胞数基本相同,每组6个复孔。将细胞置于37℃、5% CO2培养箱中培养24 h。根据“2.4”项下方法操作,考察细胞的存活率。
2.7 GP对Aβ25-35诱导损伤的dPC12细胞培养液中LDH、ROS和MDA水平的影响
将dPC12细胞接种于96孔板中,试验共设置5组,分别为正常对照组(加等体积的DMSO完全培养基常规培养,不作其他处理)、Aβ25-35处理组(先用等体积DMSO完全培养基培养细胞24 h,再加入终浓度为25µmol/L的Aβ25-35溶液继续培养24 h)与GP试验组(先分别经50、100、200µg/mL GP药液预处理24 h,再加入终浓度为25µmol/L的Aβ25-35溶液继续培养24 h)。各组细胞数基本相同,每组6个复孔。细胞培养24 h后,根据试剂盒说明书检测细胞培养培养液中LDH、ROS和MDA水平。
2.8 统计学方法
采用GraphPad Prism 6软件进行统计分析。数据以±s表示,采用独立样本t检验进行组间的两两比较。P<0.05表示差异有统计学意义。
3 结果
3.1 NGF诱导PC12细胞分化结果
常规条件下PC12细胞的形态与嗜铬瘤细胞相似,呈圆形、短梭形或三角形,有的细胞两极有短突起;当用NGF处理后,可分化成类交感神经元样细胞,形成轴突样突起,细胞胞浆中还伸出多条其他突起,突起长短不一、数目不等,细胞之间相互连接交织成网,结果见图1。
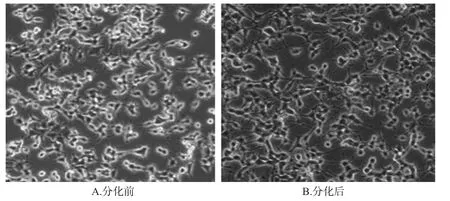
图1 PC12细胞分化前、后的形态变化Fig 1 Morphological changes of PC12 cells before and after differentiation
3.2 Aβ25-35对dPC12细胞的损伤作用考察结果
与正常对照组比较(细胞存活率为100%),Aβ25-35处理组在浓度为6.25~50µmol/L时对dPC12细胞有明显损伤作用(P<0.05或P<0.01),且随着Aβ25-35浓度的增加细胞存活率也随之明显下降,呈现浓度依赖性。当Aβ25-35浓度为12.5µmol/L时,细胞的存活率为83.18%,表明其对dPC12细胞的活性产生了明显的抑制作用(P<0.01)。Aβ25-35诱导PC12细胞损伤的半数抑制浓度(IC50)约为25µmol/L,因此本研究选择25µmol/L Aβ25-35处理dPC12细胞以复制AD细胞模型。
3.3 GP对dPC12细胞存活率的影响考察结果
GP试验组的溶剂DMSO对dPC12细胞存活率基本无影响;不同质量浓度GP(25~400µg/mL)与dPC12细胞共孵育24 h后,各组细胞存活率分别为100%、97.43%、97.43%、105%、100%,差异均无统计学意义(P>0.05),表明GP在25~400µg/mL质量浓度范围时对dPC12细胞无毒性作用。
3.4 GP对Aβ25-35诱导dPC12细胞损伤的保护作用考察结果
与正常对照组比较(细胞存活率为100%),Aβ25-35处理组细胞存活率(55.26%)显著降低(P<0.01)。与Aβ25-35处理组比较,GP试验组用25µg/mL GP预处理后,细胞存活率(59.00%)无显著变化(P>0.05);用50~400µg/mL GP预处理后,细胞存活率(分别为68.18%、76.27%、88.63%、86.36%)均显著升高(P<0.05或P<0.01)。这提示GP可以减轻Aβ25-35诱导的神经细胞毒性,对dPC12细胞有一定保护作用。
3.5 GP对Aβ25-35诱导损伤dPC12细胞培养液中LDH、ROS、MDA水平的影响
与正常对照组比较,Aβ25-35处理组细胞培养液中LDH、ROS、MDA水平均显著升高(P<0.01);与Aβ25-35处理组比较,100、200µg/mL GP试验组细胞培养液中LDH、ROS、MDA水平以及50µg/mL GP试验组细胞培养液中ROS水平均显著降低(P<0.05或P<0.01),呈一定的浓度依赖性。这提示GP可保护细胞膜的完整性,从而有效对抗Aβ25-35诱导的dPC12细胞损伤,结果见图2。
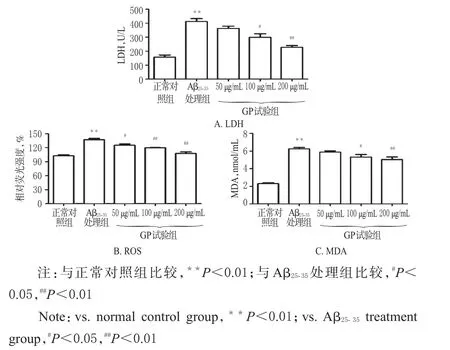
图2 各组细胞培养液中LDH、ROS和MDA水平测定结果Fig 2 Determination results of LDH,ROS and MDA levels in cell culture medium in each group
4 讨论
银杏叶提取物对脑局部缺血、癫痫发作、外周性神经炎具有神经保护作用,临床上用于治疗早期AD、血管性痴呆等疾病,但是银杏叶提取物化学成分复杂,其抗AD的物质基础未能阐明[11]。AD是老年人常见的神经退行性疾病,其发病可能与Aβ诱导的神经元凋亡密切相关。PC12细胞具有神经嵴源性和神经细胞特点,经NGF诱导后产生神经元样细胞,是目前比较公认的用来制作AD模型的细胞之一。Aβ是一种分子量为4.2 kD的多肽,含39~42个氨基酸,是许多正常细胞内的β淀粉样前体蛋白(β-amyloid precursor protein,APP)的裂解产物。Aβ通常以Aβ1-40和Aβ1-42两种形式存在,其中Aβ1-42更易沉积,是老年斑的主要成分;Aβ25-35是Aβ生物活性片段,25-35位氨基酸序列呈β折叠是引起神经毒性必需的结构。研究表明,凝聚态Aβ25-35在体或离体条件下皆可表现出神经细胞毒性作用,诱导细胞凋亡,故Aβ25-35常被广泛应用于体内外AD模型制备的研究中[12-13]。在正常细胞中,LDH是主要存在细胞内的胞浆酶,细胞凋亡裂解时,LDH会释放到细胞外基质液中。因此,可以通过测定细胞培养液中LDH的含量来反映细胞损伤的程度[14]。机体受到毒性刺激时,细胞内ROS的产生与抗氧化防御之间失去平衡,导致ROS在体内蓄积,损伤细胞功能直至细胞死亡。MDA是神经元脂质过氧化物的产物,可结合蛋白质、磷脂等物质,使膜通透性增加,引起膜内外离子浓度失衡,造成细胞损伤。细胞培养液中ROS、MDA水平也可评价神经细胞损伤的程度。
本试验研究了GP对Aβ25-35诱导dPC12细胞损伤的影响。结果显示,给予Aβ25-35处理dPC12细胞后,细胞存活率显著下降,细胞培养液中LDH、ROS、MDA水平也显著升高,这提示造模成功。用GP预处理dPC12细胞后,再用Aβ25-35诱导细胞损伤,结果与Aβ25-35处理组比较细胞存活率显著升高,细胞培养液中LDH、ROS、MDA水平明显降低,且呈一定的浓度依赖性,这提示GP具有拮抗Aβ25-35诱导dPC12细胞损伤的作用,可保护细胞膜完整性、减轻细胞损伤。GP作为一种潜在的抗AD药物,其作用机制值得进一步研究。
参考文献
[1] 田季雨,刘澎涛,李斌.银杏叶提取物化学成分及药理活性研究进展[J].国外医学中医中药分册,2004,26(3):142-145.
[2] 夏晓晖,张宇,郗砚彬.银杏叶化学成分研究进展[J].中国实验方剂学杂志,2009,15(9):100-104.
[3] 陈西娟,王成章,叶建中.银杏叶化学成分及其应用研究进展[J].生物质化学工程,2008,42(4):57-62.
[4] 周春华,陈鹏,陶俊,等.银杏叶聚戊烯醇研究进展[J].中成药,2009,31(9):1416-1419.
[5] Fedotova J,Soultanov V,Nikitina T,et al.Cognitive-enhancing activities of the polyprenol preparation Ropren®in gonadectomized β-amyloid(25-35)rat model of Alzheimer’s disease[J].Physiol Behav,2016,157(1):55-62.
[6] Lee JS,Kim HG,Lee HW,et al.Hippocampal memory enhancing activity of pine needle extract against scopolamine-induced amnesia in a mouse model[J].Sci Rep,2015,doi:10.1038/srep09651.
[7] Fedotova luO,Sultanov VS,Kuznetsova NN,et al.Effect of new polyprenol drug ropren on anxiety-depressive-like behavior in rats with experimental Alzheimer disease[J]. Eksp Klin Farmakol,2010,73(9):2-5.
[8] Wang C,He L,Yan M,et al.Effects of polyprenols from pine needles of Pinus massoniana on ameliorating cognitive impairment in a D-galactose-induced mouse model[J]. Age:Dordr,2014,doi:10.1007/s11357-014-9676-6.
[9] Ahn BR,Moon HE,Kim HR,et al.Neuroprotective effect of edible brown alga Eisenia bicyclis on amyloid beta peptide-induced toxicity in PC12 cells[J].Arch Pharm Res,2012,35(11):1989-1998.
[10] Liu YM,Li ZY,Hu H,et al.Tenuifolin,a secondary saponin from hydrolysates of polygalasaponins,counteracts the neurotoxicity induced by Aβ25-35 peptides in vitro and in vivo[J].Pharmacol Biochem Behav,2015,doi:10.1016/j.pbb.2014.11.010.
[11] 王志娟,高尔,法志强.银杏叶提取物治疗阿尔茨海默病的研究进展[J].中国药房,2007,18(36):2863-2865.
[12] D’Ursi AM,Armenante MR,Guerrini R,et al.Solution structure of amyloid β-peptide(25-35)in different media [J].J Med Chem,2004,47(17):4231-4238.
[13] Giunta S,Galeazzi R,Valli MB,et al.Transferrin neutralization of amyloid beta25-35 cytotoxicity[J].Clin Chim Acta,2004,350(1/2):129-136.
[14] 苏如维,林旭文,庄晓峰.黄芩素对过氧化氢致PC12细胞损伤的保护作用研究[J].中国药房,2008,19(15):1141-1143.
Study on Protective Effects of the Polypentenol from Ginkgo biloba Leaf on Aβ25-35-induced Damage in dPC12 Cells
CHEN Weiwei1,2,3,LIANG Di1,ZHAO Qixiu2,LUO Yi1,LIU Lingjie1,MO Liping1,HUANG Junshan1,LI Haitao2,3(1.School of Pharmacy,Guangxi University of Chinese Medicine,Nanning 530001,China;2.School of Pharmacy,Nanjing University of Chinese Medicine,Nanjing 210023,China;3.Jiangsu Institute of Ginkgo Biloba,Jiangsu Pizhou 221300,China)
OBJECTIVE:Study the protective effect of the polypentenol from Ginkgo biloba leaf(GP)on Aβ25-35-induced damage in dPC12 cells,and to provide reference for the treatment of Alzheimer’s disease(AD).METHODS:After PC12 cells were differentiated into dPC12 cells with neural activity by incubating with never growth factor(NGF),the dPC12 cells were divided into normal control group(DMSO medium),Aβ25-35treatment group(DMSO medium)and GP test group(DMSO medium respectively containing 25,50,100,200,400µg/mL GP).After 24 h cultivating,cells in Aβ25-35treatment group and GP test group were added 25 μmol/L Aβ25-35to induce cell damage(AD cell model),MTT method was used to determine the survival rate after 24 h.Other cells were divided into normal control group(DMSO medium),Aβ25-35treatment group(DMSO medium)and GP test group(DMSO medium respectively containing 25,50,100,200µg/mL GP),the lactate dehydrogenase(LDH),reactive oxygen species(ROS),malondialdehyde(MDA)levels in cell culture medium were detected after the same treatment.RESULTS:Compared with Aβ25-35treatment group,the survival rates of dPC12 cells in 50,100,200,400µg/mL GP test groups were obviously increased(P<0.05 or P<0.01);LDH,ROS,MDA levels in 100,200µg/mL GP test groups and ROS level in 50µg/mL GP test group were significantly reduced(P<0.05 or P<0.01),showing a certain concentration-dependence.CONCLUSIONS:GP has certain protective effect on Aβ25-35-induced damage in dPC12 cells,and it’s a potential drug for AD.
Ginkgo biloba leaf;Polypentenol;Aβ25-35;dPC12 cell;Lactate dehydrogenase;Reactive oxygen species;Malondialdehyde
R741.02
A
1001-0408(2017)07-0881-04
2016-08-17
2016-11-07)
(编辑:林 静)
广西自然科学基金面上项目(No.2013GXNSFAA-019115);广西壮族自治区卫生厅中医药科技专项课题(No.GZZY13-09);壮瑶药协同创新中心课题(No.桂教科研﹝2013﹞20号);广西壮瑶药重点实验室课题(No.桂科基字﹝2014﹞32号)
*教授,博士研究生。研究方向:新药研发、药理学。E-mail:weiweichen2012@sina.com
#通信作者:教授,博士生导师,博士。研究方向:新药研发、药理学。E-mail:lihaitao0003@sina.com
DOI10.6039/j.issn.1001-0408.2017.07.05

