铁粉矿在HIsarna工艺中预还原行为的研究
曲迎霞,邢力勇,张 立,邹宗树(东北大学冶金学院, 沈阳110819)
铁粉矿在HIsarna工艺中预还原行为的研究
曲迎霞,邢力勇,张 立,邹宗树
(东北大学冶金学院, 沈阳110819)
通过高温实验与理论分析研究了铁粉矿颗粒在高温下的热分解和熔化行为,以及熔化后气体与熔融粉矿液滴之间的还原动力学.当温度高于FeO熔点且产物层中有FeO生成时,铁粉矿颗粒会出现熔化现象.还原反应前210 ms伴随着剧烈的热分解反应,主要是Fe2O3分解成Fe3O4.熔化后的铁粉矿颗粒产物层是液态的FeO,颗粒中心是未反应的固态Fe3O4,还原反应发生在颗粒表面.Fe3+在产物层中的扩散是还原反应的限制性环节,通过计算得到气体与熔融铁粉矿颗粒还原反应的表观活化能约为141 kJ/mol.
HIsarna工艺;旋风熔化炉;热分解;熔化;还原动力学
HIsarna[1-2]是一种煤基铁浴法熔融还原炼铁工艺,是欧洲超低二氧化碳炼钢项目(ULCOS)的一部分.该突破性熔融还原炼铁技术可以直接利用粉煤和粉矿作为原燃料,省去了造球、烧结及炼焦这三个辅助环节.不仅缩小了炼铁厂的占地面积,而且减少了对环境的污染.与高炉炼铁技术相比,HIsarna工艺能使吨铁CO2排放量降低约20%,如果结合CO2捕集技术(Carbon Capture and Storage),可减少CO2排放量约80%.HIsarna工艺主体部分主要由两个反应器组成:旋风熔化炉和熔融还原炉.旋风熔化炉位于熔融还原炉的上部,形成一个贯通的高温反应器.旋风熔化炉内的平均温度可达 1 400 ~ 1 500 ℃ 左右.粉矿、熔剂以及氧气通过旋风熔化炉底部的水冷喷枪一同切向喷吹到炉内,形成一个漩涡流.氧气在旋风熔化炉内与从熔融还原炉进入的煤气发生燃烧反应释放出大量的热,粉矿则在高温下飞行过程中发生热分解及还原反应,同时被熔化,得到预还原度约为20%的熔融产物.熔化后的粉矿液滴飞行一段时间后会黏结到旋风熔化炉的水冷炉壁上,并顺着炉壁流淌、滴落到熔融还原炉内.熔融还原炉的熔池上方喷吹氧气和粉煤,预还原粉矿在熔池内与碳发生直接还原反应,产生热态金属铁,并且进行渣铁分离.本文针对铁粉矿在旋风熔化炉内飞行过程中的热分解和熔化行为,以及熔化后气体与熔融粉矿液滴的还原动力学进行了实验研究与理论分析,并建立了动力学模型.
1 实 验
1.1 实验原料及分析
实验原料选用的是赤铁粉矿,实验前先将铁粉矿放入150 ℃的烘干箱内保温3 h,除去水分;然后采用振动筛对干燥的铁粉矿进行筛分,获得实验所需的粉矿粒度;采用激光粒度分析仪对筛分后的粉矿进行粒度分析.本文所选用的粒度是45~53 μm,测得其平均粒度为50 μm.铁粉矿的化学分析如表1所示,主要成分为Fe2O3,其质量分数为93.1%,还含有少量的SiO2和Al2O3等成分.

表1 铁粉矿的主要成分(质量分数)
1.2 实验装置及方法
实验设备采用的是高温管式滴落炉(HDTF),其主体是一个高温管式竖炉,炉体采用6根SiC加热棒进行加热,最高工作温度为 1 873 K.炉顶安装了一个水冷加料管,炉子底部安装了一个水冷接料管,接料管底端连接一个接料器用于收集反应后的铁粉矿.高温反应区为水冷加料管底端到水冷接料管顶端之间的区域,长度为41 cm.为了防止高温下铁粉矿颗粒之间发生黏结现象,加料速度控制在1 g/h.
升温过程中炉内采用流量为1 L/min的N2作为保护气体,当高温竖炉温度升至实验预定温度时,将N2切换成还原气体并启动加料器.铁粉矿随载气从水冷加料管进入炉内,余下还原气体从炉顶气体入口通入,铁粉矿颗粒与高温还原气体在加料管出口相遇,并在向下运动的过程中发生还原反应,反应后的粉矿颗粒与气体一同进入水冷接料管,进而铁粉矿收集在接料器内,气体排出.
1.3 实验方案
本研究考察铁粉矿颗粒在1 650、1 700和1 750 K 三个温度下的热分解与还原行为,还原实验所采用的气体组成(体积分数)为42.2%CO+57.8%CO2,热分解实验所采用的气体为100%CO2.通过牛顿第二定律和斯托克斯定律计算得到铁粉矿颗粒在高温反应区内的停留时间.实验条件如表2所示.

表2 实验条件
2 结果与讨论
铁粉矿热分解和还原反应都是失氧的过程,因此本文均采用失重率f来表征其还原度或分解度,表达式如公式(1)所示,其中,Δmoxygen为铁粉矿在反应过程中失去的氧的质量,mtot-oxygen为反应前铁粉矿中与铁元素结合的总氧量.实验采用化学分析法测得反应后铁粉矿中的全铁含量w(TFe)、二价铁含量w(Fe2+)和三价铁含量w(Fe3+),进一步根据公式(1),还原度或分解度可由样品中各价态铁元素的含量计算得到,如公式(2)所示.
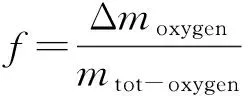
(1)
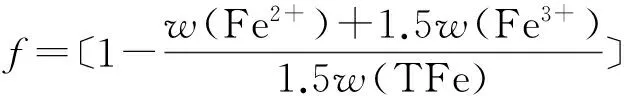
(2)
2.1 铁粉矿的还原与热分解结果
对于高温还原后的铁粉矿,取出一部分样品采用化学分析法测得各价态铁元素含量,从而计算得到在每个反应条件下铁粉矿的还原度和每个时间段的平均反应速率,如表3所示.从计算结果可以看出,还原度f随着反应时间t和温度T的增加而升高.在 1 750 K 的温度下,平均还原速率r随时间t的变化而逐渐减小,当反应时间为970 ms 时,还原反应达到了平衡状态,还原度也达到了最大值.根据Fe-O-C系平衡图[3]可知,当温度高于 1 650 K、还原气体中CO含量为42%时,铁氧化物还原的最终产物是FeO且达到平衡时的还原度约为26.5%.本研究中实验得到的最大还原为26.3%~26.6%,与理论分析一致.
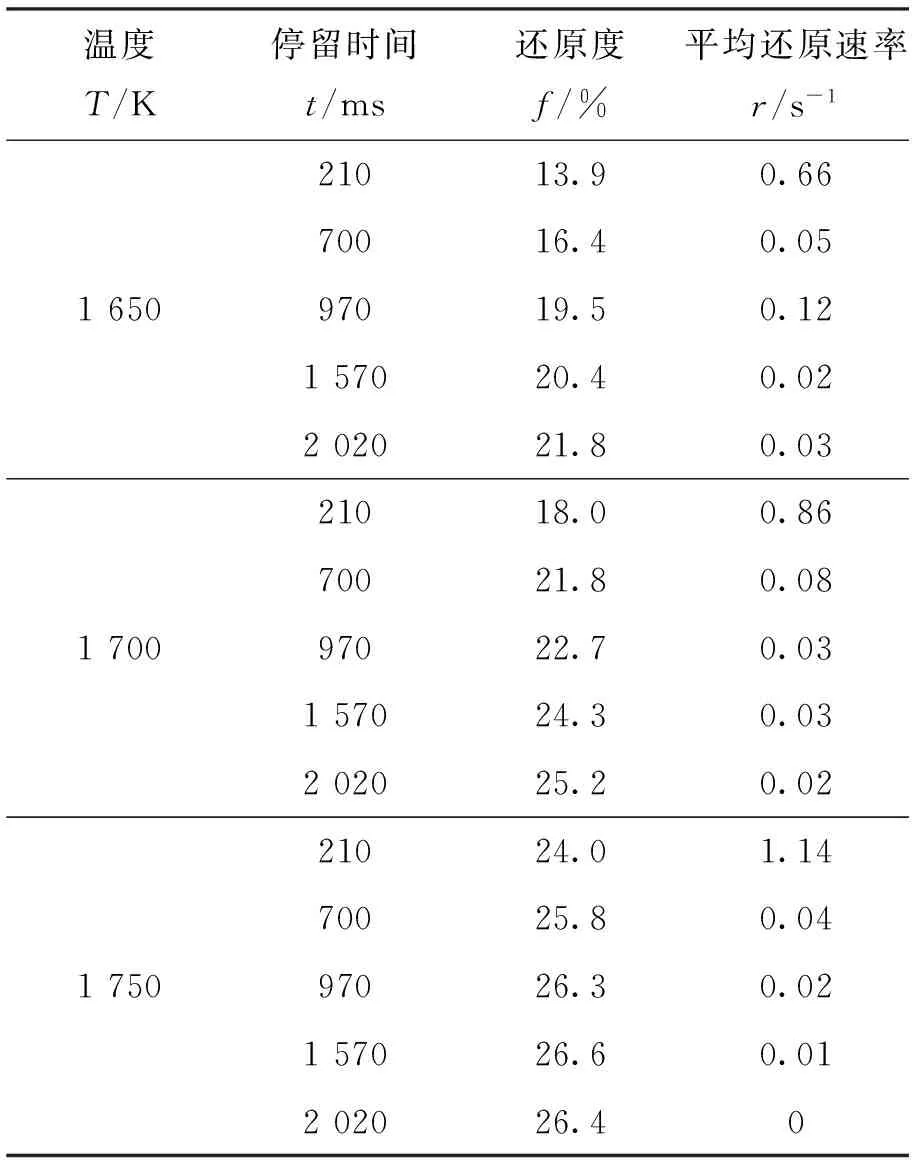
表3 1 650~1 750 K的温度下获得的还原度和平均还原速率
此外,由表3中计算得到的平均反应速率可知,前 210 ms 的平均反应速率明显大于 210 ms 之后的平均反应速率.根据热力学分析可知,这主要是因为反应前期伴随着Fe2O3的热分解.对于铁粉矿在100%CO2气氛下的热分解行为在作者的另一篇论文中做了详细的阐述[4],在本文中只给出主要相关结论.实验设备和除了气氛外的其它实验条件与还原反应实验相同.研究中发现,Fe2O3在高温下会迅速地发生热分解反应,但在本研究的温度和反应时间范围内,没有检测到Fe3O4和FeO的热分解反应.分解度随着温度的升高先是增大而后保持在11%左右,但不随反应时间的增加而发生变化.这说明Fe2O3的分解反应非常迅速,且发生在前210 ms.在反应前210 ms的分解度与还原度的对比结果如图1所示.假设在还原性气氛下,铁粉矿先发生热分解反应,然后发生还原反应,那么还原反应获得的还原度可由总的还原度减去分解度.由图可见,在 1 650~ 1 700 K 的温度下,热分解产生的还原度较大,而在 1 750 K 的温度下,气-固还原反应产生的还原度较大.
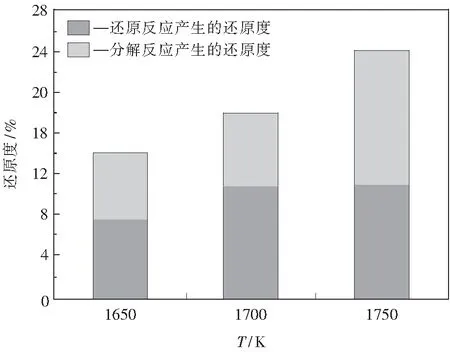
图1 铁矿粉在前210 ms的热分解度与还原度Fig.1 Thermal decomposition degree and reduction degree of the iron ore powder in the first 210 ms
2.2 铁粉矿颗粒的微观形貌
为了进一步研究铁粉矿颗粒在高温下的熔化行为和反应机理,研究中采用SEM技术观察了铁粉矿颗粒的表面和剖面微观形貌.未经还原的铁粉矿颗粒具有不规则的形状,且表面光滑、结构致密.还原后(如图2所示),在 1 650 K 的温度下,即使反应时间为 2 020 ms,仍有大部分铁粉矿颗粒没有熔化;在 1 700 K 的温度下,当反应时间为 210 ms 时,存在少部分颗粒具有不规则的形状,但当还原时间为 700 ms 时,铁粉矿颗粒则全部熔化成球形,也就是说 700 ms 及以后发生的是气体与铁粉矿液滴(气-熔滴)之间的还原反应;在 1 750 K 的温度下,当反应时间为 210 ms 时,铁粉矿颗粒则都会全部熔化成球形.根据铁氧化物的物理性质可知,Fe2O3,Fe3O4和FeO的熔点分别约为 1 838, 1 870 和 1 644 K[5],故可推断当温度高于 1 644 K,且铁粉矿颗粒中产生一定量的FeO时,铁粉矿颗粒就会熔化成球形.
在光学显微镜下,对铁粉矿颗粒的剖面进行观察发现,颗粒边缘存在一个环形区域,且结构相对致密,中心区域与环形区域不在同一平面上,因此得不到清晰的图片,如图3(a)所示.采用SEM-EDS分析技术可观察到,中心区域的结构与环形区域不同,且铁元素在中心区域的含量相对较低,而在环形区域的含量相对较高.结合化学分析结果可知,中心区域为固态的Fe3O4,环形区域为液态的FeO,如图3(b)所示.

图2 SEM(100x)还原后铁粉矿颗粒 Fig.2 SEM photos of particles for the iron ore powder after reduction(a)―1 650 K, t=2 020 ms; (b)― 1 700 K , t=700 ms; (c)―1 750 K, t=210 ms

图3 1 700 K 温度下熔化后铁粉矿颗粒的剖面微观形貌Fig.3 SEM of the polished sections of molten iron ore particles (a)—光学显微镜观察, t=970 ms; (b)—SEM-EDS观察, t=2 020 ms
2.3 铁粉矿还原的动力学分析
由对高温还原后铁粉矿的还原度和微观形貌分析可知,铁粉矿在1 650 K及以上温度下进行还原,就会发生熔化现象,但只有当温度为 1 700 K 、还原时间≥700 ms和1 750 K、还原时间≥210 ms时,铁粉矿颗粒才会全部熔化,即所有颗粒发生的都是气-熔滴之间的还原反应.这是由于不同铁粉矿颗粒本身的物理性质存在差异,如颗粒尺寸、孔隙度和成分等.当发生气-熔滴还原反应时,颗粒中心存在一个逐渐缩小的未反应核即固态Fe3O4,产物层是液态FeO.根据未反应核模型理论且经过分析得出[6],气-熔滴还原反应的机理如下:
(1) 固态Fe3O4中的Fe3+和O2-溶解到固-液界面处的液态FeO中;
(2) CO气体从气相本体穿过气相扩散边界层扩散到气-液界面;
(3) Fe3+离子从固-液界面穿过液态产物层扩散到气-液界面;
(4) 在气-液界面发生化学反应生成CO2气体;
(5) CO2气体从气-液界面穿过气相扩散边界层扩散到气相本体中.
实验中所采用的气体流量排除了气体的外扩散为限制性环节,即步骤(2)和(5).此外,根据前人研究[7-10],固相在液相中的溶解一般不是反应的限制性环节.本研究采用模型函数配合法,分别假设铁粉矿颗粒的气-熔滴还原反应为化学反应控制(Mckwan公式)、扩散控制(Ginstling-Brounshtein公式)和混合控制.通过对实验数据的拟合得出,Fe3+离子从固-液界面穿过液态产物层扩散到气-液界面是气-熔滴还原反应的限制性环节,还原度f与反应时间t的关系式如下,
(3)
将公式(3)中1-2/3f-(1-f)2/3对反应时间t作图,如图4所示,进一步采用最小二乘法计算得到不同温度下的反应速率常数k(s-1).由于在 1 750 K 的反应温度下,当反应时间大于 970 ms 时,还原反应即达到了平衡状态,还原度几乎不发生变化,因此不采用这部分实验数据进行动力学分析.通过计算得到, 1 700 K 下的反应速率常数为1.57×10-3s-1, 1 750 K下的反应速率常数为2.09×10-3s-1.已知不同温度铁粉矿的反应速率常数,则可根据Arrhenius公式(公式(4)),将lnk对1/T作图,通过直线斜率求出还原反应表观活化能E,通过截距求出指前因子A.基于上述分析结果,可计算得到铁粉矿气-熔滴还原反应的表观活化能为 141 kJ/mol,指前因子为34 s-1,则反应速率常数的表达式如公式(5)所示,Rg为摩尔气体常数.
(4)
(5)
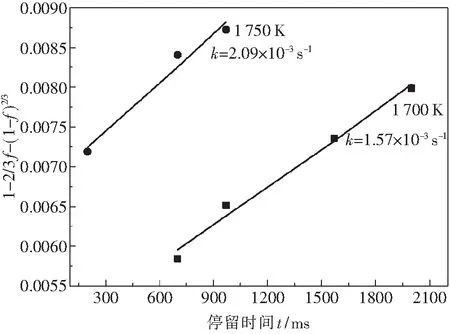
图4 1 700~1 750 K下的反应速率常数Fig.4 Reaction rate constants at 1 700~1 750 K
3 结 论
通过对铁粉矿在不同温度下、运动中发生的熔化、热分解行为,以及铁粉矿颗粒在熔融状态下发生还原反应的动力学研究,可得出以下结论:
(1) 铁粉矿在高温下发生的还原反应非常迅速,还原速度随着温度的升高而加快,在反应前期(前210 ms内)伴随着剧烈的热分解反应;
(2) 在本实验条件下,铁粉矿中Fe2O3会发生剧烈的热分解反应生成Fe3O4,但Fe3O4不会进一步发生分解反应,铁粉矿的最大还原度约为26.5%,还原的最终产物是FeO.
(3) 铁粉矿颗粒发生熔化现象,是因为颗粒产物层生成了FeO且还原温度高于FeO的熔点,即1644K,颗粒内部仍然是固态的Fe3O4.
(4) 铁粉矿颗粒熔化后的还原反应发生在颗粒表面,即气-液反应界面,Fe3+在液态产物层的扩散是还原反应的限制性环节,通过计算得到反应表观活化能为141 kJ/mol.
[1]Link J. IRMA―Flowsheet model examples of application[J]. La Revue de Metallurgie, 2009, 106(10): 398-403.
[2]Meijer K, Guenther C, Dry R J. HIsarna pilot plant project[C]// METEC conference. Dusseldorf. Germany, July 2011.
[3]Biswas A K. Principles of blast furnace ironmaking[M]. Cootha Publishing House, Brisbane Australia, (1981): 74-75.
[4]Qu Y, Yang Y, Zou Z,etal. Thermal decomposition behaviour of fine iron ore particles [J]. ISIJ International, 2014, 54(10): 2196-2205.
[5]McKewan W M. Kinetics of iron oxide reduction[J]. Trans Met Soc AIME, 1962, 218(2): 2-6.
[6]Qu Y, Yang Y, Zou Z,etal. Kinetic study on gas molten particle reduction of iron ore fines at high temperature [J]. Ironmaking and Steelmaking, 2015, 42(10): 763-773.
[7]Takeuchi N, Nomura Y, Ohno K,etal. Kinetics analysis of spherical wusitite reduction transported with CH4gas[J]. ISIJ International, 2007, 47(3): 386-391.
[8]Han Y H, Wang J S, Lan R Z,etal. Kinetic analysis of iron oxide reduction in gas recycling oxygen blast furnace[J]. Ironmaking and Steelmaking, 2012, 39 (5): 313-317.
[9]Parkash S, Ray H S. Prediction of reduction kinetics of iron ore under fluctuating temperature conditions [J]. ISIJ International, 1990, 30 (3): 183-190.
[10]Itaya H, Sato M, Taguchi S. Circulation and reduction behaviour of iron-ore in a circulating fluidized-bed[J]. ISIJ International, 1994, 34 (5): 393-400.
Study on the pre-reduction behavior of iron ore powder in HIsarna process
Qu Yingxia, Xing Liyong, Zhang Li, Zou Zongshu
(School of Metallurgy, Northeastern University, Shenyang 110819, China)
The melting behaviour, thermal decomposition behaviour and the reduction kinetics between the gas and the molten particle were investigated with the experiments and the theoretical analysis. It was found that melting of the iron ore particles happens when the temperature is higher than that of the melting point of FeO and when FeO is formed on the product layer of the iron ore particle. The accompanied by the thermal decomposition of Fe2O3prior to 210 ms, the reduction begins. The product layer of the molten particle is liquid FeO, while the unreacted core is solid Fe3O4. The reduction takes place on the surface of the iron ore particles. The mass transfer of Fe3+in the product layer is the reaction rate controlling step. The apparent activation energy of the gas-molten particle reduction was calculated to be 141 kJ/mol.
HIsarna process; melting cyclone; thermal decomposition; melting; reduction kinetics
10.14186/j.cnki.1671-6620.2017.01.002
TF 521
A
1671-6620(2017)01-0008-05

