CGRP影响人牙髓干细胞增殖分化的研究
刘航,郝建忠,栾可峰,李哲,于天资,张继萍
(1.潍坊医学院口腔系,山东 潍坊 261053;2.潍坊医学院附属医院口腔科,山东 潍坊 261031;3.潍坊医学院管理系,山东 潍坊 261053)
CGRP影响人牙髓干细胞增殖分化的研究
刘航1,郝建忠2,栾可峰1,李哲1,于天资1,张继萍3
(1.潍坊医学院口腔系,山东 潍坊 261053;2.潍坊医学院附属医院口腔科,山东 潍坊 261031;3.潍坊医学院管理系,山东 潍坊 261053)
目的 研究降钙素基因相关肽(CGRP)对人牙髓干细胞增殖分化的调控作用,并初步探讨CGRP的调控信号通路。方法首先获取健康的牙髓,体外培养并筛选牙髓干细胞;采用MTT法检测不同浓度的CGRP对牙髓干细胞的增殖作用,获取适宜的作用浓度;利用茜素红染色法观察CGRP作用下牙髓干细胞形成矿化结节的效果;在实时定量RT-PCR法及免疫印迹法检测CGRP作用下牙髓干细胞中Ⅰ型胶原(Col-1)、转录因子Runx2的mRNA和蛋白表达水平;最后利用实时定量RT-PCR法检测MAPK信号通路抑制剂作用下CGRP对牙髓干细胞中Ⅰ型胶原、Runx2 mRNA表达水平的影响。结果经过筛选培养获得生长稳定的牙髓干细胞;MTT法检测可知CGRP可促进牙髓干细胞的增殖,在CGRP的浓度达到10-7mol/L时效果最显著;在CGRP作用牙髓干细胞28 d后,经茜素红染色可见矿化结节;经实时定量RT-PCR法和免疫印迹法检测可知CGRP作用下牙髓干细胞中Col-1、Runx2的mRNA和蛋白表达水平得到显著提高;MAPK信号通路中ERK激酶通路能够调控CGRP作用下牙髓干细胞中Runx2表达的水平,ERK激酶和p38通路能够调控CGRP作用下牙髓干细胞中Col-1表达的水平。结论CGRP能够促进牙髓干细胞的增殖分化,这一作用受到MAPK信号通路的调控。
降钙素基因相关肽;牙髓干细胞;分化;MAPK信号通路;细胞增殖
牙髓干细胞是存在于牙髓组织当中具有很强增殖和多向分化功能的一种干细胞。当牙髓受到外界刺激如细菌毒素、机械化学等作用时,牙髓干细胞会通过多方定向分化对牙髓环境的稳态进行维持。其中牙髓干细胞可以通过许多外界信号诱导后形成牙本质样细胞[1-3],对牙本质及牙髓组织进行修复保护。降钙素相关基因肽(CGRP)主要是由感觉阳性神经纤维分泌产生,它的存在范围主要是随着神经末梢的分布而存在于人体绝大多数器官组织中[4]。研究发现CGRP能够促进成骨细胞的增殖和分化[5-6],体外环境下CGRP对成骨细胞中的ALP、CollaⅠ和OCN等成骨标志基因蛋白的表达具有促进作用[7-8]。牙髓组织当中的感觉神经分布很多,牙髓干细胞存在很强的定向成骨分化能力。笔者通过体外培养牙髓干细胞,研究在CGRP的作用下牙髓干细胞的增殖和成骨分化能力,探讨两者之间是否存在的关联。
1 材料与方法
1.1 主要材料 CGRP(sigma公司);RNA提取试剂盒、RT-PCR试剂盒(TaKaRa公司);逆转录试剂盒(Roche公司);DMSO(Amresco公司);胰蛋白酶、DMEM培养基(Hyclone公司);MTT、茜素红(碧云天公司)胎牛血清(杭州四季青公司);兔抗人Col-1、ALP抗体(Santa Cruz公司);PD98059、SP600125、SB203580 (Sellck Chemicals公司)。
1.2 方法
1.2.1 牙髓干细胞的获取及培养 从临床上收集到的正常健康完整的拔除的智齿,消毒后放在冷却的αMEM培养液中暂时保存。在无菌环境下破坏牙齿,取出牙髓,留下冠髓,去掉根尖1/3的牙髓,在用加有抗生素的PBS液冲洗牙髓组织下冲洗3次,剪成小块状。用3 mg/mL collagenase type I和4 mg/mL dispase在37℃环境下震荡水浴2 h,可见牙髓不再成完整形态。将液体用70 μm的筛子进行过滤,获取到的细胞悬液离心后去掉上清,将细胞接种到含有15%的胎牛血清DMEM培养基的培养瓶中。接种入直径为10 cm的塑料培养皿中培养,培养液成分:αMEM,15%胎牛血清,100 μmol/L L-ascorbic acid 2-phosphate,2 mmol/L L-glutamine,100 U/mL青霉素,100 μg/mL的链霉素,在37℃、5%CO2培养箱中进行牙髓干细胞的培养。培养48 h后,用PBS缓冲液洗涤3次,去除未贴壁的细胞。继续培养,每隔3 d换一次培养液,培养14 d后,在倒置显微镜下鉴定克隆的形成。细胞集落中含有50个以上的细胞被认为是SHED的克隆。当细胞生长至90%汇合时,0.25%胰蛋白酶消化后按1:4的比例进行传代。
1.2.2 MTT法检测不同浓度的CGRP对牙髓干细胞的增殖作用 取细胞传代至第3代且生长状况良好的人牙髓干细胞,用0.25%胰蛋白酶消化呈悬浮单细胞,以8 000/cm2的密度将牙髓细胞传至96孔细胞培养板中,继续培养20 h后细胞状态稳定后在培养皿中依次加入浓度分别为10-9mol/L、10-8mol/L、10-7mol/L、 10-6mol/L的CGRP,空白对照组为PBS缓冲液,每个浓度分别有6个复孔。细胞分别在继续培养12 h、24 h、48 h、72 h后去除培养基,用PBS缓冲液冲洗3次,在每个复孔中加入20 μL的MTT试剂,继续在细胞培养箱中静置4 h,再次去除培养基,用PBS缓冲液冲洗3次后,在每个复孔中加入150 μL的DMSO试剂,轻轻震荡5 min后在酶标仪上以490 nm的波长检测光密度值。实验共重复3次。实验结果以光密度值及CGRP浓度为轴,绘制牙髓干细胞的生长曲线。
1.2.3 茜素红染色法观察CGRP作用下牙髓干细胞形成矿化结节的效果 根据MTT检测结果,选取CGRP浓度为10-7mol/L进行以下实验。取细胞传代至第3代且生长状况良好的人牙髓干细胞,用0.25%胰蛋白酶消化呈悬浮单细胞,以8 000/cm2的密度将牙髓细胞传至细胞培养皿中。实验组为加入含10-7mol/L CGRP的αMEM,15%胎牛血清培养基;空白对照组为不含CGRP的培养基。继续培养21 d,4 d传代一次。20 d后,先用PBS缓冲液冲洗培养皿3次,然后加入无水乙醇15 min以固定细胞,蒸水冲洗培养皿3次,去净乙醇,加入pH值调整至8.3的0.1%茜素红-Tris-HCL,在37℃的环境下静置30 min,蒸水冲洗培养皿3次后室温下静置干燥,显微镜下观察并拍摄照片。实验共重复3次。
1.2.4 实时定量RT-PCR检测CGRP作用下牙髓干细胞中Col-1、Runx2的mRNA表达水平 取细胞传代至第3代且生长状况良好的人牙髓干细胞,用0.25%胰蛋白酶消化呈悬浮单细胞,以8 000/cm2的密度将牙髓细胞传至24孔细胞培养板中,在37℃、5% CO2培养箱中培养20 h后,加入10-7mol/L的CGRP继续培养,空白对照组为PBS缓冲液。分别培养刺激12 h、24 h、48 h、72 h后收集细胞。然后按照说明书提取牙髓干细胞的总mRNA,在牙髓干细胞中加入RNAiso Plus裂解细胞,在细胞混合液中加入氯仿,混匀后在4℃下离心使溶液分层液体;取上清加入同体积的异丙醇,混匀后冰上静置、离心;获得少量沉淀物,加入75%乙醇洗涤沉淀并离心,加入DEPC水溶解沉淀;紫外分光光度计测定细胞总mRNA:分别测定细胞总RNA在260 nm和280 nm处的光密度值,最后计算mRNA的含量和纯度。以提取的牙髓干细胞总mRNA逆转录形成的cDNA为模板,进行实时定量PCR实验。PCR的引物序列设计为:Col-1上游,5'-TCTACTGGCGAAACCTGTATCCG-3';下游,5'-GCAACAAGTTCAACATCATTA GAGCC-3';获得的DNA片段长度为314 bp。IQ5TM PCR仪上设置的条件为:预变性温度为95℃/4 min 1个循环;变性温度95℃/10 s,退火温度52.1℃/15 s,延伸温度72℃/25 s 40个循环;最后延伸温度72℃/1 min 1个循环。Runx2上游,5'-TCACCTCAGGCATGTCCCTC-GGTAT-3';下游,5'-TGGCTTCCATCAGCGTCAACACC-3';获得的DNA片段长度为289 bp。IQ5TM PCR仪上设置的条件为:预变性温度为95℃/4 min 1个循环;变性温度95℃/10 s,退火温度59.8℃/15 s,延伸温度72℃/25 s 40个循环;最后延伸温度72℃/1 min 1个循环。细胞实验总共重复3次。
1.2.5 Western blot检测CGPR调控人牙髓细胞中Col-1、Runx2蛋白的表达水平 取细胞传代至第3代且生长状况良好的人牙髓干细胞,用0.25%胰蛋白酶消化呈悬浮单细胞,以8 000/cm2的密度将牙髓细胞传至细胞培养皿中,继续培养20 h后细胞状态稳定后在培养皿中加入CGRP至浓度为10-7mol/L。将培养皿分为两组,每组为两个样本。实验组加入CGRP,空白对照组为PBS缓冲液,分别在作用48 h及72 h两个阶段后胰酶消化收集细胞,冰上裂解细胞并收集上清液。经酶标仪测定蛋白浓度后,取25 μL的液体加入两倍量的凝胶上样缓冲液并充分混匀,煮沸10 min使蛋白变性,再次离心获取上清。在SDS-PAGE凝胶上以60 V电压进行电泳,以120 V电压进行转膜,封闭液封闭1 h。然后Col-1、ALP兔抗人一抗进行免疫反应1.5 h,再加入Col-1、ALP鼠抗兔二抗进行免疫反应1.5 h。最后进行发光反应并拍照。上述实验重复3次。
1.2.6 实时定量RT-PCR检测MAPK信号通路抑制剂作用下CGRP对牙髓干细胞中Ⅰ型胶原、Runx2 mRNA表达水平的影响 取细胞传代至第3代且生长状况良好的人牙髓干细胞,用0.25%胰蛋白酶消化呈悬浮单细胞,以8 000/cm2的密度将牙髓细胞传至24孔细胞培养板中,在37℃、5%CO2培养箱中培养20 h后,加入10-7mol/L的CGRP继续培养,空白对照组为PBS缓冲液,刺激培养20 h。将细胞分为4组分别加入抑制剂阻断4 h,每组6个复孔。组1:DMSO空白对照;组2:ERK激酶MAPK抑制剂(PD98059)(100 μmol/L);组3:JNK MAPK抑制剂(SP600125)(100 μmol/L);组4:P38 MAPK抑制剂(SB203580)(25 μmol/L)。转染完成24 h后以此前成骨细胞的总mRNA逆转录的cDNA为模板,进行实时定量PCR,检测3种MAPK信号通路抑制剂作用下CGRP对牙髓干细胞中Ⅰ型胶原、Runx2 mRNA表达水平。引物设计及PCR反应条件以1.2.4为准。细胞实验总共重复3次。
1.3 统计学方法 利用SPSS13.0统计软件对实验数据进行统计学处理,统计学分析方法根据组间比较用配对t检验进行,以α=0.05作为检验水准。
2 结 果
2.1 牙髓干细胞的获取与培养 经过组织块酶消化法获得并筛选出牙髓干细胞24 h后可见大多数细胞贴壁,细胞形态较小,且呈长圆形,少有伸展,少量细胞悬浮在培养基中。48 h后可见牙髓干细胞完全伸展开,呈梭状,细胞尚未增殖,细胞数目较为稀疏。培养6 d后,牙髓干细胞大量增殖,形态呈长梭状,细胞之间紧密接触(图1)。

图1 牙髓干细胞的获取与培养
2.2 MTT法检测不同浓度的CGRP对牙髓干细胞的增殖作用 根据MTT检测可见在CGRP作用于牙髓干细胞24 h以后,各个浓度组的干细胞数目均多于空白对照组,表明CGRP对牙髓干细胞具有显著的促进增殖的作用。在各个浓度组中,以10-7mol/L浓度组促进效果最为显著,因此以后的实验都将以10-7mol/L浓度进行(图2)。
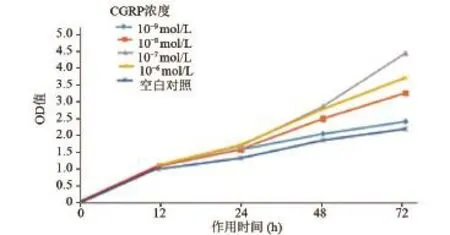
图2 MTT法检测不同浓度的CGRP对牙髓干细胞的增殖作用
2.3 茜素红染色法观察CGRP作用下牙髓干细胞形成矿化结节的效果 细胞培养21 d并经茜素红染色,在显微镜下可见,经CGRP刺激的牙髓干细胞增殖数量较多,排列较为紧密,明显可见有重度红褐色染色的团状矿化结节。空白对照组的牙髓干细胞排列相对稀疏,未见有红色染色的团状矿化结节(图3)。

图3 茜素红染色法观察CGRP作用下牙髓干细胞形成矿化结节的效果
2.4 实时定量RT-PCR检测CGRP作用下牙髓干细胞中Col-1、Runx2的mRNA表达水平 根据实时定量RT-PCR的结果,CGRP能够显著增强牙髓干细胞中Col-1、Runx2的mRNA表达水平。在作用24 h时,CGRP的上调Runx2作用最为显著,在作用48 h时,CGRP的上调Col-1作用最为显著(图4)。
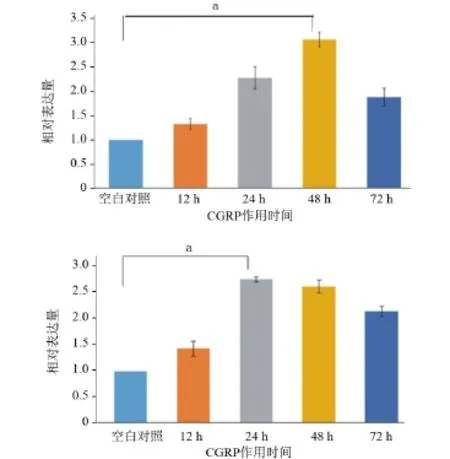
图4 实时定量RT-PCR检测CGRP作用下牙髓干细胞中Col-1、Runx2的mRNA表达水平
2.5 Western blot检测CGPR调控人牙髓细胞中Col-1、Runx2蛋白的表达水平 根据western blot的结果,在CGRP作用下,牙髓干细胞中的Col-1、Runx2的蛋白表达水平与空白对照组相比得到显著增强,在作用72 h时的蛋白表达水平最高(图5)。
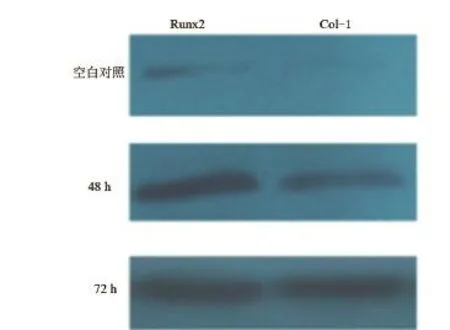
图5 Western blot检测CGPR调控人牙髓细胞中Col-1、ALP蛋白的表达水平
2.6 实时定量RT-PCR检测MAPK信号通路抑制剂作用下CGRP对牙髓干细胞中Col-1、Runx2 mRNA表达水平的影响 根据实时定量RT-PCR的结果,ERK激酶MAPK抑制剂(PD98059)能够显著抑制CGRP对牙髓干细胞中Runx2的mRNA表达水平的促进作用,P38 MAPK抑制剂(SB203580)和ERK激酶MAPK抑制剂(PD98059)能够显著抑制CGRP对牙髓干细胞中Col-1的mRNA表达水平的促进作用(图6)。说明p38和ERK通路可能参与了CGRP对牙髓干细胞的成骨分化,而JNK通路可能未参与这一过程。
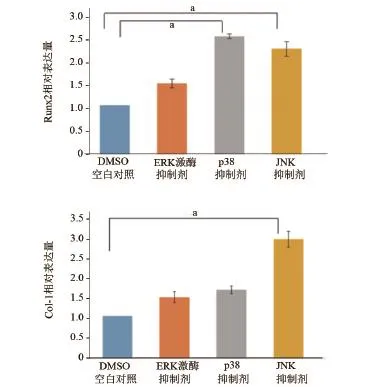
图6 实时定量RT-PCR检测MAPK信号通路抑制剂作用下CGRP对牙髓干细胞中Col-1、Runx2 mRNA表达水平的影响
3 讨 论
牙髓干细胞是最先由Gronthos等[9]从牙髓组织中获取的一种干细胞,这种干细胞属于间充质干细胞,能够接受外界细胞因子等的作用下发生高度的增殖和多向分化能力,尤其是能够分化成成牙本质细胞、脂肪细胞等。在牙髓因外界的机械或细菌病毒刺激所导致的损伤时,牙髓干细胞因环境的变化会分化成为成牙本质细胞,进而形成二期修复性牙本质,能够对受损的牙本质和牙髓环境进行修复维持。牙髓干细胞可以分化为成牙本质细胞的能力得到了很多研究人员的关注。牙髓干细胞的获取及培养的方法简单,成功率也很高。当前主要通过组织块酶消化结合法获得牙髓干细胞,培养方法也依然是贴壁培养方法,并在培养基中加入药物进行筛选牙髓干细胞。
降钙素相关基因肽是由Rosenfeld等[10]发现的,由37个氨基酸生物活性多肽构成。CGRP主要是由感觉阳性神经纤维分泌产生的,其分布的范围主要是随神经末梢的分布而广泛分布的[4]。在人的牙齿及其周围组织中,CGRP是广泛分布的,牙髓、牙周膜、牙槽骨以及颌骨都分布着大量的富含CGRP的神经纤维,尤其是在牙髓组织当中感觉神经以及血管的分布是极广的,CGRP能够参与调节牙髓、牙周膜、牙槽骨以及颌骨的生长发育、修复改建等过程[11-12]。Fristad等[13]通过实验发现CGRP的受体在大鼠的牙齿和牙周组织中广泛分布,在感觉神经受到外界刺激后,会产生大量的CGRP,从而调节牙齿及牙周组织中的成纤维细胞、成骨细胞、间充质细胞的增殖分化,最终参与牙齿、牙周、牙槽骨及颌骨对生长发育、修复以及改建的功能[14-15]。
通过筛选的牙髓干细胞经培养获得生长稳定、状态活跃的细胞,MTT检测可知在CGRP作用下牙髓干细胞的增殖效果显著高于空白对照,说明CGRP对牙髓干细胞具有促进增殖的作用,以10-7mol/L浓度组促进效果最为显著。牙髓干细胞的成骨分化对牙齿的修复与保护具有重要作用,茜素红染色法鉴定CGRP对牙髓干细胞的骨向分化具有促进作用,根据结果可知在加入CGRP的培养基培养牙髓干细胞21 d后,可见有明显的矿化结节产生。为进一步证实CGRP对牙髓干细胞的骨向分化促进作用,本研究采用实时定量RT-PCR和Western blot法检测发现牙髓干细胞中的Col-1和Runx2的mRNA、蛋白表达量在CGRP作用下的改变。Col-1是骨形成钙化结节的基本保障[16],是骨的主要构成部分。骨形成过程中钙盐的沉积须有Col-1提供支持,因此提升Col-1的表达水平,才能保证骨的正常的生长发育。转录因子Runx2作为重要的成骨因子,能够诱导间充质细胞分化为成骨细胞[17-19]。根据结果可知,在CGRP的作用下,Col-1和Runx2的表达水平显著升高,说明牙髓干细胞的成骨分化开始出现。最后笔者检测了在MAPK信号通路抑制剂作用下CGRP对牙髓干细胞中Col-1、Runx2 mRNA表达的水平,发现p38和ERK通路可能参与了CGRP对牙髓干细胞的调控,这只是对CGRP信号通路的一个初步研究。综上可知CGRP能够促进牙髓干细胞的增殖分化,同时MAPK信号通路参与了这一调控。
[1]About I,Mitsiadis TA.Molecular aspects of tooth pathogenesis and repair:in vivoandin vitroModels[J].Adv Dent Res,2001,15(1): 59-62.
[2]Tecles O,Laurent P,Zygouritsas S,et al.Activation of human dental pulp progenitor/stem cells in response to odontoblast injury[J].Arch Oral Biol,2005,50(2):103-108.
[3]Alliot-Licht B,Bluteau G,Magne D,et al.Dexamethasone stimulates differentiation of odontoblast-like cells in human dental pulp cultures [J].Cell Tissue Res,2005,321(3):391-400.
[4]郑林丰,谢应桂,许愿忠.降钙素基因相关肽在神经系统损伤中的作用[J].创伤外科杂志,2006,8(6):571-573.
[5]郑加军,杨铭艳,王建华.失神经支配下兔颌骨骨折愈合过程中VIP对微血管密度的影响[J].四川医学,2007,28(1):6-8.
[6]廉凯,杜靖远.降钙素基因相关肽对大鼠成骨细胞增殖和分化的影响[J].中国骨伤,2002,15(1):20-22.
[7]Drissi H,Hott M,Marie PJ,et al.Expression of the CT/CGRP gene and its regulation by dibutyryl cyclic adenosine monophosphate in human osteoblastic cells[J].J Bone Miner Res,1997,12(11): 1805-1814.
[8]柏永刚,秦书俭,田志逢,等.降钙素基因相关肽联合重组人骨形态发生蛋白对兔成骨样细胞增殖和碱性磷酸酶活性的影响[J].解剖科学进展,2008,14(1):73-75.
[9]Gronthos S,Brahim J,Li W,Fisher L W,et al.Stem cell properties of human dental pulp stem cells.J Dent Res,2002,81(8):531-535.
[10]Rosenfeld MG,Mermod JJ,Amara SG,et al.Production of anovel neuropeptide encoded by the calcitonin gene via tissue-specific RNA processing[J].Nature,1983,304(5922):129-135.
[11]Lerner UH,Persson E.Osteotropic effects by the neuropeptides calcitonin gene related peptide,substance P and vasoactive intestinal peptide[J].J Musculoskelet Neuronal Interact,2008,8(2):154-165.
[12]He H,Tan Y,Yang M.Effect of substance P in mandibular osteotomies after amputation of the inferior alveolar nerve[J].J Oral Maxillofac Surg,2010,68(9):2047-2052.
[13]Fristad I,Vandevska-Radunovic V,Fjeld K,et al.NK1,NK2,NK3 and CGRP1 receptors identified in rat oral soft tissues,and in bone and dental hard tissue cells[J].Cell Tissue Res,2003,311(3): 383-391.
[14]Sekiguchi T,Suzuki N,Fujiwara N,et al.Calcitoninin in a protochordate,Ciona intestinalis the prototype of the vertebrate calcitonin/calcitonin gene-related peptide,surperfamily[J].FEBS J,2009,276 (16):4437-4447.
[15]张益民,彭军,李元建.降钙素基因相关肽合成与释放调节[J].国际病理科学与临床杂志,2010,30(2):153-157.
[16]Arceo N,Sauk JJ,Moehring J,et al.Human periodontal cells initiate mineral-like nodules in vitro[J].J Periodontol,1991,62(8):499-503.
[17]Yamagucbi A,Komori T,Suda T.Regulation of osteoblast differentition mediated by bone morphogenetic proteins,hedgehogs,and Cbfa-1[J].Endocr Rev,2002,21(4):393-411.
[18]Lian JB,Javed A,Zaidi SK,et al.Regulatory control for osteblast growth and differentiation:role of Runx/Cbfa/AML factors[J].Crit Rev Eukaryot Gene Expr,2004,14(1-2):1-41.
[19]Hu X,Zhang X,Dai L,et al.Histone deacetylase inhibitor trichostatin A promotes the osteogenic differentiation of rat adipose-derived stem cells by altering the epigenetic modification on Runx2 promoter in a BMP signaling dependent manner[J].Stem Cells Dev, 2012,22(2):248-255.
Effects of CGRP on proliferation and differentiation of human dental pulp stem cells.
LIU Hang1,HAO Jian-zhong2, LUAN Ke-feng1,LI Zhe1,YU Tian-zhe1,ZHANG Ji-ping3.1.Department of Stomatology,Weifang Medical University, Weifang 261053,Shandong,CHINA;2.Department of Stomatology,Affiliated Hospital of Weifang Medical University, Weifang 261031,Shandong,CHINA;3.Department of Management,Weifang Medical University,Weifang 261053, Shandong,CHINA
ObjectiveTo study the effects of calcitonin gene-related peptide(CGRP)on proliferation and differentiation of human dental pulp stem cells,and to probe the role of CGRP signaling pathway.MethodsFirstly,the healthy pulp was collected,and the pulp stem cells were cultured and selectedin vitro.The tetrazolium-based colorimetric assay(MTT test)was used to detect the proliferation of dental pulp stem cells with different concentrations of CGRP, and the appropriate concentration was obtained.The effect of CGRP on the formation of mineralized nodules in dental pulp stem cells was observed by alizarin red staining.The expression levels of the Col-1 and Runx2 mRNA and protein acted by CGRP in dental pulp stem cells were detected by real-time RT-PCR and Western blot.At the last,we used real-time RT-PCR to observe the expression levels of Col-1 and Runx2 mRNA effect by mitogen-activated protein kinase (MAPK)signal pathway inhibitors.ResultsThe dental pulp stem cells grew stably by cultivating and filtering the cells.MTT method showed that the proliferation of dental pulp stem cells was enhanced by CGRP,and the effect was most significant when CGRP concentration was 10-7mol/L.The mineralize nodules were observed by alizarin red staining when the dental pulp stem cells enchanced by CGRP for 28 d.Real-time RT-PCR and Western blot showed that the expression levels of mRNA and protein of Col-1 and Runx2 were enhanced when CGRP acted on the dental pulp stem cells.In MAPK signal pathways,real-time RT-PCR showed that the mRNA expression level of Runx2 enhanced by CGRP was regulated by ERK kinase pathway,while the mRNA expression level of Col-1 enhanced by CGRP was regulated by ERK kinase pathway and P38 signal pathway.ConclusionCGRP can enhance the differentiation and proliferation of human dental pulp stem cells,which is regulated by the MAPK signal pathway.
Calcitonin gene-related peptide(CGRP);Dental pulp stem cells;Differentiation;Mitogen-activated protein kinase(MAPK)signal pathway;Cell proliferation
R781.3
A
1003—6350(2017)06—0867—05
10.3969/j.issn.1003-6350.2017.06.002
2016-10-16)
郝建忠。E-mail:738259426@qq.com

